Ацетил коа для синтеза холестерина
Содержание статьи
Биосинтез холестерина
Биосинтез холестерина — образование в живом организме органического спирта холестерина стероидной природы. Синтез холестерина происходит в клетках печени (50 %), кишечнике и коже. В клетке он идёт в гладком эндоплазматическом ретикулуме и цитозоле. Биосинтез холестерина служит основой синтеза других стероидных соединений. Начальные этапы синтеза являются общими с этапами синтеза других изопреноидов.
Нумерация атомов в молекуле холестерина
В 1940-е годы Блох с сотр. установил, что все атомы углерода холестерина происходят из ацетата, причём оба атома включаются в одинаковых количествах. В настоящее время установлена следующая цепь биосинтеза холестерина, включающая в себя несколько ступеней. (Образование промежуточных соединений этого пути может происходить и другими способами).
- Превращение трёх молекул активного ацетата в пятиуглеродный мевалонат.
- Превращение мевалоната в активный изопреноид — изопентенилпирофосфат.
- Образование тридцатиуглеродного изопреноида сквалена из шести молекул изопентенилдифосфата.
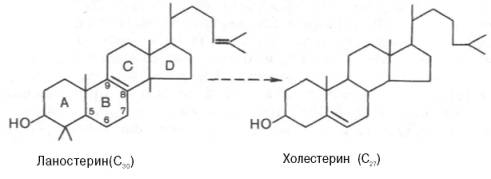
- Циклизация сквалена в ланостерин.
- Последующее превращение ланостерина в холестерин.
Синтез мевалоната[править | править код]
Синтез мевалоната протекает в три этапа.
- Образование ацетоацетил-КоА из двух молекул ацетил-КоА с помощью тиолазного фермента ацетоацетилтрансферазы. Реакция обратима. Происходит в цитозоле.
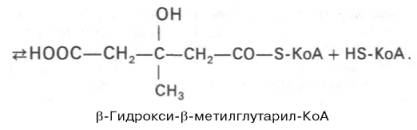
- Образование β-гидрокси-β-метилглутарил-КоА из ацетоацетил-коА с третьей молекулой ацетил-КоА с помощью гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтазы). Реакция также обратима. Происходит в цитозоле.
- Образование мевалоната восстановлением ГМГ и отщеплением HS-KoA с помощью НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза). Происходит в гЭПР. Это первая практически необратимая реакция в цепи биосинтеза холестерина, а также она лимитирует скорость биосинтеза холестерина. Отмечены суточные колебания синтеза этого фермента. Активность его увеличивается при введении инсулина и тиреоидных гормонов, снижается при голодании, введении глюкагона, глюкокортикоидов.
Схема этапа:
Существуют и другие пути синтеза мевалоната.
Синтез изопентенилпирофосфата[править | править код]
1, 2. Вначале мевалоновая кислота дважды фосфорилируется с помощью АТФ: до 5-фосфомевалоната, а затем до 5-пирофосфомевалоната. 3. 5-пирофосфомевалонат фосфорилируется по 3 атому углерода, образуя нестабильный промежуточный продукт — 3-фосфо-5-пирофосфомевалонат. 4. Последний декарбоксилируется и дефосфорилируется, образуется изопентенилпирофосфат.
Синтез сквалена[править | править код]
- Изопентенилпирофосфат изомеризуется в диметилаллилпирофосфат.
- Конденсация изопентенилпирофосфата (С5) с диметилаллилпирофосфатом (С5) и образование геранилпирофосфата (С10). При этом высвобождается молекула пирофосфата.
- Конденсация изопентенилпирофосфата (С5) с геранилпирофосфатом (С10). Образуется фарнезилпирофосфат (С15) и высвобождается ещё одна молекула пирофосфата.
- Конденсация двух молекул фарнезилпирофосфата (С15) «голова-к-голове» и образование сквалена (С30). Реакция проходит с затратой НАДФН, и высвобождаются две молекулы пирофосфата. Молекулы фарнезилпирофосфата конденсируются концами, несущими пирофосфатные группы. Сначала отщепляется одна пирофосфатная группа и образуется промежуточный прескваленпирофосфат. Он, в свою очередь, восстанавливается с помощью НАДФН. Второй пирофосфат уходит. Образуется сквален.
Начиная со сквалена, продукты пути биосинтеза холестерина нерастворимы в водной среде и участвуют в дальнейших реакциях, будучи связанными со стеринпереносящими белками (СПБ).
Синтез ланостерина[править | править код]
1. Под действием скваленэпоксидазы образуется эпоксид сквалена. 2. Затем эпоксид сквалена циклизуется в ланостерин. При этом метильная группа у С14 переносится на С13, а метильная группа у С8 — на С14.
Синтез холестерина[править | править код]
Ланостерин превращается в мембранах гладкого эндоплазматического ретикулума в холестерин.
- Метильная группа при С14 окисляется, и образуется 14-десметилланостерин.
2. Затем удаляются ещё два метила при С4, и образуется зимостерол. 3. Далее двойная связь C8=С9 перемещается в положение С8=С7 и образуется Δ7,24-холестадиенол. 4. Двойная связь далее перемещается в положение С5=С6,образуется десмостерол. 5. После чего в боковой цепи восстанавливается двойная связь, и образуется холестерин.
(Восстановление двойной связи в боковой цепи может, однако, происходить и на предшествующих стадиях биосинтеза холестерола.)
Другие пути синтеза[править | править код]
У некоторых организмов при синтезе стероидов могут встречаться другие варианты реакций (например, немевалонатный путь образования пятиуглеродных молекул).
Литература[править | править код]
- [www.xumuk.ru/biologhim/169.html Химическая энциклопедия сайта www.humuk.ru. Скан учебника «Биологическая химия», Берёзов Т. Т., Коровкин Б. Ф.]
- Кольман Я., Рём К.-Г., «Наглядная биохимия», пер. с нем., М., «Мир», 2009.
- Марри Р., Греннер Д., Мейес П., Родуэлл В., «Биохимия человека». М., «Мир», 1993.
Промежуточные продукты метаболизма холестерина и стероидов | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Мевалонатный путь |
| ||||||||||||||
| Не-мевалонатный путь |
| ||||||||||||||
| В холестерин |
| ||||||||||||||
| Витамин D С-27: Холестаны |
| ||||||||||||||
| Жёлчные кислоты С-24: Холаны |
| ||||||||||||||
| Стероидные гормоны |
| ||||||||||||||
| Не у человека |
| ||||||||||||||
Примечания Н — нейростероидные гормоны см. также ферменты, заболевания | |||||||||||||||
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
Источник
БИОСИНТЕЗ ХОЛЕСТЕРИНА
В 40-60-х годах нашего столетия К. Блох и сотр. в опытах с использованием ацетата, меченного 14С по метильной и карбоксильной группам, показали, что оба атома углерода уксусной кислоты включаются в холестерин печени приблизительно в одинаковых количествах. Кроме того, было доказано, что все атомы углерода холестерина происходят из ацетата.
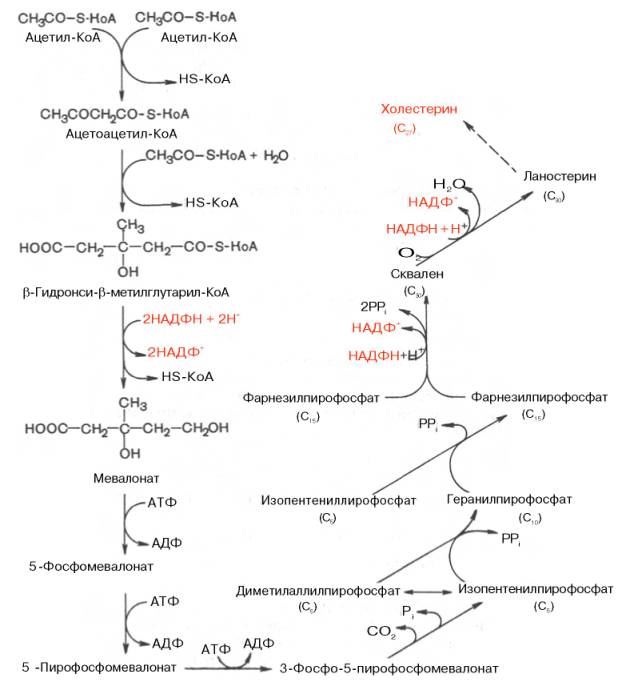
В дальнейшем благодаря работам Ф. Линена, Г. Попьяка, Дж. Корн-форта, А.Н. Климова и других исследователей были выяснены основные детали ферментативного синтеза холестерина, насчитывающего более 35 энзиматических реакций. В синтезе холестерина можно выделить три основные стадии: I — превращение активного ацетата в мевалоновую кислоту, II — образование сквалена из мевалоновой кислоты, III — циклизация сквалена в холестерин.
Рассмотрим стадию превращения активного ацетата в мевалоновую кислоту. Начальным этапом синтеза мевалоновой кислоты из ацетил-КоА является образование ацетоацетил-КоА посредством обратимой тиолазной реакции:
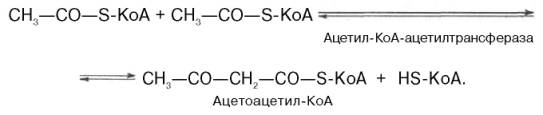
Затем при последующей конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА:
Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновую кислоту:
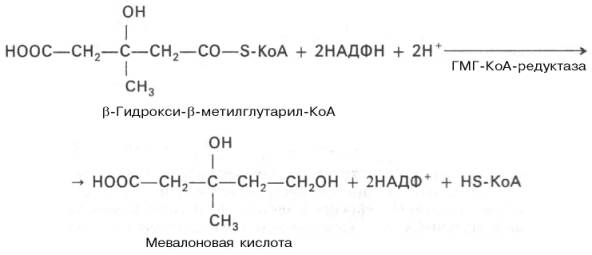
ГМГ-КоА-редуктазная реакция — первая практически необратимая реакция в цепи биосинтеза холестерина. Она протекает со значительной потерей свободной энергии (около 33,6 кДж). Установлено, что данная реакция лимитирует скорость биосинтеза холестерина.
Наряду с классическим путем биосинтеза мевалоновой кислоты имеется второй путь, в котором в качестве промежуточного субстрата, по-видимому, образуется не β-гидрокси-β-метилглутарил-КоА, а β-гидрокси-β-метилглутарил-S-АПБ. Реакции этого пути идентичны начальным стадиям биосинтеза жирных кислот вплоть до образования ацетоацетил-S-АПБ. В образовании мевалоновой кислоты по этому пути принимает участие ацетил-КоА-карбоксилаза — фермент, осуществляющий превращение ацетил-КоА в малонил-КоА. Оптимальное соотношение малонил-КоА и ацетил-КоА для синтеза мевалоновой кислоты — 2 молекулы ацетил-КоА на 1 молекулу малонил-КоА.
Участие малонил-КоА — основного субстрата биосинтеза жирных кислот в образовании мевалоновой кислоты и различных полиизопреноидов показано для ряда биологических объектов: печени голубя и крысы, молочной железы кролика, бесклеточных дрожжевых экстрактов. Этот путь биосинтеза мевалоновой кислоты отмечен преимущественно в цитозоле клеток печени. Существенную роль в образовании мевалоната в данном случае играет ГМГ-КоА-редуктаза, обнаруженная в растворимой фракции печени крысы и неидентичная микросомному ферменту по ряду кинетических и регуляторных свойств. Регуляция второго пути биосинтеза мевалоновой кислоты при ряде воздействий (голодание, кормление холестерином, введение поверхностно-активного вещества тритона WR-1339) отличается от регуляции первого пути, в котором принимает участие микросомная редуктаза. Эти данные свидетельствуют о существовании двух автономных систем биосинтеза мевалоновой кислоты. Физиологическая роль второго пути окончательно не изучена. Полагают, что он имеет определенное значение не только для синтеза веществ нестероидной природы, таких, как боковая цепь убихинона и уникального основания N6-(Δ2-изопентил)-аденозина некоторых тРНК, но и для биосинтеза стероидов (А.Н. Климов, Э.Д. Полякова).
На II стадии синтеза холестерина мевалоновая кислота превращается в сквален. Реакции II стадии начинаются с фосфорилирования мевалоновой кислоты с помощью АТФ. В результате образуется 5-фосфорный эфир, а затем 5-пирофосфорный эфир мевалоновой кислоты:
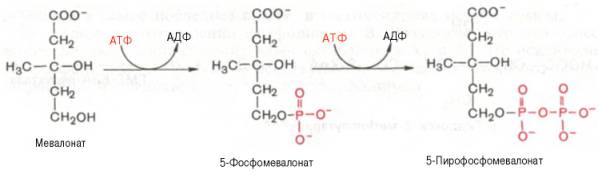
5-пирофосфомевалоновая кислота в результате последующего фосфорилирования третичной гидроксильной группы образует нестабильный промежуточный продукт — 3-фосфо-5-пирофосфомевалоновую кислоту, которая, декарбоксилируясь и теряя остаток фосфорной кислоты, превращается в изопентенилпирофосфат. Последний изомеризуется в диметилаллилпирофосфат:
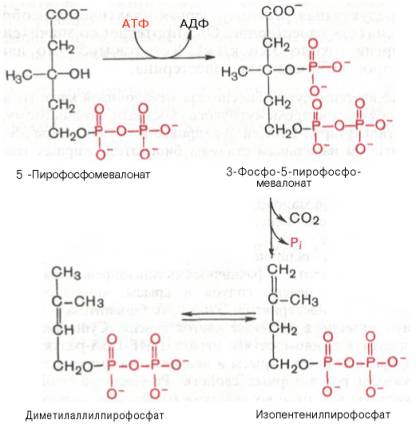
Затем оба изомерных изопентенилпирофосфата (диметилаллилпирофос-фат и изопентенилпирофосфат) конденсируются с высвобождением пи-рофосфата и образованием геранилпирофосфата:
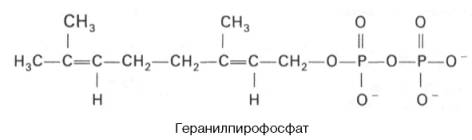
К геранилпирофосфату вновь присоединяется изопентенилпирофосфат. В результате этой реакции образуется фарнезилпирофосфат:
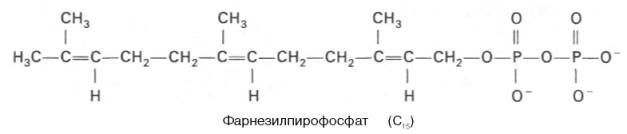
В заключительной реакции данной стадии в результате НАДФН-за-висимой восстановительной конденсации 2 молекул фарнезилпирофосфата образуется сквален:
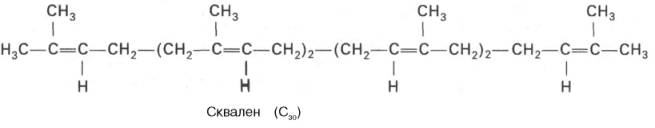
На III стадии биосинтеза холестерина сквален под влиянием сквален-оксидоциклазы циклизируется с образованием ланостерина. Дальнейший процесс превращения ланостерина в холестерин включает ряд реакций, сопровождающихся удалением трех метильных групп, насыщением двойной связи в боковой цепи и перемещением двойной связи в кольце В из положения 8, 9 в положение 5, 6 (детально эти последние реакции еще не изучены):
Приводим общую схему синтеза холестерина:
Начиная со сквалена, все промежуточные продукты биосинтеза холестерина (включая и холестерин) нерастворимы в водной среде. Поэтому они участвуют в конечных реакциях биосинтеза холестерина, будучи связанными со стеринпереносящими белками (СПБ). Это обеспечивает их растворимость в цитозоле клетки и протекание соответствующих реакций. Данный факт имеет важное значение и для вхождения холестерина в клеточные мембраны, окисления в желчные кислоты, превращения в стероидные гормоны. Как отмечалось, реакцией, регулирующей скорость биосинтеза холестерина в целом, является восстановление β-гидрокси-β-метилглутарил-КоА в мевалоновую кислоту, катализируемое ГМГ-КоА-редуктазой. Данный фермент испытывает регуляторное воздействие ряда
факторов. В частности, скорость синтеза редуктазы в печени подвержена четким суточным колебаниям: максимум ее приходится на полночь, а минимум — на утренние часы.
Активность ГМГ-редуктазы возрастает при введении инсулина и тире-оидных гормонов. Это приводит к усилению синтеза холестерина и повышению его уровня в крови.
При голодании, тиреоидэктомии, введение глюкагона и глюкокорти-коидов, напротив, отмечается угнетение синтеза холестерина, что прежде всего связано со снижением активности ГМГ-КоА-редуктазы.
Еще по теме:
- Биосинтез холестерина — Наглядная биохимия
Источник
Ацетил-КоА
| Ацетил-КоА | |
|---|---|
| Сокращения | Ацетил-КоА |
| Традиционные названия | Ацетил-коэнзим А |
| Хим. формула | C23H38N7O17P3S |
| Молярная масса | 809,572083 г/моль |
| Рег. номер CAS | 72-89-9 |
| PubChem | 444493 |
| Рег. номер EINECS | 200-790-9 |
| SMILES | O=C(SCCNC(=O)CCNC(=O)[C@H](O)C(C)(C)COP(=O)(O)OP(=O)(O)OC[C@H]3O[C@@H](n2cnc1c(ncnc12)N)[C@H](O)[C@@H]3OP(=O)(O)O)C |
| InChI | InChI=1S/C23H38N7O17P3S/c1-12(31)51-7-6-25-14(32)4-5-26-21(35)18(34)23(2,3)9-44-50(41,42)47-49(39,40)43-8-13-17(46-48(36,37)38)16(33)22(45-13)30-11-29-15-19(24)27-10-28-20(15)30/h20-11,13,16-18,22,33-34H,4-9H2,1-3H3,(H,25,32)(H,26,35)(H,39,40)(H,41,42)(H2,24,27,28)(H2,36,37,38)/t13-,16-,17-,18+,22-/m1/s1 ZSLZBFCDCINBPY-ZSJPKINUSA-N |
| ChEBI | 15351 |
| ChemSpider | 392413 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Ацетилкофермент А, ацетил-коэнзим А, сокращённо ацетил-КоА — важное для обмена веществ соединение, используемое во многих биохимических реакциях. Его главная функция — доставлять атомы углерода с ацетил-группой в цикл трикарбоновых кислот, чтобы те были окислены с выделением энергии. По своей химической структуре ацетил-КоА — тиоэфир между коферментом А (тиолом) и уксусной кислотой (носителем ацильной группы). Ацетил-КоА образуется во время второго шага кислородного клеточного дыхания, декарбоксилирования пирувата, который происходит в матриксе митохондрии. Ацетил-КоА затем поступает в цикл трикарбоновых кислот.
Ацетил-КоА — важный компонент биологического синтеза нейротрансмиттера ацетилхолина. Холин, в соединении с ацетил-КоА, катализируется ферментом холин-ацетилтрансферазой, чтобы образовать ацетилхолин и коэнзим А.
Функции[править | править код]
Дегидрогеназ пирувата и реакции пируват-формиат-лиазы[править | править код]
Кислородное преобразование пирувата в ацетил-КоА называют реакцией дегидрогеназа пирувата. Она катализируется пируватдегидрогеназным комплексом. Другие преобразования между пируватом и ацетил-КоА возможны. Например, пируват-формиат-лиазы преобразуют пируват в ацетил-КоА и муравьиную кислоту.
Метаболизм жирных кислот[править | править код]
В организме человека осуществляется синтез насыщенных жирных кислот с парным количеством углеродных атомов (в большинстве пальмиата и стеарата); метаболическим источником для этого синтеза является ацетил-КоА, который образуется за счет аэробного окисления глюкозы. Активность процесса биосинтеза жирных кислот зависит от характера диеты; еда, которая содержит большое количество жиров, подавляет скорость этого синтеза.
Ферментные реакции биосинтеза жирных кислот из ацетил-Коа, в отличие от их окисления, осуществляются в цитоплазме клеток; основным продуктом этого синтеза является пальмитиновая кислота .
Непосредственным донором двухуглеродных фрагментов, которые используются клеткой для синтеза длинноцепочечных жирных кислот, является ацетил-КоА, образованный в реакции окислительного декарбоксилирования пирувата, которая протекает в матриксе митохондрий. Поскольку внутренняя мембрана митохондрий непроницаема для ацетил-КоА, то для использования ацетил-КоА в процессе биосинтеза жирных кислот применяется специальная система, которая транспортирует митохондриальный ацетил-КоА в цитозоль. Процесс осуществляется следующим образом
1. Внутри митохондрий ацетил-КоА взаимодействует с оксалоацетатом, образуя лимонную кислоту (цитрат), которая является главным субстратом окислительного цитратного цикла, но может частично оставлять митохондрии и выходить в цитозоль с помощью специальной транспортной системы трикарбоксилатов:
1)
2)
Стимуляция выхода цитрата из митохондрий в цитоплазму возможно в условиях, если способствуют активации анаболических процессов в организме, в частности при усиленном питании глюкозой и другими сахарами, гликолитическое окисление которых порождает накопление цитрата и других метаболитов ЦТК в матриксе митохондрий.
2. В цитозольном пространстве цитрат расщепляется специальной лиазой с образованием оксалоацетата и цитозольного ацетил-КоА, который поступает в систему синтеза высших жирных кислот:
У животных ацетил-КоА является основой баланса между углеводным обменом и жировым обменом. Обычно ацетил-КоА из метаболизма жирных кислот поступает в цикл трикарбоновых кислот, содействуя энергетическому обеспечению клеток. В печени, когда уровень циркуляции жирных кислот высок, производство ацетил-КоА от разрыва жиров превышает энергетические потребности клетки. Чтобы использовать энергию, доступную из лишних ацетил-КоА, создаются кетоновые тела, которые затем могут циркулировать в крови. В некоторых обстоятельствах это может привести к высокому уровню кетоновых тел в крови, состоянию, называемому кетозом, которое отличается от кетоацидоза, опасного состояния, способного повлиять на диабетиков. У растений синтез новых жирных кислот происходит в пластидах. Многие растения запасают большие количества масел в семенах, чтобы поддерживать прорастание и ранний рост саженцов, пока они не перешли на питание от фотосинтеза. Жирные кислоты включены в липиды мембраны, главнейший компонент большинства мембран.
Другие реакции[править | править код]
- Две молекулы ацетил-КоА могут быть соединены, чтобы создать ацетоацетил-КоА, что будет первым шагом в ГМГ-КоА/биосинтезе холестерина, предшествующем синтезу изопреноидов. У животных ГМГ-КоА — это жизненный предшественник синтеза холестерина и кетоновых тел.
- Ацетил-КоА — также источник ацетил-группы, включённой в определённые лизиновые остатки гистоновых и негистоновых белков в посттрансляционной модификации ацетилирования, реакции, катализируемой ацетилтрансферазой.
- У растений и животных цитозольный ацетил-КоА синтезируется АТФ-цитратлиазой. Когда глюкоза изобилует в крови животных, она преобразуется посредством гликолиза в цитозоле в пируват, а затем в ацетил-КоА в митохондрии. Избыток ацетил-КоА вызывает производство избыточных цитратов, которые переносятся в цитозоль, чтобы дать начало цитозольному ацетил-КоА.
- Ацетил-КоА может быть карбоксилирован в цитозоле в ацетил-КоА-карбоксилазу, давая начало малонил-КоА, необходимого для синтеза флавоноидов и родственных поликетидов, для удлинения жирных кислот (образование восков), для образования кутикулы и масла в семенах у членов рода Капуста, а также для малонации протеинов и других фитохимических соединений.
- У растений они включают в себя сесквитерпены, брассиностероиды (гормоны) и мембранные стиролы.
См. также[править | править код]
- Цикл трикарбоновых кислот
- Биосинтез холестерина
Литература[править | править код]
- Т. Т. Берёзов, Б. Ф. Коровкин. Биологическая химия. — М.: Медицина, 1998. — 704 с. — 15 000 экз. — ISBN 5-225-02709-1.
- Ю. Б. Филиппович. Основы биохимии. — М.: Агар, 1999. — 512 с. — 5000 экз. — ISBN 5-89218-046-8.
Источник