Аллостерический механизм регуляции гемоглобина
Содержание статьи
Вопрос 8. Эффект Бора, аллостерическая регуляция насыщения гемоглобина кислородом
График зависимости насыщения миоглобина кислородом от парциального давления кислорода имеет вид гиперболы; для гемоглобина же это зависимость отражается S- образной кривой. Графики подтверждают функцию данных хромопротеинов. Функция миоглобина — присоединить кислород, доставляемый гемоглобином и его запасти. Миоглобин не может транспортировать кислород так как даже при парциальном давлении 20 мм.рт.ст., степень насыщения миоглобина кислородом будет около 85%. Однако при кислородном голодании, которым сопровождается тяжелая физическая работа, РО2 в мышечной ткани может понизиться и до 5 мм.рт.ст., при столь низком давлении миоглобин легко отдает связанный кислород, обеспечивая тем самым окислительный синтез АТФ в митохондриях мышечных клеток.
Кривая диссоциации оксигемоглобина имеет S- образную конфигурацию. Этот факт также связан с функцией гемоглобина и имеет биохимический смысл. В процессе поглощения кислорода в легких напряжение О2 в крови (РО2) приближается к таковому в альвеолах. У молодых людей РО2 артериальной крови составляет около 95 мм.рт.ст.. Насыщение гемоглобина при этом — 97%. С возрастом (или при заболеваниях легких) напряжение О2 в артериальной крови может значительно снижаться, однако, поскольку кривая диссоциации оксигемоглобина в правой её части почти горизонтальна, насыщение крови кислородом уменьшается не намного. При РО2 равное 60 мм.рт.ст. насыщение гемоглобина составляет 90%. Таким образом, горизонтальный участок кривой диссоциации предупреждает существенное снижение насыщения артериальной крови кислородом.
Крутой наклон среднего участка свидетельствует об очень благоприятных условиях для отдачи кислорода тканям. В состоянии покоя РО2 в области венозного конца капилляра равно приблизительно 40 мм.рт.ст., что соответствует примерно 73% насыщения. Если в результате увеличения потребления кислорода его напряжение в венозной крови падает лишь на 5 мм.рт.ст, то насыщение гемоглобина кислородом снижается не менее чем на 7%.
Олигомерные белки способны к аллостерической регуляции своих функций. Присоединение лигандов в участках, пространственно удаленных друг от друга (аллостерических), способно вызвать конформационные изменения во всем белке.
Результатом воздействия лигандов Н+, 2,3-ДФГ, СО2 является затруднение перехода из Т- состояния в R. Т-форма характеризуется меньшим сродством к кислороду и способна легко отдавать его тканям. Таким образом, при увеличение концентрации 2,3- ДФГ, уменьшение рН среды, а также при возрастании РСО2 и температуры кривая диссоциации оксигемоглобина сдвигается вправо.
Эффект Бора
Влияние рН на характер кривой диссоциации оксигемоглобина называется эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
Гемоглобин в дезоксигенерированном состоянии имеет более высокое сродство к протонам, чем оксигемоглобин. Другими словами R — форма (оксигенерированная) является более сильной кислотой, чем Т-форма (дезоксигенерированная). Поэтому когда дезоксигемоглобин в легких присоединяет кислород, происходит переход в R — форму и разрыв некоторых связей, в результате чего и высвобождаются протоны, ответственные за эффект Бора. Наоборот, при высвобождении кислорода образуется Т-структура и разорванные связи между субъединицами должны быть восстановлены, и протоны вновь присоединяются к остаткам гистидина в — цепях. Таким образом, протонирование гемоглобина снижает его сродство к О2 и увеличивает потребление О2 в ткани.
Эффект Бора имеет важное физиологическое значение. Образующийся в тканях СО2 должен транспортироваться в легкие. Он поступает в эритроциты по градиенту напряжения. В них фермент карбоангидраза превращает его в Н2СО3, который диссоциирует на бикарбонат, ион и протон. Последний сдвигает равновесие влево в уравнении (1).
Hb + 4 O2= Hb (О2)4 + (H+)n
Где n — величина порядка 2; число зависит от целого комплекса параметров, тем самым заставляя Hb О2 отдавать свой кислород.
НСО3- пассивно продвигается через ионный канал по градиенту концентрации в сыворотку.
Продвижение НСО3- не сопровождается перемещением Н+, поскольку нет канала, позволяющего ему пройти через мембрану эритроцитов. Для сохранения ионного равновесия при выходе НСО3- из клетки, Cl- перемещаются внутрь её через тот же ионный канал. Такое двойное перемещение известно как хлоридный сдвиг (сдвиг Хамбургера).
Растворенный НСО3- движется вместе с венозной кровью обратно в легкие. Здесь высвобождение протона из гемоглобина при оксигениции приводит к образованию НСО3- (по принципу Ле-Шателье).
НСО3-+ Н+= Н2СО3-,
что позволяет карбоангидразе образовать СО2.
Разрушение НСО3- в эритроците обуславливает вхождение в него НСО3- из сыворотки, так что в легких происходит обратный хлоридный сдвиг, приводящий к выведению СО2 с выдыхаемым воздухом.
Источник
Аллостерическая регуляция сродства гемоглобина к кислороду 2,3-дфг
2,3-ДФГ снижает сродство гемоглобина к кислороду и, таким образом, повышает отдачу кислорода тканям. Если кровь израсходовала весь свой запас ДФГ, гемоглобин остается фактически насыщенным кислородом. При акклиматизации в условиях высокогорья содержание ДФГ в эритроцитах резко увеличивается. ДФГ является аллотерическим лигандом, так как связывается с гемоглобином в другом по сравнению с О2 участком. ДФГ встраивается в полость тетрамерной молекулы гемоглобина, полость образована остатками всех 4 протомеров.
В Т — форме (дезоксигенерированной) молекулы Hb имеются дополнительные связи, и поэтому размер центральной полости больше, чем в R — форме (дезоксигемоглобине). Поэтому ДФГ взаимодействует только с Т — формой стабилизируя её, путем образования связи между атомами кислорода ДФГ и тремя положительно заряженными группами в каждой из — цепей.
В легких при высоком парциальном давлении кислород взаимодействует с Hb, изменяется конформация белка, уменьшается центральная полость и ДФГ вытесняется из гемоглобина.
Вопрос 9. Реакции синтеза гема, регуляция синтеза.
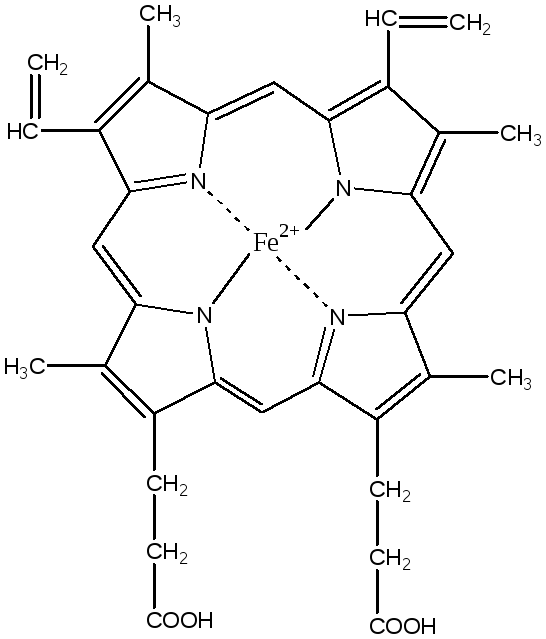
Гем является простетической группой гемоглобина, миоглобина, цитохромов, каталазы и пероксифазы.
Гем синтезируется во всех клетках, но наиболее активно синтез идет в печени и костном мозге, так как в этих тканях идет синтез гемоглобина и цитохромов. Гем в эритроцитах начинает синтезироваться уже на стадии полихроматофильных эритробластов. Клетки делится, постепенно накапливают гемоглобин, их цитоплазма становится оксифильной — это ацирофильные эритробласты. Синтез гема заканчивается только в зрелых эритроцитах (нет митохондрий).
Для синтеза гема необходимо два исходных реагента: глицин и сукцинил — КоА. Эти вещества необходимы для синтеза — аминолевулиновой кислоты ( — ALA). Реакция катализируется пиридоксальфосфатзависимым ферментам ALA — синтазой, которая локализуется в митохондриях.
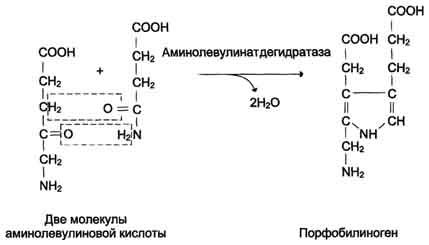
Далее процесс перемещается в цитоплазму, так как следующий фермент синтеза гема — ALA — дегидротаза, локализован именно там. ALA — дегидротаза — Zn- содержащий фермент. Этот фермент катализирует реакцию конденсации двух молекул ALA с образованием пиррола — порфобилинагена (ПБГ).
Остальные стадии биосинтеза гема включают в себя соединение 4 молекул ПБГ в единую структуру, модификацию групп боковых цепей и образование хелатных комплексов с двух валентным атомом железа. Промежуточными тетрапехронами на стадиях между образованием ПБГ и формированием гема являются бесцветные (уро-) и копропорфириногемы. (содержащий метеновые мостики (-СН=)). Опишем подробнее стадии биосинтеза гема из ПБГ.
Уропорфириноген III превращается в копропорфириноген III путем декарбоксилирования всех ацетатных групп (А), вместо которых образуются метильные группы (М). Реакцию катализирует уропорфириноген — декарбоксилаза. Далее копропорфириноген III (КПГ) поступает в митохондрии, где превращается в протопорфириноген III (ППГ), а затем в протопорфирин III. Митоходриальный фермент копропорфириногеноксидаза катализирует декарбоксилирование и окисление двух пропионовых боковых цепей с образованием винильной группы во 2,4 положении (-СН=СН2). Так образуется ППГ. Затем он окисляется протопорфириногенооксидазой с образованием протопорфирина IX.
Завершающей стадией синтеза гема является включение в протопорфирин двух валентного железа. Эта реакция катализируется митохондриальным ферментом гем — синтезой или ферро — хелатазой.
Важным является и тот факт, что в процессе синтеза гема возрастает гидрофобность тетрапиррольных соединений в результате декарбоксилирования замещающих групп. Так, более полярный уропорфириноген экскретируется преимущественно с мочой, а более гидрофобные копропорфириноген и ППГ оказываются преимущественно в желчи и удаляются в составе фекалий.
Источник
94. Синтез гема и гемоглобина. Регуляция этих процессов. Вариации первичной структуры и свойств гемоглобина. Гемоглобинопатии.
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени (рис. 13-2). В костном мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах — для образования цитохрома Р450.
Первая реакция синтеза гема — образование 5-аминолевулиновой кислоты из глицина и сук-цинил-КоА (рис. 13-3) идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции — сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза.
Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2 молекул 5-аминолевулиновой кислоты молекулу порфобилиногена (рис. 13-4), дезаминированиепорфобилиногена с образованием гидроксиметилбилана, ферментативное превращение гидроксиметилбилана в молекулу уропор-фобилиногена III, декарбоксилирование последнего с образованием копропорфириногена III. Гидроксиметилбилан может также нефермента-тивно превращаться в уропорфириноген I, который декарбоксилируется в копропорфирино-ген I. Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходят заключительные реакции синтеза гема. В результате двух последовательных окислительных реакций копропорфириноген III превращается в протопорфириноген IX, а протопорфириноген IX — в Протопорфирин IX. Фермент феррохела-таза, присоединяя к протопорфирину IX двухвалентноелентное железо, превращает его в гем (рис. 13-2). Источником железа для синтеза гема служит депонирующий железо белок ферритин. Синтезированный гем, соединяясь с α и β-полипепептидными цепями глобина, образует гемоглобин. Гем регулирует синтез глобина: при снижении скорости синтеза гема синтез глобина в ретикулоцитах тормозится.
Донором железа служит депонирующий железо в клетках белок ферритин.

Рис. 13-3. Реакция образования 5-аминолевулиновой кислоты.
Регуляция биосинтеза гема
Регуляторную реакцию синтеза гема катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Скорость реакции регулируется аллостерически и на уровне трансляции фермента.
Аллостерическим ингибитором и корепрессором синтеза аминолевулинатсинтазы является гем (рис. 13-5).
В ретикулоцитах синтез этого фермента на этапе трансляции регулирует железо. На участке инициации мРНК, кодирующей фермент, имеется последовательность нуклеотидов, образующая шпилечную петлю, которая называется железочувствительным элементом (от англ, iron-responsiveelement, IRE) (рис. 13-6).
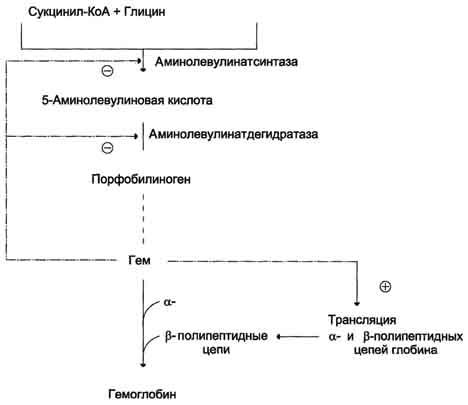
Рис. 13-5. Регуляция синтеза гема и гемоглобина. Гем по принципу отрицательной обратной связи ингибирует аминолевулинатсинтазу и аминолевулинатдегидратазу и является индуктором трансляции α- и β-цепей гемоглобина.
При высоких концентрациях железа в клетках оно образует комплекс с остатками цистеина регуляторного железосвязывающего белка. Взаимодействие железа с регуляторным железосвязывающим белком вызывает снижение сродства этого белка к IRE-элементу мРНК, кодирующей аминолевулинатсинтазу, и продолжение трансляции (рис. 13-6, А). При низких концентрациях железа железосвязывающий белок присоединяется к железо-чувствительному элементу, находящемуся на 5′-нетранслируемом конце мРНК, и трансляция аминолевулинатсинтазы тормозится (рис. 13-6, Б).
Аминолевулинатдегидратаза также аллостерически ингибируется гемом, но так как активность этого фермента почти в 80 раз превышает активность аминолевулинатсинтазы, то это не имеет большого физиологического значения.
Дефицит пиридоксальфосфата и лекарственные препараты, которые являются его структурными аналогами, снижают активность аминолевулинатсинтазы.
Альфа-полипептидная цепь заканчивается комбинацией аминокислот валина-лейцина, а бета-полипептидная цепь — комбинацией валина-гистидина-лейцина. Альфа- и бета-полипептидные цепи в гемоглобиновой молекуле не размещены линейно, как это выглядит на первый взгляд из данных,это первичная структура .
Гемоглобинопатии группа наследственных гемолитических анемий, обусловленных нарушениями первичной структуры гемоглобина (качественные гемоглобинопатии) или синтеза глобиновых цепей (количественные гемоглобинопатии).
Соседние файлы в папке экз
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
6.Связывание гемоглобина с кислородом(тритерный механизм),кооператорный аллостерический эффект.Кривая насыщения гемоглобина и миоглобина кислородом.

 <——-кривая насыщенности.
<——-кривая насыщенности.
7.Сродство гемоглобина к кислороду и его регуляции(эффект Бора,влияние 2,3-дифосфоглицерата).
2,3-ДФГ снижает сродство гемоглобина к кислороду и, таким образом, повышает отдачу кислорода тканям. Если кровь израсходовала весь свой запас ДФГ, гемоглобин остается фактически насыщенным кислородом. При акклиматизации в условиях высокогорья содержание ДФГ в эритроцитах резко увеличивается. ДФГ является аллотерическим лигандом, так как связывается с гемоглобином в другом по сравнению с О2 участком. ДФГ встраивается в полость тетрамерной молекулы гемоглобина, полость образована остатками всех 4 протомеров.

8.Транспорт углекислого газа эритроцитом.

9.Лейкоцит:функции,химический состав,особенности обмена веществ.Биохимические аспекты фагоцитоза.

Основное назначение лейкоцитов — участие в различных видах защиты организма (иммунная защита, фагоцитоз, пиноцитоз, система комплимента и т.д.).

Обмен веществ в лейкоцитах
лейкоциты являются полноценными клетками и содержат все необходимые для осуществления базального метаболизма органеллы;
лейкоцитам присущи все виды обмена (за исключением глюнеогенеза);
обмен веществ в лейкоцитах характеризуется рядом особенностей (в связи с выполнением ими специфических функций).
4.метаболизм лейкоцитов способен быстро реагировать на изменение условий среды. Это способность позволяет лейкоцитам существовать в аэробной и анаэробной среде (очаге воспаления), легко активизироваться в присутствии чужеродных веществ.
Фагоцитоз — процесс активного поглощения и переваривания клетками организма попавших в него живых и убитых микробов или других инородных частиц. Фагоцитоз осуществляется макрофагами и нейтрофилами, но присущ и другим лейкоцитам.
Стадии фагоцитоза
хемотаксис — целенаправленное передвижение фагоцитов в направлении химического градиента хемоаттрактантов (ими могут быть бактериальные компоненты, лимфокины);
адгезия (прикрепление);
эндоцитоз — впячивание мембраны с образованием фагоцитарной вакуолей — фагосомы;
внутриклеточное переваривание связано с образованием фаголизосом, путем слияния первичных лизосом (азурофильных гранул) с фагосомами.
Свертывающие и противосвертывающие системы крови.Фибринолиз
1.Гемостаз,определение,компоненты,стадии.
Гемостаз — сложная биологическая система приспособительных реакций, обеспечивающая сохранение жидкого состояния крови в сосудистом русле и остановку кровотечений из поврежденных сосудов путем тромбирования.
Проще говоря:Гемостаз — остановка крови. Возникает при повреждении стенки сосудов.Но 7этаж может до всего докапаться.
Система гемостаза включает следующие компоненты:
1) сосудистую стенку (эндотелий);
2) форменные элементы крови (тромбоциты, лейкоциты, эритроциты);
3) плазенные ферментные системы (систему свертывания крови, систему фибринолиза, клекреин-кининовую систему);
4) механизмы регуляции
Сосудисто-тромбоцитарный.
Роль:
1) обеспечивает остановку кровотечения из сосудов микроциркулярного русла и в сосудах с низким АД;
2) является предфазой коагулляционного гемостаза.
Фазы.
1 Рефлекторный спазм поврежденных сосудов. Обеспечивается БАВ, которые выделяются из разрушенных тромбоцитов (серотонин, НА, Адр.) — временно прекращают кровотечение. Эта реакция увеличивается при охлаждении поврежденного участка.
2 процесс. Спазм сосудов дополняется: адгезией тромбоцитов.
В силу электростатического взаимодействия (тромбоцит «- «), обнажаются волокна коллагена стенки «+», происходит прилипание тромбоцитов к стенке (3 — 10с).
3 стадия. Обратимая агрегация (скучивание) тромбоцитов. Начинается почти одновременно с адгезией. Катализатор этого процесса АДФ, выделяемая из поврежденных тканей сосуда — внешняя АДФ, из тромбоцитов и эритроцитов — «внутренняя». Образуется рыхлая тромбоцитарная пробка, пропускающая плазму — белый тромб.
4 стадия. Необратимая агрегация — тромбоцитарная пробка становится непроницаемой для плазмы. Происходит это под влиянием тромбина, который меняет структуру мембраны тромбоцитов, и они сливаются в гомогенную массу.
5 Ретракция белого тромба. Это сокращение и уплотнение белого тромба, за счет сокращения нитей фибрина.
Этим путем (сосудисто-тромбоцитарным) останавливается кровотечение из сосудов МЦР за 3 — 4 минуты при бытовых травмах.
АЛЬТЕРНАТИВА ОТВЕТА.Фазы свертывания крови
Свертывание крови — это сложный ферментативный, цепной (каскадный), матричный процесс, сущность которого состоит в переходе растворимого белка фибриногена в нерастворимый белок фибрин. Процесс называется каскадным, так как в ходе свертывания идет последовательная цепная активация факторов свертывания крови. Процесс является матричным, так как активация факторов гемокоагуляци происходит на матрице. Матрицей служат фосфолипиды мембран разрушенных тромбоцитов и обломки клеток тканей.
Процесс свертывания крови происходит в три фазы.
Сущность первой фазы состоит в активации Х-фактора свертывания крови и образовании протромбиназы. Протромбиназа — это сложный комплекс, состоящий из активного Х-фактора плазмы крови, активного V-фактора плазмы крови и третьего тромбоцитарного фактора. Активация Х-фактора происходит двумя способами. Деление основано на источнике матриц, на которых происходит каскад ферментативных процессов. При внешнем механизме активации источником матриц является тканевый тромбопластин (фосфолипидные осколки клеточных мембран поврежденных тканей), при внутреннем — обнаженные коллагеновые волокна, фосфолипидные осколки клеточных мембран форменных элементов крови.
Сущность второй фазы — образование активного протеолитического фермента тромбина из неактивного предшественника протромбина под влиянием протромбиназы. Для осуществления этой фазы необходимы ионы Са.
Сущность третьей фазы — переход растворимого белка плазмы крови фибриногена в нерастворимый фибрин. Эта фаза осуществляется три 3 стадии.
1. Протеолитическая. Тромбин обладает эстеразной активность и расщепляет фибриноген с образованием фибринмономе-ров. Катализатором этой стадии являются ионы Са, II и IX протромбиновые факторы.
2. Физико-химическая, или полимеризационная, стадия. В ее основе лежит спонтанный самосборочный процесс, приводящий к агрегации фибрин-мономеров, который идет по принципу «бок в бок» или «конец в конец». Самосборка осуществляется путем формирования продольных и поперечных связей между фибрин-мономерами с образованием фибрин-полимера (фибрина-S) Волокна фибрина-S легко лизируются не только под влиянием плазмина, но и комплексных соединений, которые не обладают фибринолитической активностью.
3. Ферментативная. Происходит стабилизация фибрина в присутствии активного XIII фактора плазмы крови. Фибрин-S переходит в фибрин-I (нерастворимый фибрин). Фибрин-1 прикрепляется к сосудистой стенке, образует сеть, где запутываются форменные элементы крови (эритроциты) и образуется красный кровяной тромб, который закрывает просвет поврежденного сосуда. В дальнейшем наблюдается ретракция кровяного тромба — нити фибрина сокращаются, тромб уплотняется, уменьшается в размерах, из него выдавливается сыворотка, богатая ферментом тромбином. Под влиянием тромбина фибриноген вновь переходит в фибрин, за счет этого тромб увеличивается в размерах, что способствует лучшей остановке кровотечения. Процессу ретракции тромба способствует тромбостенин — контрактивный белок кровяных пластинок и фибриноген плазмы крови. С течением времени тромб подвергается фибринолизу (или растворению). Ускорение процессов свертывания крови называется гиперкоагуляцией, а замедление — гипокоагуляцией
Соседние файлы в предмете Биохимия
- #
- #
Источник