Белковая часть гемоглобина а состоит из пептидных цепей
емоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
| Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: 1. Функции клеток крови. Функции эритроцитов. Свойства эритроцитов. Цикл Эмбдена-Мейергофа. Строение эритроцитов. 2. Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина. 3. Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты. 4. Железо. Железо в норме. Роль ионов железа в эритропоэзе. Трансферрин. Потребность организма в железе. Дефицит железа. ОЖСС. 5. Эритропоэз. Эритробластические островки. Анемия. Эритроцитоз. 6. Регуляция эритропоэза. Эритропоэтин. Половые гормоны и эритропоэз. 7. Лейкоциты. Лейкоцитоз. Лейкопения. Гранулоциты. Лейкоцитарная формула. 8. Функции нейтрофильных гранулоцитов ( лейкоцитов ). Дефенсины. Кателицидины. Белки острой фазы. Хемотаксические факторы. 9. Бактерицидный эффект нейтрофилов. Гранулопоэз. Нейтрофильный гранулопоэз. Гранулоцитоз. Нейтропения. 10. Функции базофилов. Функции базофильных гранулоцитов. Нормальное количество. Гистамин. Гепарин. Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140-175) г гемоглобина, у женщин — 138 (123-153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20-30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50-80 % гемоглобина у него представлены гемоглобином F и 15-40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5-33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. — Также рекомендуем «Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.» |
Источник
ШÈ]ÙìJP•4r!Õƒè®Ógݛ؆¶ø8ûLñRî†k@)|®›•$Óƒí^ªw¬)¡ìq)¡’?£»»:óü¤~Áæ¡Ë wýÈkùšêXwtxæM»Ù¨I $üÇå]ÚÔÁŽ’>w½-ïÊ5[¨Çå-w4 [ÔŸƒÅe>¶¸6p»Kk?/Û;î¹evŒ~ ~ÐèÛý4ŠŸÓ3µÌÑóç ÍÀ½Ñàuø¸÷ Öî’Š»Ë3W±¾× EÐ ð°»ç«Rô¼É¼‹WÞÄësKFFªSö¹ìVÎ X;’x42ËAS»LèE=ü÷ùr-² L|»¬Úæ•Y9-ÝO4gR_5¦6-f9¯O,?KÂYT˜5p&j™÷vz»Ð.AÍoßõÚß« vӢɨnV&ˆ:‹ù1T™4š =*À-¨ßÓ ºj[nÉ’Ã%µ-¯ÛÙ¬ƒ%äE;¾Ï]¬¾»å91~Àâé >^Rî $b+¯ëde=žV~òpý©‰l«Õñ$]êãXDí¢ä™-{Wº¨m5duÛM€¬ÔIb!Œø(ä»JÏHz6ÑNjXe¥º‡[nmRz6-&·2:à#hC‡€]hÂÔkJ[R;9ƒSÒsì-¨L!9@ÿHÏZÕ¾bÐßÈŽDˆ½…ÔåwôjŒ ¬¦øÚ-Žµ¾…ÊTœìÊGOSf¶NÍ$Œ´÷µÞë,à÷¥JH¿ «¯Ùz-赿9ì:uÐáŸCÍô6Þ¡£ç P˘@)5éªöböÇ[™Õ¤ØÈ?À Öikì±TsYBÍfÆÉÛÈý{)o:p²£œÝ&©D€7Ýß»þ@ú™v¬ß_PzÀÊW,-Íۮ绯Ԣ-Ï«êâòL-U ‘TC.M¸¨3¼¶¸ún»Ú†¸ëo’mT²AT0™ówcÄwø¶»€SæíÀeSæyðÆ1dâ2ükx‡= Ëu=o&ýk5=àcK·¹©èÆLö^’¤ñtÐ>=¾UlÁ±¸U7*ºŒ»õ¡mȵ6ö@¨™«½û=8%»ÛVžj»¿5∮_•à¼Ümëñr2 …[uøùs°»èÖ!äS_M¡òÏQ×#@æ½Ák/·ÓI«võªüÕ¨£nÁ•-´K’¡ CáÂXC»í¦˜®kyv¨¡]ñaøÌÝÉ渡›P^ÌjIÊ_¶ôV‰ÝsíóÒy†z; }@‹Hð’|’âàêm5Öm×|s¡5ÆÁ©nz¬z+ÃTENÖvÌòqÒÎê4·«ê[JŒ$pºÆ»ÝòN Q/ _r2f趽¦oíÀ1É1Ç;HÜ«yk»ÒžO-Ž;.Û¾j K=’µ·áú¬»Ý³›ÍÙè›îäƒt3…hE'»$^RˆÕÀ%m‹Åê½V£Áf¾Åµ›À²VXJ÷ÈÒ«Bøš7Ú!>¿f±ãzÞÇŽ¬Œ§ š¾y Ïœë»òQ·¦M‰ÿ뙈`m*A+å2¿Ý·Ò*€/Ä’-:q¿Þ,e*ù7=¡vpSU»ÑÄÏ¢Çaò`’¢x còz/íüpÖæ²-Kôí› 7-«jöï¼pO²O+tDƶ¿ø||æRâýµÍ=®3 ˜gnM»wK¨·ÏD|›âPמvŸWb²Þí&’Éÿ^SgÄÐuòü~Ì÷¦†x‡ÿ»Ë’Ÿ¿ r¢WTˆ)j¤uaãá-ñUzxëÛÞÉDOv’•Òy6ª·¨à?’yåb%Âo8½µf^áÐ’³6Õr~í Ù-»©Áb¾¸Å²ó{ÖÅ#·÷?üÍXZ´FÒ-V uXwqËï¬`ó«ùú·¿45Y+©›ÅÇ.*JHÅ°4a%È÷+»4û-DÖ¸‰)ן7$Ôš…?: ¡Eíý2Y^[n¿€®¿^¿ñf]ßJƒ9¤ˆÔãk Û윲sNO¾Ã(‰HÉHCk¶áŠòõ6(´Ÿ±.~r(³+é J¾u’YµƒµúÇ4«âh, sp·fÌø.pµºÝj¯¬íêp \*Á îV—ÁwrÕÔ» †œô2G$¼ubIvÿÛQл endstream endobj 25 0 obj > endobj 26 0 obj [ 27 0 R] endobj 27 0 obj > endobj 28 0 obj > endobj 29 0 obj > endobj 30 0 obj > endobj 31 0 obj > endobj 32 0 obj > endobj 33 0 obj [ 34 0 R] endobj 34 0 obj > endobj 35 0 obj > endobj 36 0 obj > endobj 37 0 obj >/F 4/A>/StructParent 7>> endobj 38 0 obj >/XObject>/ExtGe>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/Box[ 0 0 595.32 841.92] /Contents 39 0 R/Group>/Tabs/S/StructParents 1>> endobj 39 0 obj > stream xœ¥[K·¾/°ÿ¡ŽåòÍ&°`fvÇp 6″ ÁA’,9Ž.ù÷!YUd’Ý=ÓkÛ[=ÍGÕWï»ýxüãÛçïÞ›žžß¾½{ÿïÿšÞ>¾ùúû¯oþ÷û‡ÇŸß}úüåÝ·Ï_¿Óéù÷wo¿3ûuzó÷û»-4=/Q’i%Bd»Þ~7mPiË0küÊØéå§ó4=þœyùéüãó$;’õ¤tGo˜…Ôi=?‹€{?I9‡C¿ýãÅŒ3z˜¹ zeÃÄÀ8íIj:Øü8§?ÇÃÒùåù e~ÚÃ)ÇÇô’´e?†9ýXæ6Ê%4çž…‡ à•‹B½ž]åõ8-;-«ã»›ÃCLOw,Òw‡˜¸Œ‹KC»0ˆX%&Ó·À»¦S®^-Hp€lYJ-gÆL`¨ A5ÙÇ4ʨ÷>ÉDIyJŸa ÆM˜ˆgØ#d®]}>¸µ]V©d;W¸ÜŒpH?Ψ^AœÐY6lñ3lêó²Ç P£Må´˜}5¨Œ‡·È¹C £Â #(`¬†Ð†’¶=a¨¿:íÜ ô/¥ôÐb,ú`ÇÎø)æqè4®-g¿cÁÃU Ðüp)wfüv¸~òÀ~•Ž)»êå¶áZi»7È×½ ÚçMHÏ?åÙÌ×xÁnC _¡èðõˆø†Á¾ÊÝY-ÜÜÓºéî¬îõ|)Çi™ØÔˆ#(Yù;Š»¨1{fcÿ ¶No½!f-Ú‡Ÿ}ït˜²U’68$R×3¡8×6 ŠÉRäáË!HÐÓ9+-d’yü’Üžª3W†É}ËÿÁ&!Ó-Ì0HÔ’K:mwðé«HÝvl)W’¾‰e VìÈ^©Ú©b Ælýë6÷ٴ̦VéµÏ‡d¯P&’Ew>€u üLB,3′:(ÃcË!°0’Ì1Ô_»8Úü:&´¥1þÄjï m€-›¹-Bmp…Ê6-˜™›ææuÊvGº¦£ÎtL»^Á4 ‹,à»ùþ¸ºË¶Òép/äcÀ@*‹O»ÿôßä ¦ŠÛ(ÔgÉŸ’ƒ{†áŠ ðŒá¹cCóáiEà¨UıǚY9¾»ÁyÝæü…™›Í!!Í?*î’ræÇ6Àn /Ÿ%’S;Ëž÷hE²Ýâ>’Fv…š[|Ö@ç*AlsË% )cêÀäÛoYx} JÊçÓ yФ޶Içp›y´RT «Ù§)-©N%¾¢F.÷Š5žÑ¸Ñ3[[Šž¡]-ƒÉÁþºUWf.•Zxö0 ~íEyéxïT ¥‹Ý+D¯UR¨Ù{»VN̪ãôzP2]Pr‹ ‘¥ˆ 9Dh2)b%¹xñ jW@軑¤qóÌÌþŒ:¤ êúsËd-:áÝ@LI˱^hשI’µ0õ§¢žó’äâ»ò9þhM±Š«Ëù؇T+#yé`•®ö,×»@Ú¥TTú¼H¬oÈEÁbh3ºe/ ±®vĵg ,}Är-Ò8JðY*Ú2#4vƒÃæÊ7õÓÙYÌ3a-Ñ-æSÕ¹ÒìˆVi’%ôôLJû»ß_«Qr«É[%’m½¬¢±’È}íœÿ(m ’®ôue@ÓúعõÞ«ó»Ýs1fìpÜúV…žæ‹`8_oŸZõêx’ïLpMà×ÐPzGåjl.v›/j°Y§»sšoÖ&‰kpσ/§žâ‹mË°^ýu°_rþF:I*©ˆª ©>]¥8«)«íy¦¦»kŸìlæû_-EƒÚ»ðV¸ÉF•õ`Ç®‹(v£ÌÉ«…ë)¡ÄB§±(úÅÌ,Š°€’š¯%Úñ½ÅØ.>µŽÜ¶UÙ g]0älãsüã-ÔHì)¢šÜð$ǸsÓ±W¼·Î ŸØýì‹,°ÖIsY°¼Î ëj&*}ÃfÙã]¡Ð#¢z5…Æ¡Ü’ÂX7¶$Dñ»IÙ(3ja±x×B©»glxÕj³Ödž=‹Å>ïèZ»=æ`·®uzœÇ]gkÔy[9cS÷ý]ˆÍ’ÎT±$¸æ5Ñß’éVÄæ$!°¤lÍjÖÌÏŽÖ3G›[‘TÑLÖ%â[µPšº³mÉÃNºã»RÑD»Ü³k&ÓLR KRdb}qìló’)Íž²ñ|Þ»Dc·÷¾, ™¶[ÜÎB¸~-b€I,´ì€Îv6Å5dÇMØ%!÷ýÁeë0Û9æ¦ó@3j¤u» 5 z:%»ê[I|»Ì{,u̾-tók ‡J§ën³ŒsuçJçvŠkã¹-«ßŠÓ Ÿ%q`=™ÊJaQôÝaÀGaÔ*Y3″;žlU>öêçZ›€ üš¡r6Ú´z¸5¢zëH «òÑÔSAHWÏTÉ,±¼€’Ú¯‹|¬euM¥¡BW§˜é&¦ÙЮ€f£ºµap)dSw»ù’ÒÜ:Žöx)c®¯ Œ»Z9aHìÜßÔ¬G¬¶âD’U(µB’›òEûŠ4-Ål^͸Ñ6_ãè7_ÓCª¸ôziv™w_€VG´^9ÿÉÓ®:…:³Øk#•â>’¥ ¶Uõ¬ÿyÝ.¤šý’÷¯y9Zë8h>ÁqÛWàÄ6ž0o»ã7o«ÀºÏ%2•Áí*/UF93`ïÒ{)…uF¶ÊS®Y¿c†ªÐ²8`òȶÅkì昒ñnw-ÂR¥ÔNƒPW»q¥¿¨gxV#ÙmR³’,qš÷¨MOã[‰EçV?Õ»(×µÒ¤ºÌ,S©ñ¤¶6,øƒ#ê½ 9LÉ5’æ?´& Õ}¤`’gÑÂ]ÚË×lvèNG-ý•w³ $û;=±Ïݘ¾gYÈÅi9ž²Âš˜¬yÄ;ÁHG]ßn&Ç…*€6w&LU3$þçŠÒžŽ)÷NE¿Ø°è¿ø]ÇÌÚx~,n‹ ¸ÕU©·¤6zíÍ´päe¸´H·d׎Yô É=ty@wêüÔ+à¦ßÏl×/_Ù’]÷fDþS£]x¢c¦õ>}kWîêÒ-°Ëð‹‹ê~-¢Sòp»c€Åš[~bÝÒîeK쪧dyŨŽÔJcI~WSP¢q þ-‘™ ÜYÍÓyLÃ;b Ëpa¥»æÉÑ.6A i8Ô×m8ìê¡ji›OHAìh›Å¸˜ú’z`O`¦…±ìîUChõ`½%W»šX?äâW¯Lc=´®W¶hÚÁýÄ:vÁÝn{&Àu캊ø¼Ëkªy-ÁZC@ƒ;½pð˜ìxEÓɲF-$Kg?çWºõ¢ð|Háe…)Žê¦ãêµÕ Ú°yíp^[¾ Þ8Õ3{²8jZs»S9´£þ²6ÇSÒ®t’¡c3Y»G«Þ€¢a¦ã714F1BÅq’ÌÕ)ÏA;á4 ×qØiqEÂìÂ~> ²¡å>é&̥׌ñ½iÊFcnRm÷ÆÜ*’ª^Ë7‡ïM%zfB…˜Öc ¶^î:d¨hµ«áHÍN÷Ñ»¸Ü¸šÒ…Šªh+í.Œ2=åõFŠ_˜Ì-vl(]Y)»0ð¿&vñ¨7øñ÷ÊFw¼Ú•1t4ÈÉ}%°-o¬Ì§0Lh×ÝlD7ûøÃ?Âôé¿÷wÿ¹¿{H±1ÿ£œö» Qx;¹˜Róä)L ks9øÿç÷Ó-û»äÎó*M’28ö¢’Þù41Xu9µfzŸ{üé÷wVNÏ_§_Òí¿¼yMÿ £LŸ’· BÎD™6Z8Ï)K±Ý8€%Qmì»8IåuNÜ•~üíݧvFÊÖÿc‰± endstream endobj 40 0 obj >/ExtGe>>>/BBox[ 0 0 465.77 193] /Matrix[ 0.15458 0 0 0.37306 0 0] /Filter/FlateDecode/Length 2018>> stream xœYI5¾·4ÿáPŒ«¼Kh$&’ DÜ’Ä»À!Ÿ¯¼¼g¿¶»»¢Ö¤ÜåÚW÷Óû‡Ëg_¥¬Ò·÷¿.zûØoÞÅí׿zópùáÅë-?nï¿y¸| JOïëÁ+c†ë#®V)%GÛLJ°ß.>@¹à$~°*i.ïF‰Trn£»nÞv.1¨hT)&V&ßðŠÅK´Ê° F¥Œ»»çÝ _§¼3£foV V’+|=Èè‹Œ»ÖÉ*vvusKÔÊM)’UL¢$K|¿¤CëE-¸JñûE-«u=EÇr㚢ìî¤õ·1Á im¡§¡IÖvˆPCŠá’ȯ›ÜÜËí,ÄŒmmP6″kÛ.2€¼àgÑâ,»G#Øq/»>óæ,E‡øn×Fd ëšì6š†7¥Óåð.Y•ã©·‡7I¸ -•hÎXZÑNwÆ×#¾GMVáÍÛ÷ëQÆeܵfíóZëfs»·ŸS»º1åðŽÅŽí ZÏ(Z:Âäû•ÅtiÄÝžŒÂ_ü‹Ø·¦^¥™àÈ»çzÁf÷£ÑK’¿¬’ŠLPµD-ü⊡F%¹×~w‰Šµ_P´ëýÒ~aämâ,#Ý-ànFÔs8ÈÂÝÜ1″=ÌÎYÐRöƒ(ªMEæJé¹¯Ê #Þuã^u»1’å[¸#?ml»ZJ¨ãE:;-FCn|¯+ACF’p‡:@-ÜãLAÒ0O#:cê³{5V5À0T¶kç€WP½Æ†œÒ¼Ö¸Ù{íÁHÊûÞƒíàŽÑá̽ÀèÈtÂ}f `LèadPØͬ!59’kÑõ’;Lš¯X
ñ±TÙÎ`2’Ì {SÞ¢ÐJR,`dÉ$¡ÎݵB?Ad¨’¢|›»Bůµ¦ÐÚ¡´ß.(`ÅÞûAž9-D›[cU ¹]…)¸Ýd-MBk‡¨ÞõÆíߪÕáÉõ¶m¹p1²$¸#©x‡@•-Sà›Ü·*:þxÞI5(sÊ-Ëd,þÙ² VQ¯rÚÑDÙÑ$èU‹JªA™ÓO’wküÙuŒˆç¡»0Rµt¢½;|ÚÅéw÷°L^· Œ¥®YQC†/»žb°ÔŠ·h´Xèé»QÃëfk¼8§høêå+óbãç§qjù¨#K÷Í{ã6cÞIv»µ&¸{}•ÅBHm•›VÚ•HÈ’œR$Ì™WºF’®Qf-+å.Ùü´M²U›*$Ùfo’l2‹%ƒ=ÊÀÐ:ÉÓAƒeDAÀ2‰÷ú£’%cÀ|fw4Ø+Ò†)§ËZ•0’z±@=ÀDÃÑ»‘ùê°ËV;±Ó*9(»ýY!ÊH]K7B»CÑ÷Â`o ºá4|ŸäQ Ã÷,FÙÊ(Ÿ•¶Ÿ!ñ°ÝÕGT¤A «zM’jçX’Èß® ÈS, {pG…ÚsâˆÙ)ãÿK 1G•üI4¹‹¤r0DÒEKŒEëŠ-íõÉÊš»1k#EGk#Ò«~3rWF&e£VKÛsáF»M²¥º7Òb׺€¢-ˆŠ¦¯˜Mô£»w°°?Ix_cª pD V¶éN¬ˆ çFjU£¬MlQ8:ðŽ‰WqÜ®!V®Bl’ˆ)#׳š²và¡É¹»]÷шô,?´ò)akÁ¶ã-ϵ6˜ëI?¾2ŸköŸˆOx|Å€ƒÖì¾Âç5>_ NÖEÒF>sC4F˜»ãÁ(ðþÑ >xd~Â-+ü»«ç™ïã0BÝÑ’°Ùé0¼íëǬߕw*úŠn>>rî¾üW¼Œ41ƒÚNOû$mƬJ1fùÿÙ ^ß3hå{†ÿßžè=ùi«Hyß’^»2ætÝm¥9`0í`’ɺlá|`eñuTßÃê»iãB!B…$ظ›ËÌ¢.vS®°-ö‹u¬ÀR•¹Ã°?6·ÍwïqP»ÉóÖÖOIV;§ëyH±Hh5ú27˜å!Ŧ*’¹ÄÞÒˆï•/æ’H]ß+d®¾×Ý÷)ž¾Nýít¾K}80°p¤+P€NX•1£Áæh û™pdJÏûêÏr€îâ¯Ä‰îŒefXgZaF+œi…žÉ/kZ†Š¼É†ãìgåò»?[aÜþúù´¾.ªÈ£í¶f˜¹+?ØIaI³Šudþ¤ ä¢RJûS©:g$ýX ßã->]UË!Àœ¶ýíe€»ïcý±IéÝ5¾·-ÍËKü½ãþȯ>À11o’¡ÙO1g¾¼7•Gî¾÷œ!õ5¾Ô‹£nÙ ½ãþȯ‰E8F°-€êoeM~°ákXŠc†&×Êz(â-ïÚ‹¢]û+XÞÝv*ÿ ºM- endstream endobj 41 0 obj > endobj 42 0 obj > endobj 43 0 obj > endobj 44 0 obj [ 45 0 R] endobj 45 0 obj > endobj 46 0 obj > endobj 47 0 obj > endobj 48 0 obj > stream ÿØÿà JFIF ,, ÿÛ C $.’ «,#(7),01444’9=82<.342></.342>
Источник
Тесты из задачника 989898FF
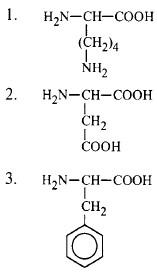
Строение пептидов и белков
1. Установите соответствие.
Подберите к каждой аминокислоте соответствующее название.
A. Apг
2-Б. Асп
B. Вал
1-Г. Лиз
3-Д. Фен
2. Установите соответствие.
Подберите к каждой аминокислоте соответствующее свойство радикала.
3-А. Фен
1-Б. Глу
В. Цис
2-Г. Apг
Д. Сер
1.Гидрофильный с анионной группой
2.Гидрофильный с катионной группой
3.Гидрофобный
3*. Выберите один правильный ответ.
Присутствие любого белка в растворе можно определить с помощью реакции:
А. Биуретовой
Б. Ксантопротеиновой В. Нингидриновой
Г. С фенилизотиоцианатом Д. Фоля
4. Выберите правильные ответы. Цветные реакции позволяют судить о:
А. Присутствии белков в биологических жидкостях
Б. Первичной структуре белков
В. Присутствии некоторых аминокислот в белке Г. Количестве аминокислот в белке
Д. Функции белков
5*. Выберите один правильный ответ.
Пептид, на С-конце которого находится иминокислота: А. Вал — Иле — Сер — Тре Б. Цис — Ала — Про — Тир В Про — Гис — Гли — Три Г. Мет — Глу — Лиз — Фен
Д. Иле — Три — Сер — Про
6*. Выберите один правильный ответ.
Пептид, на N-конце которого находится диаминомонокарбоновая кислота: А. Тре — Ала — Лиз — Про
Б. Лиз — Сер — Гис — Глн
В. Асн — Вал — Иле — Apг Г. Глу — Лей — Тре — Лиз Д. Три — Мет — Гли — Глн
7*. Выберите один правильный ответ.
Для количественного определения аминокислот в растворе используют: А. Биуретовый метод Б. Реакцию Фоля
В. Ксантопротеиновую реакцию
Г. Реакцию с нингидрином
Д. Реакцию Сакагути
8.Установите соответствие. А. Окситоцин Б. Вазопрессин В. Оба Г. Ни один
1.Является нанопептидом-В
2.Увеличивает реабсорбцию воды в почках-Б
3.Стимулирует выделение молока в период лактации-А
4.Устойчив к действию протеолитических ферментов-Г
9.Установите соответствие.
А. Ангиотензин I Б. Ангиотензин II В. Оба Г. Ни один
1.Является декапептидом-А
2.Образуется в результате действия протеолитического фермента-В
3.Регулирует водно-солевой баланс-Б
4.Представляет собой белок-предшественник-Г
10*. Выберите один неправильный ответ.
Радикалы аминокислот могут образовывать водородные связи: А. Тре
Б. Apг
В. Гис
Г. Три
Д. Асп
11. Выберите один правильный ответ. Фенилизотиоцианат используется для определения: А. Количества белка в растворе Б. Присутствия циклических аминокислот В. С-концевой аминокислоты
Г. N-концевой аминокислоты
Д. Количества аминокислот в белке
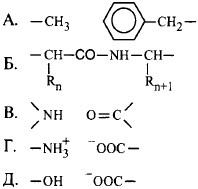
12. Установите соответствие.
Подберите к пронумерованным типам связей их графическое изображение:
1.Водородная связь, участвующая в формировании вторичной структуры-В
2.Водородная связь, участвующая в формировании третичной структуры-Д
3.Гидрофобное взаимодействие-А
13. Установите соответствие. А. Первичная структура Б. Вторичная структура В. Третичная структура
Г. Супервторичная структура Д. Конформация
1.Стабилизируется водородными связями между атомами пептидного остова-Б
2.В ее формировании принимают участие гидрофобные взаимодействия радикалов аминокислот-В
3.Фиксируется ковалентными связями между α-амино- и α- карбоксильными группами аминокислот-А
14*. Выберите один неправильный ответ.
Водородные связи могут образовываться между радикалами аминокислот: А. Сер, Глн
Б. Три, Асп
В. Тре, Лиз Г. Глу, Цис Д. Асп, Сер
15*. Выберите один неправильный ответ. Гидрофобные связи могут образовываться между радикалами аминокислот:
А. Лей, Мет Б. Три, Иле
В. Ала, Тре
Г. Вал, Фен
Д. Мет, Про
16*. Выберите один неправильный ответ.
К слабым связям, участвующим в образовании нативных белков, относятся:
А. Пептидные
Б. Водородные В. Гидрофобные Г. Ионные
Д. Ван-дер-ваальсовы взаимодействия
17*. Выберите один правильный ответ.
Водородные связи образуются между радикалами аминокислот:
А. Сер, Асн
Б. Ала, Вал В. Глу, Асп Г Цис, Три Д.
Асп, Apr
18. Установите соответствие.
1.Аминокислота, образующая ионную связь с Асп
2.Аминокислота, располагающаяся внутри цитозольного глобулярного белка
3.Аминокислота, не имеющая радикала
А. Асн
3-Б. Гли
2-В. Ала
Г. Глу
1-Д. Лиз
19*. Выберите один неправильный ответ.
Гидрофобные радикалы аминокислот чаще всего располагаются: А. Внутри глобулярных цитозольных белков Б. В местах контактов протомеров олигомерных белков
В. На поверхности цитозольных белков
Г. На поверхности интегральных мембранных белков Д. В активном центре белков
20*. Выберите один наиболее полный ответ.
Вбелках водородные, ионные и гидрофобные связи участвуют
вформировании: А. Вторичной структуры
Б. Третичной структуры В. Супервторичной структуры Г. Первичной структуры
Д. Конформации
21*. Выберите одно наиболее полное утверждение.
В формировании конформации белка принимают участие преимущественно связи: А. Водородные Б. Гидрофобные В. Ионные
Г. Слабые
Д. Межрадикальные
22. Установите соответствие.
А. Первичная структура Б. Вторичная структура
В. Третичная структура
Г. Супервторичная структура
Д. Четвертичная структура
1.Порядок чередования аминокислот, соединенных пептидной связью -А
2.Пространственная структура, образованная водородными связями, возникающими между атомами пептидного остова -Б
3.Специфический порядок чередования вторичных структур -Г
23. Выберите правильные ответы. Олигомерный белок:
А. Состоит из нескольких протомеров
Б. Имеет полипептидные цепи, связанные дисульфидными связями
В. Содержит контактные поверхности протомеров, комплементарные друг другу
Г. Может связывать только один лиганд
Д Формирует четвертичную структуру путем самосборки
24*. Выберите один неправильный ответ. Шапероны:
А. Являются глобулярными белками Б. Связываются с частично денатурированными белками
В. Облегчают разрушение частично денатурированных белков
Г. Находятся во всех отделах клетки Д. Их синтез усиливается при стрессовых воздействиях
25*. Выберите одно наиболее полное утверждение.
Самосборка протомеров в олигомерный белок происходит благодаря наличию:
А. Гидрофобных радикалов в местах контакта Б. Противоположно заряженных функциональных групп В. Ионов металлов
Г. Комплементарности контактных поверхностей
Д. Ферментов, облегчающих взаимодействие контактирующих участков
26. Выберите правильные ответы.
Комплементарностью молекул обусловлены взаимодействия:
А. Белка с лигандом Б. Протомеров в олигомерном белке
В. Белка с диполями воды в растворе
Г. Различных белков в процессе самосборки клеточных органелл
Д. Радикалов аминокислот при формировании третичной структуры белка
27*. Выберите одно наиболее полное определение. Конформация белка:
А. Аминокислотная последовательность полипептидной цепи Б. Число полипептидных цепей в олигомерном белке В. Укладка α-спиралей и β-структур в полипептидной цепи Г. Характерное строение супервторичной структуры
Д. Пространственная структура белка
Основы функционирования белков
28. Выберите правильные ответы.
Лигандом для белка может быть: А. Ион металла Б. Простетическая группа В. Другой белок
Г. Органическая небелковая молекула Д. Лекарственное вещество
29*. Выберите один неправильный ответ. Активный центр белка:
А. Расположен в углублении белковой молекулы
Б. Является фрагментом полипептидной цепи
В. Сформирован радикалами аминокислот, находящихся на расстоянии друг от друга Г. Имеет неровный рельеф
Д. Способен комплементарно связывать специфические лиганды
30. Выберите одно наиболее полное утверждение. Активный центр белка — это участок:
А. Комплементарно взаимодействующий с лигандом
Б. Находящийся в углублении белковой молекулы В Расположенный на поверхности белка и образованный радикалами аминокислот Г. Сформированный на уровне третичной структуры
Д. Находящийся между двумя доменами
31*. Выберите одно наиболее полное утверждение. Простетическая группа:
А. Неорганическая часть белка Б. Органическая часть белка
В. Присоединенное к белку лекарственное вещество Г. Лиганд, присоединяемый к белку при функционировании
Д. Небелковая часть, прочно связанная с активным центром белка
32. Установите соответствие. | ||
1. | Лиганд Н-холинорецепторов | 3-А. Ацетилхолин |
2. | Миорелаксант | 2-Б. Дитилин |
3. | Нейромедиатор | 1-В. Оба |
4. | Ингибитор ацетилхолинэстеразы | 4-Г. Ни один |
33*. Выберите один правильный ответ. Ацетилхолин и атропин:
А. Нейромедиаторы Б. Взаимодействуют в активном центре ацетилхолинэстеразы
В. Участвуют в проведении импульса через холинергические синапсы
Г. Лиганды М-холинорецептора
Д. Лекарственные препараты конкурентного действия
34*. Выберите один неправильный ответ. Дитилин и атропин:
А. Нейромедиаторы
Б. Структурные аналоги ацетилхолина В. Конкурентные ингибиторы холинорецепторов Г. Лиганды холинорецепторов Д. Лекарственные вещества
35. Установите соответствие. | ||
1. | Антагонист адреналина | 4-А. Мезатон |
2. | Лиганд адренергических рецепторов | 3-Б. Норадреналин |
3. | Нейромедиатор | 2-В. Оба |
4. | Лекарственное вещество | 1-Г. Ни один |
36. Выберите один правильный ответ. Мезатон и атропин:
А. Антагонисты нейромедиатора Б. Агонисты нейромедиатора
В. Лиганды фермента, разрушающего нейромедиатор
Г. Лиганды рецептора нейромедиатора
Д. Конкурентные ингибиторы действия нейромедиатора
37*. Выберите один неправильный ответ. Гем:
А. Небелковая часть гемосодержащих белков Б. Состоит из 4 пиррольных колец
В. Обратимо связан с белковой частью гемоглобина
Г. Имеет в составе атом железа Д. Входит в состав миоглобина
38*. Выберите один неправильный ответ. Сродство гемоглобина к кислороду уменьшается:
А. По мере присоединения молекул О2 к протомерам гемоглобина
Б. При увеличении в крови концентрации СО2 В. В результате протонирования гемоглобина
Г. По мере отщепления О2 от протомеров гемоглобина Д. При присоединении 2,3-бисфосфоглицерата
39. Установите соответствие.
1. | Мономерный белок | 1-А. Миоглобин |
2. | Гемопротеин | 3-Б. Гемоглобин |
3. | Аллостерический белок | 2-В. Оба |
4. | Фермент | 4-Г. Ни один |
40*. Выберите один неправильный ответ.
Центр связывания белковой части миоглобина и гемоглобина с гемом: А. Находится в углублении между двумя α-спиралями Б. Образован преимущественно гидрофобными радикалами аминокислот
В. Удерживает гем за счет множества водородных и ионных связей
Г. Содержит 2 функционально важных остатка Гис Д. Снижает сродство белков к оксиду углерода
41*. Выберите один правильный ответ. Миоглобин и гемоглобин:
А. Олигомерные белки
Б. Гемопротеины
В. Фосфопротеины Г. Взаимодействуют с 2,3-бисфосфоглицератом
Д. Белки эритроцитов
42. Установите соответствие.
3-А. Гистидин Е7
2-Б. Гистидин F8
1-В. Оба
4-Г. Ни один
1.Находится в активном центре миоглобина и гемоглобина
2.Связан координационной связью с железом гема
3.Уменьшает сродство оксида углерода к железу гема
4.Связывается с О2
43*. Выберите один неправильный ответ.
2,3-Бисфосфоглицерат:
А. Синтезируется в эритроцитах Б. Содержится в клетке в одинаковых концентрациях с гемоглобином
В. Присоединяется к аллостерическому центру оксигемоглобина
[Нb(О2)4]
Г. Уменьшает сродство гемоглобина (Нb) к О2
Д. Взаимодействует с радикалами аминокислот ионными связями
44. Установите соответствие.
1.Не взаимодействует с 2,3-бисфосфоглицератом
2.Преобладает в эритроцитах взрослого человека
3.Участвует в переносе О2
4.Содержит в составе 2α- и 2δ-цепи
2-А. НbА
1-Б. HbF
3-В. Оба
4-Г. Ни один
45. Установите соответствие. | ||
1. | Мономерный белок | 3-А. НЬА |
2. | В дезоксиформе образует фибриллярные агрегаты 2-Б.HbS | |
3. | В 6-м положении β-цепей содержит Глу | 4-В. Оба |
4. | Относится к холопротеинам | 1-Г. Ни один |
46. Установите соответствие.
1-А. Активный центр гемоглобина
2-Б. Аллостерический центр гемоглобина
3-В. Оба
4-Г. Ни один
1.Взаимодействует с О2
2.Находится в центральной полости молекулы белка
3.Комплементарно взаимодействует с лигандом
4.Образует прочное соединение с лигандом
47*. Выберите один неправильный ответ. Сродство гемоглобина к О2 увеличивается при: А. Увеличении парциального давления О2
Б. Увеличении концентрации Н+
В. Уменьшении концентрации Н+ Г. Уменьшении концентрации 2,3-бисфосфоглицерата Д. Гликозилировании гемоглобина
48. Установите соответствие.
1.Присоединяется к гемоглобину в активном центре
2.Вырабатывается в организме в небольших количествах
3.Является физиологическим лигандом гемоглобина
4.Связывается с гемоглобином в аллостерическом центре А. О2 Б. СО
2.Оба
Г. Ни один
49. Установите соответствие.
1.Является лигандом гемоглобина
2.Взаимодействует с Нb(О2)4
3.Присоединяется к Fe2+ гема
4.Аллостерический регулятор функции гемоглобина
3-А. О2
2-Б. 2,3-Бисфосфоглицерат
1-В. Оба
4-Г. Ни один
50. Установите соответствие. | ||
1. | Мутантная форма НbА | 2-А. Метгемоглобин |
2. | Содержит Fe3+ в активном центре | 3-Б. HbS |
3. | Плохо растворим в воде | 1-В. Оба |
4. | Нормально функционирующий белок | 4-Г. Ни один |
51*. Выберите один неправильный ответ. В гемоглобине S (HbS):
А. На поверхности находится гидрофобная аминокислота
Б. Нарушения затрагивают α-цепи гемоглобина
В. Образуется участок, склонный к агрегации Г. Имеет 8 α-спиралей Д. Содержит 4 гема
52*. Выберите один неправильный ответ.
При нагревании раствора белков до 80°С происходит: А. Разрыв слабых связей
Б. Приобретение молекулами белка случайной конформации В. Нарушение взаимодействия белка с лигандами Г. Уменьшение растворимости белков
Д. Изменение первичной структуры белков
53*. Выберите один правильный ответ.
Что общего между нативной и денатурированной рибонуклеазой:
А. Первичная структура
Б. Конформация В. Строение активного центра
Г. Межрадикальные связи
Д. Функция
54*. Выберите один неправильный ответ. Белки денатурируют в результате:
А. Действия протеолитических ферментов
Б. Повышения температуры В. Изменения pH
Г. Действия солей тяжелых металлов Д. Воздействия мочевины
55*. Выберите один неправильный ответ. В результате денатурации белков:
А. Уменьшается их растворимость Б. Разрушается нативная конформация В. Молекула занимает больший объем
Г. Увеличивается доступность белка для действия протеолитических ферментов
Д. Происходит гидролиз пептидных связей
56*. Выберите один правильный ответ.
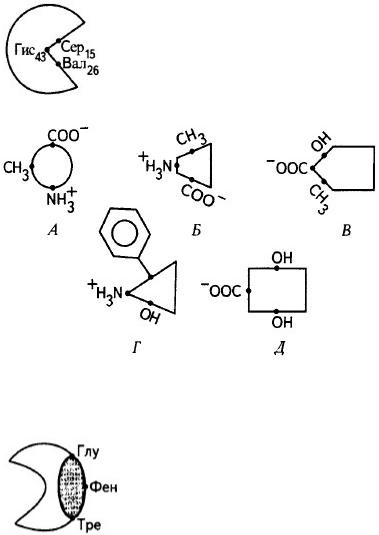
Подберите к активному центру белка комплементарный лиганд.
Белок В
Лиганды
57. Выберите один правильный ответ.
Подберите к каталитическому протомеру олигомерного белка комплементарный регуляторный протомер.
Каталитический протомер Г
Источник
