Биохимия транспортные формы холестерина
Содержание статьи
Холестерол используется как переносчик полиненасыщенных жирных кислот
Транспорт холестерола и его эфиров осуществляется липопротеинами низкой и высокой плотности.
Липопротеины высокой плотности
Общая характеристика
- образуются в печени de novo, в плазме крови при распаде хиломикронов, некоторое количество в стенке кишечника,
- в составе частицы примерно половину занимают белки, еще четверть фосфолипиды, остальное холестерин и ТАГ (50% белка, 25% ФЛ, 13% эфиров ХС и 5% свободного ХС, 7% ТАГ),
- структурным апобелком является апо А1, также содержат апоЕ и апоСII.
Функция
- Транспорт свободного ХС от тканей к печени.
- Фосфолипиды ЛПВП являются источником полиеновых кислот для синтеза клеточных фосфолипидов и эйкозаноидов.
Метаболизм
1. Синтезированные в печени частицы (насцентные или первичные ЛПВП) содержат в основном фосфолипиды и апобелки. Остальные липидные компоненты накапливаются в ЛПВП по мере метаболизма в плазме крови.
Новосинтезированные ЛПВП выглядят на электронных микрофотографиях как двухслойные диски из двух монослоев фосфолипидов (таблеткообразная форма). Синтез апоЕ и апоС происходит главным образом в печени, в отличие от апо А-I, образующегося как в печени, так и в тонком кишечнике.
2-3. В плазме крови насцентный ЛПВП сначала превращается в ЛПВП3 (условно его можно назвать «зрелый»). В этом превращении главным является то, что ЛПВП
- забирает от клеточных мембран свободный холестерин при непосредственном контакте или при участии специфических транспортных белков,
- взаимодействуя с мембранами клеток, отдает им часть фосфолипидов из своей оболочки, доставляя таким образом полиеновые жирные кислоты в клетки,
- тесно взаимодействует с ЛПНП и ЛПОНП, получая от них свободный холестерин. В обмен ЛПВП3 отдают эфиры ХС, образованные благодаря переносу жирной кислоты от фосфатидилхолина (ФХ) на холестерин (ЛХАТ-реакция, см п.4).
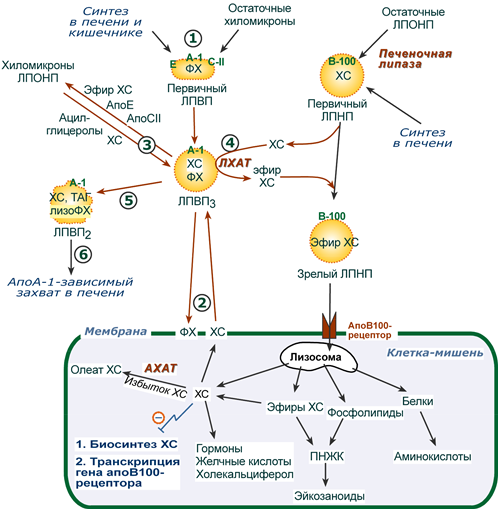
Транспорт холестерола и его эфиров в организме
(цифры соответствуют пунктам метаболизма ЛПВП по тексту)
4. Внутри ЛПВП активно протекает реакция при участии лецитин:холестерол-ацилтрансферазы (ЛХАТ-реакция). В этой реакции остаток полиненасыщенной жирной кислоты переносится от 2-го положения фосфатидилхолина (из оболочки самого ЛПВП) на получаемый свободный холестерин с образованием лизофосфатидилхолина (лизоФХ) и эфиров ХС. ЛизоФХ остается внутри ЛПВП, эфир холестерина отправляется в ЛПНП.
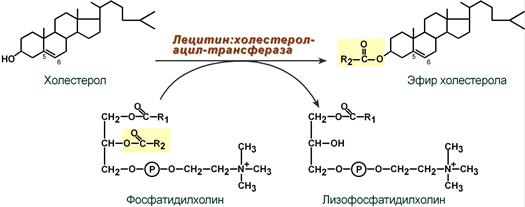
Реакция этерификации холестерола
при участии лецитин:холестерол-ацилтрансферазы
5. В результате первичный ЛПВП постепенно, через зрелую форму ЛПВП3, преобразуется в ЛПВП2 (остаточный, ремнантный). При этом происходят и дополнительные события:
- взаимодействуя с разными формами ЛПОНП и ХМ, ЛПВП получают ацил-глицеролы (МАГ, ДАГ, ТАГ), и обмениваются холестерином и его эфирами,
- ЛПВП отдают апоЕ- и апоСII-белки на первичные формы ЛПОНП и ХМ, и потом забирают обратно апоСII-белки от остаточных форм.
Таким образом, при метаболизме ЛПВП в нем происходит накопление свободного ХС, МАГ, ДАГ, ТАГ, лизоФХ и утрата фосфолипидной оболочки. Функциональные способности ЛПВП снижаются.
6. Далее ЛПВП2 захватывается гепатоцитами при помощи апоА-1-рецептора, происходит эндоцитоз и частица разрушается.
Липопротеины низкой плотности
Общая характеристика
- образуются в гепатоцитах de novo и в сосудистой системе печени под воздействием печеночной ТАГ-липазы из ЛПОНП,
- в составе преобладают холестерол и его эфиры, другую половину массы делят белки и фосфолипиды (38% эфиров ХС, 8% свободного ХС, 25% белки, 22% фосфолипидов, 7% триацилглицеролов),
- основным апобелком является апоВ-100,
- нормальное содержание в крови 3,2-4,5 г/л,
- самые атерогенные.
Функция
1. Транспорт холестерола в клетки, использующих его
- для реакций синтеза половых гормонов (половые железы), глюкокортикоидов и минералокортикоидов (кора надпочечников),
- для превращения в холекальциферол (кожа),
- для образования желчных кислот (печень),
- для выведения в составе желчи (печень).
2. Транспорт полиеновых жирных кислот в виде эфиров ХС в некоторые клетки рыхлой соединительной ткани (фибробласты, тромбоциты, эндотелий, гладкомышечные клетки), в эпителий гломерулярной мембраны почек, в клетки костного мозга, в клетки роговицы глаз, в нейроциты, в базофилы аденогипофиза.
Клетки рыхлой соединительной ткани активно синтезируют эйкозаноиды. Поэтому им необходим постоянный приток полиненасыщенных жирных кислот (ПНЖК), что осуществляется через апо-В-100-рецептор, т.е. регулируемым поглощением ЛПНП, которые несут ПНЖК в составе эфиров холестерола.
Особенностью клеток, поглощающих ЛПНП, является наличие лизосомальных кислых гидролаз, расщепляющих эфиры ХС. У других клеток таких ферментов нет.
Иллюстрацией значимости транспорта ПНЖК в указанные клетки служит ингибирование салицилатами фермента циклооксигеназы, образующей эйкозаноиды из ПНЖК. Салицилаты успешно применяются в кардиологии для подавления синтеза тромбоксанов и снижения тромбообразования, при лихорадке, как жаропонижающее средство за счет расслабления гладких мышц сосудов кожи и повышения теплоотдачи. Однако одним из побочных эффектов тех же салицилатов является подавление синтеза простагландинов в почках и снижение почечного кровобращения.
Также в мембраны всех клеток, как сказано выше (см «Метаболизм ЛПВП»), ПНЖК могут переходить в составе фосфолипидов от оболочки ЛПВП.
Метаболизм
1. В крови первичные ЛПНП взаимодействуют с ЛПВП, отдавая свободный ХС и получая этерифицированный. В результате в них происходит накопление эфиров ХС, увеличение гидрофобного ядра и «выталкивание» белка апоВ-100 на поверхность частицы. Таким образом, первичный ЛПНП переходит в зрелый.
2. На всех клетках, использующих ЛПНП, имеется высокоафинный рецептор, специфичный к ЛПНП – апоВ-100-рецептор. Около 50% ЛПНП взаимодействует с апоВ-100-рецепторами разных тканей и примерно столько же поглощается гепатоцитами.
3. При взаимодействии ЛПНП с рецептором происходит эндоцитоз липопротеина и его лизосомальный распад на составные части – фосфолипиды, белки (и далее до аминокислот), глицерол, жирные кислоты, холестерол и его эфиры.
- ХС превращается в гормоны или включается в состав мембран,
- излишки мембранного ХС удаляются с помощью ЛПВП,
- принесенные с эфирами ХС ПНЖК используются для синтеза эйкозаноидов или фосфолипидов.
- при невозможности удалить ХС часть его этерифицируется с олеиновой или линолевой кислотами ферментом ацил-SКоА:холестерол-ацилтрансферазой (АХАТ-реакция),
Синтез олеата холестерола при участии
ацил-SKoA-холестерол-ацилтрансферазы
На количество апоВ-100-рецепторов влияют гормоны:
- инсулин, тиреоидные и половые гормоны стимулируют синтез этих рецепторов,
- глюкокортикоиды уменьшают их количество.
Источник
72.Лпнп и лпвп — транспортные, формы холестерина в крови, роль в обмене холестерина. Гиперхолестеринемия. Биохимические основы развития атеросклероза.
Холестерол
транспортируется кровью только в составе
ЛП. ЛП обеспечивают поступление в ткани
экзогенного холестерола, определяют
потоки холестерола между органами и
выведение избытка холестерола из
организма.
Транспорт
экзогенного холестерола.Холестерол
поступает с пищей в количестве 300-500
мг/сут, в основном в виде эфиров. После
гидролиза, всасывания в составе мицелл,
этерификации в клетках слизистой
оболочки кишечника эфиры холестерола
и небольшое количество свободного
холестерола включаются в состав ХМ и
поступают в кровь. После удаления жиров
из ХМ под действием ЛП-липазы холестерол
в составе остаточных ХМ доставляется
в печень. Остаточные ХМ взаимодействуют
с рецепторами клеток печени и захватываются
по механизму эндоцитоза. Затем ферменты
лизосом гидролизуют компоненты остаточных
ХМ, и в результате образуется свободный
холестерол. Экзогенный холестерол,
поступающий таким образом в клетки
печени, может ингибировать синтез
эндогенного холестерола, замедляя
скорость синтеза ГМГ-КоА-редуктазы.
Транспорт
эндогенного холестерола в составе ЛПОНП
(пре-β-липопротеинов). Печень
— основное место синтеза холестерола.
Эндогенный холестерол, синтезированный
из исходного субстрата ацетил-КоА, и
экзогенный, поступивший в составе
остаточных ХМ, образуют в печени общий
фонд холестерола. В гепатоцитах
триацилглицеролы и холестерол
упаковываются в ЛПОНП. В их состав
входят, кроме того, апопротеин В-100 и
фоефолипиды. ЛПОНП сек-ретируются в
кровь, где получают от ЛПВП апопротеины
Е и С-IIВ крови на ЛПОНП действует
ЛП-липаза, которая, как и в ХМ, активируется
апоС-II гидролизует жиры до глицерола и
жирных кислот. По мере уменьшения
количества ТАГ в составе ЛПОНП они
превращаются в ЛППП. Когда количество
жиров в ЛППП уменьшается, апопротеины
С-II реносятся обратно на ЛПВП. Содержание
холестерола и его эфиров в ЛППП достигает
45%; часть этих липопротеинов захватывается
клетками печени через рецепторы ЛПНП,
которые взаимодействуют и с апоЕ и с
апоВ-100.
Транспорт
холестерола в составе ЛПНП. Рецепторы
ЛПНП.На
ЛППП, оставшиеся в крови, продолжает
действовать ЛП-липаза, и они превращаются
в ЛПНП, содержащие до 55% холестерола и
его эфиров. Апопротеины Е и С-II реносятся
обратно в ЛПВП. Поэтому основным
апопротеином в ЛПНП служит апоВ-100.
Апопротеин В-100 взаимодействует с
рецепторами ЛПНП и таким образом
определяет дальнейший путь холестерола.
ЛПНП — основная транспортная форма
холестерола, в которой он доставляется
в ткани. Около 70% холестерола и его эфиров
в крови находится в составе ЛПНП. Из
крови ЛПНП поступают в печень (до 75%) и
другие ткани, которые имеют на своей
поверхности рецепторы ЛПНП. Рецептор
ЛПНП — сложный белок, состоящий из 5
доменов и содержащий углеводную часть.
Рецепторы ЛПНП синтезируются в ЭР и
аппарате Гольджи, а затем экспонируются
на поверхности клетки, в специальных
углублениях, выстланных белком клатрином.
Эти углубления называют окаймлёнными
ямками. Выступающий на поверхность
N-концевой домен рецептора взаимодействует
с белками апоВ-100 и апоЕ; поэтому он может
связывать не только ЛПНП, но и ЛППП,
ЛПОНП, остаточные ХМ, содержащие эти
апопротеины. Клетки тканей содержат
большое количество рецепторов ЛПНП на
своей поверхности: например, на одной
клетке фибробласта имеется от 20 000 до
50 000 рецепторов. Из этого следует, что
холестерол поступает в клетки из крови
в основном в составе ЛПНП. Если количество
холестерола, поступающего в клетку,
превышает её потребность, то синтез
рецепторов ЛПНП подавляется, что
уменьшает поток холестерола из крови
в клетки. При снижении концентрации
свободного холестерола в клетке,
наоборот, активируется синтез
ГМГ-КоА-редуктазы и рецепторов ЛПНП. В
регуляции синтеза рецепторов ЛПНП
участвуют гормоны: инсулин и трийодтиронин
(Т3),
полрвые гормоны. Они увеличивают
образование рецепторов ЛПНП, а
глюкокортикоиды (в
основном кортизол) уменьшают. Эффекты
инсулина и Т3,
вероятно, могут объяснить механизм
гиперхолестеролемии и увеличение риска
атеросклероза при сахарном диабете или
гипотиреозе.
Роль
ЛПВП в обмене холестерола.ЛПВП
выполняют 2 основные функции: они
поставляют апопротеины другим ЛП в
крови и участвуют в так называемом
«обратном транспорте холестерола».
ЛПВП синтезируются в печени и в небольшом
количестве в тонком кишечнике в виде
«незрелых липопротеинов» —
предшественников ЛПВП. Они имеют
дисковидную форму, небольшой размер и
содержат высокий процент белков и
фосфолипидов. В печени в ЛПВП включаются
апопротеины А, Е, С-II, фермент ЛХАТ. В
крови апоС-II и апоЕ переносятся с ЛПВП
на ХМ и ЛПОНП. Предшественники ЛПВП
пракгически не содержат холестерола и
ТАГ и в крови обогащаются холестеролом,
получая его из других ЛП и мембран
клеток. Для переноса холестерола в ЛПВП
существует сложный механизм. На
поверхности ЛПВП находится фермент
ЛХАТ — лецитишхолестерол-ацилтрансфераза.
Этот фермент превращает холестерол,
имеющий гидроксильную группу, выступающую
на поверхность липопротеинов или мембран
клеток, в эфиры холестерола. Радикал
жирной кислоты переносится от
фосфатидилхолита (лецитина) на
гидроксильную группу холестерола.
Реакция активируется апопротеином A-I,
входящим в состав ЛПВП. Гидрофобная
молекула, эфира холестерола перемещается
внутрь ЛПВП. Таким образом, частицы ЛПВП
обогащаются эфирами холестерола. ЛПВП
увеличиваются в размерах, из дисковидных
небольших частиц превращаются в частицы
сферической формы, которые называют
ЛПВП3,
или «зрелые ЛПВП». ЛПВП3 частично
обменивают эфиры холестерола на
триацилглицеролы, содержащиеся в ЛПОНП,
ЛППП и ХМ. В этом переносе участвует
«белок,
переносящий эфиры холестерина» (он
также называется aпoD). Таким образом,
часть эфиров холестерола переносится
на ЛПОНП, ЛППП, а ЛПВП3 за
счёт накопления триацилглицеролов
увеличиваются в размерах и превращаются
в ЛПВП2.
ЛПОНП под действием ЛП-липазы превращаются
сначала в ЛППП, а затем в ЛПНП. ЛПНП и
ЛППП захватываются клетками через
рецепторы ЛПНП. Таким
образом, холестерол из всех тканей
возвращается в печень в основном в
составе ЛПНП, но в этом участвуют также
ЛППП и ЛПВП2.
Практически весь холестерол, который
должен быть выведен из организма,
поступает в печень и уже из этого органа
выделяется в виде производных с фекалиями.
Путь возвращения холестерола в печень
называют «обратным транспортом»
холестерола.
Гиперхолестеролемия.
Роль алиментарных факторов в развитии
гиперхолестеролемии.Концентрация
холестерола в крови взрослых людей
составляет 200±50 мг/дл (5,2±1,2 ммоль/л) и,
как правило, увеличивается с возрастом.
Превышение нормальной концентрации
холестерола в крови называют
гиперхолестеролемией. Гиперхолестеролемия
часто развивается вследствие избыточного
поступления холестерола с пищей, а также
углеводов и жиров. Гиперкалорийное
питание — один из распространённых
факторов развития гиперхолестеролемии,
так как для синтеза холестерола необходимы
только ацетил-КоА, АТФ и NADPH. Все эти
субстраты образуются при окислении
глюкозы и жирных кислот, поэтому
избыточное поступление этих компонентов
пищи способствует развитию
гиперхолестеролемии. В норме поступление
холестерола с пищей снижает синтез
собственного холестерола в печени,
однако с возрастом эффективность
регуляции у многих людей снижается.
Правильное
питание в течение всей жизни — важнейший
фактор профилактики гаперхолестеролемии.
Доказана корреляция между увеличением
концентрации холестерола в плазме крови
и смертностью от заболеваний ССС —
инфаркта миокарда и инсульта, развивающихся
в результате атеросклероза.
Ген
рецептора ЛПНП: структура и типы мутаций.Наследственные
факторы играют важную роль в
предрасположенности к развитию
атеросклероза. Наиболее часто встречаются
мутации в структуре гена рецептора
ЛПНП. Ген рецептора ЛПНП находится в
хромосоме 19 и состоит из 18 экзонов.
Различные группы экзонов кодируют
различные домены в составе этого белка.
Мутации в этом гене подробно изучены и
разделены на 4 класса. Первый класс
мутаций, наиболее распространённый,
приводит к полному отсутствию рецептора;
второй класс мутаций характеризуется
тем, что рецептор синтезируется, но не
может транспортироваться на поверхность
клетки; третий класс мутаций соответствует
ситуации, когда рецептор транспортируется
на поверхность клеток, но не связывает
ЛПНП; четвёртый класс мутаций — рецептор
связывает ЛПНП, но не происходит
эндоцитоз. Изменения структуры рецепторов
ЛПНП в результате всех типов мутаций
приводит к гиперхолестеролемии; так
как ЛПНП не захватываются клетками, и
холестерол в составе ЛПНП накапливается
в крови.
Семейная
гиперхолестеролемия.Любой
дефект рецептора ЛПНП или белка апоВ-100,
взаимодействующего с ним, приводит к
развитию наиболее распространённого
наследственного заболевания — семейной
гиперхолестеролемии. Причиной этого
аутосомно-доминантного заболевания
выступают указанные выше мутации в гене
рецептора ЛПНП. Гетерозиготы, имеющие
один нормальный ген, а другой дефектный,
встречаются с частотой 1:500 человек, у
некоторых народностей Африки — даже
1:100 человек. Количество рецепторов ЛПНП
на поверхности клеток у гетерози-гот
снижено вдвое, а концентрация холестерола
в плазме, соответственно, вдвое повышается.
У гетерозигот концентрация холестерола
в крови в 35-40 лет достигает 400-500 мг/дл,
что приводит к выраженному атеросклерозу
и ранней смерти в результате инфаркта
миокарда или инсульта. Гомозиготы
встречаются редко — 1:1 000 000 человек.
Концентрации холестерола и ЛПНП в крови
таких больных уже в раннем детском
возрасте увеличены в 5-6 раз. ЛПНП
захватываются макрофагами путём
фагоцитоза. Макрофаги, нагруженные
избытком холестерола и других лигшдов,
содержащихся в ЛПНП, откладываются в
коже и даже сухожилиях, образуя так
называемые ксантомы. Холестерол
откладывается также и в стенках артерий,
образуя атеросклеротические бляшки.
Такие дети без экстренных мер лечения
погибают в возрасте 5-6 лет. Лечение
данной формы заболевания проводят путём
удаления ЛПНП из крови с помощью
плазмафереза, но наиболее радикальный
метод лечения — трансплантация печени.
Печень донора с нормальным количеством
рецепторов ЛПНП существенно понижает
концентрацию холестерола в крови и
предотвращает раннюю смерть от
атеросклероза. Кроме генетических
дефектов рецептора ЛПНП, причинами
гиперхолестеролемии и, следовательно,
атеросклероза являются наследственные
дефекты в структуре апоВ-100, а также
повышенные
синтез или секреция апоВ-100 в случае
семейной комбинированной гиперли-пидемии,
при которой в крови повышены концентрации
и холестерола и триацилглицеролов.
Молекулярные
механизмы патогенеза атеросклероза
Развитие
атеросклероза проходит несколько стадий
Процесс
начинается с повреждения эндотелия
сосудов, причём повреждение может иметь
различные механизмы. Важнейший механизм
— повреждение эндотелия за счёт изменённой
структуры ЛПНП, например в результате
активации свободнорадикального ПОЛ в
составе ЛПНП; повреждение провоцируется
свободными радикалами, образующимися
в процессе метаболизма или поступающими
извне. В ходе ПОЛ в ЛПНП изменяется не
только структура самих липидов, но и
нарушается структура апопротеинов.
Окисленные ЛПНП захватываются макрофагами
через скевенджер-рецепторы. Этот процесс
не регулируется количеством поглощённого
холестерола, как в случае его поступления
в клетки через специфические рецепторы,
поэтому макрофаги перегружаются
холестеролом и превращаются в «пенистые
клетки», которые проникают в
субэндотелиальное пространство. Это
приводит к образованию жировых полосок
в стенке кровеносных сосудов. На этой
стадии эндотелий сосудов может сохранять
свою структуру. При увеличении количества
«пенистых клеток» происходит
повреждение эндотелия сосудов. В норме
клетки эндотелия секретируют простагландин
I2 (простациклин
I2),
который ингибирует агрегацию тромбоцитов.
При повреждении клеток эндотелия
тромбоциты активируются. Во-первых, они
секретируют тромбоксан А2 (ТХ
А2,
который стимулирует агрегацию тромбоцитов,
что может привести к образованию тромба
в области атеросклеротической бляшки;
во-вторых, тромбоциты начинают
продуцировать пептид — тромбоцитарный
фактор роста, стимулирующий пролиферацию
ГМК. ГМК мигрируют из медиального слоя
во внутренний слой артериальной стенки
и способствуют таким образом росту
бляшки. Далее происходит прорастание
бляшки фиброзной тканью (коллагеном
ластином);
клетки под фиброзной оболочкой
некротизируются, а холестерол откладывается
в межклеточном пространстве. На этой
стадии в центре бляшки образуются даже
холестериновые кристаллы. На последних
стадиях развития бляшка пропитывается
солями кальция и становится очень
плотной. В области бляшки часто образуются
тромбы, перекрывающие просвет сосуда,
что приводит к острому нарушению
кровообращения в соответствующем
участке ткани и развитию инфаркта. Чаще
всего атеросклеротические бляшки
развиваются в артериях миокарда, поэтому
наиболее распространённое заболевание,
развивающееся в результате атеросклероза,
— инфаркт миокарда.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
21.05.2015184.29 Кб24Bazovaya_SLR_u_detey_33.pdf
- #
- #
- #
- #
- #
- #
- #
Источник