Буферное действие системы гемоглобин оксигемоглобин
Содержание статьи
YOBA-3000 / Khimia_1_7_Bufernye_sistemy (1)
Буферные системы
Буферные растворы
Организм человека располагает тонкими механизмами координации происходящих в нем процессов и поддержания постоянства внутренней среды.
Эта координация называется гомеостазом. Она осуществляется с помощью гуморальной регуляции, т.е. через кровь, тканевую жидкость, лимфу с помощью биологически активных веществ (ферментов, гормонов и других веществ).
Сохранение постоянства pH жидких сред организма имеет очень важное значение для жизнедеятельности человеческого организма, т.к.
Ионы H+ катализируют многие биохимические превращения (расщепление белков в жкт),
Кроме того, многие ферменты и гормоны проявляют свою биологическую активность только в строго определенном интервале pH
Даже незначительные сдвиги pH могут оказать существенное влияние на величину осмотического давления биологических жидкостей.
Буферные растворы
Поддержание на постоянном уровне концентрации ионов водорода способствуют буферные растворы — растворы, рН которых не меняется при добавлении к ним небольших количеств сильных кислот, щелочей, а также при разведении.
Простейший буферный раствор — это смесь слабой кислоты и соли, имеющей с этой кислотой общий анион — буферная система I типа.
Смесь слабого основания и соли с общим катионом.
Классификация буферных растворов
1 тип буферных растворов:
Ацетатный — CH3COOH и СН3СООNa
Фосфатный — NaH2PO4 и Na2HPO4
Бикарбонатный — H2CO3 и NaHCO3
Белковый — PtCOOH и PtCOONa
Гемоглобиновый — HHb и KHb
Оксигемоглобиновый — HhbO2 и KHbO2
* Все ацетатные буферные системы входят в состав организменных сред
2 тип буферных растворов:
Аммиачный — NH4OH и NH4Cl
По более современной классификации БР делят на следующие группы:
БР, состоящие из слабой кислоты и ее аниона — HA/A- (CH3COOH / CH2COO-)
БР, состоящие из слабого основания и его катиона — B/BH+ (NH4OH / NH4+)
БР, состоящие из аниона кислой и средней соли, или из анионов двух кислых солей, например, фосфатная буферная система — H2PO4-/HPO42-
БР, состоящие из ионов и молекул амфолитов. К ним относятся белковые БС, гемоглобиновая и оксигемоглобиновая БС.
pH буферных растворов

Так как концентрация ионов CH3COO- велика из-за диссоциации соли, процесс диссоциации CH3COOH по принципу Ле-Шателье сдвинут влево, поэтому концентрация недиссоциированных молекул CH3COOH практически равна общей концентрации кислоты в БР.
А концентрация ионов CH3COO- равна концентрации соли в БР, поэтому:

Механизм буферного действия
Если к буферному раствору добавить сильную кислоты, то ионы водорода будут соединяться с анионами с образованием слабого электролита и реакция среды при этом не меняется:
CH3COONa + HCl = CH3COOH + NaCl
CH3COO- + H+ = CH3COOH
pH практически не изменится, т.к. добавленный сильный электролит замещается эквивалентным количеством слабого электролита
Механизм буферного действия
Если к буферному раствору прибавить сильное основание, то ионы ОН- будут взаимодействовать с ионами Н+, которые содержатся в небольшом количестве, вследствие небольшой диссоциации кислоты. В результате образуется Н2О.
Кроме этого, увеличение концентрации ионов СН3СОО- приводит к смещению равновесия процесса диссоциации СН3СООН влево, поэтому рН не изменяется:
CH3COOH + NaOH = CH3COONa + H2O
CH3COOH + OH- = CH3COO- + H2O
Уравнение Гендерсона-Гассельбаха показывает, что рН буферного раствора данного состава определяется соотношением кислоты и соли не зависит от разбавления, т.к. при изменении объема раствора концентрация каждого компонента изменяется в одинаковое число раз, а их соотношение остается постоянным.
Буферная емкость.
Способность буферного раствора сохранять рН при добавлении сильных кислот или щелочей не беспредельна и ограничена величиной, называемой буферной емкостью.
За единицу буферной емкости принята емкость такого БР, для изменения рН которого на единицу требуется введение сильной кислоты или щелочи в количестве 1 моль эквивалента на 1 литр буферного раствора.

Буферная емкость
От природы и общих концентраций компонентов буферного раствора, а также от соотношения их концентраций:
Чем больше концентрация компонентов и
Чем ближе отношение кислота/соль к 1, тем больше буферная емкость.
Буферные системы крови
Для каждой биологической жидкости характерно определенное значение рН и сохранение этого значения имеет очень важную роль для нормальной жизнедеятельности организма.
Значение рН крови в норме 7.36, которое поддерживается за счет буферных систем, содержащихся в крови.
Буферные системы плазмы крови
Водородкарбонатная (гидрокарбонатная) — состоит из слабой H2CO3 и сопряженного основания HCO3-
Углекислота образуется при взаимодействии растворенного в плазме СО2 с водой:
СО2 + Н2О = Н2СО3

при поступлении в кровь кислот (например, молочной кислоты) гидрокарбонат их нейтрализует, а избыток СО2 выводится через легкие, вызывая увеличение легочной вентиляции.
Таким образом, соотношение НСО3-/Н2СО3, а следовательно, и рН крови не меняется.

у гидрокарбонатной буферной системы наибольшая взаимосвязь со всеми буферными системами и вне-, и внутриклеточных жидкостей
нарушение в любой буферной системе сказывается на концентрациях составляющих гидрокарбонатной БС, поэтому изменение ее параметров может достаточно точно характеризовать состояние дыхательных или метаболических нарушений, т.е. кислотно-основного состояния.
Фосфатная буферная система состоит из слабой кислоты Н2РО4- и сопряженного основания НРО42-. В основе ее действия лежит равновесие:
Н2РО4- ↔ НРО42- + Н+
Фосфатная буферная система способна сопротивляться изменению рН в интервале 6,2-8,2, т.е. обеспечивает значительную долю буферной емкости крови.
Отношению НРО42-/Н2РО4- в плазме крови равно 4:1, поэтому данная буферная система имеет более высокую емкость по кислоте, чем по щелочи (Вк = 1-2 ммоль/л; Вщ = 0,5 ммоль/л)
В связи с малым содержанием фосфатов в плазме крови она менее мощная, чем гидрокарбонатная, однако, эта система играет решающую роль в других биологических средах — в клетке, моче и соках пищеварительных желез.
Белковые буферные системы — состоят из остатков аминокислот, которые содержат -NH2 группы, имеющие слабый основный характер, и -СООН группы, со слабыми кислотными свойствами, поэтому белки способны противодействовать как подкислению, так и подщелачиванию среды.

при увеличении количества ионов Н+ (при избыточном образовании молочной кислоты при гипоксии или 3 гидроксимасляной кислоты при диабетическом кетозе) обе эти реакции сдвигаются влево, образуя PtCOOH и СО2, избыток которого выводится через легкие.
Буферная емкость, определяемая белками плазмы, зависит от:
концентрации белков в плазме,
их вторичной и третичной структуры,
а также числа свободных протон-акцепторных групп.
Эта система способна нейтрализовать как кислые, так и основные продукты, однако, вследствие преобладания формы белок-основание, ее буферная емкость значительно выше по кислоте и составляет для альбуминов 10ммоль/л, а для глобулинов — 3 ммоль/л
Буферные системы эритроцитов
-гемоглобиновая/оксигемоглобиновая
БС, на долю которой приходится 75% буферной емкости крови.
-Гемоглобиновый буфер является разновидностью белковой БС и состоит из 2х форм гемоглобина:
Восстановленного (ННb)
Окисленного (ННbO2)
В эритроцитах система гемоглобин/оксигемоглобин играет важную роль в процессах дыхания (транспортная функция по переносу О2 к тканям и органам и удаление из них метаболического СО2), а также в поддержании постоянства рН внутри эритроцитов, а в результате и в крови в целом).
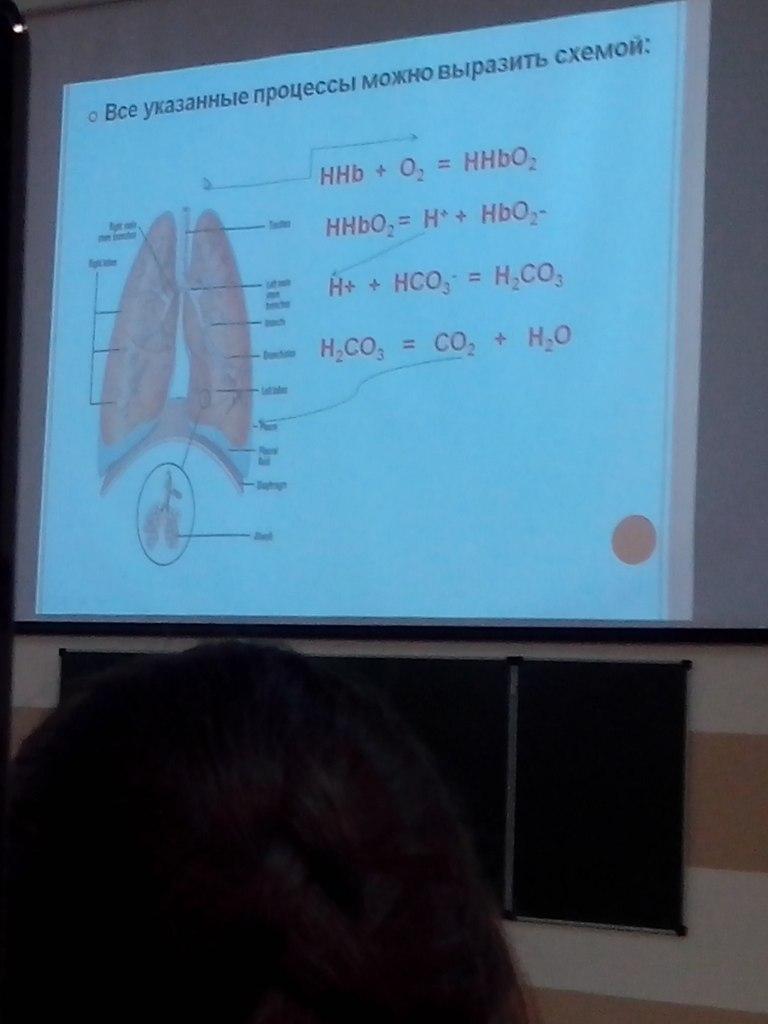
В основе действия системы гемоглобин/оксигемоглобин лежит следующее уравнение:
ННb + O2 = HHbO2
HHb является более слабой кислотой, чем ННbO2:
К(HHb) = 6.3*10-9
K(HHbO2) = 1.12*10-7
Поэтому ион Hb- способен активнее связывать протон Н+, чем ион HbO2
В организме гемоглобиновые БС взаимодействуют с гидрокарбонатной БС.
Совместное действие гемоглобиновой и гидрокарбонатной БС.
В капиллярах большого круга кровообращения оксигемоглобин диссоциирует и отдает О2 тканям:
HHbO2 = HHb + O2
Вследствие образования восстановленного гемоглобина, являющегося более слабой кислотой, снижается степень диссоциации кислотных групп гемоглобина и уменьшается отдача ионов Н+ в среду, но активная реакция среды (рН) не меняется, т.к. из тканей в кровь поступает СО2
Под действием угольной ангидразы СО2 превращается в Н2СО3, при этом происходит одновременный процесс ее диссоциации:
Н2СО3 ↔ Н+ + НСО3-
Образующиеся в ходе этой реакции ионы Н+ связываются в эритроцитах с восстановленным гемоглобином, который освобождает часть связанных ионов К+:
КHb + H+ = HHb + K+
Часть ионов НСО3- образуют с ионами К+ соединение КНСО3, другая часть ионов НСО3- переходит в плазму, где образуется NaHCO3
Из плазмы в обмен на ионы НСО3- в эритроциты переходят ионы Cl-, которые с ионами К+ образуют KCl
В капиллярах большого круга кровообращения:

В легочных капиллярах
Через тончайшую легочную мембрану по градиенту парциального давления О2 переходит в плазму и эритроциты, при этом происходит оксигенация гемоглобина
HHb + O2 = HHbO2 = H+ + HbO2-
Ионы Н+ связываются с гидрокарбонат-ионами, а ионы К+ с гемоглобином:
Н+ + НСО3 = Н2СО3
К+ + Нb- = KHb
Угольная кислота под действием карбоангидразы разлагается на СО2 и Н2О.
Образовавшийся СО2 переходит из эритроцитов в плазму, диффундирует в легкие и удаляется с выдыхаемым воздухом.
Вследствие уменьшения концентрации НСО3- в плазме крови, из эритроцитов в плазму переходят ионы Cl-, где связываются с ионами Na+.
В результате этих преобразований соотношение в артериальной крови HCO3-/H2CO3 остается оптимальным (20:1).
Кислотно-основное состояние
Таким образом, благодаря буферному действию буферных систем происходит лишь небольшое снижение рН крови, т.е. сохраняется кислотно-основное состояние, несмотря на поступление в кровь значительных количеств кислот,
Т.к. в процессе усвоения пищи в организме генерируется значительное количество диоксида углерода (550-775 г/сут), при взаимодействии которого с влагой образуется угольная кислота в количестве, эквивалентном поступлению в кровь от 25 до 35 ммоль/сут ионов Н+.
Кислотно-основное состояние организма — неотъемлемая часть гомеостаза внутренней среды организма.
Физиологические системы регуляции кислотно-основного состояния связаны с функциональной активностью легких и почек.
Смещение кислотно-основного равновесия крови в сторону повышения концентрации ионов Н+ (снижения рН) и уменьшения резервной щелочности называется ацидозом.
Смещение его в сторону снижения концентрации ионов водорода (повышение рН) и увеличение резервной щелочности — алкалозом.
Ацидоз и алкалоз
В зависимости от механизма развития расстройств кислотно-основного состояния выделяют
-дыхательный
-метаболический ацидоз и алкалоз.
Метаболический ацидоз характеризуется нарушением метаболизма и может наступить в результате следующих причин:
-избыточное введение или образование в организме стойких кислот (поступление кетокислот при голодании и диабете,
-повышенное образование молочной кислоты при шоке; поступление кислот с пищей, питьем, медикаментами, в результате вдыхания загрязненного воздуха и т.д.);
-неполное удаление кислот (при почечной недостаточности);
-избыточные потери HCO3- иона (в результате поноса, колита, язвы кишечника
Метаболический алкалоз наступает вследствие:
-потери ионов Н+ (рвоте, кишечной непроходимости и др.);
-увеличения концентрации НСО3- иона (при потере воды, введение солей органических кислот — молочной, уксусной, лимонной, катаболизирующихся с поглощением ионов Н+).
Соседние файлы в папке YOBA-3000
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
7.3. Буферные системы крови
Из буферных систем организма наибольшей емкостью характеризуются буферные системы крови. Они распределены между эритроцитами и плазмой (рисунок 14).
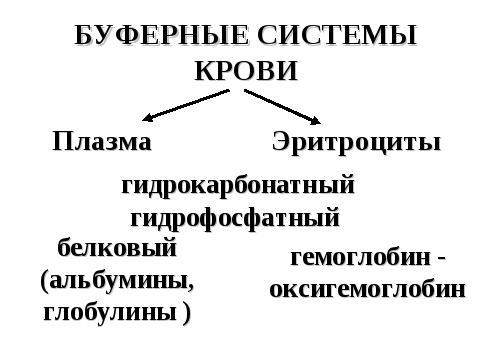
Рисунок 14. — Буферные системы крови
Гидрокарбонатный (водокарбонатный) буфер: H2CO3/HCO3-
Его образование описывается схемой:
СО2 + Н2ОН2СО3НСО3- + Н+
Механизм буферного действия можно представить следующим образом:
Н+ + НСО3Н2СО3
ОН- + Н2СО3НСО3- + Н2О
В крови отношение концентрация угольной кислоты и гдрокарбонат-иона составляет:

Избыток гидрокарбоната создает щелочной резерв крови. Для данного буфера Вк = 40 ммоль/л, а Вщ = 1-2 ммоль/л.
Гидрокарбонатный буфер связан со всеми буферными системами вне- и внутриклеточных жидкостей. Всякие изменения в них сказываются на концентрации составляющих данного буфера. Анализируя содержание НСО3- в крови можно диагностировать наличие дыхательных и метаболических нарушений.
Гидрофосфатная буферная система: Н2PO4-/HPO42-
Механизм ее буферного действия рассмотрен в разделе 7.2. Для этого буфера Вк = 1-2 ммоль/л, а Вщ = 0,5 ммоль/л. Его низкая буферная емкость объясняется низкой концентрацией ионов в крови. Однако эта система играет решающую роль в других биологических жидкостях: в моче, соках пищеварительных желез, а также во внутриклеточных жидкостях.
Гемоглобин-оксигемоглобин: ННb/Нb-
Гемоглобин ННb — это слабая кислота (Ка = 6,37·10-9), обратимо диссоциирующая в водном растворе:
ННbН+ + Нb-
Механизм буферного действия гемоглобина описывается следующими уравнениями:
Н+ + Нb-ННb
ОН- + ННbHb- + H2O.
В эритроцитах гемоглобин окисляется до оксигемоглобина:
HHb + O2HHbO2
Оксигемоглобин так же является слабой кислотой (Ка = 1,17·10-7), поэтому в состав оксигемоглобинового буфера входят HHbO2 и анион HbO2- .
Механизм буферного действия оксигемоглобина описывается следующими уравнениями:
H+ + HbO2-HHbO2
OH- + HHbO2HbO2- + H2O.
Буферная система гемоглобин-оксигемоглобин обеспечивает 75% буферной емкости крови.
Белковая буферная система (альбумины, глобулины).
Белки являются амфотерными полиэлектролитами, существующими в виде биполярных ионов:

Механизм буферного действия:
(а) нейтрализация кислот:

(б) нейтрализация оснований:

Вк (альбуминов) = 10 ммоль/л, а Вк (глобулинов) = 3 ммоль/л. Белковые буферы содержатся не только в крови, но практически во всех биологических жидкостях.
Лекция 8 Электрохимия План
8.1. Термодинамика окислительно-восстановительных реакций.
8.2. Устройство и принцип действия гальванических элементов.
8.3. Потенциометрические методы анализа.
Электрохимия — это раздел химической науки, изучающий электрохимические процессы. Электрохимическими называются процессы:
а) протекающие в растворе под воздействием электрического тока (электролиз);
б) протекающие в растворе и приводящие к возникновению электрического тока во внешней цепи (гальванический элемент).
Большинство электрохимических процессов являются окислительно-восстановительными (ОВР).
8.1. Термодинамика окислительно-восстановительных реакций
Окислительно-восстановительные реакции — это реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
Степень окисления — это условный заряд атома в молекуле, вычисленный исходя из допущения, что вещество состоит из ионов. Степень окисления принимает любые значения: целые, дробные, положительные, отрицательные:
К2+1О‾2 Na2+1О2-1
КО3-1/3 F2‾1O+2
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Гемоглобиновая буферная система
KHb KHbO2
HHb (венозная кровь) HHbO2 (артериальная кровь)
Образующаяся в процессе обмена веществ двуокись углерода поступает в плазму, а затем в эритроцит, где под влиянием фермента карбоангидразы при взаимодействии с водой образуется угольная кислота:
СО2 + Н2О Н2СО3
В тканевых капиллярах гемоглобин отдает свой кислород тканям, а восстановленная слабая соль гемоглобина вступает в реакцию с еще более слабой угольной кислотой:
KНb + H2CO3 KHCO3 + HHb
Таким образом происходит связывание водородных ионов гемоглобином. Проходя через капилляры легких, гемоглобин соединяется с кислородом и восстанавливает свои высокие кислотные свойства, поэтому реакция с Н2СО3 протекает в обратном направлении:
CO2
ННbO2 + KHCO3 KHbO2 + H2CO3
H2O
Двуокись углерода поступает в плазму, возбуждает дыхательный центр и выводится с выдыхаемым воздухом.
Особенности гемоглобинового буфера
1.Большая емкость.
2.Взаимодействие с дыхательной системой обеспечивает выведение углекислого газа из организма.
Белковая буферная система
Белки, главным образом альбумины, являются амфотерными электролитами, кислотные свойства их обусловлены содержанием кислых групп СООН, NH2, которые являются донорами протонов. Основные свойства обеспечиваются содержанием основных групп СОО, NH3+.
Поступление кислот и щелочей в кровь вызывает следующие реакции:
(NH3+)n (NH3+)n
Pt + mH+ Pt
(COO)m (COOH)m
(NH3+)n (NH2)n
Pt + nOH- Pt + Н2О
(COO)m (COO)m
Особенности белкового буфера
1.Емкость белкового буфера невелика.
2.Он не имеет прямой связи с физиологическими регуляторами pH крови.
3.В кислой среде белковый буфер связывает водородные ионы, а при изменении условий отдает их, так как его буферные свойства определяются амфотерными свойствами белка.
Осмотическое давление плазмы
Для характеристики плазмы как внутренней среды организма особое значение имеет суммарная концентрация всех ионов и молекул, содержащихся в ней, или ее осмотическая концентрация.
Осмотическая концентрация в современной биологии измеряется в осмолях.
Осмоль концентрация одного моля неэлектролита (например, глюкозы, мочевины и др.), растворенного в литре воды.
Осмотическая концентрация неэлектролита меньше осмотической концентрации электролита, так как его молекулы диссоциируют на ионы, вследствие чего возрастает концентрация кинетически активных частиц, которыми и определяется величина осмотической концентрации.
Осмотическое давление, которое может развить раствор, содержащий 1 осмоль = 22,4 атм. Поэтому осмотическое давление может быть выражено в атмосферах, в килоПаскалях или миллиметрах ртутного столба.
Осмотическая концентрация плазмы равна 0,300 осм или 300 мосм.
Часть общего осмотического давления, обусловленная белками, называется коллоидно-осмотическим (онкотическим) давлением плазмы крови равна 25-30 мм рт.ст.
Постоянство осмотической концентрации внутренней среды обеспечивается специальными осморегулирующими системами. Уменьшение ее может привести к гемолизу.
Гемолиз разрушение оболочки эритроцитов с выходом гемоглобина в плазму, которая окрашивается при этом в красный цвет и становится прозрачной (лаковая кровь). Различают следующие виды гемолиза:
Осмотический гемолиз развивается при уменьшении осмотического давления. Происходит набухание, затем разрушение эритроцитов.
Химический гемолиз происходит под влиянием веществ, разрушающих белково-липидную оболочку эритроцитов (эфир, хлороформ, алкоголь, бензол, желчные кислоты, сапонин и др.).
Механический гемолиз возникает при сильных механических воздействиях на кровь, например, сильном встряхивании ампулы с кровью.
Термический гемолиз обусловлен замораживанием и размораживанием крови.
Биологический гемолиз развивается при переливании несовместимой крови, при укусах некоторых змей, под влиянием иммунных гемолизинов и т.д.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник