Что такое неэстерифицированный холестерин
Содержание статьи
Хороший, плохой, злой холестерин
Статья на конкурс «био/мол/текст»: Вряд ли сейчас найдется человек, который не слышал, что высокий холестерин — это плохо. Однако столь же мала вероятность встретить человека, который знает, ПОЧЕМУ высокий холестерин — это плохо. И чем определяется высокий холестерин. И что такое высокий холестерин. И что такое холестерин вообще, зачем он нужен и откуда берется.
Итак, история вопроса такова. Давным-давно, в одна тысяча девятьсот тринадцатом году, петербуржский физиолог Аничков Николай Александрович показал: не что иное, как холестерин, вызывает атеросклероз у экспериментальных кроликов, содержащихся на пище животного происхождения [1]. Вообще же, холестерин необходим для нормального функционирования животных клеток и является основной составляющей клеточных мембран , а также служит субстратом для синтеза стероидных гормонов и желчных кислот.
Главный липидный компонент пищевого жира и жировых отложений — это триглицериды, которые представляют собой эфиры глицерина и жирных кислот. Холестерин и триглицериды, будучи неполярными липидными веществами, транспортируются в плазме крови в составе липопротеиновых частиц. Частицы эти подразделяют по размеру, плотности, относительному содержанию холестерина, триглицеридов и белков на пять больших классов: хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП) [2]. Традиционно ЛПНП считается «плохим» холестерином, а ЛПВП — «хорошим» (рис. 1).
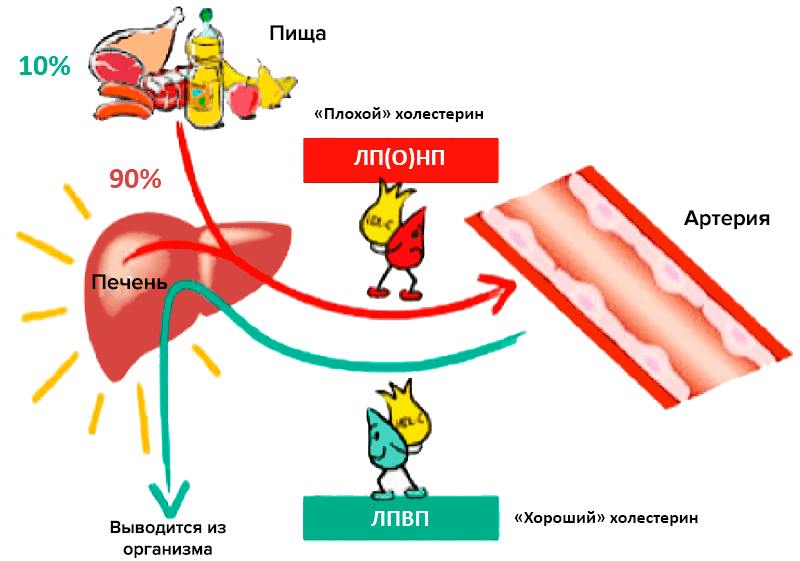
Рисунок 1. «Плохой» и «хороший» холестерины. Участие различных липопротеиновых частиц в транспорте липидов и холестерина.
Схематично структура липопротеина включает неполярное ядро, состоящее по большей части из холестерина и триглицеридов, и оболочку из фосфолипидов и апопротеинов (рис. 2). Ядро — функциональный груз, который доставляется до места назначения. Оболочка же участвует в распознавании клеточными рецепторами липопротеиновых частиц, а также в обмене липидными частями между различными липопротеинами [3].
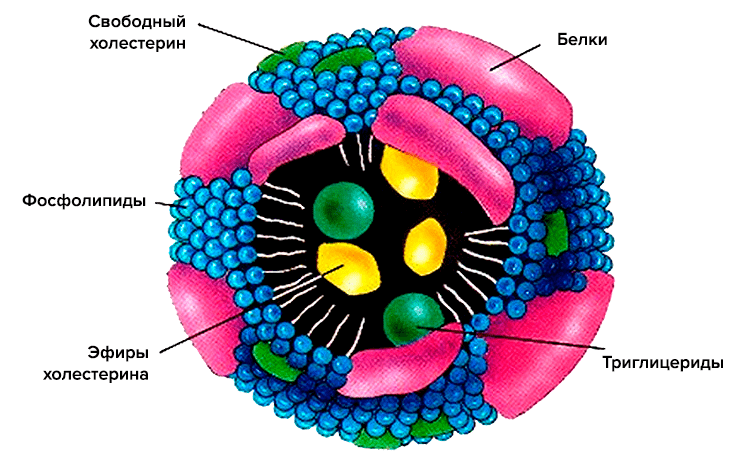
Рисунок 2. Схематическое строение липопротеиновой частицы
Баланс уровня холестерина в организме достигается следующими процессами: внутриклеточный синтез, захват из плазмы (главным образом из ЛПНП), выход из клетки в плазму (главным образом в составе ЛПВП). Предшественник синтеза стероидов — ацетил коэнзим А (CoA). Процесс синтеза включает, по крайней мере, 21 шаг, начиная с последовательного преобразования ацетоацетил CoA. Лимитирующая стадия синтеза холестерина в большой степени определяется количеством холестерина, абсорбируемого в кишечнике и транспортируемого в печень [4]. При недостатке холестерина происходит компенсаторное усиление его захвата и синтеза.
Транспорт холестерина
Систему транспорта липидов можно разделить на две большие части: внешнюю и внутреннюю.
Внешний путь начинается с всасывания в кишечнике холестерина и триглицеридов. Его конечный результат — доставка триглицеридов в жировую ткань и мышцы, а холестерина — в печень. В кишечнике пищевой холестерин и триглицериды связываются с апопротеинами и фосфолипидами, формируя хиломикроны, которые через лимфоток попадают в плазму, мышечную и жировую ткани. Здесь хиломикроны взаимодействуют с липопротеинлипазой — ферментом, который освобождает жирные кислоты. Эти жирные кислоты поступают в жировую и мышечную ткани для накопления и окисления соответственно. После изъятия триглицеридного ядра остаточные хиломикроны содержат большое количество холестерина и апопротеина Е. Апопротеин Е специфически связывается со своим рецептором в клетках печени, после чего остаточный хиломикрон захватывается и катаболизируется в лизосомах. В результате этого процесса освобождается холестерин, который затем преобразуется в желчные кислоты и выводится или участвует в формировании новых липопротеинов, образующихся в печени (ЛПОНП). При нормальных условиях хиломикроны находятся в плазме в течение 1-5 ч. после приема пищи [2], [3].
Внутренний путь. Печень постоянно синтезирует триглицериды, утилизируя свободные жирные кислоты и углеводы. В составе липидного ядра ЛПОНП они выходят в кровь. Внутриклеточный процесс формирования этих частиц схож с таковым для хиломикронов, за исключением различия в апопротеинах. Последующее взаимодействие ЛПОНП с липопротеинлипазой в тканевых капиллярах приводит к формированию остаточных ЛПОНП, богатых холестерином (ЛППП). Примерно половина этих частиц выводится из кровотока клетками печени в течение 2-6 ч. Остальные претерпевают модификацию с замещением оставшихся триглицеридов эфирами холестерина и освобождением от всех апопротеинов, за исключением апопротеина В. В результате формируются ЛПНП, которые содержат ¾ всего плазменного холестерина. Их главная функция — доставка холестерина в клетки надпочечников, скелетных мышц, лимфоцитов, гонад и почек [3]. Модифицированные ЛПНП (окисленные продукты, количество которых возрастает при повышенном содержании в организме активных форм кислорода, так называемом окислительном стрессе) могут распознаваться иммунной системой как нежелательные элементы. Тогда макрофаги их захватывают и выводят из организма в виде ЛПВП. При чрезмерно высоком уровне ЛПНП макрофаги становятся перегруженными липидными частицами и оседают в стенках артерий, образуя атеросклеротические бляшки.
Основные транспортные функции липопротеинов приведены в таблице.
Таблица. Функции липопротеинов [5].
| Класс | Размеры | Функция |
|---|---|---|
| ЛПВП | 4-14 нм | Транспорт холестерина от периферийных тканей к печени |
| ЛПНП | 20-22,5 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛППП | 25-35 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛПОНП | 30-80 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| Хиломикроны | 75-1200 нм | Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень |
Регуляция уровня холестерина
Уровень холестерина в крови в большой степени определяется диетой. Пищевые волокна снижают уровень холестерина, а пища животного происхождения повышает его содержание в крови.
Один из основных регуляторов метаболизма холестерина — рецептор LXR (рис. 3). LXR α и β принадлежат к семейству ядерных рецепторов, которые образуют гетеродимеры с ретиноидным Х рецептором и активируют гены-мишени. Их естественные лиганды — оксистерины (окисленные производные холестерина). Обе изоформы идентичны на 80% по аминокислотной последовательности. LXR-α обнаружен в печени, кишечнике, почках, селезенке, жировой ткани; LXR-β в небольшом количестве обнаруживается повсеместно [6]. Метаболический путь оксистеринов быстрее, чем у холестерина, и поэтому их концентрация лучше отражает краткосрочный баланс холестерина в организме. Существует всего три источника оксистеринов: ферментативные реакции, неферментативное окисление холестерина и поступление с пищей. Неферментативные источники оксистеринов как правило минорные, но в патологических состояниях их вклад возрастает (окислительный стресс, атеросклероз), и оксистерины могут действовать наряду с другими продуктами перекисного окисления липидов [6]. Основное влияние LXR на метаболизм холестерина: обратный захват и транспорт в печень, вывод с желчью, снижение кишечного всасывания. Уровень продукции LXR различается на протяжении аорты; в дуге, зоне турбулентности, LXR в 5 раз меньше, чем в участках со стабильным течением. В здоровых артериях повышение экспрессии LXR в зоне сильного потока оказывает антиатерогенное действие [7].
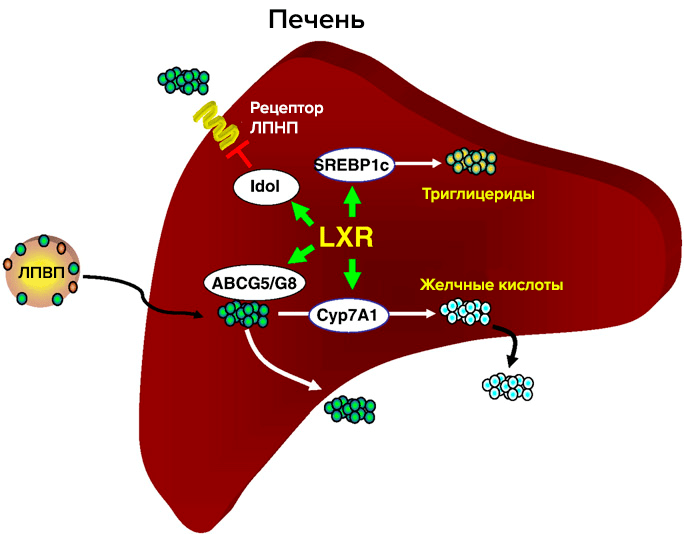
Рисунок 3. Участие рецептора LXR в метаболизме холестерина в печени
Важную роль в метаболизме холестерина и стероидов играет рецептор-«мусорщик» SR-BI (рис. 4). Он был обнаружен в 1996 году как рецептор для ЛПВП [8]. В печени SR-BI отвечает за избирательный захват холестерина из ЛПВП. В надпочечниках SR-BI опосредует избирательный захват этерифицированного холестерина из ЛПВП, который необходим для синтеза глюкокортикоидов. В макрофагах SR-BI связывает холестерин, что является первым этапом в обратном транспорте холестерина. SR-BI также захватывает холестерин из плазмы и опосредует его прямой выход в кишечник [9].
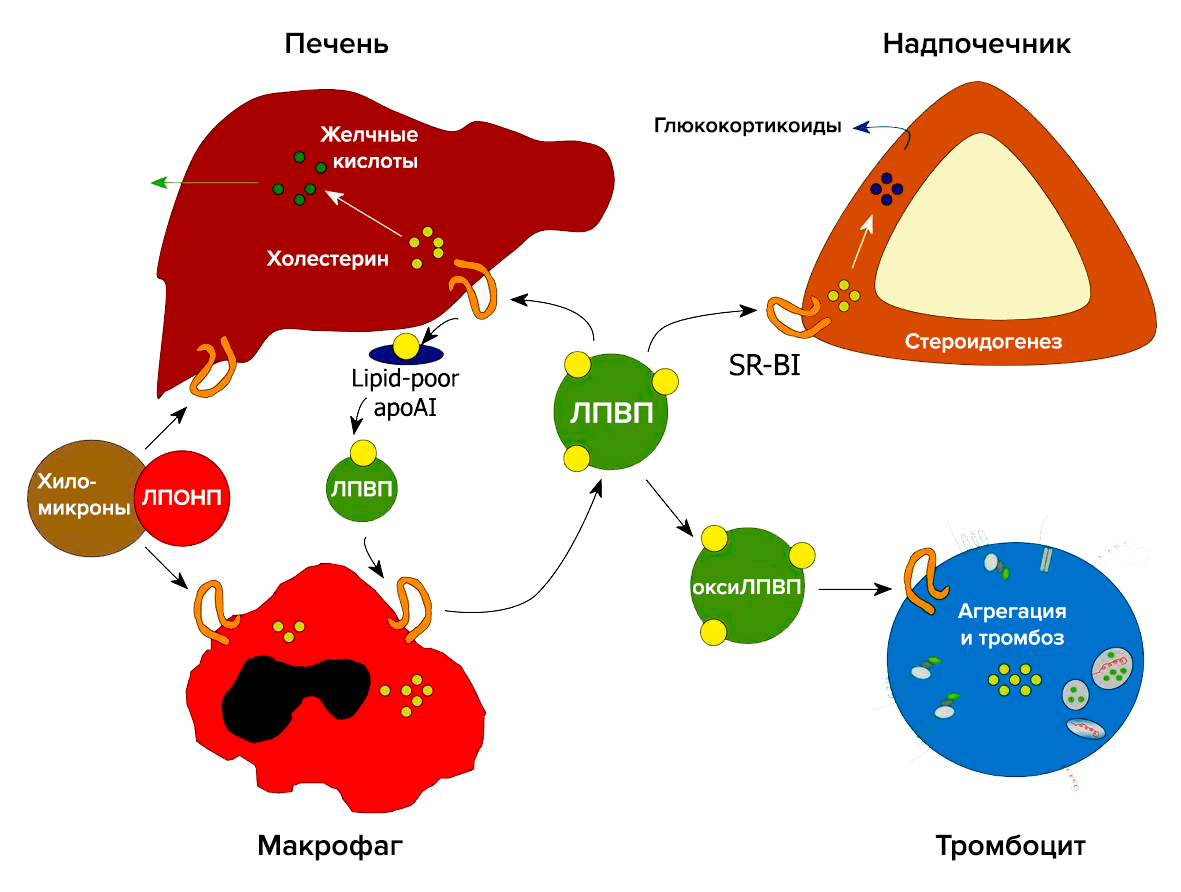
Рисунок 4. Участие рецептора SR-BI в метаболизме холестерина
Выведение холестерина из организма
Классический путь выведения холестерина: транспорт холестерина с периферии в печень (ЛПВП), захват клетками печени (SR-BI), экскреция в желчь и выведение через кишечник, где большая часть холестерина возвращается в кровь [10].
Основная функция ЛПВП — обратный транспорт холестерина в печень. Плазменные ЛПВП являются результатом комплекса различных метаболических событий. Состав ЛПВП очень различается по плотности, физико-химическим свойствам и биологической активности. Это сферические или дисковидные образования. Дисковидные ЛПВП в основном состоят из апопротеина A-I с вложенным слоем фосфолипидов и свободного холестерина. Сферические ЛПВП больше и дополнительно содержат гидрофобное ядро из эфиров холестерина и небольшого количества триглицеридов.
При метаболическом синдроме активируется обмен триглицеридов и эфиров холестерина между ЛПВП и триглицерид-богатыми липопротеинами. В результате содержание триглицеридов в ЛПВП повышается, а холестерина снижается (т.е. холестерин не выводится из организма) [11]. Отсутствие ЛПВП у людей встречается при болезни Tangier, главные клинические проявления которой — увеличенные оранжевые миндалины, роговичная дуга, инфильтрация костного мозга и мукозного слоя кишечника [3].
Если коротко обобщить, то страшен не сам холестерин, который является необходимым компонентом, обеспечивающим нормальную структуру клеточных мембран и транспорт липидов в крови, а кроме того он является сырьем для производства стероидных гормонов. Метаболические расстройства же проявляются при нарушении баланса ЛПНП и ЛПВП , что отражает нарушение системы транспорта липопротеинов, включающей работу печени, образование желчи и участие макрофагов. Поэтому любые заболевания печени, а также аутоиммунные процессы могут вызвать развитие атеросклероза даже при вегетарианской диете. Если мы вернемся к изначальным опытам Н.А. Аничкова по кормлению кроликов пищей, богатой холестерином, то увидим, что холестерин не встречается в естественном рационе кроликов и поэтому, как яд, нарушает работу печени, вызывает сильное воспаление сосудов и, как следствие, образование бляшек.
- Anitschkow N. and Chalatow S. (1983). Classics in arteriosclerosis re: On experimental cholesterin steatosis and its ificance in the origin of some pathological processes by N. Anitschkow and S. Chalatow, translated by Mary Z. Pelias, 1913. Arteriosclerosis, Thrombosis, and Vascular Biology. 3, 178-182;
- Климов А.Н. Причины и условия развития атеросклероза. Превентивная кардиология. М.: «Медицина», 1977. — 260-321 с.;
- Cox R.A. and Garcia-Palmieri M.R. Cholesterol, triglycerides, and associated lipoproteins. Clinical methods: the history, physical, and laboratory examinations (3rd Edition). Boston: Butter-worths, 1990. — 153-160 p.;
- Grundy S.M. (1978). Cholesterol bolism in man. West. J. Med. 128, 13-25;
- Википедия: «Липопротеины»;
- Wójcicka G., Jamroz-Wisniewska A., Horoszewicz K., Beltowski J. (2007). Liver X receptors (LXRs). Part I: Structure, , regulation of activity, and role in lipid bolism. Postepy Hig. Med. Dosw. 61, 736-759;
- Calkin A. and Tontonoz P. (2010). Liver X Receptor aling pathways and atherosclerosis. Arterioscler. Thromb. Vasc. Biol. 30, 1513-1518;
- S. Acton, A. Rigotti, K. T. Landschulz, S. Xu, H. H. Hobbs, M. Krieger. (1996). Identification of Scavenger Receptor SR-BI as a High Density Lipoprotein Receptor. Science. 271, 518-520;
- Vrins C.L.J. (2010). From blood to gut: Direct secretion of cholesterol via transintestinal cholesterol efflux. World J. Gastroenterol. 16, 5953-5957;
- Van der Velde A.E. (2010). Reverse cholesterol transport: From classical view to new insights. World J. Gastroenterol. 16, 5908-5915;
- Wilfried Le Goff, Maryse Guerin, M.John Chapman. (2004). Pharmacological modulation of cholesteryl ester transfer protein, a new therapeutic target in atherogenic dyslipidemia. Pharmacology & Therapeutics. 101, 17-38;
- Липидный фундамент жизни;
- Наночастицами — по «плохому» холестерину!.
Источник
Холестерин: нормы, снижение, лечение
Доктор в исполнении прекрасного Леонида Броневого абсолютно верно замечал: нож и вилка действительно могут сослужить нам дурную службу. Особенно если использовать их для усиленного потребления жирных продуктов, столь богатых органическим соединением — холестерином, содержащемся во всех клеточных мембранах всех живых организмов. Однако в определенных количествах он жизненно необходим. Где проходит граница между добром и злом, которое может приносить это ставшее притчей во языцех вещество?
Плохой и хороший холестерин
Холестерин — необходимый элемент всех клеток. Наша печень постоянно вырабатывает до 80 % от общего количества этого липида в крови. Роль его велика: холестерин обеспечивает устойчивость клеточных стенок, участвует в синтезе жизненно важных веществ — витамина D, стероидных гормонов (в том числе и половых), желчных кислот.
Поскольку сам холестерин, будучи жиром, нерастворим в воде, он циркулирует в сыворотке в виде комплексов липопротеидов. Они разделяются на липопротеиды высокой плотности (ЛПВП), низкой плотности (ЛПНП) и очень низкой плотности (ЛПОНП).
Первые очищают стенки сосудов от излишков холестерина, транспортируя их для повторной переработки, поэтому их называют «хорошим» холестерином. А вот вторые и третьи, напротив, могут накапливаться на сосудистой стенке, образуя холестериновые бляшки — те самые, которые и становятся «спусковым крючком» атеросклероза, а с ним и тяжелых сердечно-сосудистых заболеваний: ишемической болезни сердца, стенокардии, инфаркта миокарда и инсульта.
Читайте также:
Холестерин: нужно ли с ним бороться?
«Плохой» холестерин угрожает столь тяжкими последствиями лишь при повышении его уровня в крови — дислипидемии. К сожалению, это состояние клинически не проявляется, поэтому нередко о нем узнают постфактум, когда перечень диагнозов уже внушителен. А вот список факторов риска, многократно увеличивающих вероятность трагического роста уровня холестерина в крови, известен.
В группе особого внимания
Доказано, что повышению уровня «плохого» холестерина с большой долей вероятности способствуют:
- Несбалансированный рацион. Около 20 % содержащегося в организме холестерина поступает с пищей. Потребление продуктов, богатых насыщенными и транс-жирами, резко повышает шансы на развитие дислипидемии. К богатым холестерином продуктам относятся красное мясо, сало, жирное молоко, творог, сыры, сливочное масло, яйца, маргарин.
- Ожирение. Индекс массы тела (отношение массы тела в килограммах к росту в метрах, возведенному в квадрат) выше 30.
- Большая окружность талии. Риски увеличиваются, если окружность талии у мужчин становится больше 102 см, а у женщин — 89 см.
- Недостаток физической активности. Гимнастика и прочие виды тренировок помогают повысить уровень «хорошего» холестерина, который, в свою очередь, выводит излишки «плохого».
- Курение. Никотин повреждает стенки кровеносных сосудов, что повышает склонность к образованию холестериновых бляшек. Кроме того, курение напрямую может снизить уровень «хорошего» и увеличить содержание «плохого» холестерина.
- Сахарный диабет. Слишком высокий уровень глюкозы в крови повреждает «выстилку» артерий и способствует увеличению уровня холестерина в крови.
Независимо от того, относитесь ли вы к группе риска, необходимо периодически контролировать уровень холестерина в крови.
Контроль по правилам
Американская ассоциация сердца рекомендует проводить анализ, определяющий уровень холестерина, каждые 4-6 лет всем, кому исполнилось 20 лет. Более частые исследования придется проводить людям, которые относятся к группе риска. Тем же, у кого в анамнезе уже есть инфаркт миокарда, инсульт или дислипидемия, необходимо проверять содержание холестерина с регулярностью, которую определит лечащий врач.
Анализы «расшифровываются» примерно так:
Общий холестерол | ЛПНП | ЛПВП | Интерпретация |
<200 мг/дл (<5,15 мМ/л) | <130 мг/дл (<3,35 мМ/л) | ≥60 мг/дл (≥1,55 мМ/л) | Уровень, к которому нужно стремиться. Низкий риск сердечно-сосудистых заболеваний |
200-240 мг/дл (5,2-6,2 мМ/л) | 130-159 мг/дл (3,35-4,1 мМ/л) | 35-59 мг/дл (0,9-1,55 мМ/л) | Пограничный уровень. Средний риск сердечно-сосудистых заболеваний |
>240 мг/дл (≥6,2 мМ/л) | ≥160 мг/дл (≥4,15 мМ/л) | <35 мг/дл (<0,9 мМ/л) | Высокий уровень. Высокий риск сердечно-сосудистых заболеваний |
По диагностическим следам
Если по результатам анализов вы находитесь в верхней строчке «турнирной таблицы», вас можно поздравить и пожелать и впредь вести здоровый образ жизни. И, конечно, повторить исследование через 6 лет.
Тем же, кто опустился на второе место, почивать на лаврах не придется. Но и паниковать тоже. Дислипидемия лечится, и основой терапии признаны диета, повышение физических нагрузок и контроль массы тела. Эти «три кита» могут обеспечить снижение уровня ЛПНП на 10-20 %.
Если через полгода после корректировки рациона уровень холестерина остается повышенным, придется воспользоваться помощью фармацевтики. При очень высоких показателях ЛПНП фармакотерапия может быть назначена еще раньше.
Какие препараты помогут
Препаратами выбора при повышенном уровне холестерина являются средства из группы статинов. В России зарегистрирован ряд статинов, среди которых:
- Ловастатин;
- Правастатин;
- Симвастатин;
- Флувастатин;
- Аторвастатин;
- Розувастатин.
Все статины в разной степени уменьшают уровень общего холестерина, ЛПНП и немного повышают фракцию «хорошего» холестерина.
Снижение уровня общего холестерола на 1 % уменьшает риск развития ишемической болезни на 2 %.
Действие статинов проявляется уже спустя 2-3 недели после начала их приема, а максимальный эффект развивается примерно через месяц и сохраняется на протяжении всего времени лечения. Чтобы результат был оптимальным, лучше принимать их вместе с ужином или перед сном.
Стоит отметить, что между статинами существуют различия. Так, аторвастатин может оказывать большее влияние на снижение уровня ЛПНП и общего холестерина. Однако вплоть до сегодняшнего дня еще не было проведено достоверных сравнительных исследований статинов, которые бы помогли найти ответ на простой вопрос, тревожащий потребителей: какой препарат этой группы все-таки самый-самый? Тем более не знают его наверняка врачи и аптекари. Возможно, не так уж это и важно, ведь каждый статин в комбинации со здоровым образом жизни может обеспечить снижение уровня холестерина.
Марина Поздеева
Фото istockphoto.com
Товары по теме: [product strict=»Ловастатин»](Ловастатин), [product strict=»Симвастатин»](Симвастатин), [product strict=»Флувастатин»](Флувастатин), [product strict=»Аторвастатин»](Аторвастатин), [product strict=»Розувастатин»](Розувастатин)
Источник