Фонд холестерина в организме пути его выведения
Содержание статьи
Структура и функции холестерина в организме человека.Фонд,пути использования в организме и выведения холестерина.Метаболическая и гормональная регуляция биосинтеза.
Мы поможем в написании ваших работ! Мы поможем в написании ваших работ! Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ? | Холестерин относится к группе стероидов.Характерным для них является наличие ОН-группы в 3м положении и боковой цепи в 17м положении. Холестерин-производное стеринов,представляющее собой мононенасыщенный спирт. Роль холестерина в организме. 1)Холестерин является компонентом всех плазматических мембран.Он влияет на микросвязь бислоя,регулируя фазовые переходы,а также на проницаемость мембран для Н2О,ионов,неэлектролитов. 2)Из холестерина синтезируются стероидные гормоны:в корковом слое надпочечников-альдостерон и кортизол;в яичниках-эстрогены;в семенниках-андрогены. 3)Реакция дегидрирования холестерина в положении 7и 8 приводят к образованию 7-дегидрохолестерина,а это биологический предшественник витамина D3. 4)В печени при окислении холестерина образуются желчные кислоты,которые играют важную роль в переваривании и всасывании липидов. Синтез ХС осуществляется в клетках почти всех органов и тканей, однако в значительных количествах — в печени (80%), стенке тонкой кишки (10%) и коже (5%). Биосинтез ХС имеет 3 стадии: 1)биосинтез мевалоновой кислоты 2)образование из мевалоната свалена 3)циклизация сквалена и образование ХС Регуляторным ферментом биосинтеза ХС является ГМГ-КоА-редуктаза.Различают метаболическую и гормональную регуляцию. Метаболическая регуляция Скорость синтеза ГМГ-КоА-редуктазы в печени подвержена суточным колебаниям.Максимум приходиться на полночь,минимум-на утренние часы. В печени скорость синтеза ХС регулируется по механизму отрицательной обратной связи.ХС как конечный продукт синтеза ингибирует активность ГМГ-КоА-редуктазы.Пищевой ХС угнетает синтез эндогенного ХС. В энтероцитах хенодезоксихолевая кислота подавляет синтез эндогенного ХС,поэтому можно считать,что в энтероцитах синтез ХС регулируется концентрацией желчных кислот. Гормональная регуляция На активность ГМГ-КоА-редуктазы влияют гормоны:инсулин,Т3 и Т4,повышающие активность фермента;глюкагон и глюкокортикоиды-снижают активность.Осуществляется по механизму ковалентной модификации-фосфорилирование/дефосфорилирование(регуляторный фермент-ГМГ-КоА-редуктаза). Инсулин,Т3 и Т4 активируют протеинфосфатазу,которая катализирует дефосфорилирование ГМГ-КоА-редуктазы,тем самым,стимулируя синтез ХС. Глюкагон активирует протеинкиназу,которая катализирует фосфорилирование белков.В результате блокируется активность регулируемого фермента ГМГ-КоА-редуктазы и происходит синтез ХС. В надпочечниках и плаценте из ХС образуются кортикоидные гормоны.В половых железах из ХС синтезируются стероидные гормоны.В печени катаболизм ХС протекает с образованием желчных кислот. Путём выведения ХС из организма являются желчные кислоты. 2. Предсердный натрийуретический фактор (ПНФ): химическая природа, механизм действия, органы-мишени, биологические эффекты. Это пептид, содержащий 28 аминокислот с единственным дисульфидным мостиком. ПНФ синтезируется, главным образом, в кардиомиоцитах предсердий, и хранится в виде препрогормона, состоящего из 126 аминокислотных остатков. Основным фактором, регулирующим секрецию предсердного натрийуретического фактора, является увеличение АД. Другие стимулы секреции — увеличение осмолярности плазмы, повышение частоты сердцебиений, повышенный уровень катехоламинов и глюкокортикоидов в крови. Основные клетки-мишени ПНФ — почки, периферические артерии. В почках ПНФ стимулирует расширение приносящих артериол, усиление почечного кровотока, увеличение скорости фильтрации и экскреции ионов натрия. В периферических артериях ПНФ снижает тонус гладких мышц и соответственно расширяет артериолы. Таким образом, суммарным действием ПНФ является увеличение экскреции Na+ и понижение АД. Механизм передачи сигнала ПНФ не включает актвивацию G-белка. Рецептор ПНФ имеет доменное строение: домен связывания с лигандом, локализованный во внеклеточном пространстве, и один домен, пронизывающий мембрану и обладающий активностью гуанилатциклазы. В отсутствие ПНФ его рецептор находится в фосфорилированном состоянии и неактивен. Связывание ПНФ с рецептором вызывает конформационные изменения и возрастание гуанилатциклазной активности рецептора. В результате ГТФ превращается в циклический ГМФ (цГМФ), который активирует протеинкиназу G. ПНФ обычно рассматривают как физиологический антагонист ангиотензина II, поскольку под его влиянием возникают не сужение просвета сосудов и задержка натрия, а, наоборот, расширение сосудов и увеличение почечной экскреции соли. Задача. 8-месячный ребёнок доставлен в детское инфекционное отделение. Со слов матери, у ребёнка периодически возникает рвота и потеря сознания после кормления. При обследовании в крови обнаружена высокая концентрация аминокислоты цитруллина. О чём свидетельствует этот диагностический признак? Какова возможная причина данного состояния у этого ребёнка? Цитруллин — один из участников орнитинового цикла — основного пути обезвреживания аммиака с образованием мочевины. Повышение содержания этого метаболита в крови свидетельствует о нарушении синтеза мочевины и накоплении аммиака в крови (гипераммониемии). Бедная белками (гипопротеиновая) диета снижает образование аммиака в организме.Цитруллинурия связана с наследственно обусловленной недостаточностью синтеза аргининоянтарной кислоты. В сыворотке крови, спинномозговой жидкости и моче отмечается высокое содержание цитруллина. Олигофрения сопровождается приступами рвоты и аммиачной интоксикацией. Зав. кафедрой, профессор __________________________ Микашинович З.И«___» ___________________ 2016 г. |
Источник
Хороший, плохой, злой холестерин
Статья на конкурс «био/мол/текст»: Вряд ли сейчас найдется человек, который не слышал, что высокий холестерин — это плохо. Однако столь же мала вероятность встретить человека, который знает, ПОЧЕМУ высокий холестерин — это плохо. И чем определяется высокий холестерин. И что такое высокий холестерин. И что такое холестерин вообще, зачем он нужен и откуда берется.
Итак, история вопроса такова. Давным-давно, в одна тысяча девятьсот тринадцатом году, петербуржский физиолог Аничков Николай Александрович показал: не что иное, как холестерин, вызывает атеросклероз у экспериментальных кроликов, содержащихся на пище животного происхождения [1]. Вообще же, холестерин необходим для нормального функционирования животных клеток и является основной составляющей клеточных мембран , а также служит субстратом для синтеза стероидных гормонов и желчных кислот.
Главный липидный компонент пищевого жира и жировых отложений — это триглицериды, которые представляют собой эфиры глицерина и жирных кислот. Холестерин и триглицериды, будучи неполярными липидными веществами, транспортируются в плазме крови в составе липопротеиновых частиц. Частицы эти подразделяют по размеру, плотности, относительному содержанию холестерина, триглицеридов и белков на пять больших классов: хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП) [2]. Традиционно ЛПНП считается «плохим» холестерином, а ЛПВП — «хорошим» (рис. 1).
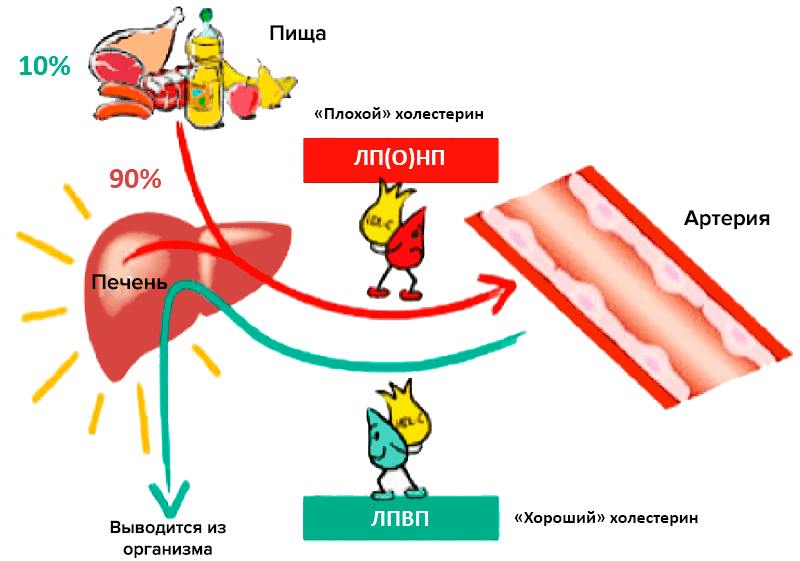
Рисунок 1. «Плохой» и «хороший» холестерины. Участие различных липопротеиновых частиц в транспорте липидов и холестерина.
Схематично структура липопротеина включает неполярное ядро, состоящее по большей части из холестерина и триглицеридов, и оболочку из фосфолипидов и апопротеинов (рис. 2). Ядро — функциональный груз, который доставляется до места назначения. Оболочка же участвует в распознавании клеточными рецепторами липопротеиновых частиц, а также в обмене липидными частями между различными липопротеинами [3].
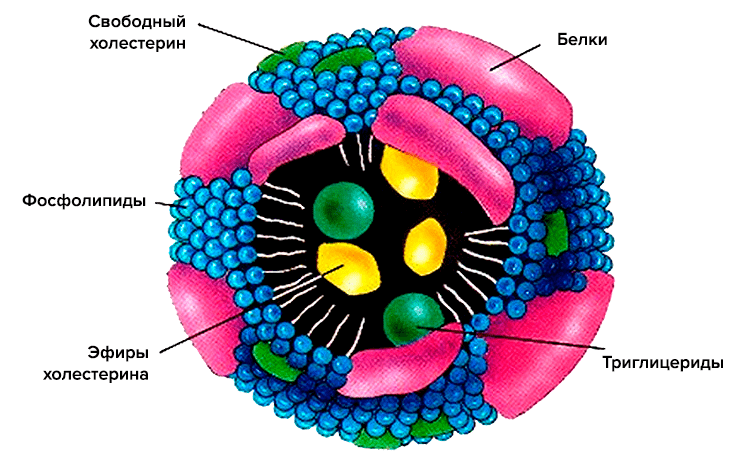
Рисунок 2. Схематическое строение липопротеиновой частицы
Баланс уровня холестерина в организме достигается следующими процессами: внутриклеточный синтез, захват из плазмы (главным образом из ЛПНП), выход из клетки в плазму (главным образом в составе ЛПВП). Предшественник синтеза стероидов — ацетил коэнзим А (CoA). Процесс синтеза включает, по крайней мере, 21 шаг, начиная с последовательного преобразования ацетоацетил CoA. Лимитирующая стадия синтеза холестерина в большой степени определяется количеством холестерина, абсорбируемого в кишечнике и транспортируемого в печень [4]. При недостатке холестерина происходит компенсаторное усиление его захвата и синтеза.
Транспорт холестерина
Систему транспорта липидов можно разделить на две большие части: внешнюю и внутреннюю.
Внешний путь начинается с всасывания в кишечнике холестерина и триглицеридов. Его конечный результат — доставка триглицеридов в жировую ткань и мышцы, а холестерина — в печень. В кишечнике пищевой холестерин и триглицериды связываются с апопротеинами и фосфолипидами, формируя хиломикроны, которые через лимфоток попадают в плазму, мышечную и жировую ткани. Здесь хиломикроны взаимодействуют с липопротеинлипазой — ферментом, который освобождает жирные кислоты. Эти жирные кислоты поступают в жировую и мышечную ткани для накопления и окисления соответственно. После изъятия триглицеридного ядра остаточные хиломикроны содержат большое количество холестерина и апопротеина Е. Апопротеин Е специфически связывается со своим рецептором в клетках печени, после чего остаточный хиломикрон захватывается и катаболизируется в лизосомах. В результате этого процесса освобождается холестерин, который затем преобразуется в желчные кислоты и выводится или участвует в формировании новых липопротеинов, образующихся в печени (ЛПОНП). При нормальных условиях хиломикроны находятся в плазме в течение 1-5 ч. после приема пищи [2], [3].
Внутренний путь. Печень постоянно синтезирует триглицериды, утилизируя свободные жирные кислоты и углеводы. В составе липидного ядра ЛПОНП они выходят в кровь. Внутриклеточный процесс формирования этих частиц схож с таковым для хиломикронов, за исключением различия в апопротеинах. Последующее взаимодействие ЛПОНП с липопротеинлипазой в тканевых капиллярах приводит к формированию остаточных ЛПОНП, богатых холестерином (ЛППП). Примерно половина этих частиц выводится из кровотока клетками печени в течение 2-6 ч. Остальные претерпевают модификацию с замещением оставшихся триглицеридов эфирами холестерина и освобождением от всех апопротеинов, за исключением апопротеина В. В результате формируются ЛПНП, которые содержат ¾ всего плазменного холестерина. Их главная функция — доставка холестерина в клетки надпочечников, скелетных мышц, лимфоцитов, гонад и почек [3]. Модифицированные ЛПНП (окисленные продукты, количество которых возрастает при повышенном содержании в организме активных форм кислорода, так называемом окислительном стрессе) могут распознаваться иммунной системой как нежелательные элементы. Тогда макрофаги их захватывают и выводят из организма в виде ЛПВП. При чрезмерно высоком уровне ЛПНП макрофаги становятся перегруженными липидными частицами и оседают в стенках артерий, образуя атеросклеротические бляшки.
Основные транспортные функции липопротеинов приведены в таблице.
Таблица. Функции липопротеинов [5].
| Класс | Размеры | Функция |
|---|---|---|
| ЛПВП | 4-14 нм | Транспорт холестерина от периферийных тканей к печени |
| ЛПНП | 20-22,5 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛППП | 25-35 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛПОНП | 30-80 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| Хиломикроны | 75-1200 нм | Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень |
Регуляция уровня холестерина
Уровень холестерина в крови в большой степени определяется диетой. Пищевые волокна снижают уровень холестерина, а пища животного происхождения повышает его содержание в крови.
Один из основных регуляторов метаболизма холестерина — рецептор LXR (рис. 3). LXR α и β принадлежат к семейству ядерных рецепторов, которые образуют гетеродимеры с ретиноидным Х рецептором и активируют гены-мишени. Их естественные лиганды — оксистерины (окисленные производные холестерина). Обе изоформы идентичны на 80% по аминокислотной последовательности. LXR-α обнаружен в печени, кишечнике, почках, селезенке, жировой ткани; LXR-β в небольшом количестве обнаруживается повсеместно [6]. Метаболический путь оксистеринов быстрее, чем у холестерина, и поэтому их концентрация лучше отражает краткосрочный баланс холестерина в организме. Существует всего три источника оксистеринов: ферментативные реакции, неферментативное окисление холестерина и поступление с пищей. Неферментативные источники оксистеринов как правило минорные, но в патологических состояниях их вклад возрастает (окислительный стресс, атеросклероз), и оксистерины могут действовать наряду с другими продуктами перекисного окисления липидов [6]. Основное влияние LXR на метаболизм холестерина: обратный захват и транспорт в печень, вывод с желчью, снижение кишечного всасывания. Уровень продукции LXR различается на протяжении аорты; в дуге, зоне турбулентности, LXR в 5 раз меньше, чем в участках со стабильным течением. В здоровых артериях повышение экспрессии LXR в зоне сильного потока оказывает антиатерогенное действие [7].
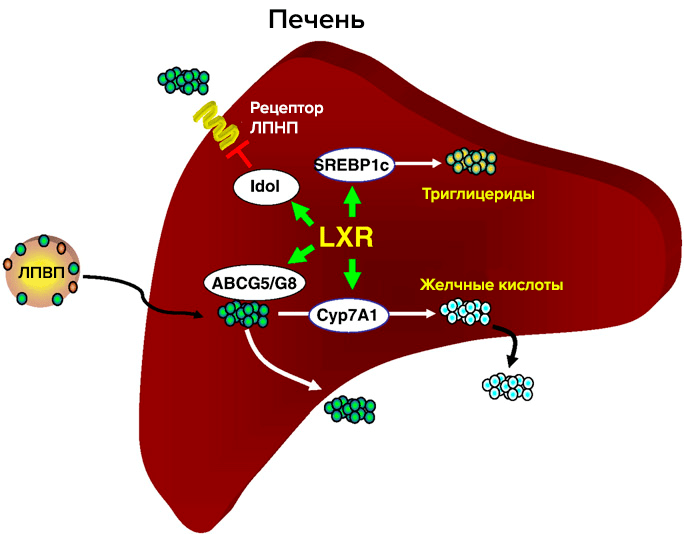
Рисунок 3. Участие рецептора LXR в метаболизме холестерина в печени
Важную роль в метаболизме холестерина и стероидов играет рецептор-«мусорщик» SR-BI (рис. 4). Он был обнаружен в 1996 году как рецептор для ЛПВП [8]. В печени SR-BI отвечает за избирательный захват холестерина из ЛПВП. В надпочечниках SR-BI опосредует избирательный захват этерифицированного холестерина из ЛПВП, который необходим для синтеза глюкокортикоидов. В макрофагах SR-BI связывает холестерин, что является первым этапом в обратном транспорте холестерина. SR-BI также захватывает холестерин из плазмы и опосредует его прямой выход в кишечник [9].
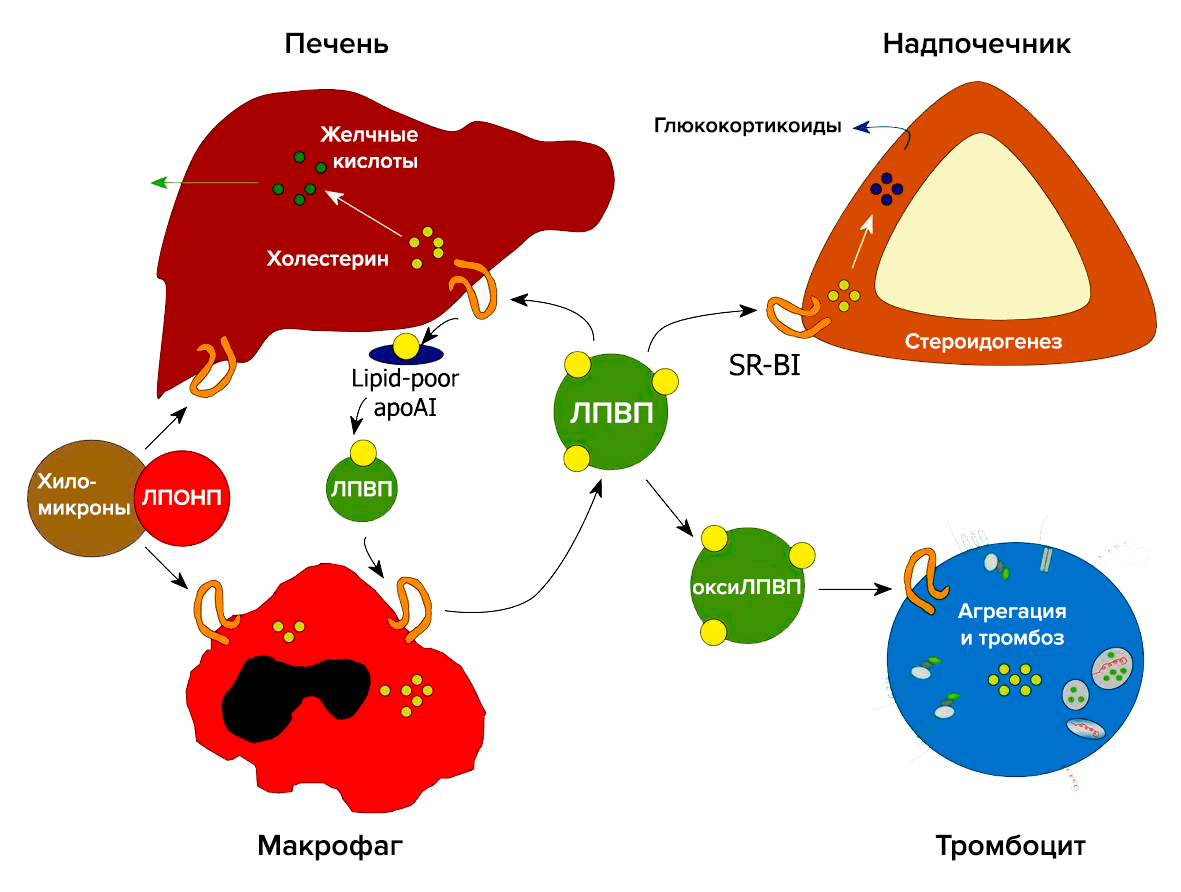
Рисунок 4. Участие рецептора SR-BI в метаболизме холестерина
Выведение холестерина из организма
Классический путь выведения холестерина: транспорт холестерина с периферии в печень (ЛПВП), захват клетками печени (SR-BI), экскреция в желчь и выведение через кишечник, где большая часть холестерина возвращается в кровь [10].
Основная функция ЛПВП — обратный транспорт холестерина в печень. Плазменные ЛПВП являются результатом комплекса различных метаболических событий. Состав ЛПВП очень различается по плотности, физико-химическим свойствам и биологической активности. Это сферические или дисковидные образования. Дисковидные ЛПВП в основном состоят из апопротеина A-I с вложенным слоем фосфолипидов и свободного холестерина. Сферические ЛПВП больше и дополнительно содержат гидрофобное ядро из эфиров холестерина и небольшого количества триглицеридов.
При метаболическом синдроме активируется обмен триглицеридов и эфиров холестерина между ЛПВП и триглицерид-богатыми липопротеинами. В результате содержание триглицеридов в ЛПВП повышается, а холестерина снижается (т.е. холестерин не выводится из организма) [11]. Отсутствие ЛПВП у людей встречается при болезни Tangier, главные клинические проявления которой — увеличенные оранжевые миндалины, роговичная дуга, инфильтрация костного мозга и мукозного слоя кишечника [3].
Если коротко обобщить, то страшен не сам холестерин, который является необходимым компонентом, обеспечивающим нормальную структуру клеточных мембран и транспорт липидов в крови, а кроме того он является сырьем для производства стероидных гормонов. Метаболические расстройства же проявляются при нарушении баланса ЛПНП и ЛПВП , что отражает нарушение системы транспорта липопротеинов, включающей работу печени, образование желчи и участие макрофагов. Поэтому любые заболевания печени, а также аутоиммунные процессы могут вызвать развитие атеросклероза даже при вегетарианской диете. Если мы вернемся к изначальным опытам Н.А. Аничкова по кормлению кроликов пищей, богатой холестерином, то увидим, что холестерин не встречается в естественном рационе кроликов и поэтому, как яд, нарушает работу печени, вызывает сильное воспаление сосудов и, как следствие, образование бляшек.
- Anitschkow N. and Chalatow S. (1983). Classics in arteriosclerosis re: On experimental cholesterin steatosis and its ificance in the origin of some pathological processes by N. Anitschkow and S. Chalatow, translated by Mary Z. Pelias, 1913. Arteriosclerosis, Thrombosis, and Vascular Biology. 3, 178-182;
- Климов А.Н. Причины и условия развития атеросклероза. Превентивная кардиология. М.: «Медицина», 1977. — 260-321 с.;
- Cox R.A. and Garcia-Palmieri M.R. Cholesterol, triglycerides, and associated lipoproteins. Clinical methods: the history, physical, and laboratory examinations (3rd Edition). Boston: Butter-worths, 1990. — 153-160 p.;
- Grundy S.M. (1978). Cholesterol bolism in man. West. J. Med. 128, 13-25;
- Википедия: «Липопротеины»;
- Wójcicka G., Jamroz-Wisniewska A., Horoszewicz K., Beltowski J. (2007). Liver X receptors (LXRs). Part I: Structure, , regulation of activity, and role in lipid bolism. Postepy Hig. Med. Dosw. 61, 736-759;
- Calkin A. and Tontonoz P. (2010). Liver X Receptor aling pathways and atherosclerosis. Arterioscler. Thromb. Vasc. Biol. 30, 1513-1518;
- S. Acton, A. Rigotti, K. T. Landschulz, S. Xu, H. H. Hobbs, M. Krieger. (1996). Identification of Scavenger Receptor SR-BI as a High Density Lipoprotein Receptor. Science. 271, 518-520;
- Vrins C.L.J. (2010). From blood to gut: Direct secretion of cholesterol via transintestinal cholesterol efflux. World J. Gastroenterol. 16, 5953-5957;
- Van der Velde A.E. (2010). Reverse cholesterol transport: From classical view to new insights. World J. Gastroenterol. 16, 5908-5915;
- Wilfried Le Goff, Maryse Guerin, M.John Chapman. (2004). Pharmacological modulation of cholesteryl ester transfer protein, a new therapeutic target in atherogenic dyslipidemia. Pharmacology & Therapeutics. 101, 17-38;
- Липидный фундамент жизни;
- Наночастицами — по «плохому» холестерину!.
Источник
Фонд холестерола в организме, пути его использования и выведения.

Рис. 8-66. Синтез холестерола. С5 — изопентенилпирофосфат; С1 — Фарнезилпирофосфат. Все атомы углерода холестерола происходят из ацетил-КоА. Сквален — углеводород линейной структуры — превращается ферментом циклазой в ланостерол, содержащий 4 конденсированных кольца и гидроксильную группу. Ланостерол через ряд последовательных реакций превращается в холестерол (I, II, III — этапы синтеза).
Этерификация холестерола
В некоторых тканях гидроксильная группа холестерола этерифицируется с образованием более гидрофобных молекул — эфиров холестерола. Реакция катализируется внутриклеточным ферментом АХАТ (ацилКоА:холестеролаиилтрансферазой).
Реакция этерификации происходит также в крови в ЛПВП, где находится фермент ЛХАТ (лецитин:холестеролацилтрансфераза). Эфиры холестерола — форма, в которой они депонируются в клетках или транспортируются кровью. В крови около 75% холестерола находится в виде эфиров.
Регуляция синтеза холестерола
Регуляция ключевого фермента синтеза холестерола (ГМГ-КоА-редуктазы) происходит разными способами.
Фосфорилирование/дефосфорилирование ГМГ-КоА-редуктазы (рис. 8-67). При увеличении соотношения инеулин/глюкагон этот фермент дефосфорилируется и переходит в активное состояние. Действие инсулина осуществляется через 2 фермента:
фосфатазу киназы ГМГ-КоА-редуктазы, которая превращает киназу в неактивное дефосфорилированное состояние;
фосфатазу ГМГ-КоА-редуктазы путём превращения её в дефосфорилированное активное состояние. Результатом этих реакций служит образование дефосфорилированной активной формы ГМГ-КоА-редуктазы.
Следовательно, в абсорбтивный период синтез холестерола увеличивается. В этот период увеличивается и доступность исходного субстрата для синтеза холестерола — ацетил-КоА (в результате приёма пищи, содержащей углеводы и жиры, так как ацетил-КоА образуется при распаде глюкозы и жирных кислот).
В постабсорбтивном состоянии глюкагон через протеинкиназу А стимулирует фосфорилирование ГМГ-КоА-редуктазы, переводя её в неактивное состояние. Это действие усиливается тем, что одновременно глюкагон стимулирует фосфорилирование и инактивацию фосфатазы ГМГ-КоА-редуктазы и фосфорилирование киназы ГМГ-КоА-редуктазы, удерживая, таким образом, ГМГ-КоА-редуктазу в фосфорилированном неактивном состоянии. В результате синтез холестерола в постабсорбтивном периоде и при голодании ингибируется.
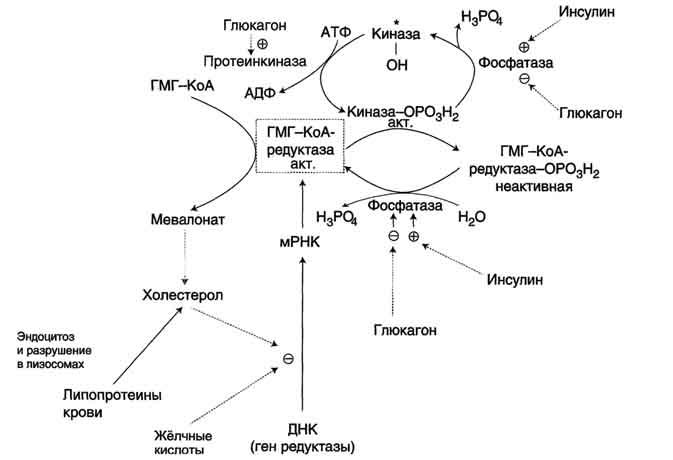
Рис. 8-67. Регуляция активности ГМГ-КоА-редуктазы в печени. Холестерол и жёлчные кислоты снижают скорость транскрипции и, таким образом, синтез фермента. Инсулин стимулирует дефосфорилирование, а глюкагон — фосфорилирование ГМГ-КоА-редуктазы. Инсулин активирует 2 фосфатазы: киназы ГМГ-КоА-редуктазы* и фосфатазу, дефосфорилирующую непосредственно ГМГ-КоА-редуктазу. Глюкагон стимулирует фосфорилирование и инактивацию 2 фосфатаз и фосфорилирование и активацию киназы ГМГ-КоА-редуктазы.
Ингибирование синтеза ГМГ-КоА-редуктазы. Конечный продукт метаболического пути (холестерол) снижает скорость транскрипции гена ГМГ-КоА-редуктазы, подавляя таким образом собственный синтез. В печени активно идёт синтез жёлчных кислот из холестерола, поэтому и жёлчные кислоты (как конечные продукты синтеза) подавляют активность гена ГМГ-КоА-редуктазы (рис. 8-67). Так как молекула ГМГ-КоА-редуктазы существует около 3 ч после синтеза, то ингибирование синтеза этого фермента конечным продуктом метаболического пути (холестеролом) является эффективной регуляцией.
70. Роль липопротеинов низкой и высокой плотности (ЛПНПи ЛПВП) в обмене холестерина. Биохимические основы развития атеросклероза Количественное определение общего холестерина в сыворотке крови. Клиническое значение определения.

Синтез рецепторов ЛПНП и их последующие превращения. После взаимодействия ЛПНП с рецептором (1) окаймлённые ямки вместе с рецептором и ЛПНП поглощаются по механизму эндоцитоза (2). В образовавшейся эндосоме снижается значение рН за счёт работы протонного насоса, использующего энергию АТФ. При снижении рН рецепторы ЛПНП отделяются от ЛПНП (3), и большая часть рецепторов возвращается в плазматическую мембрану (5). Таким образом, рецепторы ЛПНП могут многократно использоваться клеткой. После удаления рецептора ЛПНП эндосомы сливаются с лизосомами, и гидролитические ферменты лизосом расщепляют компоненты эндосом (4). В результате освобождается холестероп, который может, быть использован для формирования структуры мембран, в клетках печени для синтеза жёлчных кислот, в клетках эндокринной системы для синтеза стероидных гормонов.

Рис. 8-70. Роль ЛПВП и ЛПНП в обратном транспорте холестерола в печень. Незрелые ЛПВП-предшественники обогащаются холестеролом, который поступает в ЛПВП при участии фермента ЛХАТ с поверхности клеток и других липопротеинов, содержащих холестерол. Незрелые ЛПВП, обогащаясь холестеролом, превращаются в ЛПВП3 — частицы сферической формы и большего размера. ЛПВП3 обменивают эфиры холестерола на триацилглицеролы, содержащиеся в ЛПОНП, ЛППП при участии «белка, переносящего эфиры холестерола»*. ЛПВП3 превращается в ЛПВП2, размер которых увеличивается за счёт накопления триацилглицеролов. ЛПОНП и ЛППП под действием ЛП-липазы превращаются в ЛПНП, которые доставляют холестерол в печень. Часть ЛПВП захватывается клетками печени, взаимодействуя со специфическими для ЛПВП рецепторами к апоА-I. На поверхности клеток печени фосфолипиды и триацилглицеролы ЛППП, ЛПВП2 гидролизуются печёночной ЛП-липазой**, что дестабилизирует структуру поверхности ЛП и способствует диффузии холестерола в гепатоциты. ЛПВП2 в результате этого опять превращаются в ЛПВП3 и возвращаются в кровоток. X — холестерол, ЭХ — эфиры холестерола, ФЛ — фосфолипиды, ЛХАТ — лецитин-холестеролацилтрансфераза, А-I — апопротеин, активатор ЛХАТ.
Молекулярные механизмы патогенеза атеросклероза
Развитие атеросклероза проходит несколько стадий .
Процесс начинается с повреждения эндотелия сосудов, причём повреждение может иметь различные механизмы. Важнейший механизм — повреждение эндотелия за счёт изменённой структуры ЛПНП, например в результате активации свободнорадикального ПОЛ в составе ЛПНП; повреждение провоцируется свободными радикалами, образующимися в процессе метаболизма или поступающими извне. В ходе ПОЛ в ЛПНП изменяется не только структура самих липидов, но и нарушается структура апопротеинов. Окисленные ЛПНП захватываются макрофагами через скевенджер-рецепторы. Этот процесс не регулируется количеством поглощённого холестерола, как в случае его поступления в клетки через специфические рецепторы, поэтому макрофаги перегружаются холестеролом и превращаются в «пенистые клетки», которые проникают в субэндотелиальное пространство. Это приводит к образованию жировых полосок в стенке кровеносных сосудов. На этой стадии эндотелий сосудов может сохранять свою структуру. При увеличении количества «пенистых клеток» происходит повреждение эндотелия сосудов. В норме клетки эндотелия секретируют простагландин I2 (простациклин I2), который ингибирует агрегацию тромбоцитов. При повреждении клеток эндотелия тромбоциты активируются. Во-первых, они секретируют тромбоксан А2 (ТХ А2, который стимулирует агрегацию тромбоцитов, что может привести к образованию тромба в области атеросклеротической бляшки; во-вторых, тромбоциты начинают продуцировать пептид — тромбоцитарный фактор роста, стимулирующий пролиферацию ГМК. ГМК мигрируют из медиального слоя во внутренний слой артериальной стенки и способствуют таким образом росту бляшки. Далее происходит прорастание бляшки фиброзной тканью (коллагеном,
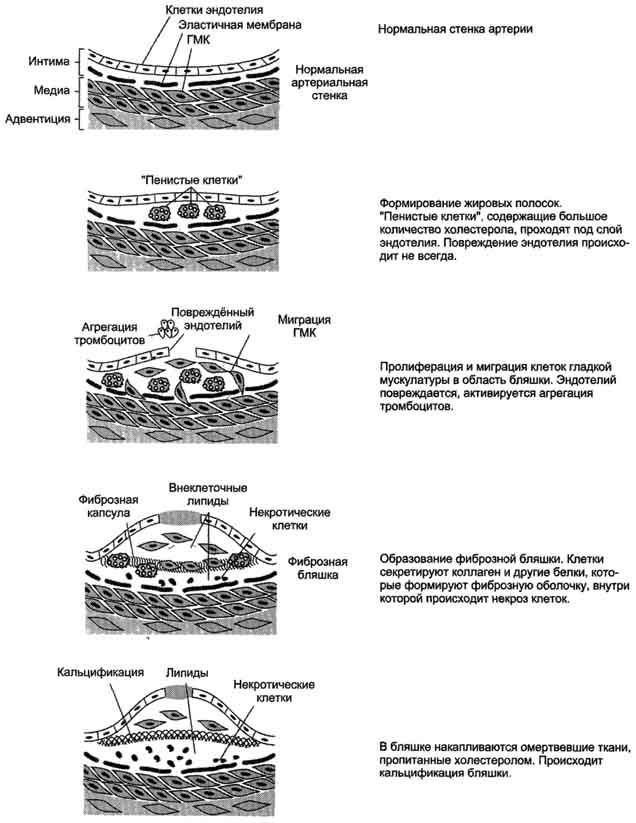
Рис. 8-76. Развитие атеросклеротической бляшки в клетках эндотелия кровеносных сосудов.
эластином); клетки под фиброзной оболочкой некротизируются, а холестерол откладывается в межклеточном пространстве. На этой стадии в центре бляшки образуются даже холестериновые кристаллы. На последних стадиях развития бляшка пропитывается солями кальция и становится очень плотной. В области бляшки часто образуются тромбы, перекрывающие просвет сосуда, что приводит к острому нарушению кровообращения в соответствующем участке ткани и развитию инфаркта. Чаще всего атеросклеротические бляшки развиваются в артериях миокарда, поэтому наиболее распространённое заболевание, развивающееся в результате атеросклероза, — инфаркт миокарда.
Биохимические основы лечения атеросклероза и предупреждения развития инфаркта миокарда
Важным лечебным фактором, снижающим риск развития гиперхолестеролемии и атеросклероза, является гипокалорийная и гипохолестериновая диета. Поступление холестерола с пищей не должно превышать 300 мг/сут .
Холестерол — стероид животного происхождения, поэтому он поступает в организм при употреблении животных жиров и жирного мяса. Растительная пища не содержит холестерола, поэтому у людей среднего и старшего возраста она должна составлять основу рациона.
К лечебным и профилактическим факторам относят обогащение пищи полиеновыми жирными кислотами семейства ω-3, уменьшающими риск тромбообразования. Ненасыщенные жирные кислоты способствуют более быстрому выведению холестерола из организма, хотя механизм этого явления до конца не выяснен. В то же время доказано, что полиеновые кислоты подавляют синтез тромбоцитарного фактора роста и таким образом замедляют развитие атеросклеротической бляшки.
Витамины С, Е, А, обладающие антиоксидантными свойствами, ингибируют перекисное (свободнорадикальное) окисление липидов в ЛПНП и поддерживают нормальную структуру липидов ЛПНП и их метаболизм.
Однако меры по исправлению диеты недостаточны при лечении выраженной гиперхолестеролемии и атеросклерозе. Лечение гиперхолестеролемии, как правило, комплексное.
Один из принципов лечения — «размыкание» цикла энтерогепатической циркуляции жёлчных кислот. Для этого используют лекарства типа холестирамина — полимера, который в кишечнике адсорбирует жёлчные кислоты, выделяется с фекалиями и таким образом уменьшает возврат жёлчных кислот в печень. В печени увеличивается
Таблица 8-11. Основы диеты, снижающей количество холестерола и жиров в организме человека
Проводимое вмешательство | Количество холестерола и жиров | Источники питания |
Снижение потребления общего количества жиров Снижение насыщенных жиров | <30% суточной энергии <7-10% | Уменьшить потребление масла, маргарина, цельного молока, мороженого, жирных сыров, жирного мяса, шоколада |
Использование пищи с высоким содержанием белка | Рыба, цыплята и индейка (без шкурки), телятина | |
Использование сложных углеводов, клетчатки, содержащейся во фруктах и овощах | ~ 35-40 г/сут клетчатки и пектинов растений | Фрукты, овощи, бобы и соя, неочищенные зерновые продукты |
Снижение холестерина в пище | <300 мг/день | Не более 2 яиц в неделю, печень 2 раза в месяц |
Умеренное увеличение использования масел, содержащих полиеновые жирные кислоты | Мононенасыщенные (10-1 5% энергии) Полиненасыщенные (7-10% энергии) | Подсолнечное, кукурузное, оливковое масло |
захват холестерола из крови для синтеза новых жёлчных кислот. Препараты типа холестирамина называют секвестрантами жёлчных кислот.
Наиболее эффективные препараты, применяемые при лечении атеросклероза, — ингибиторы ГМГ-КоА-редуктазы. Эти препараты — антибиотики, например мевакор, в печени трансформируются в активную форму и эффективно ингибируют регуляторный фермент биосинтеза холестерола. Такие препараты могут практически полностью подавить синтез собственного холестерола в организме. В этих условиях печень увеличивает захват холестерола из крови. Для этого в клетках печени почти вдвое увеличивается синтез белков-рецепторов Л ПНП и, соответственно, увеличивается захват ЛПНП из крови. Таким образом концентрация холестерола в крови даже у больных с гетерозиготной формой семейной гиперхолестеролемии может быть доведена практически до нормы.
Лекарственные препараты — фибраты (клофибрат, фенофибрат) — ускоряют катаболизм ЛПОНП, активируя ЛП-липазу. Эти препараты также активируют окисление жирных кислот в печени, уменьшая тем самым синтез триацилглицеролов и эфиров холестерола и, как следствие, секрецию ЛПОНП печенью. Клофибрат индуцирует синтез ферментов пероксисом, способных окислять жирные кислоты. Фибраты обычно применяют при сочетании гипертриглицеролемии и гиперхолестеролемии. Для эффективного лечения атеросклероза применяют, как правило, комбинированное воздействие нескольких лекарственных препаратов.
АБЕЛЛЯ МЕТОД (L. L. Abell) — один из методов количественного определения общего холестерина в сыворотке крови.
Основан на способности эфирной вытяжки холестерина давать с уксусным ангидридом и серной к-той цветную реакцию (реакция Либерманна — Бурхардта), интенсивность к-рой определяется колориметрически.
71. Общая схема источников поступления и путей расходования аминокислот в тканях. Динамическое состояние белков в организме. Причины необходимости постоянного обновления белков организма. «Незаменимые» аминокислоты.

Источники и пути использования аминокислот
ДИНАМИЧЕСКОЕ СОСТОЯНИЕ БЕЛКОВ ОРГАНИЗМА Кажущаяся стабильность химического состава целостного организма является результатом существования определенного равновесия между скоростями синтеза и распада его составляющих. Внедрение в биохимическую и клиническую практику метода меченых атомов позволило доказать, что белки нужны не только растущему, но и сформировавшемуся организму, когда его рост прекратился, т.е. имеются доказательства существования в организме механизма постоянного обновления химических составных частей тела. При нормальных физиологических условиях, как и при патологических состояниях, скорости синтеза и распада специфических веществ определяются, помимо нервно-гормонального влияния, химической природой веществ и внутриклеточной их локализацией. В растущем организме скорость синтеза многих компонентов органов и тканей преобладает над скоростью их распада. Тяжелые изнуряющие болезни, а также голодание, напротив, характеризуются преобладанием скорости катаболизма над скоростью синтеза. Почти все белки тела, включая структурные белки, гемоглобин, белки плазмы и других биологических жидкостей организма, также подвергаются постепенному распаду и синтезу. Например, более половины белков печени, сыворотки крови и слизистой оболочки кишечника подвергается распаду и ресинтезу в течение 10 дней. Медленнее обновляются белки мышц, кожи и мозга.
Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме, в частности, в организме человека. Поэтому их поступление в организм с пищей необходимо.Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треони́н, триптофан и фенилалани́н; Для детей незаменимыми также являются аргинин и гистидин.
72. Катаболизм аминокислот. Общие пути распада аминокислот. Трансаминирование аминокислот. Схема реакций, ферменты, роль витамина В6. Биологическое значение трансаминирования. Диагностическое значение определения трансаминаз в сыворотке крови.
Аминокислоты, образующиеся при переваривании белков и поступающие в клетки тканей, подвергаются катаболизму и анаболизму, а также специфическим реакциям, в результате которых синтезируются биологически активные соединения.
Катаболизм большинства аминокислот начинается с Отщепления α-аминогруппы.Аминокислота теряет аминогруппу в результате двух типов реакций: трансаминирования и дезаминирования.
А. Трансаминирование
Трансаминирование — реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая кетокислота и новая аминокислота. Константа равновесия для большинства таких реакций близка к единице (Кр~1,0), поэтому процесс трансаминирования легко обратим (см. схему А).
Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) — производное витамина В6 (пиридоксина, см. раздел 3) (см. схему Б).
Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариот. Причём митохондриальные и цитоплазматические формы ферментов различаются по физико-химическим свойствам. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты,за исключением лизина, треонина и пролина.
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник