Формула гемоглобина как комплексного соединения
Содержание статьи
Топоева Н. |
Комплексные соединения. Урок-лекция. 11 класс | Журнал «Химия
Занятие, представленное на конкурс «Я иду на
урок», я провожу в 11-м биолого-химическом классе,
где на изучение химии отводится 4 часа в неделю.
Тему «Комплексные соединения» я взяла,
во-первых, потому что эта группа веществ имеет
исключительно большое значение в природе;
во-вторых, многие задания ЕГЭ включают понятие о
комплексных соединениях; в-третьих, учащиеся из
этого класса выбирают профессии, связанные с
химией, и будут встречаться с группой
комплексных соединений в будущем.
Цель. Сформировать понятие о составе,
классификации, строении и основах номенклатуры
комплексных соединений; рассмотреть их
химические свойства и показать значение;
расширить представления учащихся о многообразии
веществ.
Оборудование. Образцы комплексных
соединений.
План урока
I. Организационный момент.
II. Изучение нового материала (лекция).
III. Подведение итогов и постановка домашнего
задания.
План лекции
1. Многообразие веществ.
2. Координационная теория А.Вернера.
3. Строение комплексных соединений.
4. Классификация комплексных соединений.
5. Природа химической связи в комплексных
соединениях.
6. Номенклатура комплексных соединений.
7. Химические свойства комплексных соединений.
8. Значение комплексных соединений.
ХОД УРОКА
I. Организационный момент
II. Изучение нового материала
Многообразие веществ
Мир веществ многообразен, и мы уже знакомы с
группой веществ, которые принадлежат к
комплексным соединениям. Данными веществами
стали заниматься с XIX в., но понять их строение с
позиций существовавших представлений о
валентности было трудно.
Координационная теория А.Вернера
В 1893 г. швейцарским химиком-неоргаником
Альфредом Вернером (1866–1919) была сформулирована
теория, позволившая понять строение и некоторые
свойства комплексных соединений и названная координационной
теорией*. Поэтому
комплексные соединения часто называют
координационными соединениями.
Соединения, в состав которых входят сложные
ионы, существующие как в кристалле, так и в
растворе, называются комплексными, или
координационными.
Строение комплексных соединений
Согласно теории Вернера центральное положение
в комплексных соединениях занимает, как правило,
ион металла, который называют центральным ионом,
или комплексообразователем.
Комплексообразователь – частица (атом,
ион или молекула), координирующая (располагающая)
вокруг себя другие ионы или молекулы.
Комплексообразователь обычно имеет
положительный заряд, является d-элементом,
проявляет амфотерные свойства, имеет
координационное число 4 или 6. Вокруг
комплексообразователя располагаются
(координируются) молекулы или кислотные
остатки – лиганды (адденды).
Лиганды – частицы (молекулы и ионы),
координируемые комплексообразователем и
имеющие с ним непосредственно химические связи
(например, ионы: Cl–, I–, NO3–,
OH–; нейтральные молекулы: NH3, H2O,
CO).
Лиганды не связаны друг с другом, так как между
ними действуют силы отталкивания. Когда
лигандами являются молекулы, между ними возможно
молекулярное взаимодействие. Координация
лигандов около комплексообразователя является
характерной чертой комплексных соединений (рис.
1).
Рис. 1. Координация цианид-ионов |
Координационное число – это
число химических связей, которые
комплексообразователь образует с лигандами.
Рис. 2. Тетраэдрическая структура иона |
Значение координационного числа
комплексообразователя зависит от его природы,
степени окисления, природы лигандов и условий
(температура, концентрация), при которых
протекает реакция комплексообразования.
Координационное число может иметь значения от 2
до 12. Наиболее распространенными являются
координационные числа 4 и 6. Для координационного
числа 4 структура комплексных частиц может быть
тетраэдрической [AlBr4]– (рис. 2) и в виде
плоского квадрата [Pt(NH3)2Cl2] (рис.
3). Комплексные соединения с координационным
числом 6 имеют октаэдрическое строение [AlF6]3–
(рис. 4).
Рис. 3. Соединение [Pt(NH3)2Cl2] |
Рис. 4. Ион [AlF6]3– |
Комплексообразователь и окружающие
его лиганды составляют внутреннюю сферу
комплекса. Частица, состоящая из
комплексообразователя и окружающих лигандов,
называется комплексным ионом. При изображении
комплексных соединений внутреннюю сферу
(комплексный ион) ограничивают квадратными
скобками. Остальные составляющие комплексного
соединения расположены во внешней сфере (рис.
5).
Суммарный заряд ионов внешней сферы должен
быть равен по значению и противоположен по знаку
заряду комплексного иона:
Рис. 5. Пояснения к изображению формул |
Заряд комплексного иона легко
подсчитать, зная степень окисления составляющих
его частей.
Классификация комплексных
соединений
Большое многообразие комплексных соединений и
их свойств не позволяет создать единую
классификацию. Однако можно группировать
вещества по некоторым отдельным признакам.
1) По составу.
2) По типу координируемых лигандов.
а) Аквакомплексы – это комплексные
катионы, в которых лигандами являются молекулы H2O.
Их образуют катионы металлов со степенью
окисления +2 и больше, причем способность к
образованию аквакомплексов у металлов одной
группы периодической системы уменьшается сверху
вниз.
Примеры аквакомплексов:
[Al(H2O)6]Cl3, [Cr(H2O)6](NO3)3.
б)Гидроксокомплексы – это комплексные
анионы, в которых лигандами являются
гидроксид-ионы OH–.
Комплексообразователями являются металлы,
склонные к проявлению амфотерных свойств – Be,
Zn, Al, Cr.
Например: Na[Al(OH)4], Ba[Zn(OH)4].
в) Аммиакаты – это комплексные катионы, в
которых лигандами являются молекулы NH3.
Комплексообразователями являются d-элементы.
Например: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl.
г) Ацидокомплексы – это комплексные
анионы, в которых лигандами являются анионы
неорганических и органических кислот.
Например: K3[Al(C2O4)3], Na2[Zn(CN)4],
K4[Fe(CN)6].
3) По заряду внутренней сферы.
Природа химической связи в
комплексных соединениях
Во внутренней сфере между
комплексообразователем и лигандами существуют
ковалентные связи, образованные в том числе и по
донорно-акцепторному механизму. Для образования
таких связей необходимо наличие свободных
орбиталей у одних частиц (имеются у
комплексообразователя) и неподеленных
электронных пар у других частиц (лиганды). Роль
донора (поставщика электронов) играет лиганд, а
акцептором, принимающим электроны, является
комплексообразователь. Донорно-акцепторная
связь возникает как результат перекрывания
свободных валентных орбиталей
комплексообразователя с заполненными
орбиталями донора.
Между внешней и внутренней сферой существует
ионная связь. Приведем пример.
Электронное строение атома бериллия:
Электронное строение атома бериллия в
возбужденном состоянии:
Электронное строение атома бериллия в
комплексном ионе [BeF4]2–:
Пунктирными стрелками показаны электроны
фтора; две связи из четырех образованы по
донорно-акцепторному механизму. В данном случае
атом Be является акцептором, а ионы фтора –
донорами, их свободные электронные пары
заполняют гибридизованные орбитали (sp3-гибридизация).
Номенклатура комплексных
соединений
Наибольшее распространение имеет
номенклатура, рекомендованная IUPAC. Название комплексного
аниона начинается с обозначения состава
внутренней сферы: число лигандов обозначается
греческими числительными: 2–ди, 3–три, 4–тетра,
5–пента, 6–гекса и т.д., далее следуют названия
лигандов, к которым прибавляют соединительную
гласную «о»: Cl– – хлоро-, CN– –
циано-, OH– – гидроксо- и т.п. Если у
комплексообразователя переменная степень
окисления, то в скобках римскими цифрами
указывают его степень окисления, а его название с
суффиксом -ат: Zn – цинкат, Fe – феррат(III),
Au – аурат(III). Последним называют катион
внешней сферы в родительном падеже.
Примеры:
K3[Fe(CN)6] – гексацианоферрат(III)
калия,
K4[Fe(CN)6] – гексацианоферрат(II)
калия,
K2[Zn(OH)4] – тетрагидроксоцинкат
калия.
Названия соединений, содержащих комплексный
катион, строятся из названий анионов внешней
среды, после которых указывается число лигандов,
дается латинское название лиганда (молекула
аммиака NH3 – аммин, молекула воды H2O –
аква от латинского названия воды) и русское
название элемента-комплексообразователя;
римской цифрой в скобках указывается степень
окисления элемента-комплексообразователя, если
она переменная. Например:
[Cu(NH3)4]SO4 – сульфат
тетраамминмеди(II),
[Al(H2O)6]Cl3 – хлорид
гексаакваалюминия.
Химические свойства комплексных
соединений
1. В растворе комплексные соединения ведут
себя как сильные электролиты, т.е. полностью
диссоциируют на катионы и анионы:
[Pt(NH3)4]Cl2 = Pt(NH3)4]2+
+ 2Cl–,
K2[PtCl4] = 2K+ + [PtCl4]2–.
Диссоциация по такому типу называется
первичной.
Вторичная диссоциация связана с удалением
лигандов из внутренней сферы комплексного иона:
[PtCl4]2– PtCl3– + Cl–.
Вторичная диссоциация происходит ступенчато:
комплексные ионы ([PtCl4]2–) являются
слабыми электролитами.
2. При действии сильных кислот происходит
разрушение гидроксокомплексов, например:
а) при недостатке кислоты
Na3[Al(OH)6] + 3HCl = 3NaCl + Al(OH)3 + 3H2O;
б) при избытке кислоты
Na3[Al(OH)6] + 6HCl = 3NaCl + AlCl3 +
6H2O.
3. Нагревание (термолиз) всех аммиакатов
приводит к их разложению, например:
[Cu(NH3)4]SO4 CuSO4 + 4NH3.
Значение комплексных соединений
Координационные соединения имеют
исключительно большое значение в природе.
Достаточно сказать, что почти все ферменты,
многие гормоны, лекарства, биологически активные
вещества представляют собой комплексные
соединения. Например, гемоглобин крови,
благодаря которому осуществляется перенос
кислорода от легких к клеткам ткани, является
комплексным соединением, содержащим железо (рис.
6), а хлорофилл, ответственный за фотосинтез в
растениях, – комплексным соединением магния
(рис. 7).
Рис. 6. Гем-группа в молекуле |
Значительную часть природных
минералов, в том числе полиметаллических руд и
силикатов, также составляют координационные
соединения. Более того, химические методы
извлечения металлов из руд, в частности меди,
вольфрама, серебра, алюминия, платины, железа,
золота и других, также связаны с образованием
легкорастворимых, легкоплавких или летучих
комплексов. Например: Na3[AlF6] –
криолит, KNa3[AlSiO4]4 – нефелин
(минералы, комплексные соединения, содержащие
алюминий).
Рис. 7. Хлорофилл c1 |
Современная химическая отрасль
промышленности широко использует
координационные соединения как катализаторы при
синтезе высокомолекулярных соединений, при
химической переработке нефти, в производстве
кислот.
III. Подведение итогов и постановка
домашнего задания
Домашнее задание.
1) Приготовиться по лекции к уроку-практикуму по
теме: «Комплексные соединения».
2) Письменно дать характеристику следующим
комплексным соединениям по строению и
классифицировать по признакам:
K3[Cr(OH)6], [Cr(H2O)6](NO3)3,
Na2[Zn(CN)4], [Ag(NH3)2]OH.
3) Написать уравнения реакций, при помощи
которых можно осуществить превращения:
* За открытие этой
новой области науки А.Вернер в 1913 г. был
удостоен Нобелевской премии.
Н.Н.ТОПОЕВА,
учитель химии
Аскизского лицея-интерната
(с. Аскиз, Республика Хакасия)
Источник
Комплексные соединения Гемоглобин Hb 4 O

Комплексные соединения
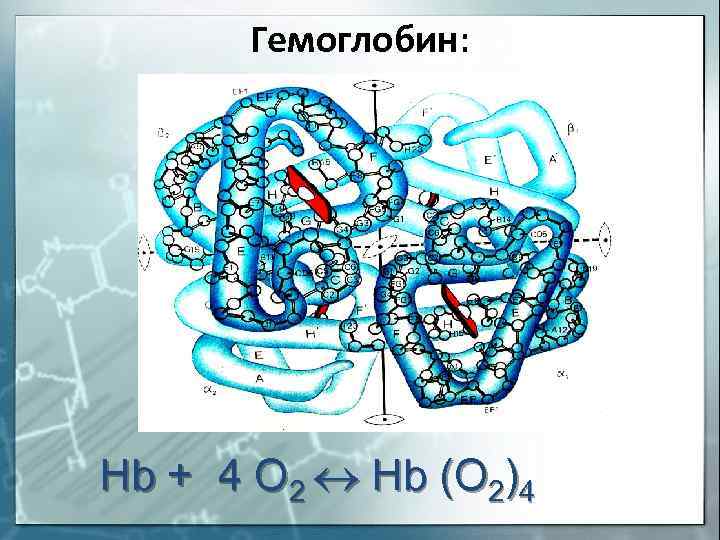
Гемоглобин: Hb + 4 O 2 Hb (O 2)4
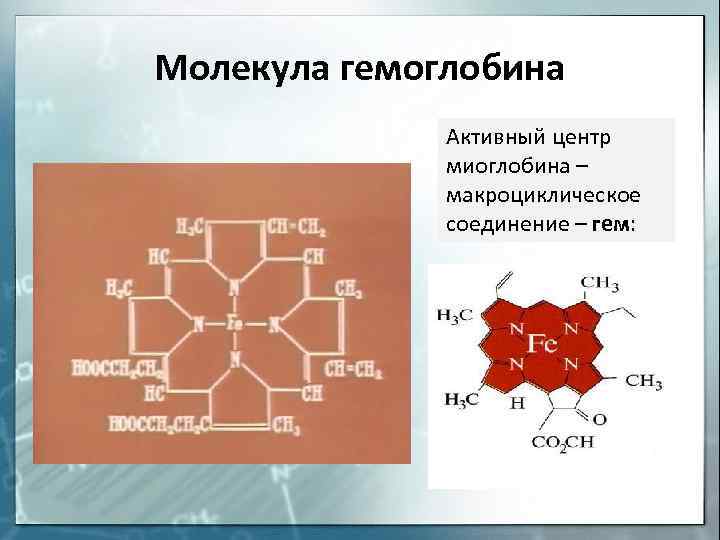
Молекула гемоглобина Активный центр миоглобина – макроциклическое соединение – гем:
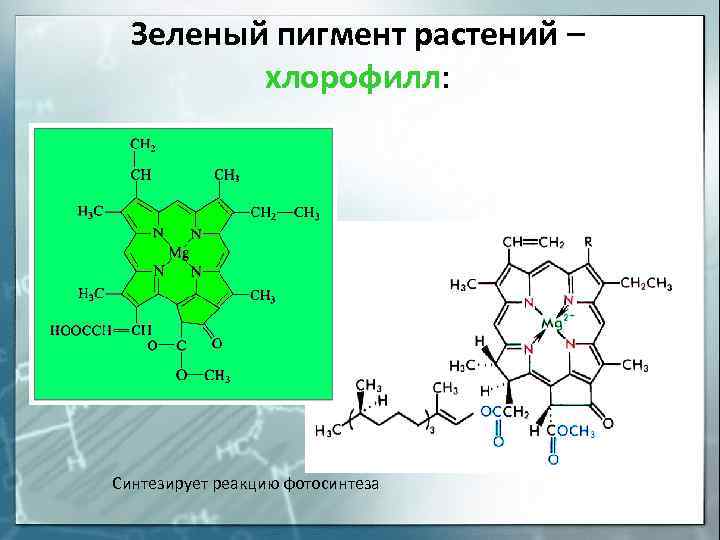
Зеленый пигмент растений – хлорофилл: Синтезирует реакцию фотосинтеза
Витамин В 12
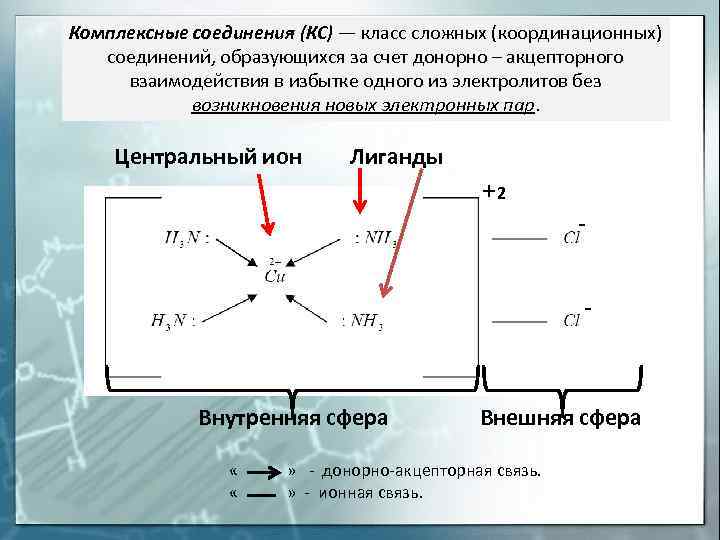
Комплексные соединения (КС) — класс сложных (координационных) соединений, образующихся за счет донорно – акцепторного взаимодействия в избытке одного из электролитов без возникновения новых электронных пар. Центральный ион Лиганды 2 Внутренняя сфера Внешняя сфера « » — донорно-акцепторная связь. « » — ионная связь.
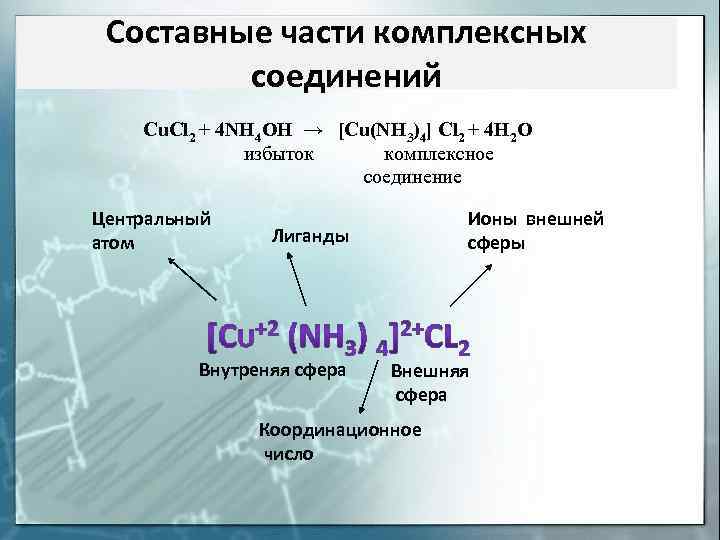
Составные части комплексных соединений Cu. Cl 2 + 4 NH 4 OH → [Cu(NH 3)4] Cl 2 + 4 H 2 O избыток комплексное соединение Центральный атом Ионы внешней сферы Лиганды Внутреняя сфера Внешняя сфера Координационное число

Характеристики комплексов Заряд комплексного иона равен алгебраической сумме зарядов (или степеней окисления) комплексообразователя и лигандов. Z = Zко +∑Zлиг Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с донорными атомами лигандов, т. е. координационное число (КЧ). Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости (Kн).

Ковалентная (диссоциация по типу слабого электролита) Ионная связь (диссоциация по типу сильного электролита) [Cu(NH 3)4] Cl 2 → [Cu(NH 3)4]2+ + 2 Cl–

Внешняя сфера комплексного соединения – ионы и (или) молекулы, не находящиеся в непосредственной химической связи с комплексообразователем, но нейтрализующие заряд комплексного иона (внутренней сферы) Внутренняя (координационная) сфера комплексного соединения – совокупность комплексообразователя и непосредственно с ним связанных лигандов Лиганды — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно–акцепторной связью. Центральный атом (комплексообразователь) – выполняет роль акцептора электронных пар и поэтому комплексообразователем могут быть любые частицы, имеющие вакантные орбитали.

комплексообразователи Типичными комплексообразователями являются катионы d- и f- элементов, имеющие вакантные орбитали, например Ag+, Au+, Cu 2+, Zn 2+, Cd 2+, Hg 2+, Fe 3+, Co 2+, Ni 2+, Pt 4+, La 3+, Eu 2+, Th 4+, U 4+ и нейтральные атомы металлов того же типа, например Co, Ni, Fe.
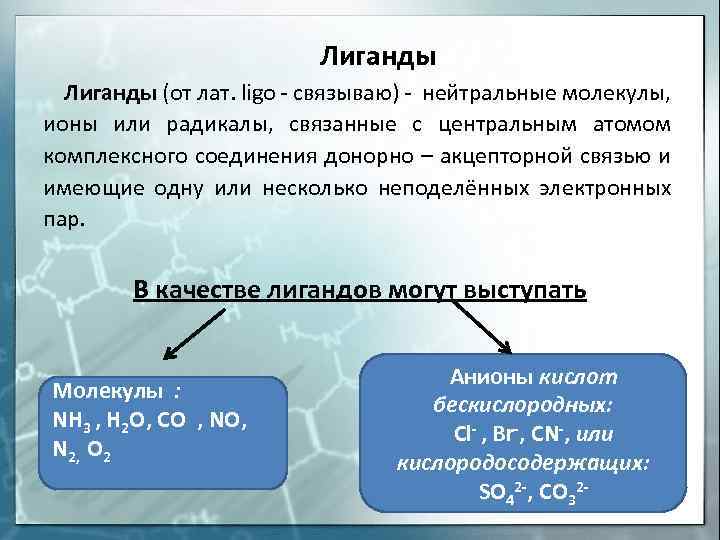
Лиганды (от лат. ligo — связываю) — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно – акцепторной связью и имеющие одну или несколько неподелённых электронных пар. В качестве лигандов могут выступать Молекулы : NH 3 , H 2 O, CO , NO, N 2, O 2 Анионы кислот бескислородных: Cl- , Br-, CN-, или кислородосодержащих: SO 42 -, CO 32 —
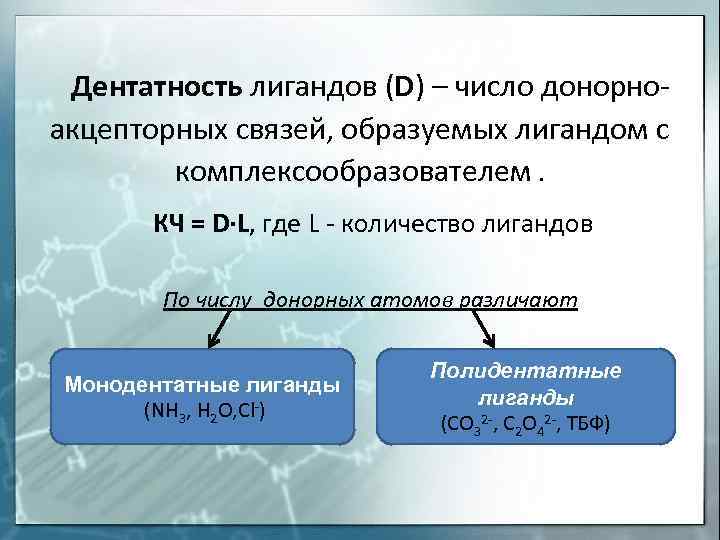
Дентатность лигандов (D) – число донорноакцепторных связей, образуемых лигандом с комплексообразователем. КЧ = D∙L, где L — количество лигандов По числу донорных атомов различают Монодентатные лиганды (NH 3, H 2 O, Cl-) Полидентатные лиганды (CO 32 -, C 2 O 42 -, ТБФ)
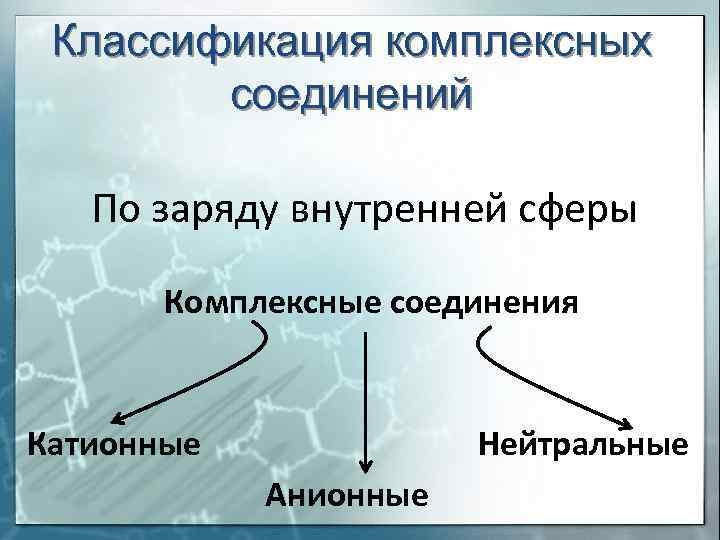
Классификация комплексных соединений По заряду внутренней сферы Комплексные соединения Катионные Нейтральные Анионные
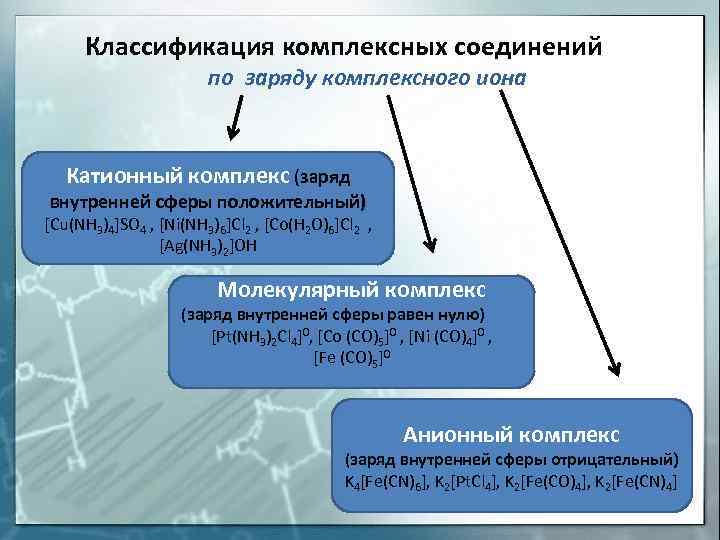
Классификация комплексных соединений по заряду комплексного иона Катионный комплекс (заряд внутренней сферы положительный) [Cu(NH 3)4]SO 4 , [Ni(NH 3)6]Cl 2 , [Co(H 2 O)6]Cl 2 , [Ag(NH 3)2]OH Молекулярный комплекс (заряд внутренней сферы равен нулю) [Pt(NH 3)2 Cl 4]0, [Co (CO)5]0 , [Ni (CO)4]0 , [Fe (CO)5]0 Анионный комплекс (заряд внутренней сферы отрицательный) K 4[Fe(CN)6], K 2[Pt. Cl 4], K 2[Fe(CO)4], K 2[Fe(CN)4]
![2+ 3 - [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4 2+ 3 - [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4](https://present5.com/presentation/-42515008_134710477/image-16.jpg)
2+ 3 — [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4 Cl 2] Cl [Pt(NH 3)2 Cl 2] 0 3 — [Fe(CO)5] K 3 [Fe(CN) 6]
![[Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2 [Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2](https://present5.com/presentation/-42515008_134710477/image-17.jpg)
[Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2 Cl 2] Дихлородиамминплатина [Cr(H 2 O)2(NH 3)3 Cl]Br 2 Бромид хлородиакватриамминхрома (III)

Двойные соли • Двойные соли являются сильными электролитами и в растворах диссоциируют полностью, т. к. связи между катионами металла и анионами кислотного остатка носят ионный характер: • KAl(SO 4)2 → K+ + Al 3+ + 2 SO 42 —

Образование комплексных соединений Реакции комплексообразования: 1. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 2. Ni. Cl 2 + 4 NH 4 OH → [(Ni(NH 3 )4]Cl 2 + 4 H 2 O 3. UO² 2 – катион, который способен образовывать комплексы анионного типа (КЧ=8) Na 2 U 2 O 7↓ + 6 Na 2 CO 3 + 3 H 2 O → 2 Na 4[UO 2(CO 3)3] 2 UO 2 SO 4 + K 4[Fe(CN)6] → (UO 2)2[Fe(CN)6] ↓ + 2 K 2 SO 4 Cu. SO 4 + K 4[Fe(CN)6] → Cu 2[Fe(CN)6]↓ + 2 H 2 SO 4
![Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30 Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30](https://present5.com/presentation/-42515008_134710477/image-20.jpg)
Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30 2 ст. [Cu(NH 3)3]2+ = [Cu(NH 3)2]2+ + NH 30 3 ст. [Cu(NH 3)2]2+ = [Cu(NH 3)]2+ + NH 30 4 ст. [Cu(NH 3)]2+ = Cu 2+ + NH 30 Общий процесс диссоциации комплекса: ∑ [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30
![Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ = Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ =](https://present5.com/presentation/-42515008_134710477/image-21.jpg)
Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30

Свойства константы нестойкости 1. Константы нестойкости характеризуют относительную устойчивость внутренней координационной сферы комплексов 2. Чем меньше КН , тем прочнее комплекс. 3. По КН, можно рассчитать концентрацию свободных ионов комплексообразователя в растворе комплексного соединения. 4. Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть трудно растворимое соединение или более устойчивый комплекс.
![сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7 сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7](https://present5.com/presentation/-42515008_134710477/image-23.jpg)
сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7 ∙ 10 -8 K[Ag(CN)2] , Kн = 1, 0 ∙ 10 -21 Допустим, что исходная концентрация этих комплексов равна 1 моль/л. Тогда: C(NH 3) = 2 x, C(CN-) = 2 x, C[Ag(NH 3)2]+ = 1 -x, C[Ag(CN)2]- = 1 -x. Так как x

По константе нестойкости и заданной начальной концентрации комплекса можно рассчитать концентрацию комплексообразователя и лигандов. Для корректности расчетов возьмем раствор с избытком лигандов. K 4[Fe(CN)6] → 4 K ++ [Fe(CN)6]4 — ; C = 0, 1 M; Kн = 1, 0 ∙ 10 -37 ; избыток KCN →K+ + CN 0, 1 M 0, 1 M 1 M 1 M Fe [(CN)6]4 — Fe 2+ + 6 CN 0, 1 — x x 6 x+1 исходя из значений константы нестойкости x

Пространственное строение комплексов Геометрическая форма комплексов – это координационный многогранник, образованный в результате определенного расположения лигандов относительно комплексообразователя. Тип гибридизации определяется числом гибридных орбиталей, их формой, направлением в пространстве, взаимным влиянием друг на друга и определенную форму комплекса. Между координационным числом, типом гибридизации и формой есть взаимосвязь:

Пространственное строение комплексов Связь между координационным числом, типом гибридизации и формой:
![Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4 Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4](https://present5.com/presentation/-42515008_134710477/image-27.jpg)
Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4 d 10 5 s 1 — электронная конфигурация атома серебра Ag+ [ ]4 d 10 5 s 0 — электронная конфигурация иона серебра Вакантные 5 s- и 5 p- орбитали иона серебра являются акцепторами электронных пар атомов азота молекул аммиака (доноров) .
![Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) - электронная конфигурация атома бора Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) - электронная конфигурация атома бора](https://present5.com/presentation/-42515008_134710477/image-28.jpg)
Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) — электронная конфигурация атома бора — электронная конфигурация катиона бора
![Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ - плоскоквадратная) Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ - плоскоквадратная)](https://present5.com/presentation/-42515008_134710477/image-29.jpg)
Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ — плоскоквадратная)
![Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– - октаэдрическое) Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– - октаэдрическое)](https://present5.com/presentation/-42515008_134710477/image-30.jpg)
Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– — октаэдрическое)
![Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– - октаэдрическое) Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– - октаэдрическое)](https://present5.com/presentation/-42515008_134710477/image-31.jpg)
Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– — октаэдрическое)
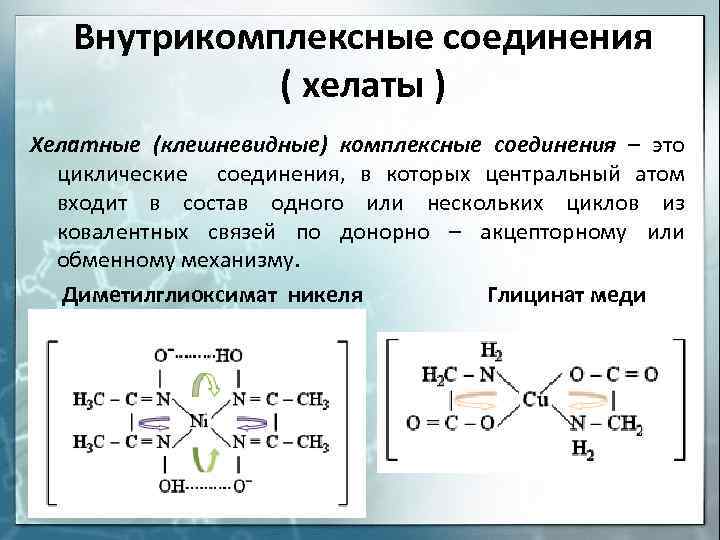
Внутрикомплексные соединения ( хелаты ) Хелатные (клешневидные) комплексные соединения – это циклические соединения, в которых центральный атом входит в состав одного или нескольких циклов из ковалентных связей по донорно – акцепторному или обменному механизму. Диметилглиоксимат никеля Глицинат меди
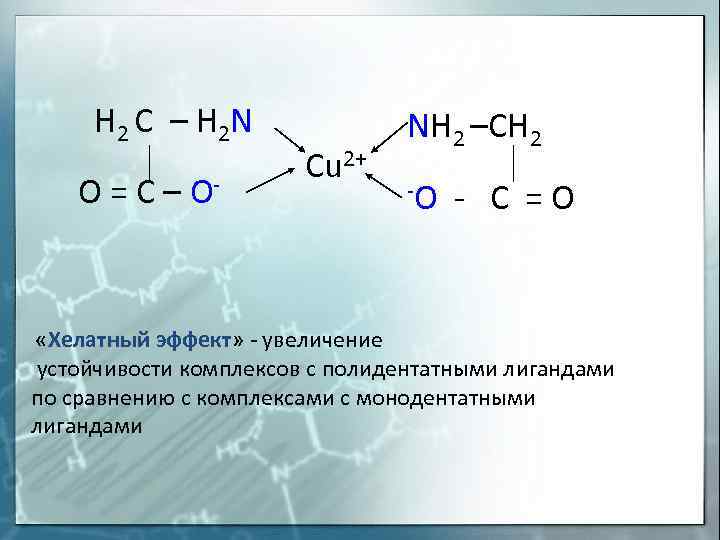
H 2 C – H 2 N O = C – O- «Хелатный Cu 2+ NH 2 –CH 2 -O — C = O эффект» — увеличение устойчивости комплексов с полидентатными лигандами по сравнению с комплексами с монодентатными лигандами
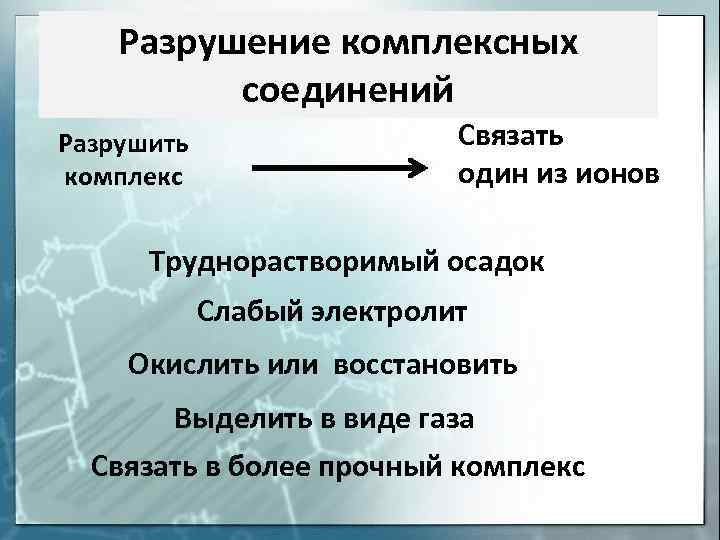
Разрушение комплексных соединений Разрушить комплекс Связать один из ионов Труднорастворимый осадок Слабый электролит Окислить или восстановить Выделить в виде газа Связать в более прочный комплекс
![[Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка + [Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка +](https://present5.com/presentation/-42515008_134710477/image-37.jpg)
[Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка + HNO 3 + KCN NH 4 NO 3 Образование более прочного комплекса Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть: трудно растворимое соединение или более устойчивый комплекс.
![[Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9, [Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9,](https://present5.com/presentation/-42515008_134710477/image-38.jpg)
[Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9, 3 ·10 -8 ПРAg. I = 1, 5·10 -16 [Ag (NH 3)2]++2 CN- = [Ag(CN)2]- +2 NH 3 Кн = 8·10 -22

Химические свойства комплексных соединений. Реакции комплексообразования: Ni. Cl 2 + 4 NH 4 OH → [Ni(NH 3 )4]Cl 2 + 4 H 2 O Реакции обмена с сохранением внутренней сферы комплекса: 4 Fe. Сl 3 + 3 K 4[Fe(CN)6] → Fe 4[Fe(CN)6]3↓ + 12 K Cl
![Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H](https://present5.com/presentation/-42515008_134710477/image-40.jpg)
Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H 2 O → Cu. S↓ + Na 2 SO 4 + 4 NH 3 Реакция замещения лигандов во внутренней сфере: K 3[Fe. F 6] + 6 KSCNизб → K 3[Fe(SCN)6] +6 KF

Окислительно – восстановительные реакции с участием комплексных соединений сопровождаются изменением степени окисления комплексообразователя :
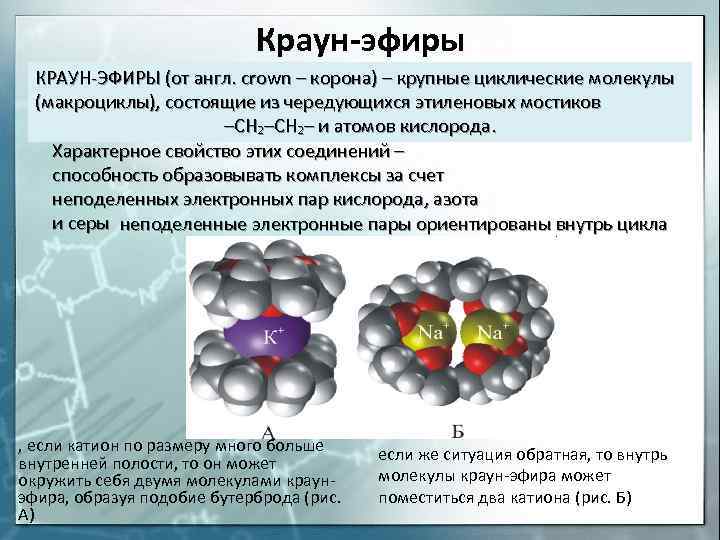
Краун-эфиры КРАУН-ЭФИРЫ (от англ. crown – корона) – крупные циклические молекулы (макроциклы), состоящие из чередующихся этиленовых мостиков –СН 2– и атомов кислорода. Характерное свойство этих соединений – способность образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы неподеленные электронные пары ориентированы внутрь цикла , если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краунэфира, образуя подобие бутерброда (рис. А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. Б)
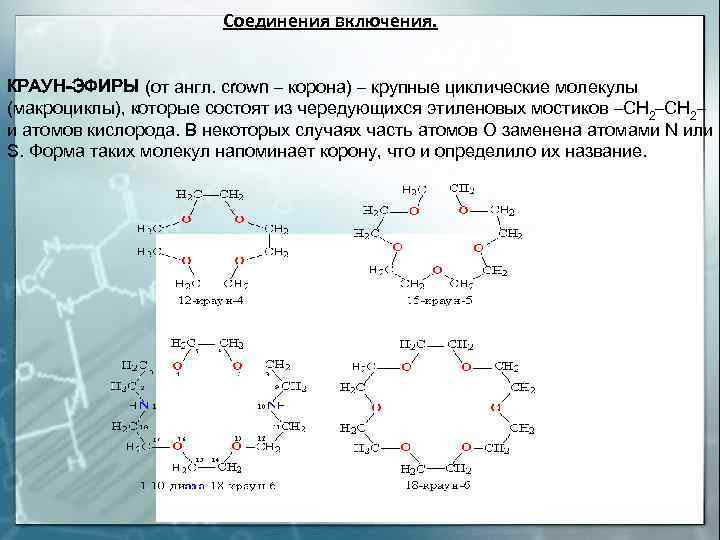
Соединения включения. КРАУН-ЭФИРЫ (от англ. crown – корона) – крупные циклические молекулы (макроциклы), которые состоят из чередующихся этиленовых мостиков –СН 2– и атомов кислорода. В некоторых случаях часть атомов О заменена атомами N или S. Форма таких молекул напоминает корону, что и определило их название.

Реакции комплексообразования. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 оранж. Hg. I 2 ↓ + 2 KI (р-р. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый Суммарная реакция: Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый
Источник