Функции холестерина в печени
Содержание статьи
Как связаны функции печени и холестерин?
Автор Хусаинов Руслан Халилович На чтение 3 мин. Опубликовано 19.06.2018 15:19 Обновлено 19.06.2018 15:19
Большая часть холестерина вырабатывает печень и он необходим для нашего здоровья. Но некоторые формы холестерина могут вызывать проблемы со здоровьем, включая повреждение печени.
Холестерин — жировая молекула, которая содержится в некоторых продуктах, а также в печени. Существуют два основных типа холестерина: липопротеины высокой плотности (ЛПВП) и липопротеины низкой плотности (ЛПНП) .
- ЛПНП должен быть менее 100 мг / дл
- ЛПВП должен составлять более 40 мг / дл
ЛПВП переносится из клеток организма в печень. Печень расщепляет их или выводит из организма в виде отходов.
Эта функция полезна для организма, поэтому ЛПВП иногда называют «хорошим холестерином».
ЛПНП переносятся из печени в клетки. Клетки используют холестерин, но слишком много его остается в артериях. Это может вызвать проблемы со здоровьем, поэтому врачи иногда называют ЛПНП «плохим холестерином».
Холестерин может накапливаться в артериях, в результате чего просвет их сужается, что ограничивает подачу крови и кислорода в органы. Сужение просвета артерий также увеличивает риск образования тромбов. Если кровоток к сердцу ограничен, то это может увеличить риск развития ишемической болезни сердца, сердечных приступов и сердечной недостаточности.
Если ограничен кровоток в головной мозг, то увеличивается риск развития инсульта.
Почему печень вырабатывает много плохого холестерин?
Существует множество различных заболеваний печени. Гепатиты, связанные с алкоголем, а также неалкогольная жировая болезнь печени являются одними из наиболее распространенных заболеваний печени.
Болезнь печени вызывает ее повреждение, и печень не в состоянии адекватно функционировать. Одной из функций печени является расщепление холестерина. Если печень не работает должным образом, это может привести к увеличению холестерина в организме.
Неалкогольная жировая болезнь печени может увеличить риск проблем со здоровьем, таких как инсульт или диабет. Если заболевание обнаружено на ранней стадии, то возможно предотвратить ухудшения.
Повышение холестерина — симптомы
Обычно высокий уровень холестерина не вызывает никаких симптомов. Но простой анализ крови покажет уровень холестерина.
Врач может рекомендовать тест на уровень холестерина, если у человека есть в семейном анамнезе заболевания сердца, диабет и избыточный вес.
Для диагностики заболевания печени обычно используется биопсия печени и тест на функции печени. При биопсии берется крошечный кусок ткани печени, чтобы проверить на наличие болезни. Тест на функцию печени — это анализ крови, который измеряет уровень белка и ферменты в крови. Уровни белков и ферментов могут показать, повреждена ли печень.
Лечение
Человек может изменить образ жизни и принимать препараты для снижения уровня холестерина. Как правило, ему будет предложено сначала изменить диету и выполнять физические упражнения. Если он имеет избыточный вес, то ему может быть рекомендовано снижение веса.
Наиболее распространенными препаратами для снижения уровня холестерина являются статины, которые человек должен принимать всю жизнь. Статины — это препараты, которые блокируют химическое вещество в печени, продуцирующее холестерин.
Лечение печени зависит от типа заболевания. Обычно оно связано с изменением образа жизни, препаратами, иногда прибегают к трансплантации печени, если печень повреждена.
Человеку, страдающему алкогольной болезнью печени, обычно рекомендуют отказ от алкоголя. Употребление достаточного количества белка и углеводов в составе сбалансированной диеты может помочь поддерживать нормальный вес.
Профилактика
- Можно предотвратить проблемы со здоровьем, такие как повреждение печени, путем снижения высокого уровня ЛПНП.
- Изменения диеты и физические упражнения помогут человеку управлять высоким уровнем холестерина.
Источник
Хороший, плохой, злой холестерин
Статья на конкурс «био/мол/текст»: Вряд ли сейчас найдется человек, который не слышал, что высокий холестерин — это плохо. Однако столь же мала вероятность встретить человека, который знает, ПОЧЕМУ высокий холестерин — это плохо. И чем определяется высокий холестерин. И что такое высокий холестерин. И что такое холестерин вообще, зачем он нужен и откуда берется.
Итак, история вопроса такова. Давным-давно, в одна тысяча девятьсот тринадцатом году, петербуржский физиолог Аничков Николай Александрович показал: не что иное, как холестерин, вызывает атеросклероз у экспериментальных кроликов, содержащихся на пище животного происхождения [1]. Вообще же, холестерин необходим для нормального функционирования животных клеток и является основной составляющей клеточных мембран , а также служит субстратом для синтеза стероидных гормонов и желчных кислот.
Главный липидный компонент пищевого жира и жировых отложений — это триглицериды, которые представляют собой эфиры глицерина и жирных кислот. Холестерин и триглицериды, будучи неполярными липидными веществами, транспортируются в плазме крови в составе липопротеиновых частиц. Частицы эти подразделяют по размеру, плотности, относительному содержанию холестерина, триглицеридов и белков на пять больших классов: хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП) [2]. Традиционно ЛПНП считается «плохим» холестерином, а ЛПВП — «хорошим» (рис. 1).
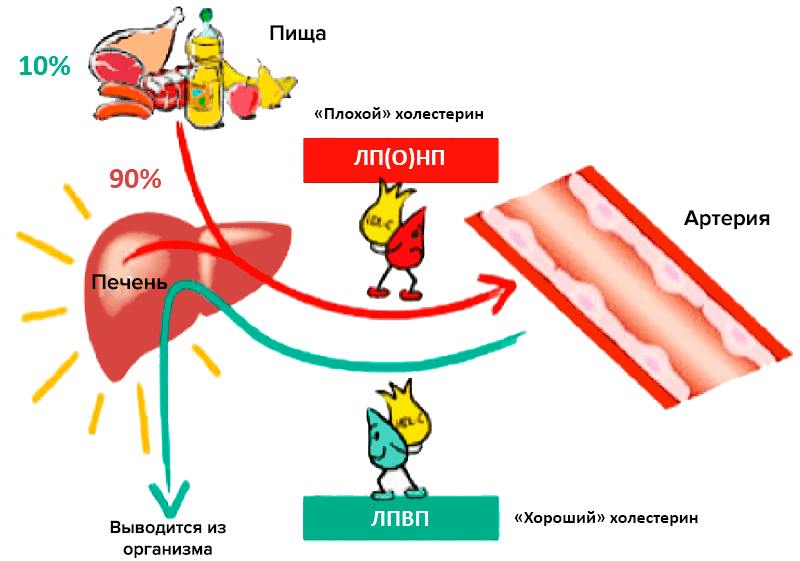
Рисунок 1. «Плохой» и «хороший» холестерины. Участие различных липопротеиновых частиц в транспорте липидов и холестерина.
Схематично структура липопротеина включает неполярное ядро, состоящее по большей части из холестерина и триглицеридов, и оболочку из фосфолипидов и апопротеинов (рис. 2). Ядро — функциональный груз, который доставляется до места назначения. Оболочка же участвует в распознавании клеточными рецепторами липопротеиновых частиц, а также в обмене липидными частями между различными липопротеинами [3].
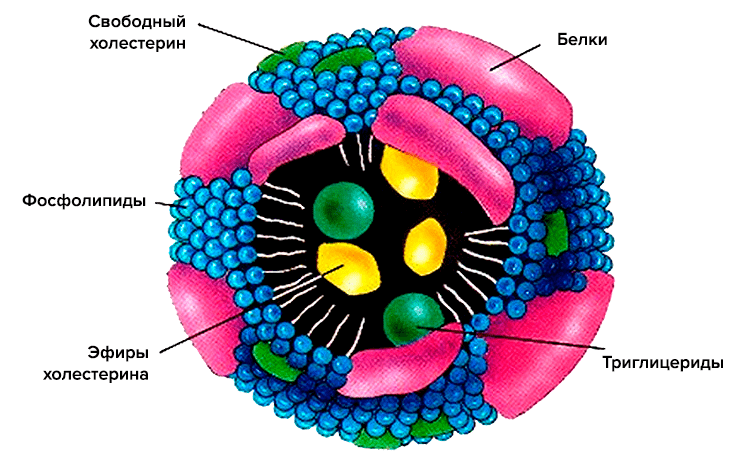
Рисунок 2. Схематическое строение липопротеиновой частицы
Баланс уровня холестерина в организме достигается следующими процессами: внутриклеточный синтез, захват из плазмы (главным образом из ЛПНП), выход из клетки в плазму (главным образом в составе ЛПВП). Предшественник синтеза стероидов — ацетил коэнзим А (CoA). Процесс синтеза включает, по крайней мере, 21 шаг, начиная с последовательного преобразования ацетоацетил CoA. Лимитирующая стадия синтеза холестерина в большой степени определяется количеством холестерина, абсорбируемого в кишечнике и транспортируемого в печень [4]. При недостатке холестерина происходит компенсаторное усиление его захвата и синтеза.
Транспорт холестерина
Систему транспорта липидов можно разделить на две большие части: внешнюю и внутреннюю.
Внешний путь начинается с всасывания в кишечнике холестерина и триглицеридов. Его конечный результат — доставка триглицеридов в жировую ткань и мышцы, а холестерина — в печень. В кишечнике пищевой холестерин и триглицериды связываются с апопротеинами и фосфолипидами, формируя хиломикроны, которые через лимфоток попадают в плазму, мышечную и жировую ткани. Здесь хиломикроны взаимодействуют с липопротеинлипазой — ферментом, который освобождает жирные кислоты. Эти жирные кислоты поступают в жировую и мышечную ткани для накопления и окисления соответственно. После изъятия триглицеридного ядра остаточные хиломикроны содержат большое количество холестерина и апопротеина Е. Апопротеин Е специфически связывается со своим рецептором в клетках печени, после чего остаточный хиломикрон захватывается и катаболизируется в лизосомах. В результате этого процесса освобождается холестерин, который затем преобразуется в желчные кислоты и выводится или участвует в формировании новых липопротеинов, образующихся в печени (ЛПОНП). При нормальных условиях хиломикроны находятся в плазме в течение 1-5 ч. после приема пищи [2], [3].
Внутренний путь. Печень постоянно синтезирует триглицериды, утилизируя свободные жирные кислоты и углеводы. В составе липидного ядра ЛПОНП они выходят в кровь. Внутриклеточный процесс формирования этих частиц схож с таковым для хиломикронов, за исключением различия в апопротеинах. Последующее взаимодействие ЛПОНП с липопротеинлипазой в тканевых капиллярах приводит к формированию остаточных ЛПОНП, богатых холестерином (ЛППП). Примерно половина этих частиц выводится из кровотока клетками печени в течение 2-6 ч. Остальные претерпевают модификацию с замещением оставшихся триглицеридов эфирами холестерина и освобождением от всех апопротеинов, за исключением апопротеина В. В результате формируются ЛПНП, которые содержат ¾ всего плазменного холестерина. Их главная функция — доставка холестерина в клетки надпочечников, скелетных мышц, лимфоцитов, гонад и почек [3]. Модифицированные ЛПНП (окисленные продукты, количество которых возрастает при повышенном содержании в организме активных форм кислорода, так называемом окислительном стрессе) могут распознаваться иммунной системой как нежелательные элементы. Тогда макрофаги их захватывают и выводят из организма в виде ЛПВП. При чрезмерно высоком уровне ЛПНП макрофаги становятся перегруженными липидными частицами и оседают в стенках артерий, образуя атеросклеротические бляшки.
Основные транспортные функции липопротеинов приведены в таблице.
Таблица. Функции липопротеинов [5].
| Класс | Размеры | Функция |
|---|---|---|
| ЛПВП | 4-14 нм | Транспорт холестерина от периферийных тканей к печени |
| ЛПНП | 20-22,5 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛППП | 25-35 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛПОНП | 30-80 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| Хиломикроны | 75-1200 нм | Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень |
Регуляция уровня холестерина
Уровень холестерина в крови в большой степени определяется диетой. Пищевые волокна снижают уровень холестерина, а пища животного происхождения повышает его содержание в крови.
Один из основных регуляторов метаболизма холестерина — рецептор LXR (рис. 3). LXR α и β принадлежат к семейству ядерных рецепторов, которые образуют гетеродимеры с ретиноидным Х рецептором и активируют гены-мишени. Их естественные лиганды — оксистерины (окисленные производные холестерина). Обе изоформы идентичны на 80% по аминокислотной последовательности. LXR-α обнаружен в печени, кишечнике, почках, селезенке, жировой ткани; LXR-β в небольшом количестве обнаруживается повсеместно [6]. Метаболический путь оксистеринов быстрее, чем у холестерина, и поэтому их концентрация лучше отражает краткосрочный баланс холестерина в организме. Существует всего три источника оксистеринов: ферментативные реакции, неферментативное окисление холестерина и поступление с пищей. Неферментативные источники оксистеринов как правило минорные, но в патологических состояниях их вклад возрастает (окислительный стресс, атеросклероз), и оксистерины могут действовать наряду с другими продуктами перекисного окисления липидов [6]. Основное влияние LXR на метаболизм холестерина: обратный захват и транспорт в печень, вывод с желчью, снижение кишечного всасывания. Уровень продукции LXR различается на протяжении аорты; в дуге, зоне турбулентности, LXR в 5 раз меньше, чем в участках со стабильным течением. В здоровых артериях повышение экспрессии LXR в зоне сильного потока оказывает антиатерогенное действие [7].
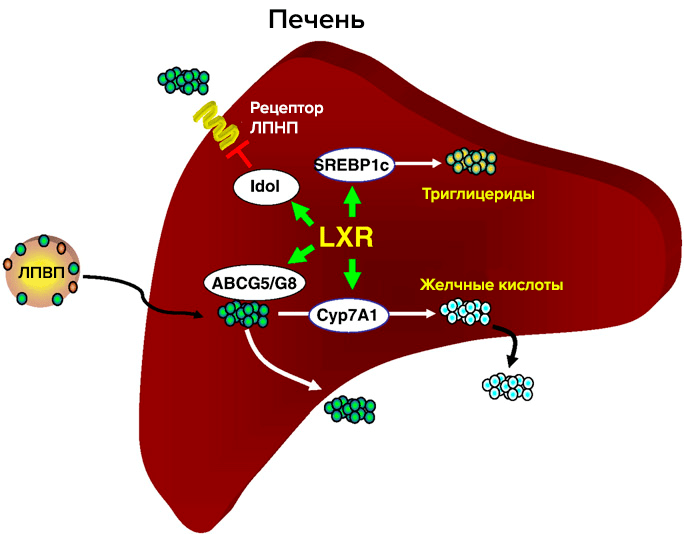
Рисунок 3. Участие рецептора LXR в метаболизме холестерина в печени
Важную роль в метаболизме холестерина и стероидов играет рецептор-«мусорщик» SR-BI (рис. 4). Он был обнаружен в 1996 году как рецептор для ЛПВП [8]. В печени SR-BI отвечает за избирательный захват холестерина из ЛПВП. В надпочечниках SR-BI опосредует избирательный захват этерифицированного холестерина из ЛПВП, который необходим для синтеза глюкокортикоидов. В макрофагах SR-BI связывает холестерин, что является первым этапом в обратном транспорте холестерина. SR-BI также захватывает холестерин из плазмы и опосредует его прямой выход в кишечник [9].
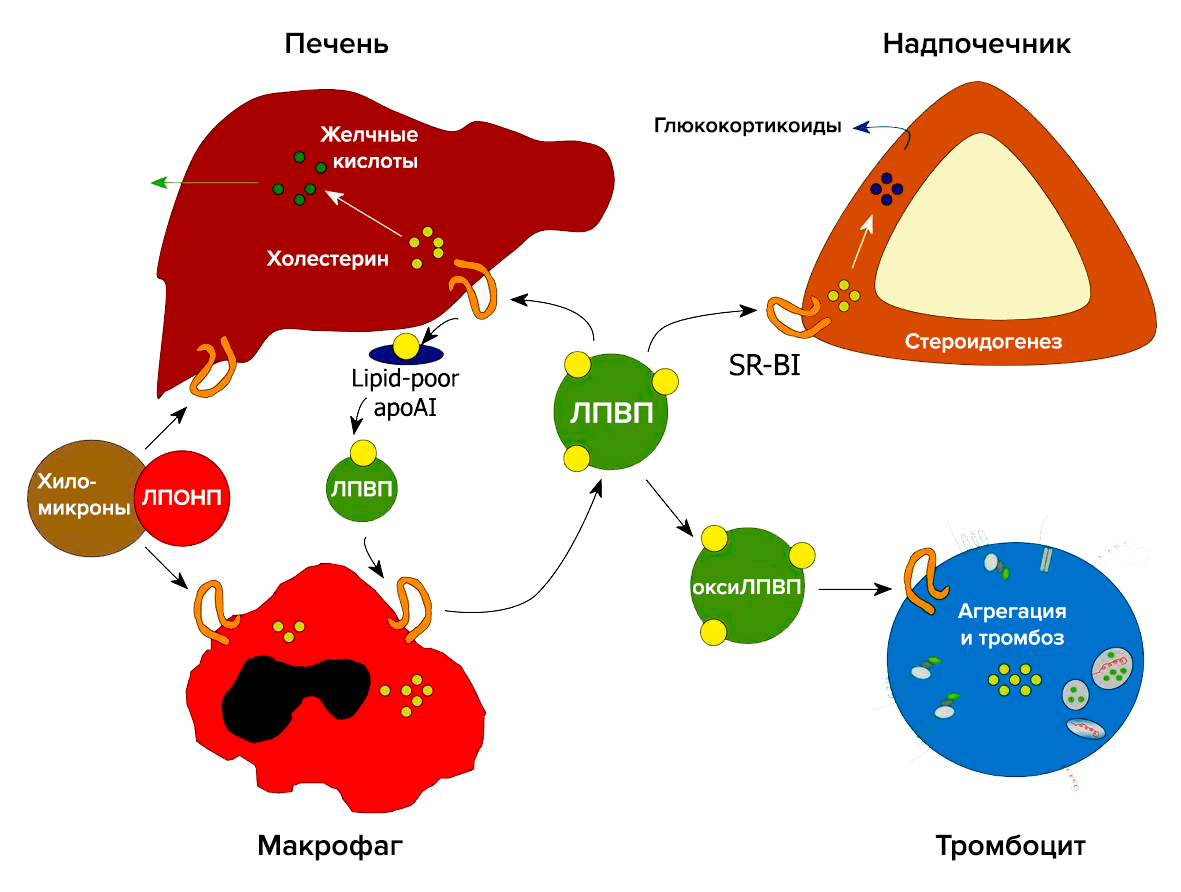
Рисунок 4. Участие рецептора SR-BI в метаболизме холестерина
Выведение холестерина из организма
Классический путь выведения холестерина: транспорт холестерина с периферии в печень (ЛПВП), захват клетками печени (SR-BI), экскреция в желчь и выведение через кишечник, где большая часть холестерина возвращается в кровь [10].
Основная функция ЛПВП — обратный транспорт холестерина в печень. Плазменные ЛПВП являются результатом комплекса различных метаболических событий. Состав ЛПВП очень различается по плотности, физико-химическим свойствам и биологической активности. Это сферические или дисковидные образования. Дисковидные ЛПВП в основном состоят из апопротеина A-I с вложенным слоем фосфолипидов и свободного холестерина. Сферические ЛПВП больше и дополнительно содержат гидрофобное ядро из эфиров холестерина и небольшого количества триглицеридов.
При метаболическом синдроме активируется обмен триглицеридов и эфиров холестерина между ЛПВП и триглицерид-богатыми липопротеинами. В результате содержание триглицеридов в ЛПВП повышается, а холестерина снижается (т.е. холестерин не выводится из организма) [11]. Отсутствие ЛПВП у людей встречается при болезни Tangier, главные клинические проявления которой — увеличенные оранжевые миндалины, роговичная дуга, инфильтрация костного мозга и мукозного слоя кишечника [3].
Если коротко обобщить, то страшен не сам холестерин, который является необходимым компонентом, обеспечивающим нормальную структуру клеточных мембран и транспорт липидов в крови, а кроме того он является сырьем для производства стероидных гормонов. Метаболические расстройства же проявляются при нарушении баланса ЛПНП и ЛПВП , что отражает нарушение системы транспорта липопротеинов, включающей работу печени, образование желчи и участие макрофагов. Поэтому любые заболевания печени, а также аутоиммунные процессы могут вызвать развитие атеросклероза даже при вегетарианской диете. Если мы вернемся к изначальным опытам Н.А. Аничкова по кормлению кроликов пищей, богатой холестерином, то увидим, что холестерин не встречается в естественном рационе кроликов и поэтому, как яд, нарушает работу печени, вызывает сильное воспаление сосудов и, как следствие, образование бляшек.
- Anitschkow N. and Chalatow S. (1983). Classics in arteriosclerosis re: On experimental cholesterin steatosis and its ificance in the origin of some pathological processes by N. Anitschkow and S. Chalatow, translated by Mary Z. Pelias, 1913. Arteriosclerosis, Thrombosis, and Vascular Biology. 3, 178-182;
- Климов А.Н. Причины и условия развития атеросклероза. Превентивная кардиология. М.: «Медицина», 1977. — 260-321 с.;
- Cox R.A. and Garcia-Palmieri M.R. Cholesterol, triglycerides, and associated lipoproteins. Clinical methods: the history, physical, and laboratory examinations (3rd Edition). Boston: Butter-worths, 1990. — 153-160 p.;
- Grundy S.M. (1978). Cholesterol bolism in man. West. J. Med. 128, 13-25;
- Википедия: «Липопротеины»;
- Wójcicka G., Jamroz-Wisniewska A., Horoszewicz K., Beltowski J. (2007). Liver X receptors (LXRs). Part I: Structure, , regulation of activity, and role in lipid bolism. Postepy Hig. Med. Dosw. 61, 736-759;
- Calkin A. and Tontonoz P. (2010). Liver X Receptor aling pathways and atherosclerosis. Arterioscler. Thromb. Vasc. Biol. 30, 1513-1518;
- S. Acton, A. Rigotti, K. T. Landschulz, S. Xu, H. H. Hobbs, M. Krieger. (1996). Identification of Scavenger Receptor SR-BI as a High Density Lipoprotein Receptor. Science. 271, 518-520;
- Vrins C.L.J. (2010). From blood to gut: Direct secretion of cholesterol via transintestinal cholesterol efflux. World J. Gastroenterol. 16, 5953-5957;
- Van der Velde A.E. (2010). Reverse cholesterol transport: From classical view to new insights. World J. Gastroenterol. 16, 5908-5915;
- Wilfried Le Goff, Maryse Guerin, M.John Chapman. (2004). Pharmacological modulation of cholesteryl ester transfer protein, a new therapeutic target in atherogenic dyslipidemia. Pharmacology & Therapeutics. 101, 17-38;
- Липидный фундамент жизни;
- Наночастицами — по «плохому» холестерину!.
Источник
Глава 4 Печень и обмен холестерина
Глава 4
Печень и обмен холестерина
Эволюционная роль холестерина заключается в том, что он служит каркасом клеточных мембран человека. Все цитоплазматические мембраны и мембраны органелл клеток млекопитающих и человека в основном состоят из фосфолипидов, гликолипидов и холестерина. Фосфолипиды являются пластичной, жидкой и фунциональной частью мембран, взаимодействуют с включенными в мембрану ферментами и рецепторами (рис. 12). Холестерин образует каркас клеточной мембраны, занимая свободное пространство между нерастворимыми в воде хвостами фосфолипидов и не позволят им изгибаться. Мембраны с низким содержанием холестерина — более гибкие и функционально активные, с высоким содержанием холестерина — более жесткие и инертные. Свободный (не этерифицированный и не связанный с липопротеидами) холестерин может свободно проникать в клеточные мембраны и образовывать эфиры с жирными кислотами, входящими в состав фосфолипидов, нарушая их функциональное состояние. Именно образование этого резервного компартмента холестерина, как и дефицит эссенциальных фосфолипидов, приводит к снижению вязкости и текучести, «старению» клеточных мембран и коррелирует с выраженностью атеросклероза. Таким образом, борьба с излишками холестерина в тканях и циркуляцией свободного холестерина в плазме для человека является эволюционной задачей, которую здоровый и молодой организм успешно решает путем его этерификации, включения в ЛПВП и транспортировки в печень для утилизации.
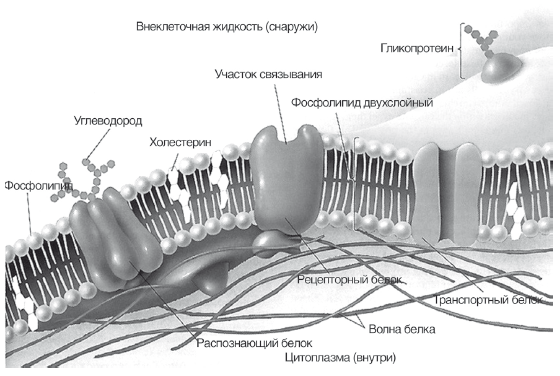
Рис. 12.
Виртуальная модель цитоплазматической мембраны клетки человека
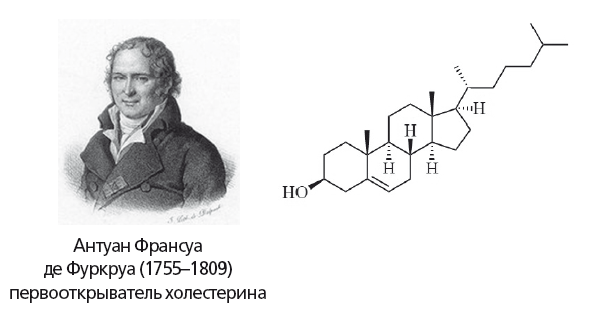
Рис. 13.
Формула холестерина. Холестерин обеспечивает стабильность клеточных мембран в широком интервале температур. Он необходим для выработки витамина D, стероидных и половых гормонов, а также для деятельности синапсов головного мозга и иммунной системы, включая защиту от рака
В 1769 году Пулетье де ла Саль из желчных камней получил плотное белое вещество («жировоск»), обладавшее свойствами жиров. В 1815 году Мишель Шеврёль также выделил это соединение и назвал его холестерином («холе» — желчь, «стерин» — жирный). Однако формулу и химические свойства холестерина установил Антуан Франсуа де Фуркруа. Холестерин и фосфолипиды (98 % их — фосфатидилхолин) составляют липидный комплекс желчи.
В сухом остатке желчи фосфатидилхолин (ФХ) составляет 22 %, а ХС — 4 %. В сутки через каналикулярную мембрану гепатоцита путем активного транспорта переносчиком фосфолипидфлиппазой (MDR3) или в составе фосфолипиднохолестериновых пузырьков и мицелл переносится 1,8-8,2 г ФХ. В кишечнике ФХ желчи расщепляется до лизофосфолипидов и реабсорбируется. Основная функция ФХ заключается в солюбилизации практически нерастворимого в воде ХС путем формирования ядра устойчивых простых (ФХ + холестерин, диаметр до 3 нм) или смешанных мицелл (ФХ + холестерин + желчные кислоты, диаметр 3-6 нм), а также везикул (ФХ + холестерин + желчные кислоты, диаметр 25-130 нм).
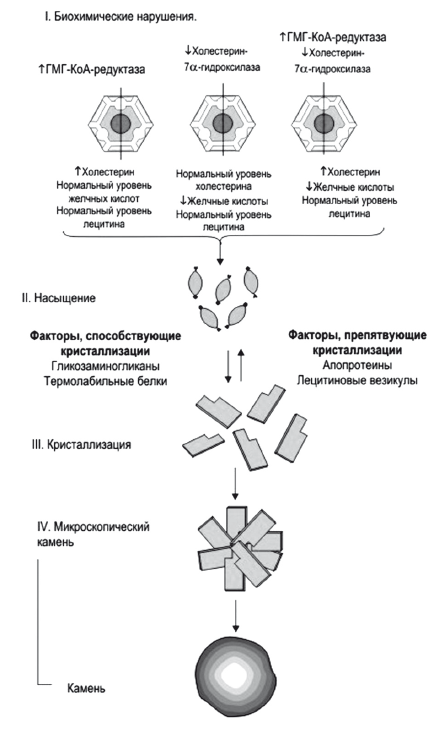
Рис. 14.
Растворимость холестерина в желчи
Потребность в холестерине в организме и печени зависит от активности человека — настройки симпато-адреналовой системы — человеку холестерин жизненно необходим для синтеза прогестерона, стероидных и половых гормонов, деятельности синапсов головного мозга, выработки витамина D. При стрессе и длительном напряжении в организме печень синтезирует много холестерина, который не весь расходуется на синтетические процессы и остается в виде эфиров в цитоплазме гепатоцита. Кроме того, длительное физическое и нервно-психическое напряжение может создать избыток холестерина в тканях преимущественно в форме ЛПНП. Высокое содержание (> 2 %) холестерина в пище также увеличивает фракцию ЛПНП и ЛПВП. При высоком содержании холестерина в пище синтез эндогенного холестерина в печени и других тканях ингибируется по механизму обратной связи.
В норме утилизация избытка холестерина касается только ЛПНП. Захват печенью циркулирующих в плазме ЛПНП — процесс активного транспорта через синусоидальную мембрану гепатоцита. После захвата ЛПНП скавендер-рецепторами гепатоцита они транспортируются в лизосомы, где из них высвобождается свободный холестерин, который используется для синтеза желчных кислот, стероидных гормонов и нейтральных стероидов или секретируется в желчь. Активная экскреция в желчь является основным физиологическим способом выведения избытков холестерина у человека (рис. 15). В сутки у человека образуется 500-1000 мл желчи. При относительно постоянном дебите желчи из организма человека в норме выводится до 1 г продуктов метаболизма холестерина в сутки.
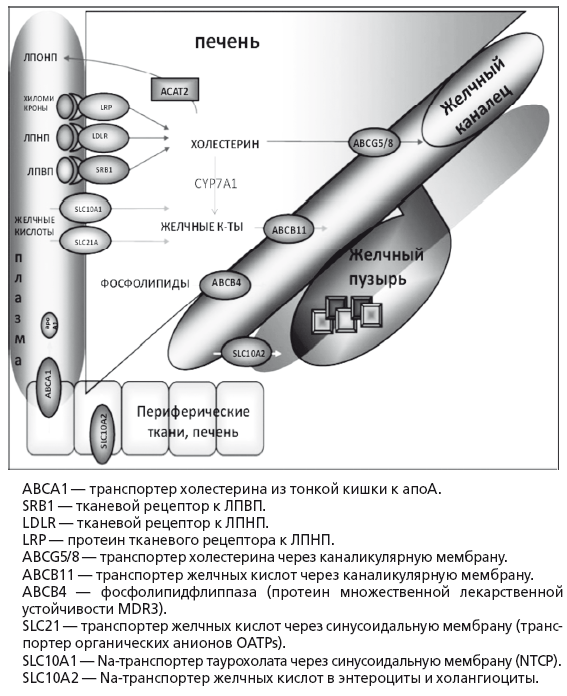
Рис. 15.
Транспорт основных метаболитов в печени (по Marschall HU, Einaon С, 2007)
Приблизительно половина этого количества экскретируется с фекалиями после превращения в желчные кислоты, оставшаяся часть представляет собой нейтральные стероиды. Холестерин секретируется в желчь активно, в желчные канальцы его переносит специальный насос ABCG5/8 (25). Поскольку холестерин не растворим в воде, его удержание в жидкой фракции желчи прямо зависит от концентрации эмульгирующих его желчных кислот и эссенциальных фосфолипидов — преимущественно ФХ, который обеспечивает его растворимость путем образования мицелл. При недостатке желчных кислот образуются более крупные частицы — везикулы, состоящие из лецитина и холестерина. При недостатке ФХ происходит кристаллизация холестерина и образуется желчный камень. Дефицит ФХ в желчи возникает при низком поступлении эссенциальных фосфолипидов или основной функциональной части — незаменимых полиненасыщенных жирных кислот (ПНЖК) в рационе питания. Относительный дефицит эссенциальных фосфолипидов также создается при их высоком потреблении гепатоцитами или другими тканями организма в печени при хронических воспалительных заболеваниях или интоксикациях, в частности, при хронической алкогольной интоксикации. Секреция в желчь холестерина, желчных кислот и ФХ — это энерго- и взаимозависимый, сложный процесс, который может нарушаться при первичном токсическом и аутоиммунном поражении гепатоцитов и холангиоцитов, а также лекарственном или инфекционном холестазе. Увеличение содержания холестерина в желчи форсирует синтез и секрецию в желчь эссенциальных фосфолипидов и базовых желчных кислот, без которых в желчи невозможно поддержание холестерина в растворимой форме и последовательно приводит к увеличению содержания всех этих веществ в тонкой кишке, крови воротной вены и фекалиях.
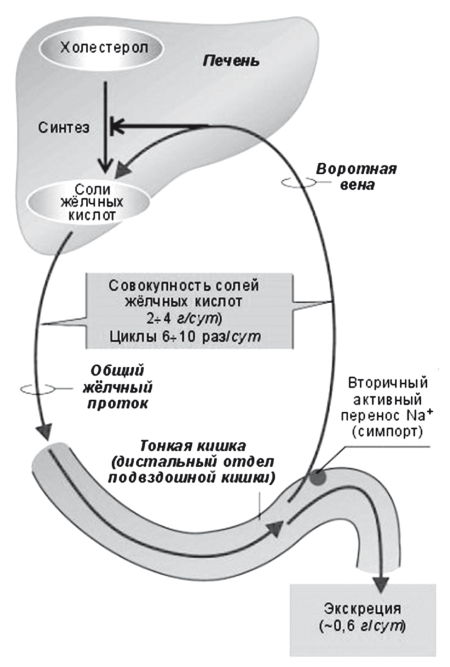
Рис. 16.
Схема энтерогепатической циркуляции желчных кислот
В процессе пассажа химуса по ЖКТ на всем протяжении кишечника всасывается до 90 % «съеденного» холестерина и реабсорбируется около 98 % желчных кислот и около 50 % холестерина, экскретированного с желчью. Оставшееся количество под действием микрофлоры толстой кишки превращается в стеролы, либо выводится с фекалиями, потому что связано с плохо растворимыми желчными кислотами (например, с литохолевой). Энтерогепатическая циркуляция желчных кислот протекает настолько эффективно, что суточная потеря желчных кислот с фекалиями составляет не более 500-1000 мг. Для восполнения потери первичные желчные кислоты — у человека холевая и хенодезоксихолевая кислоты — посредством фермента 7?-гидроксилазы (СУР7А1) постоянно синтезируются из холестерина в эндоплазматическом ретикулуме гепатоцитов, конъюгируются с глицином или таурином и активно секретируются в желчные канальцы (рис. 15). При помощи CYP7a в гепатоцитах из холестерина ежедневно синтезируются около 500 мг новых желчных кислот взамен тех, что были выведены с фекалиями (около 5 % общего пула). Этот метаболический путь является основным не только для синтеза желчных кислот, но и для утилизации избытков холестерина, поскольку приводит к утилизации около 80 % холестерина, циркулирующего в плазме (рис. 17).
Вторичные и третичные желчные кислоты: дезоксихолевая, литохолевая (около 1 % от общего пула желчных кислот) и урсодезоксихо-левая (< 3 % от общего пула желчных кислот) кислоты (УДХК) образуются из первичных желчных кислот под действием бактерий в толстой кишке и также частично реабсорбируются. Этот процесс тонко регулируется по механизму обратной связи — желчные кислоты синтезируются в гепатоците в точном соответствии с их потерей с фекалиями в энтерогепатической циркуляции. Интересно, что синтез желчных кислот более активно протекает в гепатоцитах III зоны печеночной дольки. Напротив, желчные кислоты, реабсорбируемые из кишечника и плазмы, концентрируются в гепатоцитах перипортальной зоны [36].
При увеличении потребности в синтезе нового холестерина в гепатоците активируется ген, кодирующий активность ключевого фермента ГМГ-КоА-редуктазы (рис. 17). Синтез первичных желчных кислот резко уменьшается. Это приводит к уменьшению секреции желчных кислот в желчь и снижению растворимости холестерина в желчи, притом что его концентрация в желчи увеличивается. В общем смысле этот механизм всегда сопутствует прогрессирующему атерогенезу, пожилому возрасту и терапии статинами. Таким образом, неудивительно, что у европейцев с сердечно-сосудистой патологией частота ЖКБ в 1,5 раза превышает среднюю во взрослой популяции, а в возрасте старше 71 года ЖКБ болеют около 14,3 % населения Европы и чаще — мужчины с ССЗ [36]. У представителей некоторых рас и этнических групп возможно также генетически детерминированное увеличение активности ГМГ-КоА-редуктазы: например, известна зависимость частоты ЖКБ от степени экспрессии американо-индейского гена. Накопление холестерина в гепатоцитах также может происходить при DOWN-регуляции CYP7a/
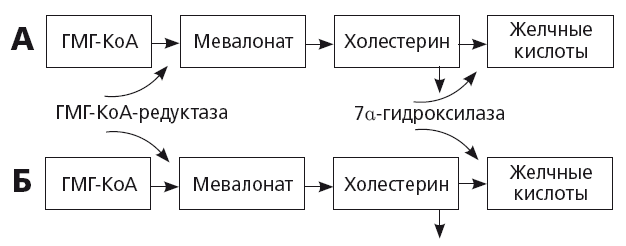
Рис. 17.
Регуляция секреции холестерина и желчных кислот у здоровых людей (А) и пациентов с ожирением и желчнокаменной болезнью (Б) [36]
Установлено, что активность CYP7a увеличивается при уровне холестерина в рационе более 2 %, и происходит это посредством активации ядерных рецепторов LXR, регулирующих экспрессию гена, кодирующего активность этого фермента. Напротив, активная реабсорбция желчных кислот из кишечника тормозит CYP7a и синтез желчных кислот по механизму отрицательной обратной связи и приводит к накоплению холестерина в гепатоцитах. Цель этого тонкого механизма — защита гепатоцитов и холангиоцитов от избыточного накопления желчных кислот, обладающих токсичным детергентным действием.
На первый взгляд, это плохо и тоже должно увеличивать литогенность желчи вследствие снижения секреции желчных кислот. Однако in vivo так не происходит. Изучение молекулярных механизмов ауторегуляции синтеза желчных кислот недавно привело к более тонкому пониманию ключевого регулирующего влияния желчных кислот на метаболизм холестерина, триглицеридов и самих себя. В 1999 году две независимые группы исследователей: в Японии — Makishima М. и соавторы и в Великобритании — Parks D.J. и соавторы почти одновременно опубликовали результаты исследований, впервые показавших, что соли желчных кислот являются прямыми активаторами ядерных рецепторов FXRa (NR1H4), которые регулируют экспрессию генов, участвующих в секреции, транспорте и метаболизме первичных желчных кислот, холестерина и триглицеридов как в гепатоцитах, так и в плазме. Посредством активации FXR желчными кислотами, поступающими из энтерогепатической циркуляции, и происходит подавление синтеза новых желчных кислот в цитозоле гепатоцита (рис. 18).
Активация FXR предотвращает накопление ТГ и ЛПОНП в печени, висцеральной клетчатке и плазме. При этом в печени действительно накапливается холестерин, который в данный момент «не нужен» для синтеза желчных кислот. Однако одновременно стимуляция FXR активирует экскрецию не этерифицированного холестерина в желчь при помощи переносчика ABCG5/8 [60]. Стимуляция FXR также увеличивает скорость захвата желчных кислот из плазмы посредством переносчиков ОАТР (SLC21) и NTCP (SLC10A1) и активирует экскрецию солей желчных кислот в первичные желчные канальцы переносчиком BSEP (АВСВ11). Одновременно стимуляция FXR активирует переносчик MDR3, секретирующий в желчь ФХ.
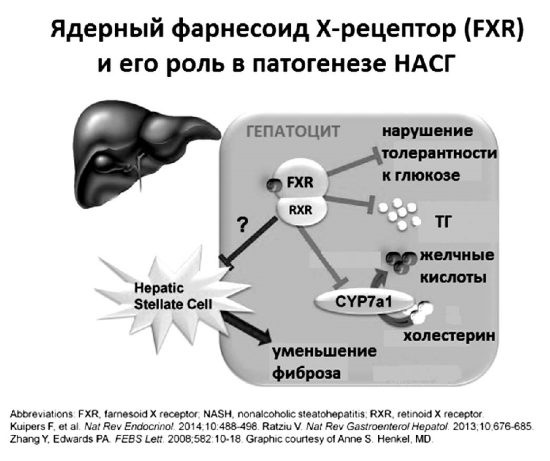
Рис. 18.
Ядерный фарнесоид Х-рецептор (FXR) и его роль в патогенезе НАСГ
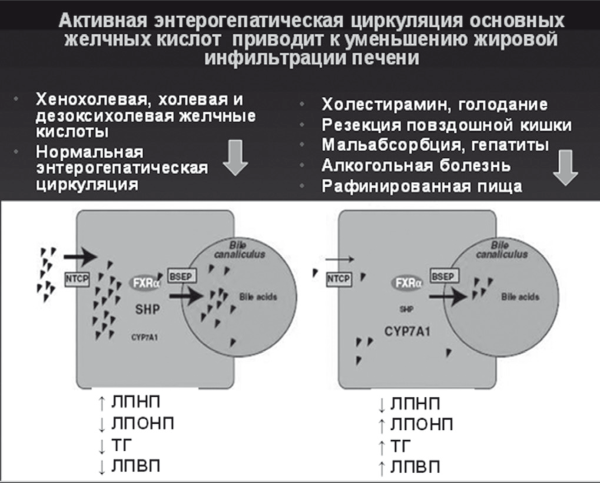
Рис. 19.
Эндокринная функция желчных кислот (модифицировано по S.M. Нouten, М. Watanabe, J. Auwerx, 2006)
Интегрально-активная энтерогепатическая циркуляция обеспечивает включение многокомпонентного механизма защиты гепатоцитов от токсичности желчных кислот при одновременном уменьшении сатурации холестерина в желчи и снижении риска образования желчных камней [60]. Позднее было установлено, что эндогенные желчные кислоты также являются сигнальными молекулами для синергичных FXR рецепторов TGR5 к G-протеину, которые находятся в тонкой кишке и опосредуют секрецию инкретинов. Стимуляция TGR5 желчными кислотами активирует активность щитовидной железы и энергообмен посредством увеличения секреции глюкагонподобных пептидов, которые препятствуют инсулинорезистентности [61]. В эксперименте на мышах оказалось, что добавление холевой кислоты к высококалорийному рациону позволяет предотвратить ожирение и развитие инсулинорезистентности путем увеличения липолиза в бурой жировой клетчатке. Таким образом, высокая реабсорбция желчных кислот при активной физиологической энтерогепатической циркуляции — как это происходит после приема холегенной и богатой жирами пищи — приводит к уменьшению синтеза желчи и накоплению в гепатоците ЛПНП, при одновременном уменьшении содержания ТГ и ЛПВП. Напротив, уменьшение всасывания желчных кислот (например, при голодании, применении секвестрантов, диарее любого происхождения) является сигналом к увеличению синтеза желчных кислот, для чего гепатоцит активно накапливает ТГ, ЛПОНП и ЛПВП. Другими словами, сбалансированный рацион питания, содержащий пищевые жиры и холеретики, служит надежной профилактикой образования желчных камней и развития жировой инфильтрации печени с дислипидемией и инсулинорезистентностью [60, 61].
Источник