Где происходит синтез липидов холестерина
Содержание статьи
иломикроны. ЛПОНП. ЛПНП. ЛПВП.
Хиломикроны. ЛПОНП. ЛПНП. ЛПВП.Хиломикроны (ХМ) — крупные шаровидные и легкие образования, содержащие в основном ТГ (более 90 %) и в меньшей степени эфиры ХС, поступающие с пищей и окруженные тонкой белковой оболочкой. ХМ синтезируются в тонком кишечнике, служат для переноса ТГ в первые часы после приема пищи: транспортируют пищевые жиры и ХС из кишечника в печень и периферические ткани. Уровень ХМ в крови резко увеличивается после употребления жирной пищи. Под влиянием липопротеидлипазы происходит гидролиз ТГ: из ХМ высвобождаются свободные жирные кислоты, которые, окисляясь, могут использоваться для энергетических процессов в мышцах и жировых клетках. При избыточном поступлении свободные жирные кислоты включаются в жировую ткань, где, эстерифицируясь, снова превращаются в ТГ и депонируются. ХМ, освободившиеся под влиянием липопротеидлипазы от значительного количества ТГ, образуют остаточные ХМ. Далее они попадают в печень, где захватываются гепатоцитами и разрушаются с высвобождением ХС. Параллельно печень секрети-руетЛПОНП. ЛПОНП (на их долю приходится только 15% ОХС и практически все ТГ) — главная транспортная форма эндогенных ТГ. Они доставляются к функционирующим клеткам, в жировые депо. Крупные ЛП (ЛПОНП и ХМ) имеют настолько большие размеры, что не могут проникать в стенку артерии и не являются атерогенными, но их избыток способен вызвать развитие острого панкреатита. Половина выделяемых ЛПОНП обратно захватывается печенью, а другая часть (после гидролиза ТГ под действием липопротеидлипазы) превращается в ЛП промежуточной плотности. Последние после снижения в них концентрации ТГ уплотняются и превращаются в атерогенные ЛПНП (конечный продукт этого метаболического каскада). Они — главный переносчик ХС (содержат большую часть, до 2/3, ХС плазмы крови) от места синтеза к органам-потребителям (служат там для синтеза мембран клеток, провитамина D и стероидных гормонов). В лизосомах ЛПНП распадаются и свободный ХС выходит в цитоплазму.
Более 2/3 ЛПНП попадает внутрь клетки при помощи «узнающих их» клеточных рецепторов, остальная часть — нерецепторным путем. Количество поверхностных рецепторов-«челноков», связывающих ЛПНП, меняется в зависимости от концентрации последних в крови, содержания в них ХС и потребностей клетки в ХС. Так, если в гепатоцитах (или других тканях организма) повышается потребность в ХС, то в клетках компенсаторно возрастает активность рецепторов к ЛПНП. Через них увеличивается утилизация ХС (в первую очередь, из ЛПНП), что приводит к уменьшению содержания ХСЛПНП и снижению транспорта ХС в стенку артерии (и интенсивности формирования атеросклеротических бляшек). Когда же ткани не нуждаются в дополнительных количествах ХС, то концентрация ЛПНП растет и активность рецепторов к ЛПНП снижается. Все это повышает вероятность переноса в артериальную стенку ЛПНП, где они легко модифицируются (окисление, гликация и др.), оставаясь в ней и оказывая проатерогенный эффект. Так, ЛПНП благоприятствуют коагуляции (усиливая выделения тканевого фактора — тромбопластина), дисфункции эндотелия и развитию в нем воспалительной реакции. Мелкие и плотные ЛПНП легко проникают в стенку артерии и задерживаются в ней, в последующем окисляясь свободными радикалами. Контактируя с макрофагами, ЛПНП дают толчок к развитию атеросклероза (и ИБС в последующем). Чем ниже концентрация ХСЛПНП, тем меньше риск развития атеросклероза. Поэтому именно уровень ХСЛПНП — главная мишень липиднормализующей терапии. Так, если ЛС стимулировать чувствительность и активность рецепторов ЛПНП, то это будет оказывать антиатерогенное действие, способствуя уменьшению концентрации ХСЛПНП. Наследственные факторы в половине случаев определяют вариабельность ХСЛПНП (их размеры и плотность). ЛПВП (синтезируются в печени и тонком кишечнике) — самые плотные и мелкие, по сравнению с ЛПНП содержат больше белка и фосфолипидов и меньше ХС. ЛПВП легко проникают в стенку сосуда и также легко ее покидают, не вызывая развитие атеросклероза. В норме удельный вес ХСЛПВП составляет около 20% в структуре ЛП. Основная функция ЛПВП — защита артерий от развития атеросклероза, обратный транспорт ХС из периферических тканей (удаляют его избыток из стенок сосудов. ГМК, органов и тканей), перевод ХС в другие ЛП или транспортировка в печень для дальнейшего катаболизма — последующего удаления из организма с желчью и калом (по желчевыводящим путям и кишечнику). Частицы ЛПВП также обладают и другими защитными эффектами: содержат антиоксиданты (тормозящие окисление ХСЛПНП), стабилизируют атеросклеротическую бляшку, снижают агрегацию тромбоцитов (и вероятность последующих тромбозов) и несколько повышают активность фибринолиза. Повышение уровня ХСЛПВП -вторая по значимости цель лечения дислипидемии. Чем выше уровень ЛПВП в крови и больше ХСЛПВП, тем меньше вероятность развития атеросклероза и больше возможность регресса атеросклеротических бляшек. Так, рост ХСЛПВП только на 0,03 ммоль/л коррелирует со снижением относительного риска развития ИБС на 3%. Низкому уровню ХСЛПВП могут благоприятствовать мужской пол, атерогенный образ жизни (курение, ожирение, гиподинамия, повышенное потребление углеводов), СД и высокий уровень ТГ. При атеросклерозе имеются дефекты липолиза хиломикронов и ЛПОНП, нарушения в системе обратного транспорта ХСЛПВП и метаболизма ЛП в плазме крови. С одной стороны, увеличение уровня ЛПНП (и содержания в них ХС), а с другой — понижение концентрации ЛПВП благоприятствуют формированию атеросклеротических бляшек и развитию ИБС. Показана прямая связь между повышением уровня ХСЛПНП и заболеваемостью ИБС. При очень высоких уровнях ХС ИБС может развиваться уже у молодых людей (даже если нет других ФР). Лечение, направленное на снижение уровня ХСЛПНП и повышение ХСЛПВП, может замедлить развитие ИБС. Каждая из нижеприводимых теорий атеросклероза имеет определенный базис (научное обоснование и клинические подтверждения), но ни одна из них не является всеобъемлющей и не может объяснить все механизмы формирования атеросклероза. — Также рекомендуем «Липидно-инфильтративная теория атеросклероза. Гиперлипидемии. Классификация гиперлипидемий.» Оглавление темы «Атеросклероз Причины атеросклероза.»: |
Источник
Синтез липидов: процесс ресинтеза и биосинтеза происходит в клетке
Профилактика атеросклероза, как и терапия заболевания, напрямую связаны с контролем уровня липидных структур в организме. Особое внимание уделяется холестерину (ХС), молекула которого представляет собой липофильный спирт. Отсюда происходит непривычное на бытовом уровне, но химически корректное название вещества – холестерол. Именно окисление неиспользованных организмом липидов свободными радикалами – первый этап в последовательности формирования атеросклеротических бляшек. С другой стороны, соединения липидных структур с протеинами, создают биологические комплексы, способные очищать сосуды. Это липопротеины высокой плотности – ЛПВП. Таким образом, синтез и биосинтез липидов важен применительно к общему здоровью человека. Процесс непосредственно влияет на уровень холестерина в организме.

Что включает класс липидов
Категория объединяет жиры и подобные им вещества. На молекулярном уровне, липид формируется на двух базовых элементах: спирт и жирная кислота. Также допускается вхождение дополнительных компонентов. Подобные структуры относят к классу сложных липидов. Наибольший интерес, с точки зрения профилактики атеросклероза, привлекают следующие представители этого класса:
- Жирные спирты, а именно холестерин.
- Триглицериды.
Определенного внимания заслуживали бы жирные кислоты (ЖК), в частности полиненасыщенные – Омега-3. Вещество способствует снижению ХС. Однако организмом человека их синтез не осуществляется.
Общий принцип биосинтеза липидов
Образование ЖК и их производных начинается с цитоплазмы. Вторая часть биосинтеза – удлинение молекулярной цепи также продолжается в клетке, однако «производственная мастерская смещается» внутрь митохондрии. На каждом этапе, соединение обогащается двумя атомами C, что напоминает процесс бета-окисления, только в его обратной интерпретации.
Говоря более развернуто, в цитоплазме непосредственно и происходит синтез, например пальмитиновой кислоты. Митохондрии же, используют уже готовый «полуфабрикат», для производства полноценных жирных кислот, состоящих из 18-и и более атомов углерода. Выполнить весь биосинтез самостоятельно от «А» до «Я», митохондрии не в состоянии. Причина банальна – «низкий уровень квалификации». Возвращаясь к технической терминологии, митохондрии обладают очень низкой способностью включать меченые уксусные кислоты в длинную цепь липидных структур.

Базовый внемитохондриальный биосинтез ЖК, напротив, не имеет общих пересечений с процессом их окисления. Его механизм, требует трех компонент:
- ацетил-КоА – первичный метаболит;
- CO2 – тут без комментариев, вещество общеизвестное;
- ионов бикарбоната – HCO3-.
Метаболит представляет собой строительный фундамент. Изначально ацетил-КоА образуется именно в митохондрии. Его синтез – следствие процесса окислительного декарбоксилирования. Просочиться напрямую в цитоплазму, соединение не может в силу непроницаемости для него митохондриальной мембраны. Удается осуществить проникновение путем обходного маневра:
- Митохондриальный метаболит производит цитрат, посредством взаимодействия с оксалоацетатом.
- Для синтезированного цитрата митохондриальная мембрана прозрачна. Поэтому его молекулы с легкостью пробиваются в цитоплазму.
- Далее происходит обратная трансформация. Едва преодолев мембрану, цитрат расщепляется на исходные компоненты – ацетил-КоА и оксалоацетат.
Таким образом, метаболит передается от митохондрии. В цитоплазме непосредственного получения соединения не происходит. Альтернативный вариант переноса ацетил-КоА возможен при участии карнитина. Однако, в процессе синтеза ЖК, – это своеобразный «бронепоезд, стоящий на запасном пути». Данный канал используется значительно реже.

Заключительный этап биосинтеза
Оказавшись в цитоплазме метаболит готов к производству прекурсора ЖК – малонил-КоА. Для этого ацетил-КоА и требуется двуокись углерода. Катализатором процесс выступает фермент ацетил-КоА-карбоксилазы. Биосинтез распределяется на два периода:
- Карбоксилирование биотин-энзима. Протекает в присутствии CO2 и АТФ.
- Перенос карбоксильной группы на метаболит.
Результирующий малонил-КоА в дальнейшем быстро трансформируется в ЖК. Процесс происходит с участием определенной ферментной системы. Фактически, это комплекс взаимосвязанных ферментов. Он именуется синтетаза жирных кислот, имеет 6 различных ферментов и связующий элемент – ацилпереносящий белок (осуществляют роль, аналогичную КоА).
Разобравшись с биосинтезом липидов на общем уровне, самое время перейти к конкретным примерам.

Биосинтез триглицеридов
Фундаментальными кирпичиками процесса выступают глицерин и ЖК. Изначально формируется промежуточный продукт – глицерол-3-фосфат. Это характерно для процессов биосинтеза, происходящих в почках и стенках кишечника. Клетки органов отличаются гиперактивностью фермента глицеролкиназы, чего нельзя сказать о мышечной и жировой ткани. Тут вещество формируется при помощи гликолиза – окисления глюкозы.
Эффект особенно проявляется при истощении. Вследствие этого, образуется недостаток глюкозы, что приводит к резкому снижению производства глицерол-3-фосфата. Как результат свободные ЖК не используются на ресинтез липидов, просто покидая ткань.
Еще одним источником промежуточного синтеза глицерол-3-фосфат выступает печень. Орган может производить вещество обоими способами, с использованием как глицерина, так и глюкозы, в качестве базового соединения. Впрочем, для синтеза глицерол-3-фосфат главное, что события произошли, поскольку в дальнейшем соединение ацилируется. То есть происходит процесс введения RCO- остатка при помощи молекул ЖК (КоА производные).
Это приводит к синтезу фосфатидной кислоты. В дальнейшем от полученного соединения отщепляется остаток фосфорной кислоты. Реакция дефосфорилирования протекает с участием фосфатидатфосфатазы. Ее продуктом выступает 1,2-диглицерид. До получения триглицерида остается единственный шаг. Он состоит в этерификации. Кислотой выступает 1,2-диглицерид, заместителем спирта – фермент ацил-КоА.

Биосинтез холестерина
Ферментативный процесс образования ХС – достаточно сложная «многоходовая комбинация», насчитывающая более 35 энзиматических реакций. Очевидно, что охватить подобный объем преобразований не под силу даже Остапу Бендеру. Поэтому проще рассмотреть базовые стадии биосинтеза холестерола:
- Получение мевалоновой кислоты. Происходит в эукариоте – домене живых организмов. Требует три молекулы активного ацетата.
- Формирование сквалена. Прекурсором выступает ранее произведенная мевалоновая кислота. Изначально соединение трансформируется в активный изопреноид, из 6 молекул которого и образуется сквален.
- Синтез холестерина. Процесс осуществляется циклизацией сквалена. Синтезируется своеобразный прекурсор – ланостерин, переход которого в ХС все еще находится под изучением.
Первоначально биосинтез инициируется формированием ацетоацетил-КоА. Далее, структура подвергается конденсации с 3-ей молекулой активного ацетата. Полученное производное вещество вступает в реакцию восстановления, что и приводит к формированию мевалоната.
Следующий шаг в биосинтезе ХС – превращение мевалоната в сквален. Изначально, соединение подвергается переносу остатка фосфорной кислоты при помощи фермента АТФ. Продуктом реакции выступает 5′-пирофосфорный эфир. Впрочем, соединение не долговечно. Оно практически моментально трансформируется, в эфир мевалоната. Цепочка последующих преобразований достаточно запутана, поэтому проще ограничиться фактом. Результатом этих процессов становится образование сквалена. Реакция циклизации соединения приводит к формированию ланостерина, с последующим биосинтезом холестерола.
Остается добавить, что преимущественно процесс протекает в печени. Поэтому дисфункции органа, способны вызывать нарушения липидного баланса. При нормальной работе, печень производит ежесуточную норму холестерина, с учетом вещества, поступающего с продуктами. Этот факт еще раз опровергает распространенное заблуждение о вреде пищи с высоким содержанием холестерина. Здоровая печень, способна самостоятельно контролировать уровень вещества.
Источник
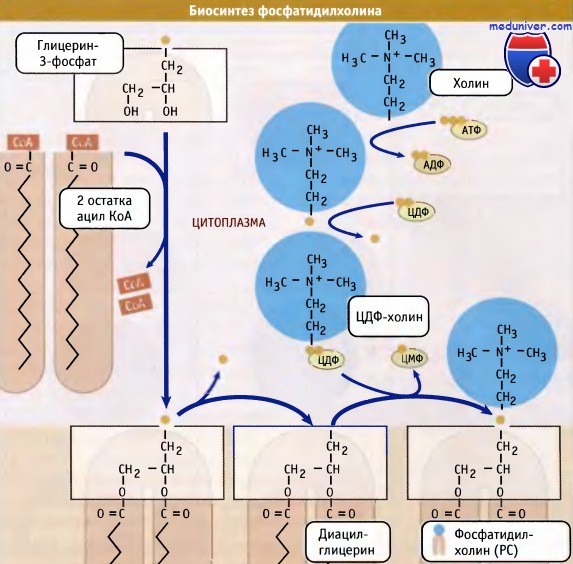
интез фосфолипидов в клетке — цик
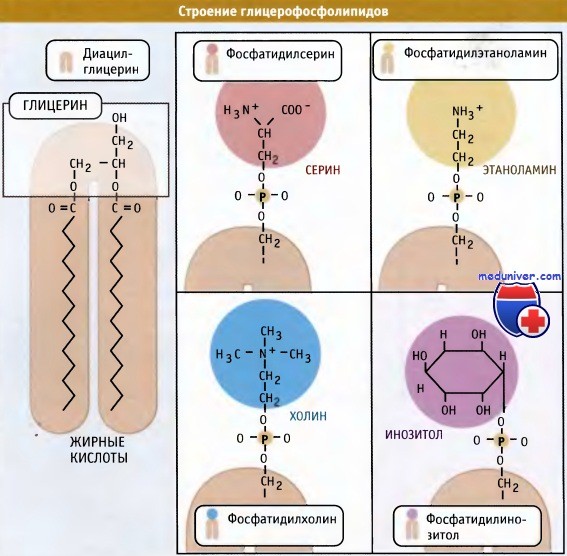
Синтез фосфолипидов в клетке — цикл Кеннеди• Основные клеточные фосфолипиды синтезируются в мембране ЭПР, главным образом, со стороны цитозоля. • Регуляция синтеза новых липидов контролируется локализацией ферментов, участвующих в этом процессе. • Биосинтез холестерина регулируется протеолизом фактора транскрипции, который интегрирован в мембрану ЭПР. Наряду с транслокацией и подготовкой белков к секреторному процессу, эндоплазматический ретикулум (ЭПР) функционирует как место первичного образования клеточных фосфолипидов. Эти молекулы синтезируются в мембране эндоплазматического ретикулума (ЭПР) и затем распределяются по отдельным мембранам и органеллам внутри клетки. К их числу относится плазматическая мембрана, митохондрии и органеллы секреторного пути. При возникновении необходимости клетка должна обладать способностью увеличивать количество мембран. Наиболее очевидно это проявляется при удвоении плазматической мембраны и всех органелл, которое происходит в ходе клеточного цикла. Наряду с этим, при гиперфункции, отдельные органеллы могут увеличиваться в размерах. Например, при созревании предшественников В-лимфоцитов в плазматические клетки, секретирующие антитела, ЭПР сильно увеличивается, что соответствует потребностям усиленного транспорта белков по секреторному пути. Образование фосфолипидов из растворимых предшественников de novo происходит, главным образом, на мембране ЭПР со стороны цитоплазмы, в ходе процесса, называемого цикл Кеннеди. Как показано на при росте мембраны ЭПР две молекулы жирных кислот, связанные с ацетил КоА, реагируют с глицерин-3-фосфатом, образуя диацилглицерин (ДАТ). В отличие от своих предшественников, ДАГ достаточно гидрофобен для того, чтобы интегрироваться в мембрану ЭПР. Попав в мембрану, ДАГ взаимодействует с «головой» будущей молекулы фосфолипида. Как показано на рисунке ниже, основные фосфолипиды различаются, главным образом, природой «головы» молекулы. Все они образуются при присоединении «головы» к ДАГ. Вначале происходит ее фосфорилирование, а затем присоединение к цитидиндифосфату (ЦДФ). После этого «голова» с одной из фосфатных групп переносится на ДАГ, и синтез завершается. Присоединение головной группы холина к ЦЦФ с образованием фосфатидилхолина иллюстрирует использование клеткой субклеточной локализации белков для регуляции процессов биосинтеза. В этой реакции участвует фермент цитидилтрансфераза (ЦТ), и она контролирует скорость всего процесса синтеза фосфатидилхолина. В клетке ЦТ находится в двух различных формах: в неактивной, в цитозоле, и в активной, с цитозольной стороны мембраны ЭПР. Механизм, который обеспечивает существование двух этих форм фермента, представляется не вполне ясным. Очевидно, однако, что условия внутри клетки, которые сигнализируют о необходимости усиления синтеза фосфатидилхолина, могут контролировать переход ЦТ из одной формы в другую. Например, увеличение в клетке концентрации свободного ДАТ или жирных кислот вызывает миграцию ЦТ на мембрану ЭПР, где эти компоненты реагируют с холином. В то же время, когда в клетке содержится много фосфатидилхолина, ЦТ локализуется в цитозоле. Таким образом, предотвращается синтез фосфатидилхолина. Наряду с фосфатидилхолином, который является наиболее распространенным мембранным фосфолипидом, в цикле Кеннеди также образуются фосфатидилэтаноламин и фосфатидилинозитол. У дрожжей S. cerevisiae синтезируется фосфатидилсерин. У животных, однако, этот фосфолипид образуется за счет другой реакции, которая не требует участия ЦЦФ, однако также протекает с цитозольной стороны мембраны ЭПР. Интересная особенность синтеза фосфатидилэтаноламина заключается в том, что хотя этот фосфолипид образуется в цикле Кеннеди, он также может синтезироваться в митохондриях. В этих органеллах он образуется при модификации фосфатидилсерина, который образовался в ЭПР. Образование фосфатидилэтаноламина в клеточных компартментах, отличающихся от тех, в которых синтезируется его предшественник, предполагает существование механизма транспорта липидов между двумя компартментами. Имеются данные, позволяющие предполагать, что этот транспорт осуществляется посредством специального субдомена ЭПР, который называется мембраной, связанной с митохондрией (МСМ). МСМ представляет собой участок ЭПР, который физически ассоциирован с митохондрией. Он характеризуется плоской поверхностью и тесным контактом с органеллой. В МСМ находятся ферменты синтеза фосфатидилсерина. Возможно, что область контакта мембраны с митохондрией обеспечивает быстрый перенос фосфатидилсерина в органеллу, хотя механизм этого переноса остается неясным. Наряду с участием в синтезе фосфолипидов, эндоплазматический ретикулум (ЭПР) является местом синтеза стеринов. К числу основных стеринов мембран клетки относится холестерин; его биосинтез осуществляется в несколько этапов. Первые несколько реакций происходят в цитозоле, а остальные в мембране ЭПР. Также в ЭПР находятся элементы, необходимые для регуляции образования холестерина. Ключевыми медиаторами этого регуляторного пути являются белки, связывающиеся с регуляторным стеринреспонсивным элементом (SREBP). Эти белки обычно интегрированы в мембрану эндоплазматического ретикулума (ЭПР) и со стороны люмена содержат небольшую петлю, соединяющую два трансмембранных домена, N- и С-концевые участки которых ориентированы в сторону цитозоля. Также в ЭПР находится белок SCAP (белок, активирующий разрезание SREBP). Этот белок контролирует уровень внутриклеточного холестерина. Когда возникает необходимость в повышенном синтезе холестерина, SCAP транспортирует SREBP из ЭПР в аппарат Гольджи. Там происходит разрезание SREBP, и N-терминальный участок молекулы высвобождается в цитозоль. (В реакции участвуют те же протеазы, которые расщепляют АТФ 6 при возникновении стрессорных условий в ЭПР. Затем N-терминальный домен SREBP мигрирует в ядро, где действует как фактор транскрипции, активируя экспрессию генов в каскаде реакций биосинтеза холестерина.
— Также рекомендуем «Механизм транспорта липидов между органеллами в клетке» Оглавление темы «Синтез белка в клетке»:
|
Источник