Гем в составе гемоглобина
Содержание статьи
Вопрос 6. Строение гема, производные гемоглобина
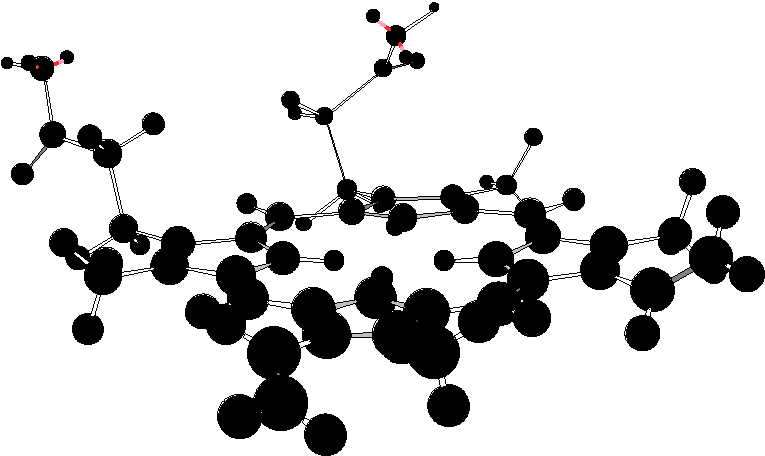
В
состав молекулы гемоглобина входят 4
одинаковые гемовые группы. Гем представляет
собой порфирин, содержащий центрально
расположенный ион Fe2+.
Является производным порфина, который
представляет собой конденсированную
систему из 4 пирролов, соединенных между
собой метиновыми мостиками (-СН=). В
зависимости от строения заместителей
в порфине различают несколько
разновидностей гемов.
гем
IX
– наиболее распространенная разновидность
гема. Производным порфина в нем является
протопорфирин IX
(1,3,5,8 – тетраметил-2,4 – дивинил – 6, 7 –
дипропионовокислый порфин);гем
а (формилпорфирин). Гем а вместо метильной
группы содержит формильный остаток в
восьмом положении (-СНО) и вместо одной
винильной группы (во втором положении)
изопреноидную цепь. Гем а входит в
состав цитохромоксидазы;гем
с, в котором с винильными (-СН=СН2)
группами в положениях 2 и 4 связаны
остатки цистеина. Входит в состав
цитохрома С;гем
представляет собой железодигидропорфирин
4.
Гем
является простетической группой не
только гемоглобина и его производных,
но и миоглобина, каталазы, пероксидазы,
цитохромов, фермента триптофанпироллазы,
катализируещего окисление троптофана
в формилкинуренин.
Координационное
число для атомов железа равно 6. В геме
железо связано двумя ковалентными
связями с атомами азота двух пиррольных
колец и двумя координационными связями
с атомами азота остальных пиррольных
колец. Пятая и шестая координационные
связи железа распределяются по-разному,
в зависимости от того в состав какой
белковой молекулы входит гем, в зависимости
от её функций. Так, например, в цитохромах
5 и 6 координационные связи железа
соединены с остатками гистидина и
метионина. Такое расположение гема в
цитохромах, необходимо для выполнения
их специфической функции – переноса
электронов в дыхательной цепи. Переходы
Fe3++
е= Fe2+;
Fe2+-е=
Fe3+
создают возможность перебрасывать
электроны от одного цитохрома к другому.
Рассмотрим
подробнее расположение гема в составе
гемоглобина (миоглобина). Гем расположен
в щели между спиралями Е и F;
его полярные пропионатные группы
ориентированы к поверхности глобулы,
а остальная часть находится внутри
структуры и окружена не полярными
остатками, за исключением His
F8
и His
F7.
Пятое координационное положение атома
железа занято атомом азота гетероциклического
кольца проксимального гистидина His
F8.
Дистальный гистидин (His
F7)
расположен по другую сторону гемого
кольца, почти напротив His
F8,
но шестое координационное положение
атома железа остаётся свободным. Из
двух не использованных координационных
связей одна идет на соединение с белком,
а вторая – на соединение с различными
лигандами (физиологическими – кислород,
вода и чужеродными – диоксид углерода,
цианид и т.д.).
Производные гемоглобина
Гемоглобин
взаимодействует с различными лигандами,
для этого предназначена шестая
координационная связь железа в геме. К
производными гемоглобина относят:
оксигемоглобин
HbО2
– соединение молекулярного кислорода
с гемоглобином. Чтобы подчеркнуть тот
факт, что валентность железа при этом
связывании не меняется, реакцию называют
не окислением, а оксигенацией; обратный
процесс называется дезоксигенацией.
Когда хотят специально отметить, что
гемоглобин не связан с кислородом, его
называют дезоксигемоглобином;карбоксигемоглобин
HbСО.
Валентность железа в результате
присоединения угарного газа (моноксида
углерода – СО) также остается II.
СО связывается с гемом примерно в двести
раз прочнее, чем связь гем- О2.
Не большая часть молекул гемоглобина
(1%) в нормальных условиях связывает СО.
У курильщиков же к вечеру эта величина
достигает 20%. При отравлении монооксидом
углерода наступает смерть от удушья,
недостаточного снабжения тканей
кислородом.метгемоглобин
(HbОН).
Он не связывает молекулярный кислород.
Атом железа в его молекуле находится
в степени окисления 3+. Метгемоглобин
образуется при воздействии на гемоглобин
окислителей (оксидов азота, метиленового
синего, хлоратов). В крови человека
метгемоглобин находится в незначительных
количествах, но при некоторых заболеваниях
(например, нарушение синтеза ГЛ-6-фосфатДГ),
либо при отравлении окислителями его
содержание возрастает, что может быть
причиной летального исхода, так как
метгемоглобин не способен к переносу
кислорода от легких к тканям;цианметгемоглобин
(HbСN)
– метгемоглобин оказывает и положительное
действие. Он связывает СN-
с образованием цианметгемоглобина и
спасает организм от смертельного
действия цианидов. Поэтому для лечения
отравлений цианидами применяют
метгемоглобинообразователи (тот же
нитрит Na);карбгемоглобин
образуется, когда гемоглобин связывается
с СО2.
Однако СО2
присоединяется не к гему, а к NН2
– группам глобина:
HbNH2
+ CO2=
HbNHCOO-
+ H+
Причем
дезоксигемоглобин связывает больше
СО2,
чем оксигемоглобин. Образование
карбгемоглобина используется для
выведения СО2
из тканей к легким. Этим путем выводится
10-15% СО2.
Вопрос 7. Механизм
насыщения гемоглобина кислородом
За
счет шестой координационной связи к
атому железа присоединяется молекула
кислорода с образованием оксигемоглобина.
Пиррольные кольца гема расположены в
одной плоскости в то время как атом
железа несколько выступает из этой
плоскости. Присоединение кислорода
«выпрямляет» молекулу гема: железо
перемещается в плоскость пиррольных
колец на 0,06 нм, так как диаметр
координационной сферы атома железа
уменьшается. Гемоглобин связывает 4
молекулы кислорода (по одной молекуле
на гем в каждой субъединице).
Оксигенерирование сопровождается
значительными конформационными
изменениями в гемоглобине. Перемещаясь
в плоскость пиррольных колец, Fe,
соединенное в 5 координационном положении
с остатком HisF8
«тянет» пептидную цепь на себя. Происходит
изменение конформации этой цепи и
связанных с ней других полипептидных
цепей, поскольку один протомер соединен
многими связями с другими протомерами.
Это явление называют коопреативностью
изменения конформации протомеров.
Изменения конформации таковы, что
первоначальное связывание О2
с одной субъединицей ускоряет связывание
молекул кислорода с отстальными
субъединицами. Это явление известно
как гомотропный положительный
кооперативный эффект (гомотропный,
потому что участвует только кислород).
Именно это обуславливает сигмовидный
характер кривой насыщения гемоглобина
кислородом. Четвертая молекула кислорода
присоединяется к гемоглобину в 300 раз
легче, чем первая молекула. Чтобы
составить себе более ясное представление
об этом механизме, целесообразно
рассматривать структуру гемоглобина
в виде двух гетеродимеров, образованных
и
— субъединицами: 1
1
и 2
2.
Незначительный сдвиг атома железа
приводит к тому, что одна /
пара субъединиц, поворачивается
относительно другой /
— пары. При этом между субъединицами
разрушаются нековалентные связи,
обусловленные электростатическими
взаимодействиями. Один набор связей
между димерами замещается на другой,
происходит их относительная ротация.
Четвертичная
структура частично оксигенерированного
гемоглобина описывается как Т-состояние
(от англ. Taut
–напряжение), полностью оксигенерированному
гемоглобину (HbО2)
отвечает R
– состояние (relaxed-
релаксирование). Состояние характеризуется
меньшим сродством к кислороду, вероятности
перехода из Т- формы в R-форму
повышается по мере последовательного
оксигенерирования каждой из 4 гемогрупп.
Солевые мостики (нековалентные связи)
по мере присоединения кислорода
разрушаются, увеличивая вероятность
перехода из Т – формы в R-
форму (состояние высокого сродства).
Источник
Гемоглобин
Гемоглобин (Hb) — сложный белок, обеспечивающий транспорт кислорода из легких к тканям. Гемоглобин состоит из белковых цепей и гема — порфиринового кольца, которое содержит железо.
Физиологически, основной функцией гемоглобина является перенос кислорода из легких к органам и тканям, но не меньшей важностью является перенос гемоглобином оксида азота (NO) и регуляция тонуса сосудов (вазомоторного тонуса).
Низкий уровень гемоглобина является одним из проявлений анемии, повышенный уровень гемоглобина также является признаком ряда заболеваний и патологических состояний.
Гемоглобин. Цифры и факты
- Одна молекула гемоглобина переносит четыре молекулы кислорода
- Во всем гемоглобине в организме содержит 2,5 грамма железа у мужчин и 1,9 грамма у женщин
- Паразит, вызывающий малярию, малярийный плазмодий, питается гемоглобином. Подробнее о малярии
ЭТО ИНТЕРЕСНО: физиологический процесс распада гемоглобина в организме называется гемоглобинолизом
Виды гемоглобинов
В организме здорового взрослого человека присутствует несколько типов гемоглобина:
- Гемоглобин А (HbA)
- Гемоглобин A2 (HbA2)
- Фетальный гемоглобин (HbF)
- Гликированный гемоглобин (HbA1C)
Гликированный гемоглобин имеет важнейшее значение в диагностике и лечении сахарного диабета
Нормы гемоглобина
Казалось бы, все знают, что норма гемоглобина для женщин составляет 120-140 г/л (грамм на литр), а для мужчин 140-160 г/л. Но как и с нормальными показателями уровня сывороточного железа, с нормами гемоглобина не все так просто.
ЭТО ИНТЕРЕСНО: Методы определения концентрации гемоглобин в крови называются гемоглобинометрией
Сначала интересные факты о том, откуда взялись вышеуказанные нормы. Эти нормы разработаны ВОЗ, но разработаны они не для оценки нормального уровня гемоглобина как такового, а для оценки питания. Т.е. проще говоря, эти уровни гемоглобина соответствующие указанному диапазону, с точки зрения экспертов ВОЗ, говорят о том, что человек, в общем то, неплохо питается, не более того.
Ассоциация гематологов США предлагает рассматривать нижнюю границу нормы гемоглобина, на следующем уровне:
Популяция* | Нижняя граница нормы гемоглобина |
Мужчины в возрасте от 20 до 59 лет | 137 г/л |
Мужчины в возрасте старше 60 лет | 132 г/л |
Женщины 20 лет и старше | 122 г/л |
* Нормы гемоглобин для представителей европеоидной расы
Как следует из приведенной таблицы, на уровень гемоглобина влияют пол и возраст, другие факторы, влияющие на уровень гемоглобина:
- Проживание на большой высоте
- Занятия спортом
- Курение
- Раса
- Сопутствующие заболевания
У курящих, живущих на большой высоте, спортсменов — уровень гемоглобина будет выше, т.е. то, что для других норма, для других будет уже анемией. Как и наоборот, то, что для людей живущих примерно на уровне моря будет повышенным уровнем гемоглобина, для курящих, спортсменов и живущих на большой высоте будет нормой.
Норма гемоглобина у беременных женщин*
Первый триместр | Второй триместр | Третий триместр | |
Гемоглобин (г/л) | 116-139 | 97-148 | 9.5-150 |
Гематокрит (в процентах) | 31.0-41.0 | 30.0-39.0 | 28.0-40.0 |
*Данные показатели получены в результате клинических исследований, но не являются нормативными. Подробнее о некоторых лабораторных нормах у беременных женщин.
Итак, после того, как мы рассказали о сложностях в оценке того, какой уровень является нормальным для гемоглобина, а какой нет, мы расскажем на какие нормативные показатели обычно ориентируются врачи.
Показатель | Мужчины | Женщины |
Гемоглобин г/л | 157 ± 17 | 138 ± 15 |
Гематокрит % | 46.0 ± 4.0 | 40.0 ± 4.0 |
Эритроцитов в мкл | 5.2 ± 0.7 | 4.6 ± 0.5 |
Ретикулоциты % | 1.6 ± 0.5 | 1.4 ± 0.5 |
Средний объем эритроцита, fL | 88.0 ± 8.0 | |
Среднее содержание гемоглобина в эритроците | 30.4 ± 2.8 | |
Средняя концентрация гемоглобина в эритроците | 34.4 ± 1.1 | |
Ширина распределения эритроцитов | 13.1 ± 1.4 | |
Напомним, что нормальные показатели гемоглобина у взрослых отличаются от показателей у детей.
Гемоглобин у детей
Возраст | Гемоглобин, г/л | Гематокрит, % | Средний эритроцитарный объем, мкм3 |
Новорожденные | 165 ± 30 | 51 ± 9 | 108 ± 10 |
1 мес | 140 ± 40 | 43 ± 12 | 104 ± 19 |
6 мес | 115 ± 20 | 35 ± 6 | 91 ± 17 |
1 год | 120 ± 15 | 36 ± 3 | 78 ± 8 |
2—6 лет | 125 ± 10 | 37 ± 3 | 81 ± 6 |
6—12 лет | 135 ± 20 | 40 ± 5 | 86 ± 9 |
12—18 лет | 140 ± 20 | 42 ± 6 | 89 ± 11 |
Подготовка к анализу на гемоглобин
Подготовка к анализу на гемоглобин обычно не требуется. Перед анализом необходимо пить достаточное количество жидкости, чтобы не допустить обезвоживания. Анализ на гемоглобин может быть сдан отдельно, но чаще всего, исследование гемоглобина проводится в рамках проведения общего анализа крови. В некоторых случаях общий анализ крови может потребовать подготовки в виде 12 часового голодания.
Симптомы пониженного гемоглобина
Пониженный гемоглобин приводит к недостаточному обеспечению органов и тканей кислородом. ОБычно симптомы низкого гемоглобина включают:
- слабость
- одышку
- головокружение
- учащенное сердцебиение
- шум в ушах
- головную боль
- похолодание конечностей
- побледнение или желтизну кожи
- боль в груди
Подробно симптомы связанные с пониженным гемоглобином обсуждаются в статье об анемиях.
Источник
Гемоглобин
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
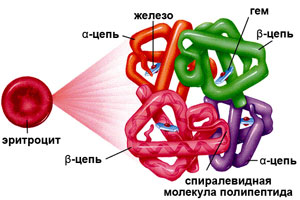 Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA — взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин | |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) — гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
Как же это происходит? Почему в легких гемоглобин забирает, а в тканях отдает кислород?
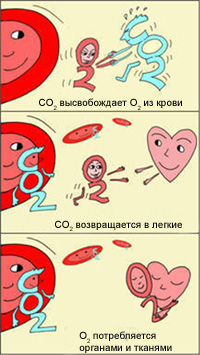 Эффект Бора
Эффект Бора
Эффект был описан датским физиологом Христианом Бором https://en.wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
Христиан Бор заявил, что при большей кислотности (более низкое значение рН, например, в тканях) гемоглобин будет меньше связываться с кислородом, что позволит его отдать.
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.
 Какой уровень гемоглобина в норме?
Какой уровень гемоглобина в норме?
В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
Заболевания, связанные с изменением количества или структуры гемоглобина
- Повышение уровня гемоглобина наблюдается при эритроцитозах, обезвоживании.
- Снижение уровня гемоглобина наблюдается при различных анемиях.
- При отравлении угарным газом образуется карбгемоглобин (не путайте с карбоксигемоглобином!), который не может присоединять кислород.
- Под действием некоторых веществ образуется метгемоглобин.
- Изменение структуры гемоглобина называется гемоглобинопатией. Самые известные и частые заболевания этой группы – серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина. См.гемоглобинопатии на сайте Всемирной организации здравоохранения https://www.who.int/mediacentre/factsheets/fs308/ru/index.html
Знаете ли Вы?
- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина – содержащий медь гемоцианин.

Другие статьи раздела
Распространенный возбудитель инфекций дыхательных путей (фарингиты, синуситы, отиты, бронхиты и пневмонии). Анализы на антитела используются для диагностики инфекции Chlamydophila pneumoniae при длительных инфекциях дыхательных путей.
Mycoplasma pneumoniae — возбудитель пневмонии человека, острых респираторных заболеваний (ОРЗ), заболеваний верхних дыхательных путей (фарингита, бронхита), а также некоторых нереспираторных заболеваний.
Азооспермия (azoospermia) — отсутствие сперматозоидов в эякуляте
Бактерии – одноклеточные микроорганизмы, некоторые из которых могут вызывать заболевания.
Mycoplasma pneumoniae (микоплазма пневмонии), Chlamydohpila pneumoniae (хламидофила пневмонии, прежнее название Chlamydia pneumoniae)
Гипофиз – непарная железа внутренней секреции, расположенная на основании головного мозга в костном кармане – гипофизарной ямке турецкого седла. Гипофиз вырабатывает гормоны, оказывающие влияние на работу всего организма – рост и развитие, обмен веществ, половую функцию.
Повышенный рост волос (гирсутизм) может быть следствием не только повышенного уровня андрогенов (см. «гиперандрогения»), но и высокой активности 5-альфа-редуказы в коже (фермента волосяных фолликулов, превращающего тестостерон в гораздо более активный дигидротестостерон.
По данным ВОЗ (Всемирная организация здравоохранения) заболеваемость в России составляет более 50 человек на 100 000 населения. Имеет важное значение то, что у женщин значительно чаще чем у мужчин (50-90% против 10%) возможно бессимптомное течение заболевания.
Делеция (ген.) – вид хромосомных мутаций, при котором происходит потеря какого-либо участка хромосомы.
Механизм обратной связи – система, которая используется организмом для контроля некоторых функций и поддержания состояния постоянства организма. Механизм обратной связи использует один из продуктов пути обмена веществ, обычно конечный продукт, для контроля активности пути обмена веществ и регуляции количества этого продукта. Обратная связь может быть отрицательной и положительной.
Источник