Гемоглобин человека и шимпанзе
Содержание статьи
Читать
А затем, что мы таким образом получаем прежде не существовавшие доказательства. Теперь у нас есть общая единица измерения. Неважно, где проводился эксперимент и какой человек с каким шимпанзе сравнивался, различие останется постоянным. Теперь, наконец, у нас есть стандартная мера эволюционных расхождений, которая принципиально отличается от колеблющихся различий в величине мозга или зубов, которые никогда не бывают совершенно одинаковыми у двух разных особей. В лабораторных сравнениях ДНК какие бы то ни было индивидуальные колебания отсутствуют.
Молекулярная биология не ограничивается изучением только ДНК. Она использует другие лабораторные методы для исследования эволюционной истории белков крови, таких, как гемоглобин и сывороточный альбумин, у различных животных. Винсент Сарич и Аллан Уилсон (Калифорнийский университет в Беркли) применили один из таких методов — иммунологические реакции — для измерения молекулярных различий в сывороточном альбумине животных. И вновь результаты согласовываются, как показывает левая таблица на (цифры представляют количества иммунологических различий в сравнении со стандартом, за который Сарич и Уилсон приняли сывороточный альбумин сенсибилизированного кролика).
Изучение молекул позволяет распутать эволюционный клубок
Метод гибридизации ДНК
Стараясь установить, насколько тесно родство между отдельными видами, ученые разработали для достижения этой цели три основных метода, опирающихся на измерение степени различий в ДНК исследуемых видов, а также в молекулах их белков. Метод гибридизации ДНК основан на исследовании генетического материала — дезоксирибонуклеиновой кислоты — и использует то счастливое обстоятельство, что ее молекулы состоят из двух цепочек, слагающихся из простых соединений. Цепочки закручены одна вокруг другой двойной спиралью и удерживаются в этом положении прочными связями. Методы лабораторных исследований позволяют разорвать связи между цепочками — разделить их, развернув двойную спираль. Если проделать это с ДНК человека и гориллы, а потом соединить одну цепочку ДНК человека с одной цепочкой ДНК гориллы, все химические связи между ними восстановятся, кроме тех мест, где звенья химически различаются. (На рисунке — два пробела там, где связи направлены в противоположные стороны.) Поскольку эти различия отражают мутации (генетические изменения, которые приводят к эволюции), близость родства между человеком и гориллой определяется по числу невосстанавливающихся химических связей. Именно эти различия в ДНК и делают человека человеком, а гориллу гориллой.
Метод сравнения аминокислотной последовательности белков
Второй способ определения эволюционного «расстояния» между двумя видами строится на сравнении белковых молекул, например молекул белков крови. Все белковые молекулы слагаются из одних и тех же кирпичиков — из 20 разных аминокислот, соединяющихся в длинные цепи в разном порядке. Белки человека, мыши и гориллы состоят из одних и тех же аминокислот, но различно расположенных, что и определяет, кто есть кто.
Сложные лабораторные методы позволяют теперь исследовать белковую молекулу от одного ее конца до другого и определять для каждого белка точное расположение 20 аминокислот, повторяющихся вновь и вновь в различных сочетаниях. Например, гемоглобин — белок красных кровяных телец — состоит из цепи, включающей 287 единиц аминокислот, последовательное расположение которых уже установлено для многих животных. Чем больше похожи эти последовательности, тем ближе родство данных животных, чем менее они похожи, тем родство отдаленнее.
У человека и шимпанзе последовательность расположения аминокислот гемоглобина совпадает полностью. Человек и горилла состоят в близком родстве — их гемоглобин имеет только два различия. А вот между гемоглобином человека и лошади имеются 43 различия. На упрощенном рисунке символами обозначено только шесть аминокислот, а не двадцать. Стрелки указывают на точки, где имеются различия.
Иммунологический метод
Анализ аминокислотной последовательности белков при всей его точности трудоемок, поскольку 20 аминокислот дают в белках сотни различных сочетаний. Иммунологический метод позволяет избежать кропотливого определения всей последовательности аминокислот. Он опирается на способность организма вырабатывать антитела для защиты от чужеродных белков, попадающих в кровь. Антитела, реагирующие с белками одного животного, будут реагировать и с белками близкородственных ему видов.
Если взять у человека альбумин, белок кровяной сыворотки, и впрыснуть его кроликам, в их крови начнут вырабатываться антитела, чтобы защитить организм от чужеродного вещества. На рисунке антитела обозначены оранжевым цветом. Сыворотку, содержащую антитела против альбумина человека, можно теперь использовать для измерения степени родства между человеком и различными животными. Смешанная с человеческим сывороточным альбумином, эта сыворотка (справа вверху) даст бурную реакцию, так как кролик выработал ее специально для борьбы с человеческим альбумином (пробирка доверху закрашена голубым цветом).
Альбумин кровяной сыворотки шимпанзе, лишь чуть-чуть отличающийся от человеческого, вызывает почти столь же бурную реакцию. Но сывороточный альбумин лошади очень отличается от человеческого и оказывает на такую кроличью сыворотку очень слабое воздействие.
Эта таблица выявляет несколько поразительных фактов. Она не только подтверждает результаты, полученные другими методами, показывая, что человек очень близок к горилле (только 8 различий), уже не так близок к гиббону (14 различий) и довольно далек от низших обезьян (32 различия), но и показывает, что низшие обезьяны равно удалены от остальных трех сравниваемых приматов. Эта равноудаленность позволяет сделать вывод, что низшие обезьяны разошлись с предком всех этих человекообразных обезьян одновременно и с тех пор темп эволюции альбумина кровяной сыворотки у них всех оставался удивительно постоянным. Другими словами, все они эволюционировали почти с одинаковой скоростью.
Для проверки этого важнейшего момента — скорости эволюции — Сарич и Уилсон вышли за пределы генеалогического древа приматов и сравнили приматов с хищниками. Результаты приведены в правой таблице. Число изменений альбумина кровяной сыворотки тут много выше, что указывает на гораздо большую древность разделения приматов и хищников, чем разделения самих приматов. Удивительно же в этих новых цифрах следующее: если не считать некоторого отклонения у долгопята, они практически совпадают, вновь доказывая, что все эти животные эволюционировали с одной скоростью.
Теперь нужно определить, какова же эта скорость. Ведь если мы сумеем количественно измерить степень эволюционных изменений и скорость, с которой они происходят, мы вернемся к знакомым задачам на время, расстояние и скорость из наших школьных учебников по арифметике. Зная две величины, мы можем вычислить третью. Наконец-то у нас появилась возможность точно измерять время эволюции тех или иных видов и с достаточной уверенностью отмечать места развилок на генеалогическом древе.
Источник
Генетики запутались в том, насколько человек отличается от обезьяны
 Насколько в действительности расходятся геномы человека и шимпанзе? Загадку «одновременного» минимального и максимального отличия ученые решают не первый год.
Насколько в действительности расходятся геномы человека и шимпанзе? Загадку «одновременного» минимального и максимального отличия ученые решают не первый год.
Насколько в действительности расходятся геномы человека и шимпанзе? Ответ далеко неоднозначен.
В 1975 году Мэри-Клэр Кинг и Аллан Уилсон опубликовали в журнале Science статью о генетическом подобии шимпанзе и человека. Но этот материал чаще цитировался для подтверждения «почти полной идентичности» шимпанзе и человека, хотя ученые пытались объяснить, что никто по-настоящему не понимает, как происходила макроэволюция.
Кинг и Уилсон сравнили аминокислотные последовательности нескольких белков шимпанзе и человека (таких как гемоглобин и миоглобин), и обнаружили, что последовательности либо идентичны, либо почти идентичны. «…Последовательности полипептидов шимпанзе и человека, изученные на данный момент, в среднем идентичны более чем на 99%», — сделали вывод эксперты.
По вине читателей, поленившихся дочитать статью до конца, родился «Миф об 1%» генетического различия Homo sapiens и Pan troglodytes, как его позднее назвал Йон Коген в своей статье в Science в 2007-м.
Проводились и прочие исследования, которые подтверждали сходство на 98,5 %. Но это была относительная цифра, поскольку сравнение проводилось только в кодирующих частях ДНК и только среди похожих генов с «заменой единичных оснований». Не брались в рассчет «вставки-удаления» и «повторы» в ДНК, поскольку тогда не представлялось возможным их сравнить. Последующие сравнительные анализы с применением новых технологий позволили уточнить данные.
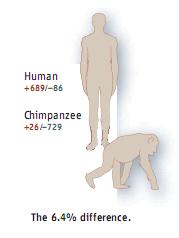 В 2002 году Рой Бриттен, сравнив «вставки-удаления», обнаружил, что они увеличивают генетическое различие еще на 4%. С тех пор мнимая «идентичность» составляла менее 95%.
В 2002 году Рой Бриттен, сравнив «вставки-удаления», обнаружил, что они увеличивают генетическое различие еще на 4%. С тех пор мнимая «идентичность» составляла менее 95%.
Через четыре года другой ученый Мэтью Ханн с коллегами установил, что, «вставки-удаления» добавляют еще больше разницы, чем определил Бриттен — а именно 6,4% (то есть 1418 генов). Итого предполагаемое совпадение уменьшилось до 92-93%.
Ну и наконец, в 2008-м, была предпринята попытка провести сравнительный анализ огромных участков «повторов»(функция которых пока не до конца ясна), в результате которой выяснилось, что абсолютное сходство между ДНК человека и шимпанзе может составлять менее 90%.
Может показаться, что разница между 98% и 95% совсем незначительна, но если учесть, что ДНК человека состоит из 3 млрд пар оснований, тогда разница в 3% составит 90 млн пар оснований.
Добавим, еще несколько лет назад американские ученые установили, что человекообразные обезьяны используют ту же жестикуляцию, что и люди. По их мнению, это подкрепляет предположение о том, что жестикуляция была важной составной частью языка, на котором общались предки человека.
Ученые университета Эмори в Атланте наблюдали за двумя группами из 34 обыкновенных и 13 карликовых шимпанзе. В этих группах обезьян ученые выделили один жест, который покажется знакомым многим людям — вытянутая вперед рука ладонью вверх. Чаще всего шимпанзе таким способом просили друг у друга еду. Но ученые заметили, что этот же жест в ином контексте мог приобрести другой смысл: самец шимпанзе мог точно так же предложить самке секс или предложить другому самцу помириться после драки.
Эта способность менять смысл роднит жесты обезьян с человеческим языком, в котором каждое выражение может приобретать самые разнообразные смыслы в зависимости от контекста.
Обезьяны, как заметили ученые, жестикулируют правой рукой, которую контролирует левое полушарие мозга. В том же полушарии у людей находится центр языка.
rosbalt.ru
Источник
Всего ничего
Люди любят рассматривать фотографии животных. Кошки, собаки, лошади, ламы — все они, особенно детеныши, кажутся нам очень симпатичным. Однако мало кто называет симпатичными или милыми обезьян, особенно высших приматов. Эти звери выглядят как пародия на человека. Явные черты сходства, перемешанные с отчетливо животными признаками, вызывают смешанные чувства.
Человек и обезьяна действительно похожи. На уровне ДНК сходство между Homo sapiens и Pan troglodytes — шимпанзе — превышает 98 процентов. В цифрах эта разница кажется не такой маленькой: из трех миллиардов «букв» человеческого генома целых 60 миллионов являются уникальными для H. sapiens. В данном случае цифры создают ложное представление о пропасти, отделяющей человека от обезьяны. Практически все гены этих двух групп организмов отличаются лишь незначительными вариациями последовательности ДНК.
Ученые до сих пор не могут объяснить, как эти небольшие генетические отличия смогли обеспечить колоссальный эволюционный прыжок от обезьяны к человеку. Первый ответ, который приходит в голову, — последовательности, характерные для H. sapiens, составили в его геноме в особые «гены человечности». Однако на практике эта теория не подтверждается: исследователи не обнаружили у человека уникальных генов. Все гены H. sapiens эволюционировали из генов общего с шимпанзе предка. Авторы нового исследования впервые обнаружили целых три исключения из этого правила.
Эволюция на генном уровне
Прежде чем описывать новое открытие, стоит чуть подробнее рассказать, как именно происходит эволюция генетических последовательностей. Геномы самых первых живых организмов, появившихся на нашей планете, содержали всего несколько сотен генов. Чтобы размножаться, первые жители Земли делили свое тело, состоящее из единственной клетки, надвое. Каждый из потомков получал по одной копии родительского генома. Копирование ДНК «папы» (или «мамы») происходило с ошибками — некоторые гены терялись, а другие, напротив, появлялись в удвоенном варианте. В некоторых случаях «лишние» гены не приводили к смерти хозяина. Они сохранялись в цепочке поколений и постепенно мутировали. Через несколько десятков сотен копирований последовательность таких генов изменялась до неузнаваемости. Соответственно, менялась и последовательность кодируемых генами белков. Постепенно строение живых существ усложнялось, но механизмы образования новых генов оставались неизменными.
В некоторых случая новые гены появлялись без удвоения старых — мутации появлялись и в генах, представленных в единственной копии. Если изменения не ухудшали жизнеспособность организма, они могли сохраняться в череде поколений. В конце концов в гене накапливалось критическое число таких нейтральных или положительных мутаций, и у кодируемого белка появлялись новые функции.
Еще один способ образования новых генов — это потеря части последовательности. Укороченный ген иногда продолжал работать не хуже полноценной копии, кроме того, место утраченных «букв» могли занимать соседние последовательности ДНК. Еще один вариант рождения новых генов — «сращивание» старых друг с другом или их расщепление.
Во всех описанных случаях гены не создаются de novo: основой для них всегда служат уже существующие у организма варианты. Биологи были уверены в этом факте вплоть до 2006 года, когда в журнале Proceedings of the National Academy of Sciences появилась статья группы исследователей, работавших с плодовой мушкой Drosophila melanogaster.
Авторы обнаружили в геноме дрозофилы целых пять генов, которых нет у ее ближайших родственников. Все они образовались из так называемой «мусорной» ДНК (junk DNA). Этим нелицеприятным эпитетом ученые обозначают не кодирующие белки последовательности ДНК, функция которых неизвестна. Термин был предложен в 1972 году американским генетиком японского происхождения Сусуму Оно (Susumu Ohno) и с тех пор прижился. У развитых организмов «мусорная» ДНК составляет более 95 процентов генома.
После выхода «мушиной» работы биологи бросились искать уникальные гены у других организмов. Однако к настоящему моменту их удалось обнаружить только у дрожжей. Тем не менее, авторы нового исследования под руководством Ифы Маклайсэт (Aoife McLysaght) из Тринити колледжа в Дублине задались целью найти новые гены у человека.
Ключи к человечности
Маклайсэт и ее коллеги сравнили геномы H. sapiens и P. troglodytes. Используя специальные программы, они сопоставляли последовательности известных на сегодняшний день генов человека и шимпанзе. Авторы обнаружили в геноме человека 644 гена, не имеющих аналогов у шимпанзе.
Порядок расположения генов у шимпанзе и человека практически не отличается. Исследователи пристально изучили области обезьяньего генома, где могли бы располагаться подозрительные последовательности. В существующих базах данных ДНК P. troglodytes в некоторых из этих мест отсутствовали большие куски кода, поэтому исследователям пришлось исключить из рассмотрения 425 из найденных 644 генов.
На следующей стадии работы ученые провели повторный поиск оставшихся 219 последовательностей в геноме шимпанзе, используя немного иной алгоритм. У 150 предположительно уникальных человеческих генов в геноме P. troglodytes обнаружились аналоги. Таким образом, «круг подозреваемых» сузился до 69 генов. Ученые вычеркнули из этого списка последовательности, которые были обнаружены в геномах других видов, кроме шимпанзе. Наконец, Маклайсэт и ее соавторы отказались от генов, которые были представлены только в одной базе данных человеческой ДНК и могли попасть туда по ошибке.
Все стадии отбора прошли только три гена — CLLU1, C22orf45 и DNAh20OS. Чтобы еще раз убедиться в их уникальности для человека, исследователи проверили геномы макаки, гиббона и гориллы. Последовательности, напоминающие CLLU1, C22orf45 и DNAh20OS, были обнаружены у всех изученных приматов, однако являться полноценными генами они не могли и присутствовали в «мусорной» ДНК.
Для того чтобы считаться геном, последовательность должна содержать определенные сочетания «букв», в частности, отмечающих конец и начало гена. Такие характерные «буквосочетания» узнаются ферментами, отвечающими за синтез белка с этого гена. У макаки, шимпанзе, гиббона и гориллы характерных для генов отличительных признаков не было. Более того, у них имелись участки, мешающие полноценной работе ферментов. Причем у всех приматов (кроме человека) эти участки были одинаковыми.
Исследователи предположили, что в ходе эволюции человека в некоторых регионах «мусорной» ДНК, присутствующих у приматов, накопились необходимые изменения, которые позволили им стать настоящими генами. Именно работа этих генов привела к появлению рода Homo.
Из-за пробелов в генетических базах данных и очень строгих критериев отбора ученые смогли полноценно изучить только 20 процентов из исходно отобранных генов. Соответственно, в будущем, когда дыры будут заполнены, авторы рассчитывают обнаружить еще как минимум 15 уникальных генов. Пока же авторы сосредоточились на поиске белков, кодируемых «человеческими» генами. В работах других исследовательских групп было показано, что белки с этих последовательностей синтезируются, однако какова может быть их функция, на данный момент не совсем ясно. Если Маклайсэт и коллегам удастся это узнать, то человечество, возможно, чуть-чуть приблизится к ответу на вопрос, чем же отличается человек от обезьяны.
О мусоре и РНК
На самом деле, частичный ответ на этот вопрос ученые знают. Результаты множества исследований, посвященных поискам разницы между человеком и обезьяной, указывают, что секрет кроется не в последовательности белков, а в регуляции их работы. Причем контролировать работу человеческого генома и белков могут не только регуляторные белки, но также особые молекулы РНК. Кодирующие эти молекулы гены также расположены в «мусорной» ДНК. Так что и мусор иногда бывает полезен.
Источник
Возможна ли жизнь без гемоглобина?
В декабре 1927 года норвежский зоолог Дитлев Рустад в 1750 километрах от побережья Антарктиды обнаружил очень странную рыбу с прозрачным телом и молочно-белыми жабрами. Когда Рустад вскрыл рыбу, он обнаружил, что ее кровь была бесцветной, как стекло. Так в его дневнике появилась запись «бесцветная кровь»…
Зачем нужен гемоглобин?
Практически всем видам позвоночных животных для транспорта кислорода к тканям необходима специальная система доставки, поскольку молекулярный кислород плохо растворим в воде: в 1 л плазмы крови растворяется всего лишь 3,2 мл О2. Содержащийся в эритроцитах позвоночных белок гемоглобин (Hb, рис. 1) способен связать в 70 раз больше — 220 мл О2/л. Содержание Hb в крови человека варьирует в пределах 120-180 г/л, что вдвое выше, чем концентрация белков плазмы (50-80 г/л). Поэтому гемоглобин вносит наибольший вклад в поддержание рН-буферной емкости крови. По своей структуре гемоглобин взрослого человека (HbA) является тетрамером, состоящим из двух α- и двух β-субьединиц с молекулярными массами около 16 кДа. α- и β-цепи отличаются аминокислотной последовательностью, но имеют сходную конформацию.
Рисунок 1. Молекула гемоглобина. Гемоглобин является одним из наиболее хорошо изученных белков. Он был открыт немецким физиологом Отто Функе в 1851 году, а структуру этого белка описал австрийский молекулярный биолог Макс Перутц в 1959 году, за что тремя годами позднее получил Нобелевскую премию по химии [1].
Visual Science
Рисунок 2. Насыщение гемоглобина и миоглобина кислородом
Каждая субъединица гемоглобина несет группу гема с ионом двухвалентного железа в центре. При связывании O2 с атомом железа в геме (оксигенация Hb) и отщеплении O2 (дезоксигенация) степень окисления атома железа не меняется. Окисление Fe2+ до Fe3+ в геме носит случайный характер. Окисленная форма гемоглобина — метгемоглобин — не способна переносить O2. Доля метгемоглобина поддерживается ферментами на низком уровне и составляет 1-2% [2]. Центры связывания O2 на каждой из четырёх субъединиц действуют кооперативно: когда молекула O2 связывается с одним из них, у других возрастает сродство к кислороду (данное явление называют положительной кооперативностью) [3]. Вследствие этого кривая насыщения гемоглобина кислородом имеет ярко выраженный сигмоидальный характер (рис. 2, кривая 2).
Другой мышечный белок — миоглобин, являющийся эволюционным предшественником гемоглобина, — является мономером и содержит единственный центр связывания O2, из-за чего его кривая насыщения кислородом несигмоидальна (рис. 2, кривая 1). Сродство к кислороду у миоглобина примерно в 13 раз выше, чем у гемоглобина (50%-насыщение миоглобина O2 достигается уже при парциальном давлении кислорода в 1-2 мм рт. ст., в то время как для гемоглобина эта цифра равна 26 мм рт. ст.) [4]. Из-за этого гемоглобин способен эффективно отдавать кислород в тканях и является более эффективным переносчиком, чем миоглобин. Но из этого не следует, что миоглобин малоэффективный и плохо устроенный белок, поскольку он выполняет принципиально иную биологическую функцию — запасание кислорода и обеспечение им митохондрий. Данные адаптивные различия между миоглобином и гемоглобином появились в результате миллионов лет эволюции…
Прозрачные рыбы
В 1927 году экспедицией норвежских китобоев близ острова Буве во время очередной промысловой охоты была поднята на сушу невиданная рыба, практически бесцветная и, самое интересное, с прозрачной («стеклянной») кровью. Это был первый обнаруженный вид позвоночных, не содержащих белка гемоглобина. За счет поразительного сходства головы рыбы с головой крокодила, рыбу назвали крокодиловая белокровка (Chaenocephalus aceratus). Белокровки (Channichthyidae; рис. 3) или ледяные рыбы обитают в холодных водах возле Антарктиды и южного побережья Южной Америки. Температура воды в этих краях опускается аж до −1,9 °C (температура замерзания морской воды ниже, чем пресной), причем является довольно постоянной.
Рисунок 3. Некоторые представители белокровок. а — Chaenodraco wilsoni. б — Chaenocephalus aceratus. в — Champsocephalus gunnari. г — Cryodraco atkinsoni. Белокровки (Channichthyidae) — семейство из отряда Окунеобразные (Perciformes), в котором описано 16 видов. Данные рыбы питаются крилем, рачками и другими рыбами. Недавние исследования показали, что рацион этих рыб различается в зависимости от возраста. В целом, в рационе преобладает антарктический криль (Euphausia superba) и равноногие рачки (Themisto gaudichaudii). В рационе молодых особей преобладает Т. gaudichaudii и эвфаузииды (Thyanoessa sp.), а доля антарктического криля меньше. Ледяные рыбы достигают общей длины 25-75 см. Они являются пелагиальными представителями антарктических вод, обитают на глубине от 200 до 700 метров. Некоторые подвиды C. aceratus обнаруживаются в районе 1-2 тыс. метров. Белокровки — доминирующий вид в Антарктиде, полностью лишенный плавательного пузыря, в связи с чем многие виды этих рыб являются донными.
Очень немногие рыбы могут выжить в суровых условиях Антарктики. Ледяная рыба выживает за счет специального антифриза, присутствующего в крови и предотвращающего образование кристаллов льда в организме. Этот антифриз (AFGP, antifreeze glycoprotein) представляет собой гликопротеин, предположительно произошедший от панкреатической трипсиногеноподобной протеазы [9]. AFGP способен связываться с микроскопическими кристалликами льда и предотвращать их рост [10].
Ледяные рыбы имеют очень низкий уровень метаболизма и проводят большую часть времени практически неподвижно. Белокровки обитают в богатой кислородом воде и поглощают его непосредственно через кожу [11], потому что при пониженных температурах кровь, содержащая гемоглобин, становится очень вязкой, и выживание с такой кровью было бы весьма проблематично.
Отсутствие гемоглобина компенсируется модификацией сердечнососудистой системы. Все представители ледяных рыб имеют большее сердце, чем у других рыб такого же размера, а это увеличивает ударный объем, в несколько раз повышает общее количество циркулирующей крови и поднимает скорость кровотока. При низком артериальном давлении это достигается за счет снижения системного сопротивления потоку. Сочетание высокой пропускной способности сердечнососудистой системы, высокого содержания кислорода и относительно низких скоростей метаболизма ледяной рыбы позволяет обеспечить достаточное количество кислорода в тканях [12].
Гемоглобиновая потеря
Белокровки пережили потерю генов гемоглобина достаточно давно. Как показывает молекулярный анализ, почти у всех ледяных рыб одна мутация привела к потере гена, кодирующего β-цепь и часть α-цепи гемоглобина. Потеря способности к синтезу гемоглобина вызвала развитие компенсаторных изменений: увеличился объем сердца и общий объем крови (приблизительно в 3.5 раза по сравнению с костистыми рыбами аналогичного размера) [13-15]. Ученые, проанализировав ДНК представителей нототениевых рыб, пришли к выводу, что только у одного вида белокровок (Neopagetopsis iona) присутствуют гены гемоглобина, но они не являются функциональными [16].
Наряду с гемоглобином, у белокровок отсутствует и миоглобин, переносящий кислород в скелетных мышцах. При этом у десяти видов миоглобин сохранился только в сердечной мышце (в частности, в желудочке) [17], а у шести видов миоглобин был утрачен и там, причем механизм утраты гена у каждого вида индивидуален [18]. Общим механизмом подобной утраты является дупликация коротких (5-25-нуклеотидных) фрагментов, приводящая к сдвигу рамки считывания, преждевременной терминации транскрипции, появлению ложного сигнала полиаденилирования или нарушению связывания РНК-полимеразы с промоторной областью ДНК [19], [20].
Утрата гемоглобина первоначально должна была стать адаптацией к холоду: известно, что растворимость кислорода в холодной воде выше [21], а значит, потребность в гемоглобине, напротив, меньше. Отсутствие эритроцитов также снижает вязкость крови, что особенно критично в условиях экстремально низкой температуры. В процессе эволюции у белокровок произошли довольно радикальные изменения, компенсирующие утрату гемоглобина, включая вдвое большие энергозатраты по перекачке крови по сравнению с другими рыбами [22].
Ледяные рыбы произошли от малоподвижного донного предка. В холодных, хорошо перемешиваемых, богатых кислородом антарктических водах рыбы с низкой скоростью метаболизма могут выжить даже без гемоглобина. В середине третичного периода экологический кризис в Южном океане, вызванный похолоданием [23], привел к появлению обширных пустующих экологических ниш. Отсутствие конкуренции позволило мутантам, не имеющим гемоглобина, оставить после себя потомство, которое заселило пустые места обитания. У детенышей развились механизмы компенсации мутаций. В относительно изолированных фьордах образовались места обитания, которые колонизировали несколько особей, что привело к возникновению шести видов рыб, изолированных друг от друга и независимо потерявших гены глобинов [22].
Гистологически показано, что особенностью ледяных рыб является высокий объем митохондрий при сходном их количестве и высокое отношение липид/белок в митохондриальных мембранах в сравнении с близкородственными видами семейства нототениевых рыб (рис. 4). Интересно, что у белокровок, у которых отсутствует миоглобин в скелетной мускулатуре, но присутствует в сердечной, объем митохондрий в скелетных мышцах существенно выше, чем в миокарде. О молекулярных механизмах этого феномена известно довольно мало. Предположительно, это явление связанно с одним из ключевых белков-регуляторов биогенеза митохондрий PGC-1α [23].
Рисунок 4. Поперечный разрез миоцитов желудочков сердца (C. aceratus). Большие митохондрии (Mt) по периферии окружены миофибриллами (My).
Регулятором биогенеза мембран митохондрий у белокровок является оксид азота-II (NO) (рис. 5). По сравнению с другими рыбами, у белокровок наблюдается повышенное содержание этого сигнального агента в крови. В ответ на потерю гемоглобина и миоглобина в мышцах ледяных рыб увеличивается биосинтез фосфолипидов, причем, независимо от синтеза митохондриальных белков и репликации митохондриальной ДНК, это приводит к увеличению размера митохондрий. Молекула NO стимулирует образование PGC-1α, который регулирует репликацию митохондриальной ДНК. Но ничего не известно о том, как биосинтез митохондриальных фосфолипидов интегрирован в этот процесс у ледяных рыб; возможно, это индуцируется высоким уровнем NO (темная стрелка на рисунке) [18].
Рисунок 5. Процесс биогенеза митохондрий у ледяных рыб. Образование митохондрий включает в себя синтез митохондриальных белков (синие точки), фосфолипидов и репликацию митохондриального генома (зеленые кружки). В ответ на стимулы, такие как понижение температуры (или повышение физической нагрузки у млекопитающих) эти три компонента митохондриального биогенеза согласованно активируется, что приводит к увеличению плотности митохондрий.
Заключение
Безусловно, гемоглобин — жизненно важный белок, на котором основано дыхание большинства организмов. Эволюция гемоглобина происходила миллионы лет, но в специфических условиях Антарктики (холодная вода, обогащенная кислородом) адаптивные преимущества могут достигаться за счет эволюционной утраты гемоглобина (дезадаптация). Ледяные рыбы являются одной из ярких иллюстраций того, как гены, которые считаются абсолютно необходимыми для жизни позвоночных, в определенных условиях могут редуцироваться, обеспечивая выживание вида. Причудливы пути эволюции.
- Макс Перутц. «Наука и техника»;
- Кольман Я., Рём К.-Г., Вирт Ю. Наглядная биохимия. М.: «Мир», 2000. — 469 с.;
- Ленинджер А. Основы биохимии. М.: «Мир», 1985. — 369 с.;
- Проссер Л. Сравнительная физиология животных. М.: «Мир», 1977. — 574 с.;
- Tate R.C. Fishes. London: ed by order of the trustees of the British Museum, 1914;
- Tate R.C. Antarctic fishes of the Scottish National Antarctic expedition. Edinburg: Robert Grant & Son, Williams & Norgate, 1913;
- Champsocephalus gunnari. Encyclopedia of life;
- Википедия: Белокровные рыбы;
- Chi-Hing C. Cheng, Liangbiao Chen. (1999). Evolution of an antifreeze glycoprotein. Nature. 401, 443-444;
- J. A. Raymond, A. L. DeVries. (1977). Adsorption inhibition as a mechanism of freezing resistance in polar fishes.. Proceedings of the National Academy of Sciences. 74, 2589-2593;
- C.-H Christina Cheng, H William Detrich. (2007). Molecular ecophysiology of Antarctic notothenioid fishes. Philosophical Transactions of the Royal Society B: Biological Sciences. 362, 2215-2232;
- Karl-Hermann Kock. (2005). Antarctic icefishes (Channichthyidae): a unique family of fishes. A review, Part I. Polar Biol. 28, 862-895;
- Yuqiong Zhao, Manoja Ratnayake-Lecamwasam, Sandra K. Parker, Ennio Cocca, Laura Camardella, et. al.. (1998). The Major Adult α-Globin Gene of Antarctic Teleosts and Its Remnants in the Hemoglobinless Icefishes. J. Biol. Chem.. 273, 14745-14752;
- Guido di Prisco, Ennio Cocca, Sandra K Parker, H.William Detrich. (2002). Tracking the evolutionary loss of hemoglobin expression by the white-blooded Antarctic icefishes. Gene. 295, 185-191;
- Guido di Prisco, Joseph T. Eastman, Daniela Giordano, Elio Parisi, Cinzia Verde. (2007). Biogeography and adaptation of Notothenioid fish: Hemoglobin and globin-gene evolution. Gene. 398, 143-155;
- T. J. Near. (2006). A Genomic Fossil Reveals Key Steps in Hemoglobin Loss by the Antarctic Icefishes. Molecular Biology and Evolution. 23, 2008-2016;
- B. D. Sidell, M. E. Vayda, D. J. Small, T. J. Moylan, R. L. Londraville, et. al.. (1997). Variable expression of myoglobin among the hemoglobinless Antarctic icefishes. Proceedings of the National Academy of Sciences. 94, 3420-3424;
- K. M. O’Brien, I. A. Mueller. (2010). The Unique Mitochondrial Form and of Antarctic Channichthyid Icefishes. Integrative and Comparative Biology. 50, 993-1008;
- D. J. Small. (2003). The myoglobin gene of the Antarctic icefish, Chaenocephalus aceratus, contains a duplicated TATAAAA sequence that interferes with transcription. Journal of Experimental Biology. 206, 131-139;
- B. D. Sidell. (2006). When bad things happen to good fish: the loss of hemoglobin and myoglobin expression in Antarctic icefishes. Journal of Experimental Biology. 209, 1791-1802;
- L. Bargelloni, S. Marcato, T. Patarnello. (1998). Antarctic fish hemoglobins: Evidence for adaptive evolution at subzero temperature. Proceedings of the National Academy of Sciences. 95, 8670-8675;
- Daniela Giordano, Ignacio Boron, Stefania Abbruzzetti, Wendy Van Leuven, Francesco P. Nicoletti, et. al.. (2012). Biophysical Characterisation of Neuroglobin of the Icefish, a Natural Knockout for Hemoglobin and Myoglobin. Comparison with Human Neuroglobin. PLoS ONE. 7, e44508;
- M. R. Urschel, K. M. O’Brien. (2008). High mitochondrial densities in the hearts of Antarctic icefishes are maintained by an increase in mitochondrial size rather than mitochondrial biogenesis. Journal of Experimental Biology. 211, 2638-2646;
- F. Garofalo, D. Pellegrino, D. Amelio, B. Tota. (2009). The Antarctic hemoglobinless icefish, fifty five years later: A unique cardiocirculatory interplay of disaptation and phenotypic plasticity. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 154, 10-28;
- S. Austin, J. St-Pierre. (2012). PGC1 and mitochondrial bolism — emerging concepts and relevance in ageing and neurodegenerative disorders. Journal of Cell Science. 125, 4963-4971.
Источник