Гемоглобин дыхательна функция крови
Содержание статьи
Гемоглобин
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1,34 мл кислорода.
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130-160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120-160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1-3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145-225 г/л, а к 3-6 месяцам снижается до минимального уровня — 95-135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110-155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4 субъединиц влияют на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии. Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный гемоглобин
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167-175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; van Holde, KE & Ahern, KG (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & Chothia, C (1976), Structural patterns in globular proteins, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). «An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure». Am Heart J. 151 (1): 91.e1-91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). «Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds». J Mol Biol. 356 (2): 335-53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). «Evolution of Hemoglobin and Its Genes». Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
Источник
1. Роль гемоглобина в дыхательной функции крови
Без красного пигмента крови-гемоглобина, способного связывать O2 в легких и отдавать его тканям в тканевых капиллярах, кровь не могла бы осуществлять свою дыхательную функцию. Способность связывать кислород выражена у гемоглобина высших животных в большей степени, чем у других переносящих кислород пигментов, например хлоркруорина, гемоэритрина, гемоцианина беспозвоночных.
Гемоглобин (НЬ) представляет собой сложный белок с молекулярным весом ~ 65 000-66000. Он состоит из белковой части глобина (96%) и небелкового компонента- гема (4%). В состав глобина входят 4 полипептидных цепи, каждая из которых связана с гемом. Гемом называют протопорфирин (IX), в котором два водорода (II и IV пиррольного кольца) замещены одним атомом двухвалентного железа. Каждый из 4 атомов железа гемоглобина, в зависимости от парциального давления кислорода, может присоединять или отдавать в окружающее пространство одну молекулу кислорода.
Следовательно, молекула гемоглобина, в составе которой имеется четыре гема, способна связывать при максимальном насыщении кислородом четыре молекулы O2. Гемоглобин человека содержит 0,335% железа. Если учесть, что 1 грамм-молекула любого газа при р=760 мм рт. ст. и температуре 0° С занимает объем 22,4 л, то отсюда легко рассчитать кислородную емкость гемоглобина: 55,84 г Fe (атомный вес Fe) гемоглобина присоединяют 22,4 л O2. Следовательно, 0,335 г Fe или 100 г гемоглобина должны связывать: (0,335-22400) : 55,84= 134 мл O2, т. е. 1 г НЬ связывает до 1,34 мл O2. Содержание гемоглобина в крови здорового человека обычно колеблется в пределах 13- 16%, т. е. в 100 мл крови находится 13-16 г НЬ.
При парциальном давлении кислорода (p0z) в артериальной крови около 80 мм рт. ст. гемоглобин насыщается кислородом на 96%. Следовательно, 100 г НЬ присоединяют в этих условиях 134 мл О2, а 15 г Hb свяжут
мл О2, а 15 г Hb свяжут или
или  19 мл О2.
19 мл О2.
В венозной крови при покое при рО2=40 мм рт. ст. гемоглобин насыщен кислородом лишь на 70-72,5%. Таким образом, содержание кислорода в венозной крови не превышает (15-134-70) : 10000=14,1 об. %, т. е. ~ 14 об. %. Артерио-венозная разница в данном случае равняется 5 об.% (19 об.%- 14об.%=5об.%).
Однако не следует забывать, что в зависимости от содержания НЬ в крови артерио-венозная разница может колебаться в пределах от 5 до 6,5 об.% O2. Итак, за 1 мин ткани в состоянии покоя получают: (через сердце в состоянии покоя протекает около 4 л крови в минуту) ~200 мл О2. Это количество кислорода в указанных условиях вполне достаточно для нормальной жизнедеятельности организма.
(через сердце в состоянии покоя протекает около 4 л крови в минуту) ~200 мл О2. Это количество кислорода в указанных условиях вполне достаточно для нормальной жизнедеятельности организма.
Возрастание интенсивности окислительных процессов, например при усиленной мышечной работе, всегда связано с более полным извлечением кислорода из крови, протекающей по тканевым капилляром. Кроме того, мышечная деятельность сопровождается повышением температуры в усиленно работающих органах и выведением в кровь кислореагирующих продуктов обмена. Это имеет весьма важное значение, так как характер кривой диссоциации оксигемоглобина зависит от рН и температуры. Чем ниже рН и чем выше температура крови, тем больше кривая диссоциации оксигемоглобина сдвинута вправо, т. е. тем легче НЬО2 отдает кислород жадно поглощающим его тканям.
Насыщение гемоглобина кислородом при усиленной мышечной работе в тканевых капиллярах в силу указанных причин может снизиться примерно до 30-32,5%. Следовательно, содержание кислорода в венозной крови в этих условиях падает до 6-6,5 об % (100 г НЬ связывают 134 мл О2, а 15 г Hb
мл О2, а 15 г Hb  об. %), а артерио-венозная разница повышается до 13,5-14 об.%.
об. %), а артерио-венозная разница повышается до 13,5-14 об.%.
Если учесть, «что при тяжелой физической нагрузке скорость кровотока резко возрастает, то становится понятным, что количество доставляемого тканям кислорода при работе может в несколько раз превысить величину, характеризующую потребность в кислороде при покое (200 мл). Считается, что при тяжелой нагрузке организм человека получает до 1250- 2000 и более мл O2в минуту.
Однако и этого количества кислорода часто оказывается недостаточно для покрытия потребности в кислороде энергично дышащих тканей. В таких случаях развивается кислородная задолженность; потребление кислорода остается высоким в течение некоторого времени и после окончания физической работы.
Зависимость между степенью насыщения гемоглобина кислородом и парциальным давлением кислорода (рО2) можно изобразить в графической форме. Кривая, отражающая эту зависимость, называется кривой насыщения гемоглобина кислородом или кривой диссоциации оксигемоглобина.
Как уже указывалось, кривая насыщения кислородом гемоглобина, входящего в состав эритроцитов, имеет S-образную форму. Такая форма кривой диссоциации оксигемоглобина соответствует оптимальным условиям насыщения гемоглобина кислородом в легочных капиллярах и освобождения кислорода в тканевых капиллярах. При этом важно, что в тканевых капиллярах рО2 (~40 мм рт. ст.) остается еще достаточно высоким, чтобы обеспечить возможность быстрой диффузии кислорода из капилляров в ткани и клетки. Чем выше рО2 в капиллярах, тем легче кислород диффундирует в клетки. При РО2<5 мм рт. ст. клетки теряют способность извлекать из Окружающей их жидкой среды кислород.
S-образный ход кривой диссоциации оксигемоглобина обусловлен взаимным влиянием субъединиц гемоглобина на их способность связывать и отдавать кислород. Это так называем мое «гем-гем» взаимодействие, по-видимому, обусловлено возникающими при связывании кислорода гемом конформационными изменениями попарно отличающихся полипептидных цепей (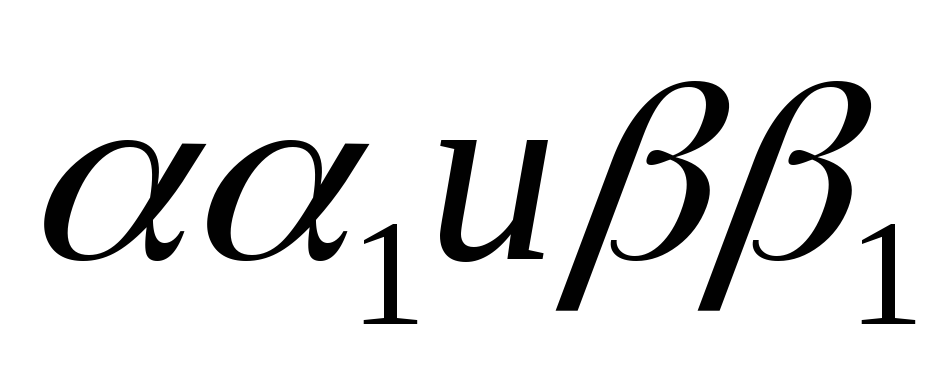 ) молекулы гемоглобина. Интересно, что у больных талассемией (анемия Кули, врожденная семейная гемолитическая анемия) кривая диссоциация НЬО2 имеет не S-образную, а приближающую к гиперболической форме (как у миоглобина). Это изменение характера кривой насыщения гемоглобина при талассемии, по-видимому, обусловлено идентичностью структуры в патологическом гемоглобине, на долю которого при данном заболевании приходится до 40% всего Hb, всех четырех полипептидных b-цепей.
) молекулы гемоглобина. Интересно, что у больных талассемией (анемия Кули, врожденная семейная гемолитическая анемия) кривая диссоциация НЬО2 имеет не S-образную, а приближающую к гиперболической форме (как у миоглобина). Это изменение характера кривой насыщения гемоглобина при талассемии, по-видимому, обусловлено идентичностью структуры в патологическом гемоглобине, на долю которого при данном заболевании приходится до 40% всего Hb, всех четырех полипептидных b-цепей.
S-образная форма кривой насыщения гемоглобина кислородом имеет большое физиологическое значение. При такой форме обеспечивается возможность насыщения крови кислородом при изменении рО2 в довольно широких пределах. Дыхательная функция существенно не нарушается, например, при снижении рО2 во вдыхаемом воздухе с 100 до 60-70 мм рт. ст. Поэтому подъем на высоту до 3-3,5 км обычно не сопровождается развитием выраженной гипоксемии.
На больших высотах, например 5-6 км, парциальное давление кислорода во вдыхаемом воздухе падает ниже 50 мм рт. ст. (рО2 в артериальной крови снижается еще сильнее), степень насыщения крови кислородом оказывается уже недостаточной, и развивается состояние гипоксии.
В состоянии кислородной задолженности и гипоксемии любого происхождения организм вынужден частично переключаться на анаэробный тип обмена (гликолиз и гликогенолиз). Поэтому при тяжелой физической работе и гипоксемиях содержание молочной кислоты в крови обычно повышается.
Следует указать, что в момент сокращения мышц (особенно мышц сердца) кровь выдавливается из сосудов, что затрудняет доставку кислорода к клеткам. Этот неблагоприятный фактор снабжения мышц O2 в значительной степени компенсируется наличием в волокнах скелетной и сердечной мускулатуры особого пигмента — миоглобина, способного подобно гемоглобину связывать кислород. По своему строению он близок к гемоглобину. Различие заключается в том, что молекула гемоглобина состоит из четырех субъединиц полипептидных цепей, а миоглобина-из одной; каждая молекула миоглобина может связывать лишь одну молекулу О2.
Кривая насыщения кислородом миоглобина имеет вид гиперболической кривой (в отличие от S-образной у гемоглобина), что обусловлено отсутствием у миоглобина характерного для гемоглобина «гем-гем взаимодействия».
Сродство к кислороду у миоглобина настолько велико, что кровь тканевых капилляров, парциальное давление О2 в которой не превышает40 мм рт. ст., приходя в соприкосновение с миоглобином, насыщает его кислородом на 95%. Даже при рО2=20 мм насыщение миоглобина достигает 85%. Понятно, что миоглобин, в отличие от гемоглобина, не пригоден для осуществления транспорта кислорода. У человека скелетные (поперечнополосатые) мышцы содержат около 1,5% миоглобина (в расчете на сухой вес ткани), сердечная мышца-2,7% и гладкая мускулатура матки-0,8%.
Таким образом, в мышцах тела человека некоторое количество кислорода всегда находится в связанной с миоглобином форме. Оно особенно велико в мышцах морских животных, проводящих часть своей жизни под водой (кит, дельфин).
Источник