Гемоглобин и цитохромы представители
Содержание статьи
Структура и функции сложных белков. Строение и функции миоглобина и гемоглобина.
Тема: «СТРОЕНИЕ И ФУНКЦИИ СЛОЖНЫХ БЕЛКОВ. СТРУКТУРА И ФУНКЦИИ МИОГЛОБИНА И ГЕМОГЛОБИНА»
1. Определение понятия и основные принципы классификации сложных белков. Примеры.
2. Гликопротеины: особенности строения, примеры, функции. Иммуноглобулины: особенности строения, классы иммуноглобулинов, их роль в организме.
3. Фосфопротеины: представители, связывание простетической группы с апопротеином, роль в организме.
4. Металлопротеины: представители, характер простетической группы, ее связывание с апопротеином, роль металлопротеинов в организме.
5. Строение и функции хромопротеинов (на примере миоглобина и гемоглобина). Аллостерические свойства гемоглобина. Кооперативный эффект. Роль СО2, водородных ионов и 2,3-дифосфоглицерата в регуляции сродства гемоглобина к кислороду.
6. Производные гемоглобина (дезоксигемоглобин, оксигемоглобин, карбгемоглобин, карбоксигемоглобин, метгемоглобин, цианметгемоглобин), их характеристика. Причины и последствия накопления метгемоглобина в крови.
7. Молекулярные формы гемоглобина. Фетальный гемоглобин, особенности структуры, свойства, биологическая роль. Серповидно-клеточный гемоглобин (HbS), особенности структуры, свойства, проявления гемоглобиноза S.
| Раздел 3.1 | Понятие о простых и сложных белках. Классификация сложных белков. | |||||||||||||||||||||
3.1.1. Запомните, что белки можно разделить на простые и сложные. Простые белки — белки, которые состоят только из аминокислотных остатков. Сложные белки (холопротеины) — белки, которые состоят из аминокислотных остатков и компонентов небелковой природы. Белковая часть сложного белка получила название апопротеин, небелковая часть сложного белка — простетическая группа. 3.1.2. Сложные белки классифицируют в зависимости от химического строения их простетических групп. Выучите названия классов сложных белков, их простетических групп и примеры представителей различных классов сложных белков (таблица 3.1) .
В этом разделе мы более подробно коснёмся строения и свойств хромопротеинов и нуклеопротеинов. Характеристика белков — представителей других классов будет рассмотрена позднее. | ||||||||||||||||||||||
| Раздел 3.2 | Особенности строения и биологическая роль липопротеинов, нуклеопротеинов, фосфопротеинов, металлопротеинов. |
3.2.1. Липопротеины – сложные белки, содержащие в качестве простетической группы липиды и их производные. Представителями служат хиломикроны и другие фракции липопротеинов крови. Липопротеины являются транспортными формами липидов в крови. Более подробно этот класс сложных белков рассматривается в разделе «Обмен липидов». 3.2.2. Нуклеопротеины – сложные белки, содержащие в качестве простетической группы нуклеиновые кислоты. Нуклеопротеинами являются вирусы, рибосомы, хроматин клеточного ядра. Существуют две разновидности нуклеопротеинов: 1) рибонуклеопротеины, в состав которых входит рибонуклеиновая кислота (РНК); 2) дезоксирибонуклеопротеины, в состав которых входит дезоксирибонуклеиновая кислота (ДНК). Строение и свойства нуклеиновых кислот будут рассматриваться позднее. Особенность белковой части нуклеопротеинов заключается в том, что в её состав входит много положительно заряженных аминокислотных остатков. Так, в состав дезоксирибонуклеопротеинов входят белки гистоны, богатые лизином и аргинином. Между белковыми и небелковыми компонентами нуклеопротеинов образуются ионные связи (так как нуклеиновые кислоты заряжены отрицательно). 3.2.3. Фосфопротеины содержат в своём составе остатки фосфорной кислоты, соединённые с остатками гидроксиаминокислот (серин, треонин) при помощи сложноэфирных связей. К этой группе сложных белков относятся казеиноген молока, яичные белки овальбумин и вителлин. Многие внутриклеточные белки являются фосфопротеинами. Присоединение фосфатной группы к белку часто вызывает изменение его функции. Фосфорилирование и обратный процесс – дефосфорилирование – распространенный механизм регуляции биологической активности белков. Например, фосфорилирование гистонов снижает их способность связываться с ДНК и участвовать в регуляции матричных синтезов с участием ДНК. 3.2.4. Металлопротеины. Если в белке содержатся ионы одного или нескольких металлов, то такие белки называются металлопротеинами. Ионы металлов соединены координационными связями с функциональными группами белка и участвуют в поддержании его пространственной структуры. Металлопротеины часто являются ферментами. Трансферрин – водорастворимый железопротеин, содержащийся в сыворотке крови в составе β-глобулинов. Молекула трансферрина содержит 2 иона Fe3+; этот белок служит переносчиком железа в организме. Ферритин – внутриклеточный глобулярный белок, содержится главным образом в селезенке, печени, костном мозге, выполняя роль депо железа в организме. Благодаря ферритину цитозольные запасы железа поддерживаются в растворимой и нетоксичной форме. Гемосидерин, в отличие от ферритина и трансферрина, является водонерастворимым железосодержащим белковым комплексом. Он содержится главным образом в клетках печени и селезенки, накапливается при избытке железа в организме, например, при частых переливаниях крови. Церулоплазмин – белок α2-глобулиновой фракции сыворотки крови, его молекула содержит 6 – 8 ионов меди. Обладает каталитической активностью, катализирует реакцию окисления Fe2+ в Fe3+. Это делает возможным связывание железа с трансферрином и его последующий транспорт в крови. | |
| Раздел 3.3 | Строение и функции гликопротеинов. Иммуноглобулины. |
3.3.1. Гликопротеины – содержат в качестве простетической группы углеводы и их производные. Они присоединяются либо N-гликозидной связью к амидогруппе остатка аспарагина, либо О-гликозидной связью к гидроксигруппе остатка серина или треонина. Углеводная часть имеет нерегулярное строение. Гликопротеины выполняют в организме следующие функции: структурную (коллаген, эластин), защитную (антитела, интерфероны), рецепторную, гормональную (гормоны гипофиза), ферментативную, транспортную. 3.3.2. Иммуноглобулины (антитела) — группа белков, вырабатываемых организмом в ответ на попадание в организм чужеродных структур (антигенов). Они синтезируются В-лимфоцитами или плазматическими клетками. В организме может вырабатываться порядка 107 разновидностей иммуноглобулинов, каждый из которых может распознавать определённый антиген. Все иммуноглобулины подразделяют на пять классов: IgA, IgG, IgM, IgD, IgE. Основную структурную единицу иммуноглобулинов, или мономер, образуют четыре полипептидные цепи, соединённые между собой дисульфидными связями, из них: а) две идентичные тяжёлые цепи (молекулярная масса 53000 — 75000 Да), обозначаемые буквами Н; б) две идентичные лёгкие цепи (молекулярная масса около 23000 Да), обозначаемые буквами L. Иммуноглобулины G, D и Е по своей структуре, как правило, являются мономерами, молекулы IgM построены из пяти мономеров, IgA могут быть как мономерами, так и состоять из двух и более структурных единиц. Белковые цепи, входящие в состав иммуноглобулинов, можно условно разделить на специфические домены, или области, имеющие определённые структурные и функциональные особенности. N-концевые участки как L-, так и Н-цепей называются вариабельной областью (V), так как их структура характеризуется существенными различиями у разных классов антител. Внутри вариабельного домена имеются 3 гипервариабельных участка, отличающихся наибольшим разнообразием аминокислотной последовательности. Именно вариабельная область антител ответственна за связывание антигенов по принципу комплементарности; первичная структура белковых цепей в этой области определяет специфичность антител. | |
С-концевые домены Н- и L-цепей обладают относительно постоянной первичной структурой в пределах каждого класса антител и называются константной областью (С). Константная область определяет свойства различных классов иммуноглобулинов, их распределение в организме, может принимать участие в запуске механизмов, вызывающих уничтожение антигенов.
3.3.3. Функции иммуноглобулинов. IgG составляют около 75% общего количества иммуноглобулинов плазмы крови. IgG эффективно связывают и инактивируют чужеродные молекулы и клетки, попавшие в организм, а также облегчают их дальнейшее уничтожение, способны преодолевать плацентарный барьер, что обеспечивает иммунитет новорождённых в течение первых недель жизни.
IgA содержатся главным образом в секретах слизистых оболочек дыхательных и выделительных путей, желудочно-кишечного тракта, т.е. обеспечивают защиту поверхностей, сообщающихся с внешней средой.
IgM синтезируются на ранних стадиях иммунного ответа, вступают в реакцию агглютинации с антигенами, активируют систему комплемента.
IgD связаны с мембраной лимфоцитов, функционируют в качестве рецепторов для антигенов.
IgE участвуют в развитии аллергических реакций, в защите от паразитарных инвазий.
| Раздел 3.4 | Миоглобин и гемоглобин: сходство и различия структуры и функции. |
| 3.4.1. Среди хромопротеинов различают гемопротеины (содержат в качестве простетической группы порфириновые производные) и флавопротеины (содержат производные рибофлавина — витамина B2). Хромопротеины участвуют в осуществлении многих жизненно важных функций, таких как тканевое дыхание, перенос кислорода, окислительно-восстановительные реакции, светоощущение, фотосинтез в растительных клетках и другие процессы. 3.4.2. К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем.
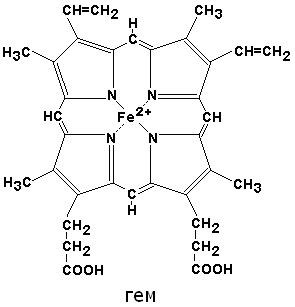
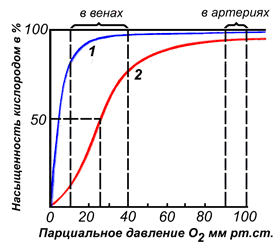
По своему химическому строению гем представляет собой протопорфирин IX, связанный с двухвалентным железом. Протопорфирин IX — органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН—. Заместителями в пиррольных кольцах являются: четыре метильные группы СН3—, две винильные группы СН2=СН— и два остатка пропионовой кислоты — СН2—СН2—СООН. Гем соединяется с белковой частью следующим образом. Неполярные группы . протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов. Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет). 3.4.3. Сравните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков. Миоглобин — хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами (см. 2.4.), кривая насыщения его кислородом имеет вид гиперболы (рисунок 4). Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода. Гемоглобин (Hb) — хромопротеин, присутствующий в эритроцитах и участвующий в транспорте кислорода к тканям. Гемоглобин взрослых людей называется гемоглобином А (Hb A). Молекулярная масса его составляет около 65000 Да. Молекула Hb А имеет четвертичную структуру и включает четыре субъединицы — полипептидные цепи (обозначаемые α1, α2, β1 и β2, каждая из которых связана с гемом. Запомните, что гемоглобин относится к аллостерическим белкам, его молекулы могут обратимо переходить из одной конформации в другую. При этом изменяется сродство белка к лигандам. Конформация, обладающая наименьшим сродством к лиганду, называется напряжённой, или Т-конформацией. Конформация, обладающая наибольшим сродством к лиганду, называется релаксированной, или R-конформацией. R- и Т-конформации молекулы гемоглобина находятся в состоянии динамического равновесия: Различные факторы среды могут сдвигать это равновесие в ту или иную сторону. Аллостерическими регуляторами, влияющими на сродство Hb к O2, являются: 1) кислород; 2) концентрация Н+ (рН среды); 3) углекислота (СO2) ; 4) 2,3-дифосфоглицерат (ДФГ) . Присоединение молекулы кислорода к одной из субъединиц гемоглобина способствует переходу напряжённой конформации в релаксированную и повышает сродство к кислороду других субъединиц той же молекулы гемоглобина. Это явление получило название кооперативного эффекта. Сложный характер связывания гемоглобина с кислородом отражает кривая насыщения гемоглобина O2, имеющая S-образную форму (рисунок 3.1). Повышение содержания СO2, Н+, ДФГ на фоне низкого парциального давления O2 в тканях способствует взаимодействию этих факторов с гемоглобином и переходу R-конформации в Т-конформацию. Это приводит к смещению равновесия в уравнении (1) вправо. Выделившийся O2 поступает в ткани.
Рисунок 3.1. Кривые насыщения миоглобина (1) и гемоглобина (2) кислородом. | |
| Раздел 3.5 | Производные гемоглобина. Молекулярные формы гемоглобина: отличия HbF и HbS от HbA. |
3.5.1. Следует различать производные гемоглобина и его молекулярные формы. К производным гемоглобина относятся продукты взаимодействия гемоглобина (дезоксигемоглобина) с различными лигандами. Это взаимодействие, как правило, носит обратимый характер. Производные гемоглобина, представляющие наибольший интерес для медицины, перечислены в таблице 3.2. Запомните, что метгемоглобин (MetHb), в отличие от гемоглобина, теряет способность связывать и транспортировать кислород. Следовательно, попадание в организм больших количеств веществ, вызывающих образование метгемоглобина (нитриты, нитраты, анилин, нитробензол, некоторые лекарства), может привести к гипоксии (кислородному голоданию) тканей и смерти. В то же время метгемоглобин может легко связывать ионы CN—, нейтрализуя их токсическое действие. В результате образуется цианметгемоглобин. 3.5.2. Молекулярные формы гемоглобина отличаются друг от друга строением полипептидных цепей. Примером такой разновидности гемоглобина, существующей в физиологических условиях, является фетальный гемоглобин (HbF), присутствующий в крови в эмбриональной стадии развития человека. В отличие от HbA, его молекула содержит 2 α- и 2 γ-цепи (то есть β-цепи заменены на γ-цепи). Такой гемоглобин обладает более высоким сродством к кислороду. Именно это позволяет эмбриону получать кислород из крови матери через плаценту. Вскоре после рождения HbF в крови ребёнка замещается на HbA. В качестве примера аномального или патологического гемоглобина можно привести уже упоминавшийся (см. 2.4.) гемоглобин S, обнаруженный у больных серповидно-клеточной анемией. Как вам уже известно, он отличается от гемоглобина А заменой в β-цепях глутамата на валин. Эта аминокислотная замена вызывает снижение растворимости HbS в воде и уменьшение его сродства к O2. | |
| Критерий | Дезоксигемоглобин | Оксигемоглобин | Карбгемоглобин | Карбоксигемоглобин | Метгемоглобин | Цианметгемоглобин |
|---|---|---|---|---|---|---|
| Лиганд | — | O2 | СО2 | СО | ОН— | CN— |
| Валентность железа | II | II | II | II | III | III |
| Место присоединения лиганда | — | Fe2+ | NH2- группы глобина | Fe2+ | Fe3+ | Fe3+ |
| Механизм образования | — | Hb + O2 « HbO2 | Hb-NH2 + CO2 « Hb-NH-COOH | HbО2 + CO « HbCO + O2 | Hb + O2 + OН— « MetHb(OH) + O2— | MetHb(OH) + CN— « MetHb(CN) + OH— |
| Сродство к O2 | низкое | высокое | низкое | очень низкое | отсутствует | отсутствует |
| Присутствие в крови в норме | присутствует | присутствует | присутствует | отсутствует | отсутствует | отсутствует |
| Примеры | Обучающие задачи и эталоны их решения |
3.5.1. Задачи.1. В гидролизате сложного белка обнаружена фосфорная кислота. Можно ли с достаточной уверенностью сказать, к какому классу относится изучаемый белок? 2. Сравните растворимость простетической группы гемоглобина в воде и органических растворителях. 3. У альпиниста через 2 дня после подъёма на высоту 4000 м над уровнем моря содержание 2,3-дифосфоглицерата в эритроцитах составляет 6,5 ммоль/л (в норме — 4,5 ммоль/л) . Как это отразится на сродстве гемоглобина к кислороду? Какое значение для организма имеет такое изменение? 3.5.2. Эталоны решения.1. Как видно из таблицы 3.1, фосфорная кислота является простетической группой белков класса фосфопротеинов. Известно также, что фосфат входит в состав нуклеиновых кислот, которые могут выступать в качестве простетической группы нуклеопротеинов. Поэтому фосфорная кислота может быть обнаружена в гидролизате как фосфопротеина, так и нуклеопротеина. Для уточнения класса гидролизованного белка нужно провести с гидролизатом качественные реакции на азотистые основания и пентозы (см. 3.1.). 2. Растворимость вещества в воде или органических растворителях зависит от того, какие функциональные группы преобладают в молекуле. Простетическая группа гемоглобина — гем — содержит только две полярные группировки (две карбоксильные группы), остальная часть молекулы неполярна (равномерное распределение электронной плотности). Поэтому гем хорошо растворяется в органических растворителях и не растворяется в воде (см. 3.2.). 3. 2, 3-Дифосфоглицерат (ДФГ) является аллостерическим регулятором, понижающим сродство гемоглобина к кислороду. Поэтому при увеличении содержания ДФГ в эритроцитах равновесие в уравнении диссоциации HbO2 смещается вправо. Увеличение отдачи кислорода оксигемоглобином имеет компенсаторное значение для организма, так как восполняет недостаточное поступление кислорода из атмосферы (см. 3.2.). | |
Источник
ЦИТОХРОМЫ
Цитохромы (греческий kytos вместилище, здесь — клетка + chroma цвет, окраска) — группа гемсодержащих белков, обладающих свойством принимать и отдавать электроны за счет изменения валентности центрального атома железа в геме. В группу цитохромов входят соединения, выполняющие различные биологические функции и принимающие участие в таких важнейших клеточных процессах, как тканевое дыхание (см. Окисление биологическое) и окисление молекулярным кислородом различного рода неполярных органических соединений (см.). Биологическая роль некоторых цитохромов неясна, хотя, по-видимому, все они функционируют путем последовательного окисления и восстановления (см. Окислительно-восстановительные реакции). Некоторые цитохромы принято считать дыхательными ферментами (см.), а другие — просто переносчиками в процессах окисления и восстановления.
Спектр поглощения системы цитохром, типичной для ряда животных тканей, с четырьмя полосами в видимой части спектра впервые наблюдал Мак-Манн (С. A. MacMunn) в 1886 году. Однако только в 1925 году Д. Кейлин смог оценить биол. роль этих гем-содержащих белков (гемопротеидов). Им и был предложен термин «цитохромы», принятый биохимиками всех стран. Д. Кейлин первым установил, что цитохромная система играет важную роль в процессах тканевого дыхания и биол. окисления.
Цитохромы содержатся почти во всех растительных, животных и бактериальных клетках, использующих для своей жизнедеятельности энергию, освобождающуюся в процессе биол. окисления. К цитохромам относят все внутриклеточные гемопротеиды (см. Металлопротеиды), за исключением гемоглобина (см.), миоглобина (см.), каталазы (см.) и пероксидаз (см.).
Классификация цитохромов основана на различиях в природе их простетической группы — гема. В соответствии с четырьмя типами гема выделяют четыре группы цитохром, цитохромы a, b, с, d, которые различаются боковыми цепями при порфириновых кольцах (см. Порфирины). У цитохромов а гемовая группа содержит формильную боковую цепь, у цитохромов b простетической группой является протогем, нековалентно связанный с белковой частью молекулы, у цитохромов с боковые цепи гема ковалентно связаны с белком, а у цитохромов d гем содержит дигидропорфирин (хлорин). Если в молекуле цитохрома со специфическим белком связаны две разные гемовые группы, то в названии этого цитохрома указывают оба типа гемов, напр, цитохром cd (цитохром-оксидаза Pseudomonas; КФ 1.9.3.2).
Если в молекуле гемопротеида атом железа координационно связан не только с четырьмя атомами азота порфирина, но также с определенными группами белка (пятая и шестая координационные связи), то в обозначении цитохромы отсутствует знак «штрих», например, в цитохроме с одна из координационных связей формируется с остатком гистидина (см.), а другая — с остатком метионина (см.) белковой части молекулы. В обозначении цитохромов, у которых характер связей гемовой группы отличается от описанного выше, используется знак «штрих» (напр., цитохром c’).
Название цитохромы с установленной структурой включает числовой индекс, стоящий при букве, обозначающей подгруппу, к к-рой принадлежит данный цитохром, например, цитохром а3 (цитохром с — оксидаза: КФ 1.9.3.1). При обозначении других цитохром указывают длину волны (в нанометрах) α-полосы в спектре поглощения восстановленной формы (например, цитохром с-554). Длину волны определяют при комнатной температуре и приводят ее значение для абсолютного (а не разностного) спектра поглощения.

Рис. 1. Графическое изображение спектров поглощения окисленной (сплошная линия) и восстановленной (пунктирная линия) форм цитохрома c: по оси абсцисс — длина волны в нм, по оси ординат — величина экстинкции в см2/моль; α, β и γ — максимумы поглощения. На графике поглощения восстановленной формы цитохрома с отчетливо видны пики, соответствующие трем характерным полосам поглощения: α-полоса 550 нм, β-полоса 520 нм и γ-полоса 415 нм. В результате окисления восстановленной формы цитохрома с поглощение в области α- и β-полос становится диффузным, максимумы исчезают, γ-полоса остается, но делается менее интенсивной и немного смещается в сторону ультрафиолетовой части спектра.
Цитохромы в восстановленной форме обладают четко выраженным характерным поглощением в видимой области спектра. В типичном спектре поглощения индивидуального цитохрома (в восстановленном состоянии) имеются три основные полосы поглощения. В порядке уменьшения длины волны они обозначаются как α-, β- и γ-полосы. Самой интенсивной является γ-полоса; γ-полоса, обычно имеющая на графике вид острого пика, интенсивней, чем β-полоса. Следует отметить, что β-полоса поглощения у цитохромов а выражена весьма слабо, а иногда и совсем отсутствует. В результате окисления восстановленной формы цитохромы α- и β-полосы исчезают и поглощение в этой области становится диффузным; γ-полоса остается, но несколько смещается в сторону ультрафиолетовой области спектра (рис. 1).
Локализация цитохромы в клетках варьирует в зависимости от специализации клеток и от интенсивности их функционирования. Большая часть клеточных цитохром локализована во внутренней митохондриальной мембране (см. Митохондрии) и в микросомах (см.) — мембранах эндоплазматической сети, в плазматических мембранах, в мембранах хлоропластов, а также частично в ядерной мембране. Например, в летательных мышцах насекомых цитохромы расположены почти исключительно в митохондриях (во внутренней митохондриальной мембране), в то время как в клетках печени значительная доля всех цитохром находится в мембранах эндоплазматической сети.
Цепь переноса электронов в митохондриях схематически выглядит следующим образом:
субстрат (НАД-Н, сукцинат и др.) -> ФП(Feиг) -> KoQ -> цитохром b -> цитохром c1 -> цитохром с -> цитохром aa3 -> кислород O2,
где ФП (Feиг — специфичный к определенному субстрату флавопротеидный фермент, с которым связано негемовое железо, KoQ — убихинон, или кофермент Q.
В свою очередь участие цитохромов в системе окисления в микросомах может быть представлено одной из возможных схем:
где RH — окисляемый субстрат, ФП1 — флавопротеид 1, или НАДФ•Н-дегидрогеназа.
Ферменты, являющиеся донорами электронов для цитохромов, носят групповое название цитохромредуктаз. Например, НАД • Н-цитохром b — редуктаза, цитохром b5 — редуктаза (КФ 1.6.2.2), окисляясь, восстанавливают соответствующие цитохромы.
Основными методами изучения функциональной активности цитохромы и их количественного содержания в тканях являются спектральные методы, основанные либо на измерении интенсивности полос поглощения восстановленных форм цитохромы, либо на определении разностного спектра поглощения между восстановленными и окисленными формами (см. Спектральный анализ). Интенсивность альфа-полос в спектре поглощения характеризует степень восстановленности разных цитохром даже тогда, когда они находятся в нативных тканях и суспензиях клеток.
Главная сложность при изучении цитохромы заключается в том, что большинство из них трудно получить в растворе. За исключением цитохрома с, большая часть которого легко экстрагируется, цитохромы можно выделить лишь с помощью таких жестких методов, как обработка клеток ультразвуком, детергентами (см.), а также путем ферментативного гидролиза. Очищенные цитохромы не реагируют друг с другом при смешивании, если при этом в реакционную смесь одновременно не добавляют фосфолипиды (см. Фосфатиды).
Наиболее характерными представителями цитохром являются цитохромы c и b5, цитохром P-450 и цитохром-оксидаза.
Цитохром с является наиболее изученным цитохромом. Он способен хорошо растворяться в воде. Этот цитохром имеет небольшой для белка молекулярный вес (около 13 000), выделен в кристаллическом виде из многих биологических источников, причем в каждом случае его первичная структура (то есть последовательность соединения аминокислотных остатков в белковой молекуле) полностью установлена. Сопоставление первичных структур цитохромов с разных биол. видов показало удивительное постоянство последовательности аминокислотных остатков в их полипептидной цепи; отмечено лишь небольшое число положений, в которых может происходить замена отдельных аминокислот. Поэтому цитохром с является удобным объектом для изучения точек дивергенции на протяжении биол. эволюции.
Цитохром с, подобно другим цитохромам с небольшим молекулярным весом, по существу является переносчиком в окислительно-восстановительных процессах, транспортируя окислительновосстановительные эквиваленты от одной молекулы к другой, как это делает НАД (см. Никотинамидадениндинуклеотид). Поэтому цитохром с можно считать истинным кофактором дыхательной цепи. Он не действует как фермент, активирующий специфический субстрат (см. Ферменты).
Цитохромоксидаза (синоним: цитохром aa3, цитохром с — оксидаза; КФ 1.9.3.1) катализирует окисление цитохрома с молекулярным кислородом и является конечным цитохромным компонентом в дыхательной цепи митохондрий (см.). Она локализована во внутренней мембране этих органелл и прочно связана с самой мембраной. Цитохромоксидаза внутренней мембраны митохондрий сердечной мышцы быка содержит шесть разных белковых субъединиц, обозначаемых номерами от I до VI. Гомогенные препараты белковых субъединиц этой цитохром-оксидазы были выделены методом электрофореза (см.) в полиакриламидном геле с додецилсульфатом натрия. Они обладают гидрофобными свойствами, определены их мол. веса и аминокислотный состав.
Одна из гемовых групп цитохром-оксидазы (гем A3) может связывать дыхательные ингибиторы — монооксид углерода (угарный газ) или синильную кислоту (см.), изменяя при этом свой спектр поглощения; гем а эти ингибиторы не связывает.

Рис. 2. Графическое изображение спектров поглощения окисленной (I), восстановленной (II) форм цитохрома Р-450 и комплекса восстановленной формы цитохрома Р-450 с монооксидом углерода — угарным газом (III): по оси абсцисс — длина волны в нм, по оси ординат — величина экстинкции. Видно отличие спектра восстановленной и окисленной форм цитохрома Р-450 от типичного спектра поглощения цитохромов (см. рис. 1). Отчетливо выражена лишь гамма-полоса, при 450 нм находится максимум поглощения не самого цитохрома Р-450, а комплекса его восстановленной формы с угарным газом.
Цитохром Р-450 представляет собой совершенно особый класс цитохромов. Он является ключевым ферментом метаболизма неполярных соединений экзогенного и эндогенного происхождения у животных и человека. Его название «цитохром Р-450» не соответствует номенклатуре, однако оно сохранилось в мировой биохимической литературе. Цитохром Р-450 представляет собой гемопротеид, который содержит гем b. Спектр поглощения его восстановленной формы не типичен для цитохромов (рис. 2). Цитохром Р-450 не поглощает свет при длине волны 450 нм, как можно было бы предполагать по его названию; полоса поглощения в этой области свойственна комплексу его восстановленной формы с монооксидом углерода CO. Сродство цитохрома P-450 к CO значительно выше, чем у цитохрома a3.
Цитохром Р-450 осуществляет реакции окисления молекулярным кислородом неполярных органических соединений. По характеру действия этот цитохром является монооксигеназой внешнего типа, использующей НАДФ-Н в качестве источника окислительно-восстановительных эквивалентов. Реакция окисления органических соединений, катализируемая этим цитохромом, протекает в соответствии с уравнением:
RH + O2+DH2 —> ROH + H2 + D,
где RH — окисляемое вещество, а DH2 — донор окислительно-восстановительных эквивалентов.
В клетках животных и человека цитохром Р-450 локализован в мембранах эндоплазматической сети, в наружной митохондриальной мембране и ядерной оболочке. Существует много различных изоформ цитохрома Р-450 (см. Изоферменты), только из печени кролика, например, выделено до 20 различных подфракций цитохрома Р-450. В клетках печени, легких, кожи и др. человека и животных цитохром Р-450 осуществляет реакции окисления неполярных чужеродных соединений (ксенобиотиков), в том числе лекарственных веществ, способствуя таким образом их удалению из гидрофобной зоны биол. мембран (см. Мембраны биологические). В стероидпродуцирующих тканях он осуществляет реакции окисления холестерина (см.) в стероидные гормоны (см.), в печени — биосинтез желчных кислот (см.) из холестерина. Цитохром Р-450 участвует в реакциях окисления ненасыщенных жирных кислот (см.) и биосинтезе простагландинов (см.). Ферментные системы, включающие цитохром Р-450, многокомпонентны и, кроме него, содержат НАДФ • Н-специфичные редуктазы, негемовые серосодержащие белки или цитохром b5.
Цитохром b5 — типичный гемопротеид типа b. Он участвует в монооксигеназных реакциях, взаимодействуя с цитохромом Р-450, в реакциях десатурации насыщенных жирных кислот. Вероятнее всего, НАД • Н-цитохром b5 — редуктазная система состоит из этого гемопротеида и НАД • Н-специфичного флавопротеида (см. Флавопротеиды) и является универсальной редуцирующей системой биологических мембран, использующей окислительно-восстановительные эквиваленты НАД-Н для восстановления-окисления белковых и небелковых функциональных групп.
Гистохимические методы определения цитохромов
Цитохромоксидазу и ее субстрат — цитохром с гистохимически выявляют с помощью так называемой G-нади-реакции или лабильной нади-реакции, окислительной реакции между альфа-нафтолом и диметил-n-фенилендиамином с образованием индофенолового синего. Эта реакция проводится на свежей фиксированной ткани. Образование индофенолового синего в G-нади-реакции катализируется цитохромом с, окисление которого молекулярным кислородом идет медленно и для ускорения требует присутствия цитохромоксидазы. Таким образом, положительная G-нади-оксидазная реакция свидетельствует о присутствии в исследуемой ткани системы цитохромоксидаза — цитохром с. Недостаток цитохрома с может препятствовать нормальному протеканию этой реакции. Структуры, обладающие ферментативной активностью, окрашиваются в синий, синевато-фиолетовый, синевато-коричневый и коричневато-черный цвет в зависимости от используемой модификации реакции. Из модификаций G-нади-реакции для определения цитохромоксидазы — цитохрома с чаще применяется модификация Б