Гемоглобин кооперативное взаимодействие субъединиц
Содержание статьи
Эффективность связывания кислорода с гемоглобином регулируется
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании — повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Источник
Кооперативное связывание кислорода гемоглобином, эффект Бора, влияние 2,3-БФГ на сродство гемоглобина к кислороду.
Мы поможем в написании ваших работ! Мы поможем в написании ваших работ! Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ? | Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании — повышается. При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина. Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид: Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях ионы водорода присоединяются к остаткам гистидина, образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы. Механизм эффекта Бора Кооперативное взаимодействие Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие. В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное. Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров. Изменение формы субъединиц гемоглобина при присоединении кислорода Роль 2,3-дифосфоглицерата 2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта. Реакции шунта Раппопорта 2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина. Расположение 2,3-дифосфоглицерата в гемоглобине Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду. Это имеет особенное значение при подъеме на высоту, при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза. |
Источник
7.Миоглобин и гемоглобин. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина. Эффект Бора. Роль 2,3 –бифосфоглицерата.
Два белка — гемоглобин1 и миоглобин — часто называют дыхательными ферментами (рис. 1). Оба этих вещества выполняют роль переносчиков при дыхании: гемоглобин — основной компонент красных кровяных телец2 (эритроцитов), переносящих по артериям кислород из легких к тканям;миоглобин — красный белок в мышцах, принимающий кислород от гемоглобина и хранящий его таме до того момента, когда он потребуется для окисления пищевых веществ. Эти процессы в организме сопряжены с одновременным переносом углекислого газа, переправляемого из тканей в легкие, в основном в виде бикарбоната. Перенос бикарбоната и углекислого газа идет также при содействии гемоглобина.
Миоглобин и гемоглобин представляют собой белки, соединенные с железосодержащим пигментом — гемом3 (рис. 2). Белковая часть миоглобина содержит около 2500 атомов углерода, азота, кислорода, водорода и серы, соединенных друг с другом в длинную цепь, образующую своего рода корзинку вокруг группы гема. Все 2500 атомов молекулы миоглобина подчинены единственному атому железа, расположенному в центре гема, они обеспечивают обратимое взаимодействие железа с молекулами кислорода.
Было установлено, что гем приобретает способность переносить кислород лишь при условии, если его окружает и защищает специфический белок — глобин (сам по себе гем не связывает кислород). Обычно при соединении кислорода с железом один или более электронов необратимо переходят с атомов железа на атомы кислорода. Иными словами, происходит химическая реакция. Экспериментально было доказано, что миоглобин и гемоглобин обладают уникальной способностьюобратимо связывать O2 без окисления гемового Fe2+ в Fe3+. Таким образом, процесс дыхания, который на первый взгляд кажется столь простым, на самом деле осуществляется благодаря взаимодействию многих видов атомов в гигантских молекулах чрезвычайной сложности.
Проблемой молекулярного механизма дыхания, а в связи с этим выяснением строения гемоглобина и миоглобина на протяжении долгого времени занимались английские ученые М.Перутц и Дж.Кендрю. Взаимодействие указанных соединений с субстратом — кислородом — было детально выяснено прежде всего на основе рентгеноструктурного анализа высокого разрешения.
Эффект Вериго-Бора (синонимы — эффект Вериго, эффект Бора) — зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты вальвеолярном воздухе и крови, при снижении которого сродство кислорода к гемоглобину повышается, что затрудняет переход кислорода из капилляров в ткани. Эффект этот был открыт независимо друг от друга Б. Ф. Вериго в 1898 году и датским физиологом Ч. Бором в 1904.
Важная особенность анаэробного гликолиза в эритроцитах по сравнению с другими клетками — присутствие в них фермента бисфосфоглицератмутазы. Бисфосфоглицератмутаза катализирует образование 2,3-бисфосфоглицерата из 1,3-бисфосфоглицерата (рис. 14-3). Образующийся только в эритроцитах 2,3-бисфосфоглицерат служит важным аллостерическим регулятором связывания кислорода гемоглобином
8. Ферменты, особенности ферментативного катализа (механизм выполнения ферментом каталитической функции, энергетический барьер реакции, энергия активации, образование фермент-субстратного комплекса). Единицы активности ферментов
Ферме́нты, или энзи́мы — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу).
Ферментативный катализ (биокатализ), ускорение биохимических реакций при участии белковых макромолекул. называемых ферментами (энзимами). Ферментативный катализ — разновидность катализа, хотя термин «ферментация» (брожение)известен с давних времен, когда еще не было понятия химического катализа.
Единицы активности ферментов.1) За единицу активности фермента (Uunit, англ.) принимают такое количество фермента, которое катализирует превращение 1 мкмоля S (суб страта) за 1 мин. при оптимальных условиях (1U= 1 мкмоль/мин.)
2) В системе СИ активность выражают в каталах: 1 катал — количество фермента, катали зирующее превращение 1 моля S за 1 сек. при оптимальных условиях (1кат.=1 моль/с)
3)Удельнаяактивность определяется количеством единиц ферментативной активности, которое приходится на 1 мг белка в биологическом объекте (U/мг белка)
Соседние файлы в папке экз
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Эффективность транспорта кислорода регулируется Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании — повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2обусловлено конформационными перестройками глобиновой части молекулы. В тканях ионы водорода присоединяются к остаткам гистидина, образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
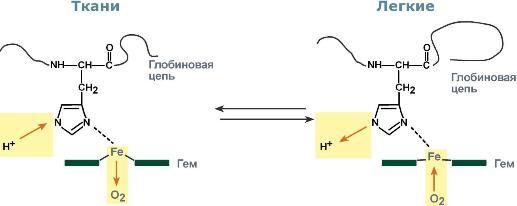
Механизм эффекта Бора Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
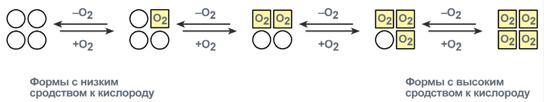
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
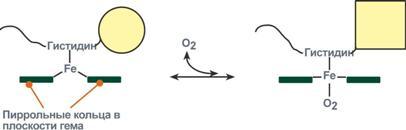
Изменение формы субъединиц гемоглобина при присоединении кислорода
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболитагликолиза, в реакциях, получивших название шунт Раппопорта.
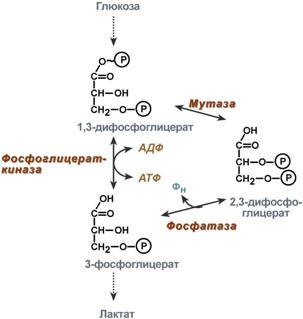
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с ?-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих ?-цепей, также аминогруппами радикалов лизина и гистидина.
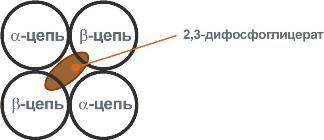
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду. Это имеет особенное значение при подъеме на высоту, при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Газообмен происходит по градиенту концентраций
Обмен кислорода и углекислого газа в тканях
В тканях диффундирующий в кровь из клеток СО2 большей частью (около 90%) по градиенту концентрации попадает в эритроциты. Движущей силой этого процесса является быстрая, постоянно идущая реакция превращения его в угольную кислоту при участии фермента карбоангидразы. Угольная кислота диссоциирует и подкисляет содержимое эритроцита, что улучшает отдачу оксигемоглобином кислорода (Эффект Бора).
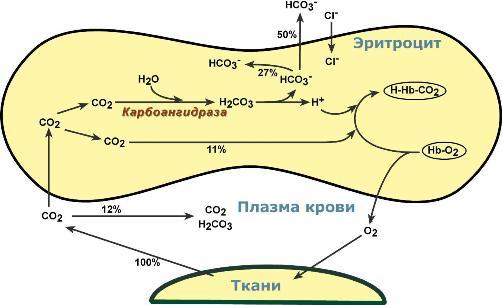
Реакции газообмена в капиллярах тканей
Одновременно с концевыми NH2-группами β-цепей гемоглобина связывается 10-12% карбонат-иона с образованием карбаминогемоглобина (H-HbCO2).
Остальные бикарбонаты выходят в плазму крови в обмен на ионы хлора (гипохлоремический сдвиг).
Обмен кислорода и углекислого газа в легких
В легочных капиллярах имеется относительно низкая концентрация углекислого газа в альвеолярном воздухе:
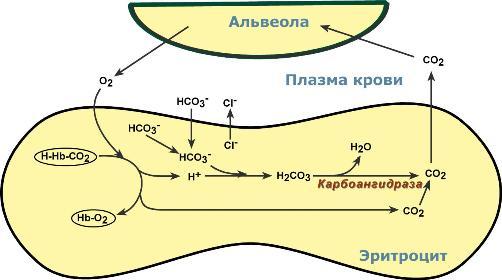
Реакции газообмена в легочных капиллярах
происходит высокоэффективная диффузия СО2 из плазмы через альвеолярные мембраны и его удаление с выдыхаемым воздухом,
уменьшение концентрации СО2 в плазме стимулирует его образование в карбоангидразной реакции внутри эритроцита и снижает здесь концентрацию иона HCO3-,
одновременно высокая концентрация кислорода вытесняет СО2 из комплекса с гемоглобином с образованием оксигемоглобина — более сильной кислоты, чем угольная,
диссоциирующие от оксигемоглобина ионы Н+ нейтрализуют поступающий извне ион HCO3- с образованием угольной кислоты. После карбоангидразной реакции образуется СО2, который выводится наружу.
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Кооперативность — Cooperativity
Кооперативность — это явление, отображаемое системами, состоящими из идентичных или почти идентичных элементов, которые действуют в зависимости друг от друга, относительно гипотетическая стандартная невзаимодействующая система, в которой отдельные элементы действуют независимо. Одним из проявлений этого является ферменты или рецепторы , которые имеют несколько сайтов связывания , где сродство сайтов связывания с лигандом, по-видимому, повышено, положительная кооперативность или уменьшенная, отрицательная кооперативность при связывании лиганда с сайтом связывания. Например, когда атом кислорода связывается с одним из четырех сайтов связывания гемоглобина, сродство к кислороду трех оставшихся доступных сайтов связывания увеличивается; то есть кислород с большей вероятностью связывается с гемоглобином, связанным с одним кислородом, чем с несвязанным гемоглобином. Это называется кооперативным связыванием .
. Мы также видим кооперативность в молекулах с большой цепью, состоящих из множества идентичных (или почти идентичных) субъединиц (таких как ДНК , белки , и фосфолипиды ), когда такие молекулы претерпевают фазовые переходы, такие как плавление, разворачивание или раскручивание. Это называется кооперативностью субъединиц. Однако определение кооперативности, основанное на очевидном увеличении или уменьшении сродства к последовательным этапам связывания лиганда, является проблематичным, поскольку понятие «энергия» всегда должно определяться относительно стандартного состояния. Когда мы говорим, что аффинность увеличивается при связывании одного лиганда, эмпирически неясно, что мы имеем в виду, поскольку кривая некооперативного связывания необходима для точного определения энергии связывания и, следовательно, также аффинности. Гораздо более общее и полезное определение положительной кооперативности: процесс, включающий несколько идентичных дополнительных шагов, в котором промежуточные состояния статистически недостаточно представлены по сравнению с гипотетической стандартной системой (нулевая гипотеза), где шаги происходят независимо друг от друга.
Точно так же определение отрицательной кооперативности будет процессом, включающим несколько идентичных дополнительных шагов, в котором промежуточные состояния чрезмерно представлены по сравнению с гипотетическим стандартным состоянием, в котором отдельные шаги происходят независимо. Эти последние определения положительной и отрицательной кооперативности легко охватывают все процессы, которые мы называем «кооперативными», включая конформационные переходы в больших молекулах (таких как белки) и даже психологические явления большого числа людей (которые могут действовать независимо друг от друга или в кооперативная мода).
Кооперативное связывание
Когда субстрат связывается с одной ферментной субъединицей, остальные субъединицы стимулируются и становятся активными. Лиганды могут иметь положительную кооперативность, отрицательную кооперативность или некооперативность.
Сигмоидальная форма кривой диссоциации кислорода гемоглобина является результатом совместного связывания кислорода с гемоглобином.
Примером положительной кооперативности является связывание кислорода с гемоглобином . Одна молекула кислорода может связываться с двухвалентным железом молекулы гема в каждой из четырех цепей молекулы гемоглобина . Дезоксигемоглобин имеет относительно низкое сродство к кислороду , но когда одна молекула связывается с одним гемом, сродство кислорода увеличивается, позволяя второй молекуле связываться более легко, а третьей и четвертый еще легче. Сродство к кислороду 3-оксигемоглобина в ~ 300 раз больше, чем у дезоксигемоглобина. Такое поведение приводит к тому, что кривая аффинности гемоглобина становится сигмоидальной , а не гиперболической , как для мономерного миоглобина . По тому же процессу способность гемоглобина терять кислород увеличивается по мере того, как связывается меньше молекул кислорода. См. Также Кривая диссоциации кислород-гемоглобин. .
Отрицательная кооперативность означает, что верно обратное; поскольку лиганды связываются с белком , сродство белка к лиганду будет уменьшаться, то есть становится менее вероятным связывание лиганда с белком. Примером этого является взаимосвязь между глицеральдегид-3-фосфатом и ферментом глицеральдегид-3-фосфатдегидрогеназой.
Гомотропная кооперативность относится к тому факту, что молекула, вызывающая кооперативность, является той, на которую она влияет. Гетеротропная кооперативность — это когда стороннее вещество вызывает изменение аффинности. Гомотропная или гетеротропная кооперативность может быть как положительной, так и отрицательной, в зависимости от того, поддерживает она или препятствует дальнейшему связыванию молекул лиганда с ферментами.
Кооперативность субъединиц
Кооперативность — это не только явление связывания лиганда, но также применяется в любое время, когда энергетические взаимодействия облегчают или затрудняют что-то, что происходит с участием нескольких единиц, в отличие от отдельных единиц. (То есть проще или сложнее по сравнению с тем, что ожидается при учете только добавления нескольких единиц). Например, раскручивание ДНК предполагает кооперативность: части ДНК должны раскручиваться, чтобы ДНК могла выполнять репликацию , транскрипцию и рекомбинацию . Положительная кооперативность между соседними нуклеотидами ДНК позволяет легче раскручивать целую группу соседних нуклеотидов, чем раскручивать такое же количество нуклеотидов, распределенных по цепи ДНК. Это количество соседних баз, которые имеют тенденцию раскручиваться как единое целое из-за эффектов положительного взаимодействия. Это явление также применимо к другим типам цепных молекул, таким как сворачивание и разворачивание белков и «плавление» фосфолипидных цепей, которые составляют мембраны клеток . Кооперативность субъединиц измеряется по относительной шкале, известной как константа Хилла.
Уравнение Хилла
Простая и широко используемая модель для молекулярных взаимодействий — это уравнение Хилла , которое обеспечивает способ количественной оценки кооперативного связывания путем описания доли связывания насыщенного лиганда. сайтов в зависимости от концентрации лиганда.
Коэффициент Хилла
Коэффициент Хилла является мерой сверхчувствительности (т.е. насколько крутой является кривая отклика).
С эксплуатационной точки зрения коэффициент Хилла можно рассчитать как:
n H = log (81) log (EC 90 / EC 10) { displaystyle n_ {H} = { frac { log (81)} { ce { log (EC90 / EC10)}}}} .
где EC 90 { displaystyle { ce {EC90}}} и EC 10 { displaystyle { ce {EC10}}} — входные значения, необходимые для получения 10% и 90% максимального отклика соответственно.
Коэффициент отклика
Показатель глобальной чувствительности, такой как коэффициент Хилла, не характеризует локальное поведение s-образных кривых. Вместо этого эти особенности хорошо отражаются мерой коэффициента отклика, определяемой как:
R (x) = xydydx { displaystyle R (x) = { frac {x} {y}} { frac {dy} {dx }}}
Связь между коэффициентом Хилла и коэффициентом отклика
Altszyler et al. (2017) показали, что эти меры сверхчувствительности могут быть связаны следующим уравнением:
n H = 2 ∫ log (EC 10) log (EC 90) R f (I) d (log I) log (EC 90) — журнал (EC 10) = 2 ⟨R f⟩ EC 10, EC 90 { displaystyle n_ {H} = 2 { frac { int _ { ce { log (EC10)}} ^ { ce { log (EC90)}} R_ {f} (I) d ( log I)} { ce { log (EC90) — log (EC10)}}} = 2 langle R_ {f } rangle _ { ce {EC10, EC90}}}
где ⟨X⟩ a, b { displaystyle langle X rangle _ {a, b}} обозначает среднее значение переменной x в диапазоне [a, b].
Сверхчувствительность в функциональном составе
Рассмотрим два связанных сверхчувствительных модуля, не принимая во внимание эффекты связывания молекулярных компонентов между слоями. В этом случае выражение кривой доза-реакция системы F является результатом математической композиции функций fi { displaystyle f_ {i}} , которые описывают ввод / вывод. взаимосвязь изолированных модулей я = 1, 2 { displaystyle i = 1,2} :
F (I 1) = f 2 (f 1 (I 1)) { displaystyle F (I_ {1}) = f_ {2} { big (} f_ {1} (I_ {1}) { big)}}
Браун и др. (1997) показали, что локальная сверхчувствительность различных слоев мультипликативно складывается:
R (x) = R 2 (f 1 (x)). R 1 (x) { displaystyle R (x) = R_ {2} (f_ {1} (x)). R_ {1} (x)} .
В связи с этим результатом Феррелл и др. (1997) показали для модулей типа Хилла, что общая глобальная сверхчувствительность каскада должна быть меньше или равна произведению оценок глобальной сверхчувствительности каждого слоя каскада,
n ≤ n 1. n 2 { displaystyle n leq n_ {1} .n_ {2}} ,
где n 1 { displaystyle n_ {1}} и n 2 { displaystyle n_ {2}} — коэффициент Хилла модулей 1 и 2 соответственно.
Altszyler et al. (2017) показали, что глобальную сверхчувствительность каскада можно рассчитать аналитически:
n = 2 ⟨R 2⟩ X 10 2, X 90 2 ⏞ ν 2 ⟨R 1⟩ X 10 1, X 90 1 ⏞ ν 1 = 2 ν 2 ν 1 { Displaystyle п = 2 overbrace { langle R_ {2} rangle _ {X10_ {2}, X90_ {2}}} ^ { nu _ {2}} overbrace { langle R_ {1} rangle _ {X10_ {1}, X90_ {1}}} ^ { nu _ {1}} = 2 , nu _ {2} , nu _ {1}}
где X 10 i { displaystyle X10_ {i}} и X 90 i { displaystyle X90_ {i}} ограничили рабочий диапазон ввода Hill композитного изображения. системы, т. е. входные значения для i-слоя так, чтобы последний слой (соответствующий i = 2 { displaystyle i = 2} в данном случае) достиг 10% и 90% это максимальный выходной уровень. Из этого уравнения следует, что коэффициент Хилла n системы может быть записан как произведение двух факторов: ν 1 { displaystyle nu _ {1}} и ν 2 { displaystyle nu _ {2}} , который характеризует локальную среднюю чувствительность по соответствующей области ввода для каждого слоя: [X 10 i, X 90 i] { displaystyle [X10_ {i}, X90_ {i}]} , в данном случае i = 1, 2 { displaystyle i = 1,2} .
Для более общего случая каскада из N модулей коэффициент Хилла может быть выражен как:
n = ν N ν N — 1. . . ν 1 { displaystyle n = nu _ {N} , nu _ {N-1} … nu _ {1}} ,
Супрамультипликативность
Несколько авторов сообщили о существовании супрамультипликативное поведение в сигнальных каскадах (т.е. сверхчувствительность комбинации слоев выше, чем произведение индивидуальных сверхчувствительности), но во многих случаях окончательное происхождение супрамультипликативности оставалось неуловимым. Altszyler et al. (2017), естественно, предложили общий сценарий, в котором может иметь место супрамультипликативное поведение. Это могло произойти, когда для данного модуля соответствующий входной рабочий диапазон Хилла был расположен во входной области с локальной сверхчувствительностью выше, чем общая сверхчувствительность соответствующей кривой доза-реакция.
Ссылки
Источник