Гемоглобин плода его физиологическое значение
96. Гемоглобины человека, структура. Транспорт кислорода и диоксида углерода. Гемоглобин плода и его физиологическое значение. Гемоглобинопатии.
Дыхательный
пигмент, содержащийся в эритроцитах, с
помощью которого осуществляется
транспорт молекулярного кислорода из
легких к тканям. Относится к сложным
белкам — хромопротеидам. Молекула
гемоглобина состоит из двух частей:
простетической группы (гема), в состав
которой входит атом железа, и белка типа
альбуминов — глобина. На долю гема
приходится 4 % молекулы гемоглобина, а
глобина — 96 %. Гем относится к порфиринам,
он содержит 4 пирроловые группы,
соединенные в центре атомом железа. При
потере железа гем превращается в
гематопорфирин. Как в оксигемоглобине,
так и в редуцированном гемоглобине
железо находится в двухвалентной
закисной форме. Трехвалентная (окисная)
форма железа, не способная переносить
молекулярный кислород, может образовываться
при окислении в метгемоглобин. При
разрушении эритроцитов (гемоглобина)
в конечном счете в печени образуются
желчные пигменты — билирубин и биливердин;
в течение суток 3,6 г гемоглобина
превращается в желчные пигменты.
В
капиллярах легких гемоглобин (гем)
вступает с кислородом в непрочное
соединение, образуя оксигемоглобин, а
в капиллярах тканей происходит отщепление
кислорода и восстановление гемоглобина.
Последний вновь легко вступает в
соединение с кислородом. Нарушение
дыхательной функции крови может
наблюдаться при уменьшении количества
гемоглобина, эритроцитов в крови (анемии)
и изменении качества гемоглобина:
образовании карбоксигемоглобина
(отравлении окисью углерода), метгемоглобина
(отравлении гемолитическими ядами)
сульфгемоглобина.
Типы
нормального гемоглобина
С
помощью физико-химических методов
исследования (электрофорез, хроматография)
удалось установить неоднородность
человеческого гемоглобина, существование
различных его типов как в нормальных,
так и в патологических условиях. В
настоящее время известны три формы
нормального гемоглобина:
Примитивный
гемоглобин (гемоглобин Р)
Это
гемоглобин, который может быть обнаружен
у трехсантиметрового зародыша,
характеризуется высокой щелочной
резистентностью и малой электрофоретической
подвижностью. Находится в эритроцитах
зародыша до 18 — недельного возраста (в
основном между 7 — й и 12 — й неделями),
затем сменяется фетальным гемоглобином.
Фетальный
гемоглобин (гемоглобин F)
Представляет
собой основную массу гемоглобина с 9 —
13 недельного возраста эмбриона. После
третьего месяца — основной гемоглобин
плода. Затем содержание его постепенно
уменьшается за счет образования с 13 — й
недели гемоглобина А. К моменту рождения
гемоглобина F остается около 20 %, а 80 %
приходится на гемоглобин А. К 4 — 5 месяцу
жизни гемоглобина F остается всего 1 — 2
%. Существует метод цитологической
дифференцировки гемоглобина F путем
обработки мазка крови лимоннокислофосфатной
буферной смесью с рН = 3,4. В этих условиях
эритроциты, содержащие преимущественно
гемоглобин А, подвергаются гемолизу и
представляются на препарате в виде
теней (стром). Эритроциты, в которых
преобладает гемоглобин F, оказываются
резистентными и контрастно окрашиваются.
Гемоглобин
взрослых (гемоглобин А)
Представляет
основную массу гемоглобина взрослых
людей. С помощью электрофореза на
крахмале установлено наличие нескольких
фракций гемоглобина А:
гемоглобин
A1 (основная
фракция, на долю которой приходится 96
— 98 % всей массы гемоглобина).гемоглобин
A2 (2
— 5 %).гемоглобин
A3 (содержание
менее 1 %).
Содержание
гемоглобина F в крови взрослого человека
составляет 1 — 2 %. Повышение этих величин
возможно в условиях патологии. Преобладание
того или иного типа гемоглобина совпадает
во времени с периодами эмбрионального
кроветворения: гемоглобин Р характерен
для периода желточного кроветворения,
гемоглобин F — для печеночного, гемоглобин
А — для периода костномозгового
кроветворения.
Аномальные
гемоглобины
Наличие
в эритроцитах людей аномальных или
патологических гемоглобинов определяет
состояния, обозначаемые как гемоглобинозы,
или гемоглобинопатии. Это наследственные
аномалии кроветворения, при которых
молекулы патологических гемоглобинов
имеют измененную структуру, поэтому
подобные заболевания относятся к группе
так называемых молекулярных болезней.
Аномальные гемоглобины различаются
своими физико — химическими свойствами
(электрофоретической подвижностью,
резистентностью к щелочам, растворимостью,
изоэлектрической точкой), а также по
молекулярной структуре глобиновой
части (по одному из пептидов, в котором
изменена последовательность аминокислот).
Появление аномальных гемоглобинов
объясняется мутационной теорией,
передача потомкам аномального гена
осуществляется по законам наследственности.
У гетерозиготных особей (Аа) заболевание
отсутствует или обнаруживаются
субклинические признаки, у гомозиготных
(от брака гетерозиготных особей)
наблюдается развитие тяжелых анемий
гемолитического типа. В настоящее время
установлено более 200 аномальных
гемоглобинов: B (S), С, D, Е, G, J, I, К, L, M, N, О,
Р, Q и других, а также возможные их
комбинации (SC, SD и др.). На XVI Международном
конгрессе гематологов (Япония, 1976 г.)
сделаны сообщения о новых аномальных
гемоглобинах: Hb Beth (Nagel, США), Hb Austin
(Moo-Peen, США), Hb Djelfa (Labie, Франция), Hb Hrosaki
(Ohba, Япония), Hb Waco (Moo-Peen, США).
Гемоглобинозы
в гетерозиготной и гомозиготной форме
имеют распространение в экваториальной
Африке, странах, омываемых Средиземным
морем, на Аравийском полуострове, в
Южной Индии, на острове Шри-Ланка, в
Юго-Восточной Азии, Южном Китае, южных
районах США. Причину появления аномальных
гемоглобинов объясняет малярийная
гипотеза, согласно которой мутации в
гене, контролирующем образование
гемоглобина, возникли в странах с широким
распространением тропической малярии.
Было установлено, что наличие аномального
гена в гетерозиготной форме повышает
устойчивость людей к заболеванию,
создает иммунитет к малярии, так как
изменения молекулы гемоглобина
препятствуют использованию его малярийным
плазмодием.
Гемоглобин
S
Отличается
от гемоглобина А строением четвертого
пептида, в котором на шестом месте вместо
глутаминовой кислоты находится
электрически нейтральный валин.
Гемоглобин S менее растворим, нейтрален
по заряду, электрофоретически менее
подвижен. В капиллярах при отдаче
кислорода гемоглобин S выпадает в осадок
в форме веретенообразных кристаллоидов
(тактоидов), которые растягивают оболочку
и ведут к распаду эритроцитов. У
гетерозиготов содержание гемоглобина
S равняется 20 — 45 %, у гомозиготов — 60 — 90
%. Гетерозиготная форма аномалии протекает
бессимптомно или сопровождается легкой
гемолитической анемией. У гомозиготных
особей уже с первых месяцев жизни
развивается тяжелая форма серповидноклеточной
анемии.
Гемоглобин
F
Характерный
для крови плода фетальный гемоглобин
может быть обнаружен в повышенных
количествах в эритроцитах крови
недоношенных детей, при коклюше,
серповидноклеточной анемии, талассемии,
врожденной микроцитарной анемии,
пернициозной анемии, острых и хронических
лейкозах, миеломной болезни. Наибольшее
содержание (до 97 %) наблюдается при
большой талассемии.
Гемоглобин
С
Отличается
строением четвертого пептида молекулы
гемоглобина, в котором на шестом месте
вместо глутаминовой кислоты находится
лизин. Центр распространения гена С —
северная часть Ганы. Частота гетерозиготности
по данным одних авторов, до 15 %, по данным
других, — 16,5 — 28 %, среди негров США — 1,8 —
3% на Ямайке — 2,7 % (В. П. Эфроимсон). Наличие
гена С в гомозиготном состоянии ведет
к развитию выраженной спленомегалии,
умеренной микроцитарной анемии с
наличием эритроцитов мишеневидной
формы. При наличии комбинации гемоглобинов
С и S анемия оказывается более тяжелой.
Гемоглобин
D
Обнаружен
у 2 % берберов Марокко и у 0,4 % негров США.
У гомозиготов наблюдается микроцитоз,
слабый анизо- и пойкилоцитоз и
мишеневидность эритроцитов. Описано
несколько гемоглобинов D (в северо-западной
Индии, среди сикхов в Индии, на острове
Кипр, в Турции).
Гемоглобин
Е
Обнаружен
у жителей Юго-Восточной Азии: в Кампучии,
Таиланде, Бирме, Бенгалии, у веддов
Шри-Ланки, в северо-восточной Малайе, у
населения Калимантана и Сулавеси.
Частота распространения гена С в разных
местностях колеблется от 1 — 3 до 13
(Таиланд) — 20 (Бирма) — 28 — 37 % (Кампучия). У
гомозиготов ЕЕ наблюдается микроцитоз,
компенсируемый развитием эритроцитоза
(до 7 — 8 x 1012 /л).
Отмечены комбинации генов ES и ЕТ, дающие
сублетальный эффект. Клинические
проявления при других гемоглобинозах
выражены слабо, а распространение более
ограниченное (гены G, I, J, К, L, M, N, О, Р, Q).
Гемоглобинопатии
Серповидноклеточная
анемия — тяжёлое наследственное
заболевание, обусловленное точечной
мутацией гена, кодирующего структуру
β-цепи гемоглобина (см. раздел 4). В
результате в эритроцитах больных
присутствует HbS, β-цепи которого в шестом
положении вместо гидрофильной глутаминовой
кислоты содержат гидрофобную аминокислоту
валин. Появление гидрофобной аминокислоты
недалеко от начала молекулы способствует
возникновению нового центра связывания,
поэтому при низком парциальном давлении
кислорода тетрамеры дезокси-HbS ассоциируют,
образуя длинные микротрубчатые
образования, которые полимеризуются
внутри эритроцитов. Полимеризация
приводит к нарушению структуры
эритроцитов, они приобретают серповидную
форму и легко разрушаются. При этом
заболевании отмечают анемию, прогрессирующую
слабость, отставание в развитии и
желтуху.
Носители
гена серповидноклеточной анемии чаще
всего встречаются среди африканского
населения, так как они приобретают
некоторое преимущество при заболевании
малярией, часто встречающейся в странах
с тропическим климатом. Причина сохранения
гена серповидноклеточной анемии в
популяции связана с тем, что в эритроцитах
гетерозигот хуже развивается малярийный
плазмодий, часть жизненного цикла
которого проходит в эритроцитах человека.
В связи с этим гетерозиготные носители
дефектного
гена
выживали при эпидемиях малярии, однако
четверть их потомства погибала от
серповиднок-леточной анемии.
Талассемии —
наследственные заболевания, обусловленные
отсутствием или снижением скорости
синтеза α- или β-цепей гемоглобина. В
результате несбалансированного
образования глобиновых цепей образуются
тетрамеры гемоглобина, состоящие из
одинаковых протомеров. Это приводит к
нарушению основной функции гемоглобина
— транспорту кислорода к тканям. Нарушение
эритропоэза и ускоренный гемолиз
эритроцитов и клеток-предшественников
при талассемиях приводит к анемии.
При
β-талассемии не синтезируются β-цепи
гемоглобина. Это вызывает образование
нестабильных тетрамеров, содержащих
только α-цепи. При этом заболевании в
костном мозге из-за преципитации
нестабильных α-цепей усиливается
разрушение эритробластов, а ускорение
разрушения эритроцитов в циркулирующей
крови приводит к внутрисосудистому
гемолизу. Как известно, для образования
фетального гемоглобина р-цепи не
требуются (см. раздел 4), поэтому клинически
β-талассемия не проявляется до рождения,
после чего происходит переключение
синтеза HbF на НBА.
В
случае α-талассемии недостаток образования
α-глобиновых цепей приводит к нарушению
образования HbF у плода. Избыточные γ-цепи
образуют тетрамеры, называемые
гемоглобином Барта. Этот гемоглобин
при физиологических условиях имеет
повышенное сродство к кислороду и не
проявляет кооперативных взаимодействий
между протомерами. В результате гемоглобин
Барта не обеспечивает развивающийся
плод необходимым количеством кислорода,
что приводит к тяжёлой гипоксии. При
α-талассемии отмечают высокий процент
внутриутробной гибели плода. Выжившие
новорождённые при переключении с γ- на
β-ген синтезируют β-тетрамеры или НBН,
который, подобно гемоглобину Барта,
имеет слишком высокое сродство к
кислороду, менее стабилен, чем НBА и
быстро разрушается. Это ведёт к развитию
у больных тканевой гипоксии и к смерти
вскоре после рождения.
Наследственный
сфероцитоз. Причиной
этой патологии чаще всего является
дефект белков цитоскелета эритроцитов
— спектрина или ан-кирина, которые
обеспечивают поддержание двояковогнутой
формы клетки и эластичности мембраны.
Эритроциты приобретают шарообразную
форму, что приводит к уменьшению площади
их поверхности и снижению скорости
газообмена. Потеря эластичности клеточной
мембраны приводит к повышению хрупкости
и травматичности клеток и, как следствие,
к ускорению их разрушения в сосудистом
русле и селезёнке. Заболевание
сопровождается анемией и желтухой.
Удаление селезёнки (спленэктомия) при
наследственном сфероцитозе улучшает
состояние больных, так как предотвращает
разрушение сфероцитов в селезёнке.
Мегалобластная
(макроцитарная) анемия развивается
при дефиците фолиевой кислоты или
витамина В12.
Фолиевая
кислота в виде кофермента (Н4-фолата)
участвует в синтезе нуклеотидов.
Недостаток фолиевой кислоты приводит
к снижению скорости синтеза ДНК в
быстроделящихся клетках, и в первую
очередь в предшественниках эритроцитов.
Клетки дольше пребывают в интерфазе,
синтезируя гемоглобин, и становятся
крупнее. Кроме того, из-за недостатка
нуклеотидов они реже делятся, и количество
эритроцитов снижается, а крупные
мегалобласты быстрее разрушаются. Всё
это в конечном итоге приводит к развитию
анемии.
Аналогичная
симптоматика развивается при недостатке
в организме витамина В12.
Этот витамин участвует в переносе
метальной группы с N5-метил-Н4-фолата
на гомоцистеин с образованием метионина
и Н4-фолата
(см. раздел 10). Недостаточность витамина
В12 приводит
к накоплению N5-метил-Н4-фолата
в клетках. Дефицит Н4-фолата
приводит к нарушению деления клеток и
развитию анемии.
97.
Биосинтез гема. Схема процесса, химизм
первых двух реакций, место протекания.
Регуляция активности ферментов
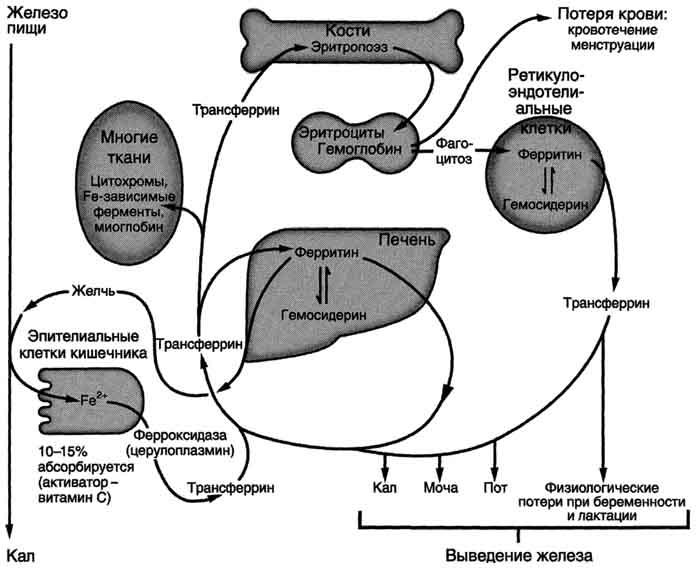
АЛК-синтазы и АЛК-дегидратазы. Источники
железа для синтеза гема, всасывание
железа, транспорт в крови, депонирование.
Гем
синтезируется во всех тканях, но с
наибольшей скоростью в костном мозге
и печени (рис. 13-2). В костном мозге гем
необходим для синтеза гемоглобина в
ретикулоцитах, в гепатоцитах — для
образования цитохрома Р450.
Рис.
13-2. Синтез гема. Цифрами
на схеме указаны ферменты: 1 —
аминолевулинатсинтаза; 2 —
аминолевулинатдегидратаза; 3 —
порфобилиногендезаминаза; 4 — уропорфириноген
III косинтаза; 5 — уропорфириногендекарбоксилаза;
6 — копропорфи-риноген III оксидаза; 7 —
протопорфириногеноксидаза; 8 —
феррохелатаза. Буквами обозначены
заместители в пиррольных кольцах: М —
метил, В — винил, П — остатки пропионовой
кислоты, А — ацетил, ПФ — пиридоксальфосфат.
Донором железа служит депонирующий
железо в клетках белок ферритин.
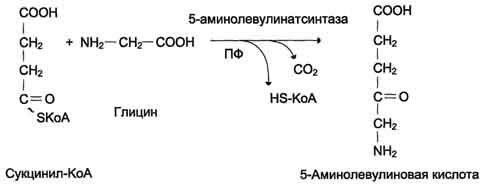
Рис.
13-3. Реакция образования 5-аминолевулиновой
кислоты.
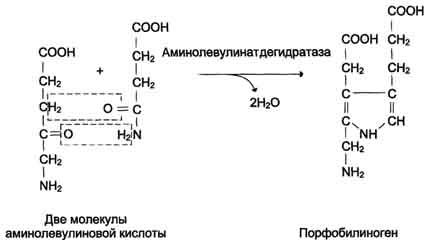
Реакция
образования порфобилиногена.
В.
Регуляция биосинтеза гема
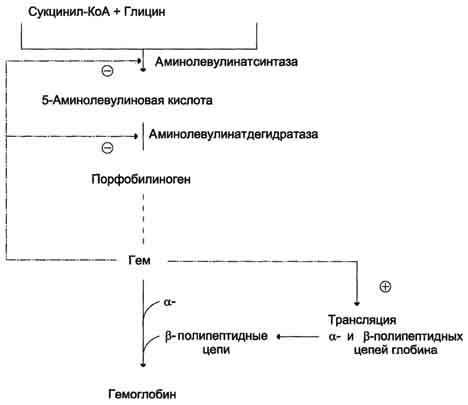
Регуляция
синтеза гема и гемоглобина. Гем
по принципу отрицательной обратной
связи ингибирует аминолевулинатсинтазу
и аминолевулинатдегидратазу и является
индуктором трансляции α- и β-цепей
гемоглобина.
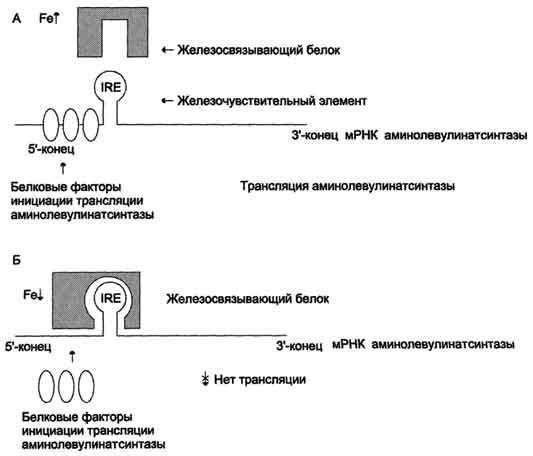
Регуляция
синтеза аминолевулинатсинтазы. А
— при высокой концентрации железа в
ретикулоцитах оно присоединяется к
железосвязывающему белку и снижает
сродство этого белка к железочувствительному
элементу (IRE) матричной РНК, кодирующей
аминолевулинатсинтазу. Белковые факторы
инициации трансляции связываются с
мРНК и инициируют трансляцию
аминолевулинатсинтазы. Б — при низком
содержании железа в ретикулоцитах
железосвязывающий белок обладает
высоким сродством к IRE и взаимодействует
с ним. Белковые факторы инициации
трансляции не могут присоединиться к
мРНК, и трансляция прекращается.
Аминолевулинатдегидратаза
также аллостерически ингибируется
гемом, но так как активность этого
фермента почти в 80 раз превышает
активность аминолевулинатсинтазы, то
это не имеет большого физиологического
значения.
Дефицит
пиридоксальфосфата и лекарственные
препараты, которые являются его
структурными аналогами, снижают
активность аминолевулинатсинтазы.
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Гемоглобин F
Это изображение матери и маленького плода,
и это точка, где плод всё ещё связан с матерью пуповиной.
Всё, что получает плод, он получает от матери.
Она контролирует все питательные вещества и кислород,
которые поступают ребёнку.
Есть несколько интересных путей того, как ребёнок
(в нашем случае этот маленький плод справа) может получить
максимально возможное количество кислорода от матери.
Мы помним, что плод старается вырасти и хочет,
чтобы все растущие и развивающиеся ткани получали
достаточно кислорода, что обеспечивается несколькими способами.
Способ 1. Я изображу его для вас на примере пробирки с кровью.
Рассмотрим одну пробирку с кровью от матери
и сравним её с пробиркой с кровью ребёнка.
Я нарисую пробирки одинаковой ширины и высоты.
Вот эти 2 пробирки.
Если бы сейчас я взял немного крови матери и центрифугировал
её в этой маленькой трубочке,
а затем сделал бы то же самое с кровью ребёнка,
взял немного крови ребёнка и тоже центрифугировал,
то такая центрифугированная кровь фактически
разделилась бы на части.
Мы бы получили 3 разных слоя.
Первый слой под названием плазма был бы таким.
Следующий слой, сразу под первым,
это тонкий слой белых клеток крови и тромбоцитов.
Сразу под ним идёт слой красных клеток крови.
Красные клетки крови — это клетки, содержащие гемоглобин.
Это единственные клетки, которые переносят кислород.
У матери процент таких красных клеток крови составляет почти 35%.
Это означает, что если взять всю кровь за 100%, то только 1/3,
или точнее 35% занимает нижний слой красных клеток крови.
Вот это слой красных клеток крови.
Назовём его гематокрит.
Это гематокрит матери, и это обычное значение для беременной женщины.
Значение гематокрита зависит от вашего пола,
а также от возраста.
Но у беременной женщины он обычно составляет 35%.
Перейдём к ребёнку.
Давайте изобразим, на что похожа кровь ребёнка.
В крови ребёнка меньшую часть занимает плазма,
поэтому здесь этот слой будет меньше.
И следующий слой, слой белых клеток крови,
остаётся таким же маленьким и практически не меняется.
Последний третий слой — слой красных клеток крови.
Этот слой занимает почти 55%.
Надеюсь, я не ошибся, и он составляет почти 55%.
Здесь значение гематокрита намного выше. Что же это означает?
Если у ребёнка гематокрит выше, почти 55%, это означает,
что у него больше красных клеток в соответствующем количестве крови,
и эти красные клетки могут принять больше кислорода,
так как именно они как часть крови его переносят.
Это и есть один из способов получения большего количества кислорода.
Просто большее количество красных клеток крови в заданном количестве крови.
У ребёнка увеличивается количество красных клеток крови,
вот один из способов, о которых я говорю.
Каков же другой способ и стратегия того, как ребёнок или плод
может получить больше кислорода от матери?
Если мы подумаем о количестве, мы можем также подумать о типе.
Я имею в виду тип гемоглобина.
Мы знаем, что взрослый гемоглобин бывает четырёх типов.
Я напишу типы взрослого гемоглобина вот здесь, слева.
И так, взрослый гемоглобин.
«Hb» — гемоглобин, и «A» — взрослый.
Я напишу здесь «взрослый», чтобы вы понимали, что к чему.
Типов взрослого гемоглобина несколько, но я изображу самый важный.
Есть ещё несколько типов…
Этот, как я сказал, самый важный состоит
из нескольких альфа-субъединиц, пептидов,
которые в определённой констелляции называются
альфа-субъединицами, и нескольких бета-субъединиц,
которые немного отличаются от альфа-субъединиц.
Соответственно мы имеем соотношение 2 на 2,
так как гемоглобин состоит из четырёх субъединиц.
Здесь мы видим по 2 субъединицы каждого типа.
С точки зрения плода всё выглядит немного иначе,
у нас есть гемоглобин, Hb, но на этот раз F — фетальный.
Фетальный гемоглобин также бывает нескольких типов,
самый важный из которых — HbF,
который также состоит из альфа-субъединиц, которых опять две,
но вместо бета-субъединиц он состоит из гамма-субъединиц.
Это греческая буква гамма.
Теперь кислород связывается обоими типами гемоглобина.
И взрослый, и фетальный гемоглобин
может связаться с 4 молекулами кислорода.
Я нарисую здесь 4 молекулы кислорода, чтобы вы поняли мысль.
Внутри красных кровяных клеток есть маленькая молекула,
я нарисую её для вас.
Она состоит из трёх углеродов, которые я пронумеровал.
Два из которых связаны с кислородом,
который в свою очередь связан с фосфатом.
Фосфат обычно имеет 5 связей.
Я просто показываю вам, как выглядит эта маленькая молекула.
То же самое происходит со всеми 3 углеродами.
Вот так выглядит молекула внутри красной клетки крови,
у неё несколько фосфатов, которые образуют подобные связи,
как показано в первом случае.
Эта маленькая молекула называется
(возможно, глядя на рисунок, вы уже догадались)
2 и 3 (я имею в виду эту 2 и вот эту 3)
Ди (так как у неё два фосфата) Ди-фосфо-глицерат.
И так, ди-фосфо и глицерат, который относится к этой части.
Именно эту часть мы имеем в виду, когда говорим о глицерате,
поэтому дифосфоглицерат.
Сокращённое название 2,3-дифосфоглицерата —
2,3-ДФГ, так как людям не нравится произносить его полное название.
Когда мы говорим «2,3-ДФГ», мы имеем в виду именно эту молекулу,
которая находится внутри красных клеток крови и
фактически помогает красной клетке крови избавляться от кислорода.
Я нарисую, как эта маленькая молекула это делает.
Теперь, когда вы знаете её состав, я просто нарисую жёлтую точку.
Это та же самая молекула, поэтому я поставил между ними знак «равно».
Эта маленькая молекула образует связь в середине красной клетки крови
с бета-субъединицами.
В реальности бета-субъединицы такой формы,
что с ними очень легко образовать связь.
Эта молекула находится между 4 субъединицами, бета- и альфа-,
фактически они формирует конформацию, или молекулярное изменение,
после которого маленькие атомы кислорода хотят выйти из её состава.
Поэтому её основная функция заключается
в облегчении выхода кислорода из гемоглобина.
Теперь, когда молекула переходит на сторону плода
и пытается образовать связь, происходит так,
что эти гамма-субъединицы начинают ей говорить: «Уходи отсюда!»
Они не хотят связываться с 2,3-ДФГ.
Их форма не подходит для такой связи.
Они просто хотят, чтобы эта молекула исчезла.
Поэтому молекула не образует связи с гемоглобином F,
в результате чего молекулы гемоглобина не теряют свой кислород
так же легко, как гемоглобин А.
Тогда зачем нам нужна здесь молекула 2,3-ДФГ?
Что она делает?
Интересно, что уровень 2,3-ДФГ повышается
при недостатке кислорода,
когда вам хронически не хватает кислорода.
Хроническая нехватка кислорода возникает, в таких ситуациях,
как например, когда вы на вершине Гималаев,
находитесь высоко над уровнем моря,
где чувствуете повышенное давление воздуха
над уровнем моря, и при этом в самом воздухе мало кислорода.
В такой ситуации ваши ткани испытывают
хроническую нехватку кислорода.
Ещё одна возможная ситуация — болезнь лёгких.
Предположим, у вас проблема с лёгкими или болезнь лёгких.
Хроническая болезнь лёгких, когда кислороду трудно попасть в кровь.
В этой ситуации тканям также не хватает кислорода,
поэтому в красных клетках крови повысится количество 2,3-ДФГ.
Наконец, это может быть анемия,
когда в организме мало циркулирующих красных клеток крови,
поэтому при анемии ткани не получают так много кислорода,
как им бы хотелось.
Опять же в этой ситуации наблюдается увеличение числа 2,3-ДФГ.
Поэтому основная функция 2,3-ДФГ —
попытаться обеспечить выведение кислорода из гемоглобина,
чтобы в случае когда тканям действительно нужен кислород,
красные клетки крови могли его легко предоставить.
Вернёмся к плоду.
Мы видим, что гемоглобин плода отличается
по своему типу от гемоглобина взрослого.
Я нарисую график, и вы увидите разницу.
Изображу кривую, но сначала маленький график.
Эта ось парциального давления кислорода,
и эта ось О2, или насыщения кислородом,
показывающая, сколько пятен на гемоглобине он закрывает.
Кривая будет идти вверх таким образом.
Начнём с того, что гемоглобин матери или взрослый гемоглобин
по причине кооперативности имеет S-образную форму.
Мы говорили об этом ранее.
Это будет гемоглобин взрослого, или гемоглобин типа А.
Также у нас есть достаточно большое количество 2,3-ДФГ.
Я изображу, как это могло бы выглядеть.
Предположим, у нас вот такой, достаточно высокий уровень 2,3-ДФГ,
что может быть вызвано одной из таких причин, как
проживание в высокогорном районе, хроническая болезнь лёгких,
постоянная анемия или любые другие ситуации.
У нас высокий уровень 2,3-ДФГ, который превышает обычный.
В этом случае произойдёт следующее: кривая будет выглядеть так.
Кривая, показывающая связывание кислорода
или насыщение кислородом, которая сдвигается вправо.
Это называется сдвиг вправо, так как выглядит так,
будто кривая просто подвинулась.
И теперь в любой точке, я просто выберу любую точку,
и ту же самую точку здесь.
Это одно и то же парциальное давление кислорода,
которое где-то здесь внизу.
При том же самом парциальном давлении кислорода
кривая направляется вниз.
Это значит, что меньшее количество кислорода связано с гемоглобином
в присутствии молекулы 2,3-ДФГ.
И это верно, так как известно, что эта молекула
помогает гемоглобину избавиться от кислорода.
Что же произойдёт при противоположной ситуации,
если я удлиню эту кривую?
Предположим, это будет ситуация с низким уровнем 2,3-ДФГ.
И это верно, так как при низком уровне 2,3-ДФГ,
когда этих молекул нет, они не могут помочь кислороду отделиться,
поэтому кислород остаётся с гемоглобином.
И так, кислород останется с гемоглобином.
При том же самом парциальном давлении кислорода
большее количество гемоглобина будет связываться с кислородом.
Вернёмся к фетальному гемоглобину.
Мы говорили, что фетальный гемоглобин состоит из гамма-субъединиц,
и гамма-субъединицы не любят молекулы 2,3-ДФГ,
они с ними не связываются,
а только говорят: «Уходи! Исчезни!»
Учитывая, что я нарисовал эту кривую для низкого уровня 2,3-ДФГ,
я мог бы просто стереть это и сказать, что это ситуация в плоде.
Фетальный гемоглобин представлен этой кривой, так?
Это кривая гемоглобина F.
Мы видим, что кривая сдвинута влево.
Основная причина этого в том, что, так как молекулы такого гемоглобина
не образуют связи с 2,3-ДФГ, то эта кривая будет идти в противоположном
от голубой кривой направлении.
Теперь посмотрите на обе эти кривые, белую и красную.
Белая кривая — кривая мамы, а красная — ребёнка.
Если вы захотите найти на белой кривой точку, где почти половина молекул
гемоглобина связалась с кислородом, то она может быть здесь.
Это означает, что пройдено полпути, 50% всего пути.
И так, 50% молекул гемоглобина связалось с кислородом
при парциальном давлении кислорода, равном 27.
Для плода та же самая точка 50% насыщения
достигается при парциальном давлении, равном 20.
Удивительно, что при более низком парциальном давлении кислорода
ребёнок или плод способен выполнить ту же самую вещь,
которую взрослый выполняет исключительно
при большем количестве кислорода в окружающей среде или крови.
Эти значения называются р50. Теперь, когда вы видите этот термин —
р50, — вы понимаете что гемоглобин F р50
ниже гемоглобина А р50,
так как фактически это 20 по сравнению с 27.
Итак, мы узнали о двух способах:
первый — количество гемоглобина или красных клеток крови у плода,
второй — тип гемоглобина и то, что гемоглобин F образует более крепкую связь
с кислородом при более низком давлении p50.
Источник