Гемоглобин по химической структуре
Содержание статьи
Строение и состав гемоглобина, структура гема и глобина, молекулярный вес и формула
Гемоглобин (Hb) — это сложный железосодержащий белок, который находится в эритроцитах. Именно он является основной составляющей эритроцитов и придает им характерный красный цвет. Это один из важнейших компонентов крови, так как основной функцией гемоглобина является перенос кислорода из альвеол легких к клеткам всего организма, а также углекислого газа в обратном направлении (к легким).
В одном эритроците содержится приблизительно 400 000 000 молекул гемоглобина.
Формула молекулы гемоглобина — С2954Н4516N780O806S12Fe4.
Молекулярная масса гемоглобина — 66 800 г/моль (66,8 кДа).
Строение гемоглобина

Строение гемоглобина в эритроците человека
Формула гемоглобина и его строение имеют не только теоретическую ценность, но и практическую. Например, замена глутаминовой кислоты на аминокислоту валин в 6-ом положении b-цепи приводит к синтезу аномального гемоглобина S — HbS, что проявляется развитием серповидноклеточной анемии.
Строение молекулы гемоглобина довольно сложное, даже несмотря на то, что в его состав входит всего 2 компонента:
- Гем
- Глобин
Гем
Гем — это природный пигмент, в состав которого входит соединение порфирина с железом. Общая доля гема в структуре гемоглобина составляет всего 4%. Железо, входящее в гем гемоглобина, имеет валентность Fe2+. Молекула гема устроена таким образом, что в ее центре находится двухвалентное железо, которое и захватывает молекулу кислорода в капиллярах альвеол.

Строение гема
Общая формула гема — C34H32O4N4.
Молекулярная масса гема — 616,5 г/моль.
Наличие в крови сильных окислителей (свободных радикалов) приводит к окислению двухвалентного железа до трехвалентного (Fe3+). Гем в этом случае превращается в гематин, а сам гемоглобин в метгемоглобин. Только двухвалентное железо способно присоединять кислород и транспортировать его от альвеол легких до тканей организма, поэтому окисление железа в составе гема и образование метгемоглобина очень негативно сказывается на способности эритроцитов транспортировать кислород, что приводит к гипоксии.
Антиоксиданты (витамины С, А, Е, селен и др.) препятствуют образованию метгемоглобина за счет инактивации свободных радикалов. А вот уже образовавшийся гематин перевести обратно в гем могут только специальные ферменты — НАДН- и НАДФН-метгемоглобинредуктаза. Именно эти ферменты восстанавливают Fe3+ в составе метгемоглобина до Fe2+ гемоглобина.
Глобин
Глобин — это альбуминовый белок, который составляет 96% массы гемоглобина и состоит из 4 цепей — 2 α и 2 β .
 Строение белка глобина — альфа- и бета-цепи
Строение белка глобина — альфа- и бета-цепиКаждая альфа-цепь глобина состоит из 141 аминокислоты, бета-цепь — из 146 аминокислот. Всего в молекуле гемоглобина присутствует 574 аминокислотных остатка.
Глобин человека, в отличие от глобина животных не содержит в своем составе аминокислот лейцин и цистин.
Молекулярный вес глобина составляет 64 400 г/моль (64,4 кДа).
Альфа- и бета-цепи глобина образуют 4 гидрофобным кармана, в которых располагается 4 гема. Именно гидрофобный карман белка глобина позволяет железу гема присоединять кислород не окисляясь, т.е. без перехода в Fe3+. Особое значение в формировании гидрофобного кармана играют 3 аминокислотных остатка: проксимальный гистидин, дистальный гистидин и валин.
Источник
емоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
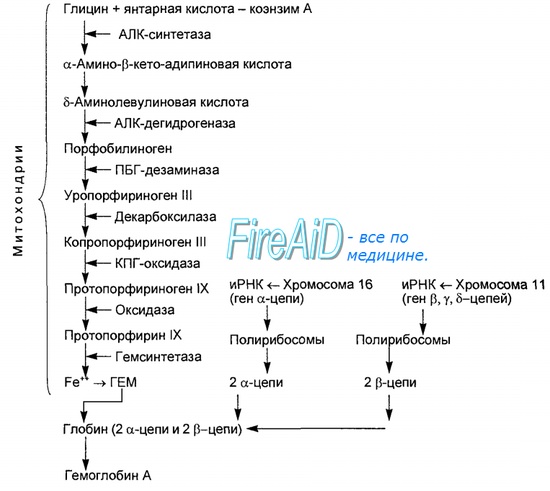
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. — Также рекомендуем «Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.» |
Источник
обин — Доказательная медицина для всех
Гемоглобин (Hb) — сложный белок, обеспечивающий транспорт кислорода из легких к тканям. Гемоглобин состоит из белковых цепей и гема — порфиринового кольца, которое содержит железо.
Физиологически, основной функцией гемоглобина является перенос кислорода из легких к органам и тканям, но не меньшей важностью является перенос гемоглобином оксида азота (NO) и регуляция тонуса сосудов (вазомоторного тонуса).
Низкий уровень гемоглобина является одним из проявлений анемии, повышенный уровень гемоглобина также является признаком ряда заболеваний и патологических состояний.
Гемоглобин. Цифры и факты
- Одна молекула гемоглобина переносит четыре молекулы кислорода
- Во всем гемоглобине в организме содержит 2,5 грамма железа у мужчин и 1,9 грамма у женщин
- Паразит, вызывающий малярию, малярийный плазмодий, питается гемоглобином. Подробнее о малярии
ЭТО ИНТЕРЕСНО: физиологический процесс распада гемоглобина в организме называется гемоглобинолизом
Виды гемоглобинов
В организме здорового взрослого человека присутствует несколько типов гемоглобина:
- Гемоглобин А (HbA)
- Гемоглобин A2 (HbA2)
- Фетальный гемоглобин (HbF)
- Гликированный гемоглобин (HbA1C)
Гликированный гемоглобин имеет важнейшее значение в диагностике и лечении сахарного диабета
Нормы гемоглобина
Казалось бы, все знают, что норма гемоглобина для женщин составляет 120-140 г/л (грамм на литр), а для мужчин 140-160 г/л. Но как и с нормальными показателями уровня сывороточного железа, с нормами гемоглобина не все так просто.
ЭТО ИНТЕРЕСНО: Методы определения концентрации гемоглобин в крови называются гемоглобинометрией
Сначала интересные факты о том, откуда взялись вышеуказанные нормы. Эти нормы разработаны ВОЗ, но разработаны они не для оценки нормального уровня гемоглобина как такового, а для оценки питания. Т.е. проще говоря, эти уровни гемоглобина соответствующие указанному диапазону, с точки зрения экспертов ВОЗ, говорят о том, что человек, в общем то, неплохо питается, не более того.
Ассоциация гематологов США предлагает рассматривать нижнюю границу нормы гемоглобина, на следующем уровне:
Популяция* | Нижняя граница нормы гемоглобина |
Мужчины в возрасте от 20 до 59 лет | 137 г/л |
Мужчины в возрасте старше 60 лет | 132 г/л |
Женщины 20 лет и старше | 122 г/л |
* Нормы гемоглобин для представителей европеоидной расы
Как следует из приведенной таблицы, на уровень гемоглобина влияют пол и возраст, другие факторы, влияющие на уровень гемоглобина:
- Проживание на большой высоте
- Занятия спортом
- Курение
- Раса
- Сопутствующие заболевания
У курящих, живущих на большой высоте, спортсменов — уровень гемоглобина будет выше, т.е. то, что для других норма, для других будет уже анемией. Как и наоборот, то, что для людей живущих примерно на уровне моря будет повышенным уровнем гемоглобина, для курящих, спортсменов и живущих на большой высоте будет нормой.
Норма гемоглобина у беременных женщин*
Первый триместр | Второй триместр | Третий триместр | |
Гемоглобин (г/л) | 116-139 | 97-148 | 9.5-150 |
Гематокрит (в процентах) | 31.0-41.0 | 30.0-39.0 | 28.0-40.0 |
*Данные показатели получены в результате клинических исследований, но не являются нормативными. Подробнее о некоторых лабораторных нормах у беременных женщин.
Итак, после того, как мы рассказали о сложностях в оценке того, какой уровень является нормальным для гемоглобина, а какой нет, мы расскажем на какие нормативные показатели обычно ориентируются врачи.
Показатель | Мужчины | Женщины |
Гемоглобин г/л | 157 ± 17 | 138 ± 15 |
Гематокрит % | 46.0 ± 4.0 | 40.0 ± 4.0 |
Эритроцитов в мкл | 5.2 ± 0.7 | 4.6 ± 0.5 |
Ретикулоциты % | 1.6 ± 0.5 | 1.4 ± 0.5 |
Средний объем эритроцита, fL | 88.0 ± 8.0 | |
Среднее содержание гемоглобина в эритроците | 30.4 ± 2.8 | |
Средняя концентрация гемоглобина в эритроците | 34.4 ± 1.1 | |
Ширина распределения эритроцитов | 13.1 ± 1.4 | |
Напомним, что нормальные показатели гемоглобина у взрослых отличаются от показателей у детей.
Гемоглобин у детей
Возраст | Гемоглобин, г/л | Гематокрит, % | Средний эритроцитарный объем, мкм3 |
Новорожденные | 165 ± 30 | 51 ± 9 | 108 ± 10 |
1 мес | 140 ± 40 | 43 ± 12 | 104 ± 19 |
6 мес | 115 ± 20 | 35 ± 6 | 91 ± 17 |
1 год | 120 ± 15 | 36 ± 3 | 78 ± 8 |
2—6 лет | 125 ± 10 | 37 ± 3 | 81 ± 6 |
6—12 лет | 135 ± 20 | 40 ± 5 | 86 ± 9 |
12—18 лет | 140 ± 20 | 42 ± 6 | 89 ± 11 |
Подготовка к анализу на гемоглобин
Подготовка к анализу на гемоглобин обычно не требуется. Перед анализом необходимо пить достаточное количество жидкости, чтобы не допустить обезвоживания. Анализ на гемоглобин может быть сдан отдельно, но чаще всего, исследование гемоглобина проводится в рамках проведения общего анализа крови. В некоторых случаях общий анализ крови может потребовать подготовки в виде 12 часового голодания.
Симптомы пониженного гемоглобина
Пониженный гемоглобин приводит к недостаточному обеспечению органов и тканей кислородом. ОБычно симптомы низкого гемоглобина включают:
- слабость
- одышку
- головокружение
- учащенное сердцебиение
- шум в ушах
- головную боль
- похолодание конечностей
- побледнение или желтизну кожи
- боль в груди
Подробно симптомы связанные с пониженным гемоглобином обсуждаются в статье об анемиях.
Источник
Строение и состав гемоглобина, структура гема и глобина, молекулярный вес и формула
Гемоглобин (Hb) — это сложный железосодержащий белок, который находится в эритроцитах. Именно он является основной составляющей эритроцитов и придает им характерный красный цвет. Это один из важнейших компонентов крови, так как основной функцией гемоглобина является перенос кислорода из альвеол легких к клеткам всего организма, а также углекислого газа в обратном направлении (к легким).
В одном эритроците содержится приблизительно 400 000 000 молекул гемоглобина.
Формула молекулы гемоглобина — С2954Н4516N780O806S12Fe4.
Молекулярная масса гемоглобина — 66 800 г/моль (66,8 кДа).
Строение гемоглобина

Строение гемоглобина в эритроците человека
Формула гемоглобина и его строение имеют не только теоретическую ценность, но и практическую. Например, замена глутаминовой кислоты на аминокислоту валин в 6-ом положении b-цепи приводит к синтезу аномального гемоглобина S — HbS, что проявляется развитием серповидноклеточной анемии.
Строение молекулы гемоглобина довольно сложное, даже несмотря на то, что в его состав входит всего 2 компонента:
- Гем
- Глобин
Гем
Гем — это природный пигмент, в состав которого входит соединение порфирина с железом. Общая доля гема в структуре гемоглобина составляет всего 4%. Железо, входящее в гем гемоглобина, имеет валентность Fe2+. Молекула гема устроена таким образом, что в ее центре находится двухвалентное железо, которое и захватывает молекулу кислорода в капиллярах альвеол.

Строение гема
Общая формула гема — C34H32O4N4.
Молекулярная масса гема — 616,5 г/моль.
Наличие в крови сильных окислителей (свободных радикалов) приводит к окислению двухвалентного железа до трехвалентного (Fe3+). Гем в этом случае превращается в гематин, а сам гемоглобин в метгемоглобин. Только двухвалентное железо способно присоединять кислород и транспортировать его от альвеол легких до тканей организма, поэтому окисление железа в составе гема и образование метгемоглобина очень негативно сказывается на способности эритроцитов транспортировать кислород, что приводит к гипоксии.
Антиоксиданты (витамины С, А, Е, селен и др.) препятствуют образованию метгемоглобина за счет инактивации свободных радикалов. А вот уже образовавшийся гематин перевести обратно в гем могут только специальные ферменты — НАДН- и НАДФН-метгемоглобинредуктаза. Именно эти ферменты восстанавливают Fe3+ в составе метгемоглобина до Fe2+ гемоглобина.
Глобин
Глобин — это альбуминовый белок, который составляет 96% массы гемоглобина и состоит из 4 цепей — 2 α и 2 β .
 Строение белка глобина — альфа- и бета-цепи
Строение белка глобина — альфа- и бета-цепиКаждая альфа-цепь глобина состоит из 141 аминокислоты, бета-цепь — из 146 аминокислот. Всего в молекуле гемоглобина присутствует 574 аминокислотных остатка.
Глобин человека, в отличие от глобина животных не содержит в своем составе аминокислот лейцин и цистин.
Молекулярный вес глобина составляет 64 400 г/моль (64,4 кДа).
Альфа- и бета-цепи глобина образуют 4 гидрофобным кармана, в которых располагается 4 гема. Именно гидрофобный карман белка глобина позволяет железу гема присоединять кислород не окисляясь, т.е. без перехода в Fe3+. Особое значение в формировании гидрофобного кармана играют 3 аминокислотных остатка: проксимальный гистидин, дистальный гистидин и валин.
Источник
Гемоглобин — основной белок крови
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. — альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы «в кармане» своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
Источник