Гемоглобин соединяется с кислородом за счет
Содержание статьи
Гемоглобин: роль в газообмене и процессе дыхания
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии… Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1–2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
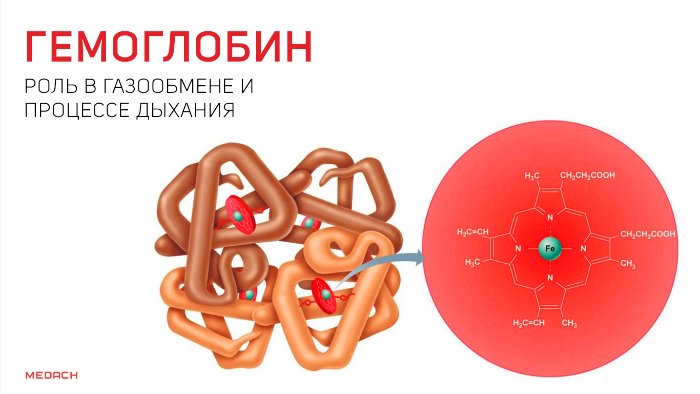
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
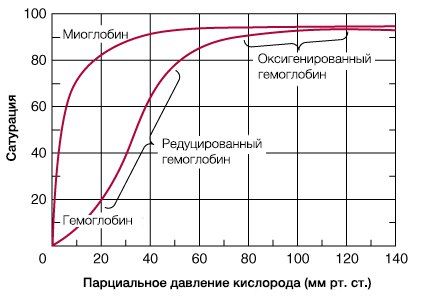
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.
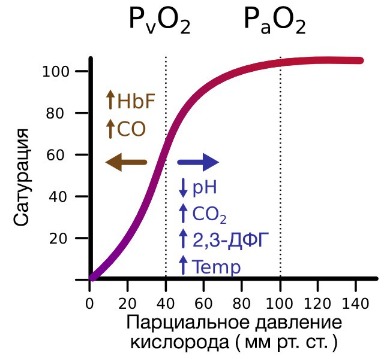
В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
- Harrison’s hematology and oncology Longo, Dan L (Dan Louis), Third edition. New York : McGraw-Hill Education Medical, 2017.
- Наглядная физиология, С. Зильбернагль, А. Деспопулос, 2013.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. /Д. Нельсон, М. Кокс ; Пер. с англ.-М.: БИНОМ: Лаборатория знаний, 2011.- 694 с.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Эффективность связывания кислорода с гемоглобином регулируется
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
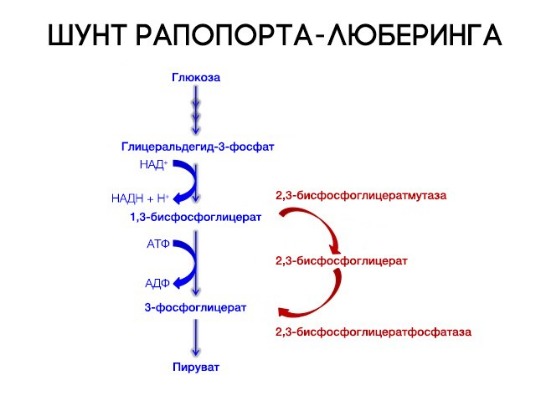
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Источник
Почему низкий гемоглобин и как от него избавиться

Гемоглобин — это особый белок крови, имеющийся в эритроцитах. Выполняет жизненно важную функцию. Благодаря ему клетки и ткани насыщаются кислородом, в организме происходит обмен газов и веществ. Поэтому значимость гемоглобина невозможно переоценить. Если его уровень падает, наблюдаются проблемы со здоровьем. Виной этому могут стать разные причины. Так что необходимо поддерживать в норме показатель белка и знать способы для его восстановления.
Содержание:
Симптомы и причины понижения гемоглобина
Какая норма гемоглобина
Как повысить гемоглобин
Симптомы и причины понижения гемоглобина
Недостаточное содержание гемоглобина в крови провоцирует частую усталость, недомогание, сонливость, наблюдается упадок сил, плохое настроение. Также больные жалуются на постоянную головную боль и головокружение. Помимо этого, отмечается бледность кожных покровов, плохой аппетит, шум в ушах, похолодание рук и ног, извращение вкуса, болевые ощущения в мышцах, также частое развитие простудных и вирусных инфекций.
В тяжелых случаях человек может терять сознание. Поэтому стоит в таком случае обязательно посетить врача и сдать необходимые анализы.
Ничего не происходит просто так. В том числе с гемоглобином, он не может снизиться без причин. На это недостаточность в организме указывают серьезные болезни и некоторые состояния:
Железодефицитная анемия в хронической форме.
Различные кровотечения.
Длительно текущий гастрит.
Воспалительные патологии кишечника, дисбактериоз.
Временной промежуток после операции.
Онкология клеток крови.
Новообразования в органах пищеварительного тракта.
Гепатит.
Туберкулез, пневмония.
Недостаток железа.
Дефицит витамина В12 и фолиевой кислоты.
Разрушение структуры эритроцитов вследствие тяжелых патологий.
Соблюдение диеты, которая предполагает ограничение большого количества продуктов питания.
Причинами снижения гемоглобина могут выступать всевозможные состояния. Однако, наибольшее влияние на дефицит белка оказывают разные кровопотери вследствие оперативного вмешательства, травм, ранения, геморроя.
У женского пола понижение гемоглобина чаще всего возникает на фоне менструации, которая длится свыше 5 дней.
Какая норма гемоглобина
Как уже известно, белок находится в красных кровяных тельцах и отвечает за перенос кислорода в организме.
Чтобы поддерживать нормальный уровень здоровья, исключить усталость, недомогание и другие характерные признаки низкого гемоглобина, рекомендуется регулярно сдавать анализ крови на определение белка.
Норма гемоглобина у всех разная, в зависимости от возраста, пола и физиологических особенностей организма. Так, для мужчин данный показатель составляет 125-160 г/л, для женщин 115-140 г/л. У новорожденных малышей уровень белка находится в пределах 140-195 г/л, для детей одного года жизни характерен гемоглобин 110 г/л. А в школьном возрасте показатель белка крови составляет не менее 150 г/л.
У женщин в период вынашивания ребенка гемоглобин падает и это считается нормой. В это время его значение около 110 г/л.
Как правило, низкий показатель связан с железодефицитной анемией, которая встречается у большинства людей вне зависимости от возраста и пола.
Как повысить гемоглобин
Для более эффективного лечения недостаточности белка крови, следует пройти медицинское обследование, в частности сдать лабораторные анализы для подтверждения диагноза. Поскольку дефицит гемоглобина может быть вызван различными состояниями, которые устраняются по-разному.
Самый основной и действенный метод терапии — это диета.
Следует обогащать рацион продуктами питания, которые содержат максимальное количество железа. Предпочтение стоит отдавать пище животного происхождения, поскольку она приносит больше пользы организму и лучше усваивается.
При анемии рекомендуется употреблять:
Свиное, куриное и говяжье мясо.
Печень любая.
Яйца, особенно желток.
Морепродукты — икра, рыба, устрицы.
Грецкие орехи, миндаль.
Овощи — сырые и вареные свекла, морковь, белокочанная и красная капуста, и другое.
Фрукты — яблоки, гранат, бананы, виноград.
Ягода — малина, шиповник.
Молочные продукты, особенно сливки и молоко высокой жирности.
Фруктовые и овощные соки.
Отвары лекарственных трав и их плодов.
Грибы.
Бобовые культуры.
Крупы — гречневая, овсяная.
Рацион питания должен быть сбалансированным, витаминизированным. Для максимального извлечения пользы от продуктов, их нужно уметь правильно готовить и употреблять. Например, свеклу желательно есть в сочетании с растительным маслом, грецкие орехи с жидким медом, сырую тертую морковь с жирной сметаной. Яблоки рекомендуется употреблять вместе с кожурой. Кофе, чаи следует заметить отваром шиповника, свежевыжетым соком из граната, свеклы или моркови.
Чтобы усвоение гемоглобина было максимальным, важно есть продукты питания вместе с пищей, содержащей аскорбиновую кислоту.
В случае тяжелой формы анемии, одной диетой не обойтись. В таком случае пациентам назначают лекарственные препараты, повышающие уровень гемоглобина в крови. Подобные средства отпускаются в разных формах: капсулы, таблетки, сироп, капли и инъекции. Курс лечения и дозировку препаратов рассчитывает врач с учетом сопутствующих заболеваний и тяжести анемии. Принимать лекарства следует в промежутках между приемами еды или после пищи.
При дефиците гемоглобина не стоит заниматься самолечением, чтобы еще больше не навредить своему здоровью. Важно обратиться к врачу, если наблюдаются какие-либо характерные симптомы и как можно раньше начать терапию.
Источник