Гемоглобин строение его соединения
Содержание статьи
Гемоглобин и его соединения. Нормальная физиология
Гемоглобин и его соединения
Гемоглобин – особый белок хромопротеида, благодаря которому эритроциты выполняют дыхательную функцию и поддерживают рН крови. У мужчин в крови содержится в среднем 130–160 г/л гемоглобина, у женщин – 120–150 г/л.
Гемоглобин состоит из белка глобина и 4 молекул гема. Гем имеет в своем составе атом железа, способный присоединять или отдавать молекулу кислорода. При этом валентность железа, к которому присоединяется кислород, не изменяется, т. е. железо остается двухвалентным. Гемоглобин, присоединивший к себе кислород, превращается в оксигемоглобин. Это соединение непрочное. В виде оксигемоглобина переносится большая часть кислорода. Гемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. Гемоглобин, соединенный с углекислым газом, носит название карбгемоглобина. Это соединение также легко распадается. В виде карбгемоглобина переносится 20% углекислого газа.
В особых условиях гемоглобин может вступать в соединение и с другими газами. Соединение гемоглобина с угарным газом (СО) называется карбоксигемоглобином. Карбоксигемоглобин является прочным соединением. Гемоглобин блокирован в нем угарным газом и неспособен осуществлять перенос кислорода. Сродство гемоглобина к угарному газу выше его сродства к кислороду, поэтому даже небольшое количество угарного газа в воздухе является опасным для жизни.
При некоторых патологических состояниях, например, при отравлении сильными окислителями (бертолетовой солью, перманганатом калия и др.) образуется прочное соединение гемоглобина с кислородом – метгемоглобин, в котором происходит окисление железа, и оно становится трехвалентным. В результате этого гемоглобин теряет способность отдавать кислород тканям, что может привести к гибели человека.
В скелетных и сердечной мышцах находится мышечный гемоглобин, называемый миоглобином. Он играет важную роль в снабжении кислородом работающих мышц.
Имеется несколько форм гемоглобина, отличающихся строением белковой части – глобина. У плода содержится гемоглобин F. В эритроцитах взрослого человека преобладает гемоглобин А (90%). Различия в строении белковой части определяют сродство гемоглобина к кислороду. У фетального гемоглобина оно намного больше, чем у гемоглобина А. Это помогает плоду не испытывать гипоксии при относительно низком парциальном напряжении кислорода в его крови.
Ряд заболеваний связан с появлением в крови патологических форм гемоглобина. Наиболее известной наследственной патологией гемоглобина является серповидноклеточная анемия. Форма эритроцитов напоминает серп. Отсутствие или замена нескольких аминокислот в молекуле глобина при этом заболевании приводит к существенному нарушению функции гемоглобина.
В клинических условиях принято вычислять степень насыщения эритроцитов гемоглобином. Это так называемый цветовой показатель. В норме он равен 1. Такие эритроциты называются нормохромными. При цветовом показателе более 1,1 эритроциты гиперхромные, менее 0,85 – гипохромные. Цветовой показатель важен для диагностики анемий различной этиологии.
Читайте также
Гемоглобин
Гемоглобин
Обычно исследуют капиллярную кровь, которую получают путем укола иглой-скарификатором в мякоть IV пальца левой руки (реже – мочки уха) или венозную кровь из локтевой вены (при работе на автоматических анализаторах).За идеальную норму принимают концентрацию
Гликолизированный гемоглобин
Гликолизированный гемоглобин
Гликолизированный гемоглобин (HbAlc) – используется как показатель риска развития осложнений сахарного диабета. В соответствии с рекомендациями ВОЗ этот тест признан оптимальным и необходимым для контроля за качеством лечения
Гемоглобин
Гемоглобин
Норма: не обнаруживается («ОТРИЦАТЕЛЬНО»).NB! Положительный результат отражает присутствие свободного гемоглобина или миоглобина в моче. Это результат внутрисосудистого, внутрипочечного, мочевого гемолиза эритроцитов с выходом гемоглобина или повреждения и
Гемоглобин
Гемоглобин
Снижение содержания гемоглобина говорит об анемии. Она может развиться в результате потери гемоглобина при кровотечениях, при заболеваниях крови, сопровождающихся разрушением эритроцитов. Низкий гемоглобин также возникает вследствие переливания
Гликозилированный гемоглобин
Гликозилированный гемоглобин
Это биохимический показатель крови, отражающий среднее содержание сахара в крови за длительный период времени (до 3 месяцев), в отличие от исследования глюкозы крови, которое дает представление об уровне глюкозы крови только на момент
Гемоглобин
Гемоглобин
Норма: не обнаруживается («ОТРИЦАТЕЛЬНО»).
NB! Положительный результат отражает присутствие свободного гемоглобина или миоглобина в моче. Это результат внутрисосудистого, внутрипочечного, мочевого гемолиза эритроцитов с выходом гемоглобина или повреждения и
«ГЕМОГЛОБИН»
«ГЕМОГЛОБИН»
Вымойте говяжью печень, нарежьте ее ломтиками и слегка обжарьте на масле, чтобы она оставалась полусырой. Затем положите на ломтик черного хлеба и посыпьте сверху тертым сыром. На сыр положите ломтик сала и плотно, штука к штуке, уложите поверх сала маслины,
ФОСФОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
ФОСФОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Фосфорорганические соединения снижают активность холинэстеразы в организме, что способствует накоплению ацетилхолина. Самый распространенный из фосфорорганических пестицидов – тиофос – представляет собой прозрачную бесцветную
ХЛОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
ХЛОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Кроме желудочно-кишечного тракта, для хлорорганических пестицидов «входными воротами» служат дыхательные пути и слизистые оболочки. Большинство этих веществ являются жирорастворимыми, поэтому они могут накапливаться в жировой ткани
Гемоглобин
Гемоглобин
Гемоглобин (ИЬ) составляет 95% от белков эритроцита. Отсутствие ядра в эритроците предоставляет место для большего количества молекул гемоглобина. Это означает, что клетка может нести больше кислорода. Дело в том, что кислород очень плохо растворяется в плазме
Как увеличить гемоглобин
Как увеличить гемоглобин
Игнатьева Татьяна Во время беременности вы можете столкнуться и с так называемой «физиологической анемией», когда уровень гемоглобина опускается до 100 мг% (в норме для женщин 120–140 мг%). Это происходит из-за увеличения объёма крови, усиления
Фенольные соединения
Фенольные соединения
Эти вещества содержат ароматические кольца с гидроксильной группой, а также их функциональные производные. Фенольные соединения, в ароматическом кольце которых имеется более одной гидроксильной группы, называют полифенолами.Большинство
Скелет и его соединения
Скелет и его соединения
Скелет (от греч. skeleton – высохший, высушенный) – формообразующая конструкция тела – выполняет множество функций. Главными из них являются опора, защита, преодоление силы тяжести. Кости представляют собой систему рычагов, которые под влиянием
Источник
емоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
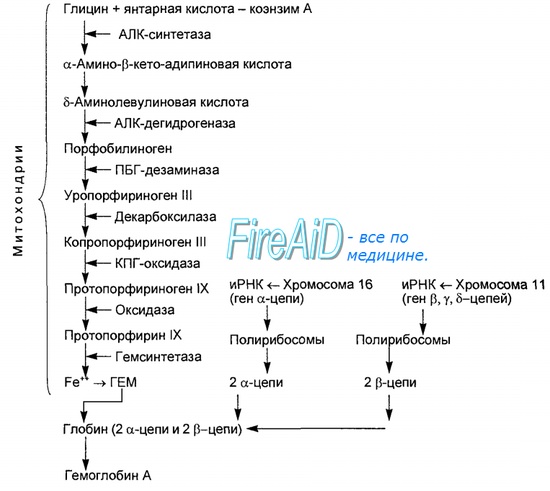
Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. — Также рекомендуем «Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.» |
Источник
Строение гемоглобина, биологическая и физиологическая роли, небелковая часть, число генов, клиническое значение
Строение гемоглобина влияет на его способность присоединять кислород, он содержит красный пигмент гем с железом и белок глобин. Они соединяются в субъединицы, а потом четыре из них скрепляются в один комплекс. Каждый гем с глобином могут переносить кислород и забирать из тканей углекислый газ.
Биологическая роль гемоглобина состоит в обеспечении тканевого дыхания, он также регулирует кислотность крови, связывает токсины. Нормальными формами считается оксигемоглобин (соединение с кислородом), дезоксигемоглобин (углекислота вместо кислорода). В норме в крови есть и немного окисленной формы (метгемоглобин), но при повышении ее уровня нарушается способность гемоглобина обеспечивать ткани кислородом.
Строение гемоглобина и его структура
Гемоглобин имеет в структуре две части – белок глобин и небелковый гем, строение молекулы позволяет ему присоединять и отдавать кислород, воду и углекислый газ. Гем относится к пигментам, то есть красящим веществам. Он придает крови алый цвет. Внутри гема есть железо. Гемоглобин содержит 4 гема, каждый со всех сторон обвит цепочкой аминокислот белка глобина. Эти 4 субъединицы позволяют связывать 4 молекулы кислорода из воздуха в легких.
Эритроциты, состоящие на 95% из гемоглобина, захватывают кислородные молекулы и переносят его к клеткам организма. Гемоглобин отдает кислород, а взамен забирает воду и углекислый газ, которые выделяются также через легкие. Соединение гемоглобина с кислородом называется оксигемоглобин, а с углекислотой – дезоксигемоглобин. Все они в норме есть в эритроцитах.
Если гемоглобин соединяется с угарным газом, то блокируются все 4 части молекулы, в результате она теряет способность соединяться с кислородом. Если есть отравление азотом или цианидами, то железо становится из двухвалентного (нормального) трехвалентным. Это тоже нарушает перенос кислородных молекул, образуется метгемоглобин. Подобная реакция бывает и при отравлении некоторыми медикаментами, наследственных болезнях.
Виды
Все виды гемоглобина делятся на нормальные (физиологические) и с нарушенной структурой (патологические). Для их обозначения используют латинские буквы и сокращение Hb (haemoglobinum).
Нормальные формы
В норме можно найти в крови:
- зрелый гемоглобин HbA, его у взрослого 95-98%, а у новорожденного 80%;
- фетальный гемоглобин HbF (фетус означает плод) образуется со 2 месяца беременности у плода, циркулирует до рождения, разрушается в первую неделю жизни, отличается большей способностью захватывать кислород;
- эмбриональный HbE образуется у плода до 2 месяца внутриутробного развития.
В зависимости от того, что присоединил гемоглобин, выделены формы:
- HbО2 – соединение с кислородом (оксигемоглобин);
- HbСО2 – гемоглобин с углекислым газом, он называется дезоксигемоглобин;
- HbMet – метгемоглобин с окисленным железом, его количество в норме допускается до 3%.
Патологические
Патологических гемоглобинов известно более 300 форм. Наиболее часто находят:
- HbS – гемоглобин при серповидно-клеточной анемии;
- HbCO – карбоксигемоглобин, образующийся при отравлении угарным газом;
- HbA1С – гликозилированный гемоглобин, его уровень возрастает при сахарном диабете.
Железо входит в состав гемоглобина крови?
Ионы металла железа входят в состав гемоглобина и находятся в центре каждой из 4 субъединиц. У них есть 4 связи постоянные и две свободные валентности, одна из них соединена с белком, а ко второй может прикрепиться кислород или вода, азот, углекислота.
Небелковая часть гемоглобина
Гем – это небелковая часть гемоглобина, составляющая 4% от его массы. По химическим свойствам он является пигментом красного цвета. Молекула гемоглобина содержит ионы железа двухвалентного, при окислении оно переходит в трехвалентное, а гем – в гематин, гемоглобин – в метгемоглобин. Перенос кислорода при этом нарушается.
Провоцируют потерю способности к транспортировке молекул свободные радикалы. Они образуются при обменных нарушениях, сахарном диабете, применении некоторых медикаментов (Парацетамол, сульфаниламиды), попадании нитратов из воды и продуктов. Препятствуют окислению гема витамины С, А, Е и микроэлемент селен. Они относятся к системе антиоксидантной защиты организма. Больше всего их содержится в таких продуктах:
- болгарском перце, черной смородине, цитрусовых, зеленом горошке (витамин С);
- говяжьей печени, молоке, твороге, моркови, шпинате (витамин А и провитамин каротин);
- растительном масле, зародышах пшеницы, орехах (витамин Е);
- яйцах, кукурузе, чечевице, миндале, бразильских орехах (селен).
Биологическая роль гемоглобина
Основная биологическая роль гемоглобина – это обеспечение тканевого дыхания, переноса кислорода для образования энергии и удаления углекислого газа. При этом первая его функция основная для организма, так как без гемоглобина кислородное обеспечение невозможно. Для выведения углекислоты есть и другие пути – 80% ее просто растворяется в крови и только 20% переносит гемоглобин.
Нарушение этих процессов происходит при снижении абсолютного числа гемоглобина или потери его активности. Чтобы проверить достаточность питания клеток кислородом, назначается общий анализ крови, а последствия нехватки показывает биохимия:
- напряжение кислорода;
- кислородная емкость;
- артерио-венозная разница по кислороду;
- насыщение гемоглобина кислородом.
Какое число гемов в составе молекулы гемоглобина
Каждая молекула гемоглобина содержит 4 единицы гема. Они образуются из аминокислоты глицина и органической янтарной кислоты. Первый компонент (глицин) содержатся в мясных и рыбных продуктах (говядина, курица, тунец, окунь, щука, скумбрия). Источником янтарной кислоты может стать:
- кефир, простокваша, йогурт, творог;
- крыжовник, вишня, яблоки;
- семена и масло подсолнечника;
- ржаной хлеб.
Физиологическая роль гемоглобина
Физиологическая роль гемоглобина не ограничивается только процессом тканевого дыхания, он также:
- поддерживает равновесие между кислотами и щелочами;
- выводит из клеток кислоту, предупреждая их закисление, снижающее иммунную реакцию;
- тормозит защелачивание крови в легких;
- связывает токсические соединения (нитраты, углекислый газ, сероводород, цианиды), но при их высокой концентрации возникает кислородное голодание или даже смерть.
Гемоглобин: клиническое значение
При снижении нормальных форм гемоглобина в крови ставят диагноз анемии, клиническое значение имеют показатели ниже 100 г/л при норме 120-140 г/л для женщин и 135-160 г/л для мужчин. Для детей результат рассматривают в зависимости от возраста – нижняя граница может быть от 90 единиц для грудничков и 105-115 для ребенка в 7-12 лет.
Симптоматика сниженного гемоглобина в крови включает признаки дефицита кислорода: общая и мышечная слабость, одышка, частый пульс, быстрая утомляемость, головная боль, головокружение, обморочные состояния. Анализ крови на эритроциты и гемоглобин покажет их нехватку, но не дает возможности определить причину. Поэтому требуется обследование: тесты на ферритин, трансферрин, железо и способность к его связыванию.
Реже обнаруживают гемоглобин выше нормы, это состояние называется полиглобулией и бывает при опухолевом процессе, длительной дыхательной и сердечной недостаточности. Для высоких показателей типично покраснение кожи, синева в носогубном треугольнике, головные боли, снижение зрения, тяжесть в правом подреберье.
Миоглобин и гемоглобин – отличия
Миоглобин и гемоглобин похожи, но первый находится в мышечной ткани, в отличие от гемоглобина, циркулирующего в крови. Он способен присоединять и временно удерживать кислород, перемещать его внутри клеток. При недостаточном поступлении кислорода миоглобин временно устраняет его дефицит.
Молекула гемоглобина имеет сложную структуру, состоит из нескольких белковых цепей, а миоглобин имеет только одну цепочку. В норме миоглобина в крови нет, он появляется только при разрушении мышечной ткани. Этим признаком пользуются при постановке диагноза инфаркта миокарда, так как в сердечной мышце содержится особый вид этого белкового комплекса.
Частые вопросы по структуре гемоглобина
Какая валентность железа в гемоглобине? В норме железо двухвалентное, при окислении переходит в трехвалентное, что ухудшает перенос кислорода.
В чем особенность химического строения гемоглобина? Гемоглобин имеет четвертичную структуру, то есть белковые цепи и пигмент вначале соединены в комплексы (первичная структура), а потом эти четыре субъединицы скрепляются между собой.
Что такое нативный гемоглобин и какую он имеет структуру? Нативный гемоглобин – это нормальный, не поврежденный, в его структуре есть гем и глобин, соединенные в 4 комплекса.
Сколько атомов железа в молекуле гемоглобина? В составе гемоглобина 4 гема с железом, поэтому в одной молекуле содержится 4 атома этого микроэлемента.
Строение гемоглобина позволяет ему присоединить кислород, переносить его к клеткам, забирать углекислый газ. При снижении возникает анемия с симптомами кислородного голодания.
Источник