Гемоглобин структура биологическая роль
Содержание статьи
Гемоглобин, строение, свойства, биологическая роль.
Гемоглобины — родственные белки, находящиеся в эритроцитах человека и позвоночных животных. Эти белки выполняют 2 важные функции:
• перенос О2 из лёгких к периферическим тканям;
• участие в переносе СО2 и протонов из периферических тканей в лёгкие для последующего выведения из организма.
Кровь ежедневно должна переносить из лёгких в ткани около 600 л О2. Так как О2 плохо растворим в воде, то практически весь кислород в крови связан с гемоглобином эритроцитов.
От способности гемоглобина насыщаться О2 в лёгких и относительно легко отдавать его в капиллярах тканей зависят количество получаемого тканями О2. и интенсивность метаболизма. С другой стороны, О2 — сильный окислитель, избыток поступления О2 в ткани может привести к повреждению молекул и нарушению структуры и функций клеток. Поэтому важнейшая характеристика гемоглобина — его способность регулировать сродство к О2 в зависимости от тканевых условий.
Гемоглобины, так же как миоглобин, относят к гемопротеинам, но они имеют четвертичную структуру (состоят из 4 полипептидных цепей), благодаря которой возникает возможность регуляции их функций.
Гемоглобин состоит из белкового и не белкового компонента:
— две пары альфа и бета цепей
— четыре молекулы гема с двухвалентным железом.
В зависимости от этапа отнологического развития могу быть вариации в строении гемоглобина: эмбриональный и фетальный. Также может отличаться при патологиях.
Варианты первичной структуры гемоглобина человека. Гемоглобинопатии.
Источник:
— Северин стр. 46.
— Коровкин стр. 81-84.
Гемоглобины взрослого человека
В эритроцитах взрослого человека гемоглобин составляет 90% от всех белков данной клетки.
— Гемоглобин А — основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина, тетрамер, состоит из 2 полипептидных цепей α и 2 β (2α2β).
— Гемоглобин А2 находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина. Он состоит из 2 α- и 2 δ-цепей.
— Гемоглобин А1с — гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы (так называемый гликозили-рованный гемоглобин).
Гемоглобины, синтезирующиеся в период внутриутробного развития плода:
— Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер 2ξ2ε. Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
— Гемоглобин F — фетальный гемоглобин, синтезируется в печени и костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2 α- и 2 γ-цепей. После рождения ребёнка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
Болезни гемоглобинов (их насчитывают более 200) называют гемоглобинозами. Принято делить их на гемоглобинопатии, в основе развития которых лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина (часто их относят также к «молекулярным болезням»), и талассемии, обусловленные наследственным нарушением синтеза какой-либо нормальной цепи гемоглобина. Различают также железодефицитные анемии.
Классическим примером наследственной гемоглобинопатии является
серповидно-клеточная анемия, широко распространенная в странах
Южной Америки, Африки и Юго-Восточной Азии. При этой патологии
эритроциты в условиях низкого парциального давления кислорода прини-
мают форму серпа (рис. 2.2). Гемоглобин S, как показали Л. Полинг и др.,
отличается рядом свойств от нормального гемоглобина: в частности, после
отдачи кислорода в тканях он превращается в плохо растворимую дез-
окси-форму и начинает выпадать в осадок в виде веретенообразных
кристаллоидов, названных тактоидами. Последние деформируют клетку
и приводят к массивному гемолизу.
Талассемии, строго говоря, не являются гемоглобинопатиями. Это генетически обусловленное нарушение синтеза одной из нормальных цепей гемоглобина. Если угнетается синтез β-цепей, то развивается β-талассемия; при генетическом дефекте синтеза α-цепей развивается α-талассемия. При β-талассемии в крови наряду с HbA1 появляется до 15% НЬА2 и резко повышается содержание HbF – до 15–60%. Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением печени, селезенки, деформацией черепа и сопровождается тяжелой гемолитической анемией. Эритроциты при талассемии приобретают мишеневидную форму.
Механизм изменения формы эритроцитов объяснить пока не удалось.
(?) 6. Схема связывания газов гемоглобином. Карбокси- и метгемоглобин.
Date: 2016-07-05; view: 6926; Нарушение авторских прав
Источник
4.Гемоглобин, строение, свойства, биологическая роль
Гемоглобин взрослого
организма является тетрамером, состоящим
из двух α- и двух β-субьединиц с
молекулярными массами примерно 16 кДа.
α- и β-цепи отличаются аминокислотной
последовательностью, но имеют сходную
конформацию. Каждая субъединица несет
группу гема с ионом двухвалентного
железа в центре. Содержание Hb в крови
составляет 140-180 г/л у мужчин и 120-160 г/л у
женщин, т. е. вдвое выше по сравнению с
белками плазмы (50-80 г/л). Поэтому Hb вносит
наибольший вклад в образование рН-буферной
емкости крови.
Гемоглобин в
качестве белкового компонента содержит
глобин, а небелкового – гем. Видовые
различия гемоглобина обусловлены
глобином, в то время как гем одинаков у
всех видов гемоглобина. Основу структуры
простетической группы большинства
гемосодержащих белков составляет
порфириновое кольцо, являющееся в свою
очередь производным тетрапиррольного
соединения – порфирина.
Атом железа
расположен в центре гема-пигмента,
придающего крови характерный красный
цвет. Каждая из 4 молекул гема «обернута»
одной полипептидной цепью. В молекуле
гемоглобина взрослого человека HbА
содержатся четыре полипептидные цепи,
которые вместе составляют белковую
часть молекулы – глобин. Две из них,
называемые α-цепями, имеют одинаковую
первичную структуру и по 141 аминокислотному
остатку. Две другие, обозначаемые
β-цепями, также идентично построены и
содержат по 146 аминокислотных остатков.
Таким образом, вся молекула белковой
части гемоглобина состоит из 574
аминокислот. Во многих положениях α- и
β-цепи содержат разные аминокислотные
последовательности, хотя и имеют почти
одинаковые пространственные структуры.
Получены доказательства, что в структуре
гемоглобинов более 20 видов животных 9
аминокислот в последовательности
оказались одинаковыми, консервативными
(инвариантными), определяющими функции
гемоглобинов; некоторые из них находятся
вблизи гема, в составе участка связывания
с кислородом, другие – в составе
неполярной внутренней структуры глобулы.
Hb=
α2β2
2α цепи и 2β цепи-96%
4 гема-4%
3.Особенности строения, развития и метаболизма эритроцита.
Эритроциты —
высокоспециализированные клетки,
которые переносят кислород от лёгких
к тканям и диоксид углерода, образующийся
при метаболизме, из тканей к альвеолам
лёгких. Транспорт О2 и СО2 в этих клетках
осуществляет гемоглобин, составляющий
95% их сухого остатка.
Дифференцировка
эритроцитов-эритроцит готовится стать
собой 2 недели.

Интерлейкин-3
синтезируется Т-лимфоцитами, а также
клетками костного мозга. Это
низкомолекулярный белок группы цитокинов
— регуляторов роста и дифференцировки
клеток.
Дальнейшую
пролиферацию и дифференцировку
унипотентной клетки эритроидного ряда
регулирует синтезирующийся в почках
гормон эритропоэтин.
В процессе
дифференцировки на стадии эритробласта
происходят интенсивный синтез гемоглобина,
конденсация хроматина, уменьшение
размера ядра и его удаление. Образующийся
ретикулоцит ещё содержит глобиновую
мРНК и активно синтезирует гемоглобин.
Циркулирующие в крови ретикулоциты
лишаются рибосом, ЭР, митохондрий и в
течение двух суток превращаются в
эритроциты.
Строение.Строение
спектрина (А), околомембранного белкового
комплекса (Б) и цитоскелета эритроцитов
(В). Каждый димер спектрина состоит из
двух антипараллельных, нековалентносвязанных
между собой α- и β-полипептидных цепей
(А). Белок полосы 4.1 образует со спетрином
и актином «узловой комплекс»,
который посредством белка полосы 4.1
связывается с цитоплазматическим
доменом гликофорина. Анкирин соединяет
спектрин с основным интегральным белком
плазматической мембраны — белком полосы
3 (Б). На цитоплазматической поверхности
мембраны эритроцита имеется гибкая
сетеобразная структура, состоящая из
белков и обеспечивающая пластичность
эритроцита при прохождении им через
мелкие капилляры (В).

Важненько:Интегральный
гликопротеин гликофорин
присутствует только в плазматической
мембране эритроцитов. К N-концевой части
белка, расположенной на наружной
поверхности мембраны, присоединено
около 20 олигосахаридных цепей.
Олигосахариды гликофорина — антигенные
детерминанты системы групп крови АВО.
Спектрин
— периферический мембранный белок,
нековалентно связанный с цитоплазматической
поверхностью липидного бислоя
мембраны,является
основным белком цитоскелета эритроцитов.
Спектрин состоит из α- и β-полипептидных
цепей, имеющих доменное строение; α- и
β-цепи димера расположены антипараллельно,
перекручены друг с другом и нековалентно
взаимодействуют во многих точках.
Спектрин может прикрепляться к мембране
и с помощью белка анкирина.
Этот крупный белок соединяется с β-цепью
спектрина и цитоплазматическим доменом
интегрального белка мембраны — белка
полосы 3(белок-переносчик
ионов С1- и НСО3- через плазматическую
мембрану эритроцитов по механизму
пассивного антипорта).
Анкирин не только фиксирует
спектрин на мембране,
но и уменьшает
скорость диффузии белка полосы 3 в
липидном слое.
Метаболизм
Метаболизм
глюкозы
Эритроциты лишены
митохондрий, поэтому в качестве
энергетического материала они могут
использовать только глюкозу. Глюкоза
поступает в эритроциты путём облегчённой
диффузии с помощью ГЛЮТ-2. Около 90%
поступающей глюкозы используется в
анаэробном гликолизе, а остальные 10% —
в пентозофосфатном пути.
Важная особенность
анаэробного гликолиза в эритроцитах
по сравнению с другими клетками —
присутствие в них фермента
бисфосфоглицератмутазы. Бисфосфоглицератмутаза
катализирует образование
2,3-бисфосфоглицерата(служит важным
аллостерическим регулятором связывания
кислорода гемоглобином) из
1,3-бисфосфоглицерата..
Глюкоза в эритроцитах
используется и в пентозофосфатном пути,
окислительный этап которого обеспечивает
образование кофермента NADPH, необходимого
для восстановления глутатиона .

Обезвреживание
кислорода
Большое содержание
кислорода в эритроцитах определяет
высокую скорость образования супероксидного
анион-радикала (О2-), пероксида водорода
(Н2О2) и гидроксил радикала (ОН.). Эритроциты
содержат ферментативную систему,
предотвращающую токсическое действие
активных форм кислорода и разрушение
мембран эритроцитов. Постоянный источник
активных форм кислорода в эритроцитах
— неферментативное окисление гемоглобина
в метгемоглобин:
Метгемоглобинредуктазная
сисгема состоит из цитохрома
B5 и флавопротеина
цитохром B5 редуктазы,
донором водорода для которой служит
NADH, образующийся в глицеральдегиддегидрогеназной
реакции гликолиза
Цитохром B5
восстанавливает Fe3+ метгемог-лобина в
Fe2+:
Hb-Fe3+ + цит. b5 восст.
→ HbFe2+ + цит. b5 ок. .
Окисленный цитохром
B5 далее восстанавливается цитохром B5
редуктазой:
Цит. B5 ок + NADH →
цит. B5 восст. + NAD+.
Супероксидный
анион с помощью фермента супероксидцисмутазы
превращается в пероксид водорода:
O2- + O2- + Н+ → H2О2 + O2
.
Пероксид водорода
разрушается каталазой и содержащим
селен ферментом глутатионпероксидазой.
Донором водорода в этой реакции служит
глутатион — трипептид глутамилцистеинилглицин
(GSH) (см. раздел 12).
2Н2О → 2Н2О + О2; 2GSH
+ 2Н2О2 → GSSG + 2Н2О .
Окисленный глутатион
(GSSG) восстанавливается NADPH-зависимой
глутатионредуктазой. Восстановление
NADP для этой реакции обеспечивают
окислительные реакции пентозофосфатного
пути (см. раздел 7).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
емоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
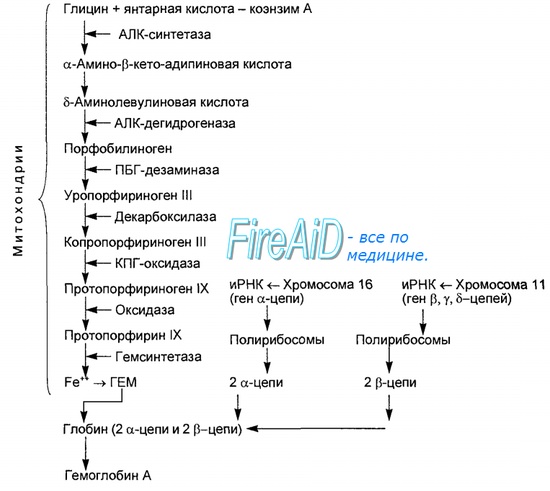
Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. — Также рекомендуем «Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.» |
Источник
Гемоглобин — основной белок крови
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. — альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы «в кармане» своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
Источник