Гемоглобин виды и соединения
Содержание статьи
емоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. — Также рекомендуем «Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.» |
Источник
Гемоглобин и его соединения. Нормальная физиология
Гемоглобин и его соединения
Гемоглобин – особый белок хромопротеида, благодаря которому эритроциты выполняют дыхательную функцию и поддерживают рН крови. У мужчин в крови содержится в среднем 130–160 г/л гемоглобина, у женщин – 120–150 г/л.
Гемоглобин состоит из белка глобина и 4 молекул гема. Гем имеет в своем составе атом железа, способный присоединять или отдавать молекулу кислорода. При этом валентность железа, к которому присоединяется кислород, не изменяется, т. е. железо остается двухвалентным. Гемоглобин, присоединивший к себе кислород, превращается в оксигемоглобин. Это соединение непрочное. В виде оксигемоглобина переносится большая часть кислорода. Гемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. Гемоглобин, соединенный с углекислым газом, носит название карбгемоглобина. Это соединение также легко распадается. В виде карбгемоглобина переносится 20% углекислого газа.
В особых условиях гемоглобин может вступать в соединение и с другими газами. Соединение гемоглобина с угарным газом (СО) называется карбоксигемоглобином. Карбоксигемоглобин является прочным соединением. Гемоглобин блокирован в нем угарным газом и неспособен осуществлять перенос кислорода. Сродство гемоглобина к угарному газу выше его сродства к кислороду, поэтому даже небольшое количество угарного газа в воздухе является опасным для жизни.
При некоторых патологических состояниях, например, при отравлении сильными окислителями (бертолетовой солью, перманганатом калия и др.) образуется прочное соединение гемоглобина с кислородом – метгемоглобин, в котором происходит окисление железа, и оно становится трехвалентным. В результате этого гемоглобин теряет способность отдавать кислород тканям, что может привести к гибели человека.
В скелетных и сердечной мышцах находится мышечный гемоглобин, называемый миоглобином. Он играет важную роль в снабжении кислородом работающих мышц.
Имеется несколько форм гемоглобина, отличающихся строением белковой части – глобина. У плода содержится гемоглобин F. В эритроцитах взрослого человека преобладает гемоглобин А (90%). Различия в строении белковой части определяют сродство гемоглобина к кислороду. У фетального гемоглобина оно намного больше, чем у гемоглобина А. Это помогает плоду не испытывать гипоксии при относительно низком парциальном напряжении кислорода в его крови.
Ряд заболеваний связан с появлением в крови патологических форм гемоглобина. Наиболее известной наследственной патологией гемоглобина является серповидноклеточная анемия. Форма эритроцитов напоминает серп. Отсутствие или замена нескольких аминокислот в молекуле глобина при этом заболевании приводит к существенному нарушению функции гемоглобина.
В клинических условиях принято вычислять степень насыщения эритроцитов гемоглобином. Это так называемый цветовой показатель. В норме он равен 1. Такие эритроциты называются нормохромными. При цветовом показателе более 1,1 эритроциты гиперхромные, менее 0,85 – гипохромные. Цветовой показатель важен для диагностики анемий различной этиологии.
Читайте также
Гемоглобин
Гемоглобин
Обычно исследуют капиллярную кровь, которую получают путем укола иглой-скарификатором в мякоть IV пальца левой руки (реже – мочки уха) или венозную кровь из локтевой вены (при работе на автоматических анализаторах).За идеальную норму принимают концентрацию
Гликолизированный гемоглобин
Гликолизированный гемоглобин
Гликолизированный гемоглобин (HbAlc) – используется как показатель риска развития осложнений сахарного диабета. В соответствии с рекомендациями ВОЗ этот тест признан оптимальным и необходимым для контроля за качеством лечения
Гемоглобин
Гемоглобин
Норма: не обнаруживается («ОТРИЦАТЕЛЬНО»).NB! Положительный результат отражает присутствие свободного гемоглобина или миоглобина в моче. Это результат внутрисосудистого, внутрипочечного, мочевого гемолиза эритроцитов с выходом гемоглобина или повреждения и
Гемоглобин
Гемоглобин
Снижение содержания гемоглобина говорит об анемии. Она может развиться в результате потери гемоглобина при кровотечениях, при заболеваниях крови, сопровождающихся разрушением эритроцитов. Низкий гемоглобин также возникает вследствие переливания
Гликозилированный гемоглобин
Гликозилированный гемоглобин
Это биохимический показатель крови, отражающий среднее содержание сахара в крови за длительный период времени (до 3 месяцев), в отличие от исследования глюкозы крови, которое дает представление об уровне глюкозы крови только на момент
Гемоглобин
Гемоглобин
Норма: не обнаруживается («ОТРИЦАТЕЛЬНО»).
NB! Положительный результат отражает присутствие свободного гемоглобина или миоглобина в моче. Это результат внутрисосудистого, внутрипочечного, мочевого гемолиза эритроцитов с выходом гемоглобина или повреждения и
«ГЕМОГЛОБИН»
«ГЕМОГЛОБИН»
Вымойте говяжью печень, нарежьте ее ломтиками и слегка обжарьте на масле, чтобы она оставалась полусырой. Затем положите на ломтик черного хлеба и посыпьте сверху тертым сыром. На сыр положите ломтик сала и плотно, штука к штуке, уложите поверх сала маслины,
ФОСФОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
ФОСФОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Фосфорорганические соединения снижают активность холинэстеразы в организме, что способствует накоплению ацетилхолина. Самый распространенный из фосфорорганических пестицидов – тиофос – представляет собой прозрачную бесцветную
ХЛОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
ХЛОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Кроме желудочно-кишечного тракта, для хлорорганических пестицидов «входными воротами» служат дыхательные пути и слизистые оболочки. Большинство этих веществ являются жирорастворимыми, поэтому они могут накапливаться в жировой ткани
Гемоглобин
Гемоглобин
Гемоглобин (ИЬ) составляет 95% от белков эритроцита. Отсутствие ядра в эритроците предоставляет место для большего количества молекул гемоглобина. Это означает, что клетка может нести больше кислорода. Дело в том, что кислород очень плохо растворяется в плазме
Как увеличить гемоглобин
Как увеличить гемоглобин
Игнатьева Татьяна Во время беременности вы можете столкнуться и с так называемой «физиологической анемией», когда уровень гемоглобина опускается до 100 мг% (в норме для женщин 120–140 мг%). Это происходит из-за увеличения объёма крови, усиления
Фенольные соединения
Фенольные соединения
Эти вещества содержат ароматические кольца с гидроксильной группой, а также их функциональные производные. Фенольные соединения, в ароматическом кольце которых имеется более одной гидроксильной группы, называют полифенолами.Большинство
Скелет и его соединения
Скелет и его соединения
Скелет (от греч. skeleton – высохший, высушенный) – формообразующая конструкция тела – выполняет множество функций. Главными из них являются опора, защита, преодоление силы тяжести. Кости представляют собой систему рычагов, которые под влиянием
Источник
Структура, соединения и основные виды гемоглобина
Кровеносная система выполняет транспортную функцию в организме всех теплокровных животных, доставляя к тканям питательные вещества и кислород. Транспортировка кислорода и углекислого газа осуществляется благодаря красным тельцам крови, в состав которых входит важное вещество – гемоглобин. В этой статье мы рассмотрим виды и соединения гемоглобина.
Что такое гемоглобин
Гемоглобин – это компонент эритроцитов, относящийся к группе белков. Состоит из 96% белкового вещества глобина и 4% вещества с атомом 2-валентного железа — гем. В 1 клетке эритроцита его содержится порядка 280 млн молекул, что и формирует красный цвет крови.
Главное свойство гемоглобина – это способность железа присоединять и отщеплять газы, формируя перемещение кислорода из лёгких к тканям и углекислого газа от тканей к лёгким. Таким образом, его роль в процессе газообмена в организме незаменима.
Структура и виды гемоглобина крови человека
На разных стадиях развития человеческого организма состав гемоглобина отличается по структуре полипептидных цепей. В зависимости от того, какие полипептидные цепи содержит гемоглобиновая структура, виды гемоглобина у человека следующие:
- Взрослый гемоглобин (HbA) встречается в доминантном количестве (около 98-99% от общего количества в крови) у взрослых людей. HbA состоит из 2 и 2 полипептидных цепей. В каждой из аминокислотных спиралей содержится компонент гема с атомом, отвечающим за сродство с молекулой кислорода. HbA обладает меньшей способностью к сродству с кислородом нежели другие виды гемоглобина, но в то же время он более устойчив к колебаниям pH и t.
- Фетальный (HbF) синтезируется у плода ещё в утробе матери начиная с 6-7 недель беременности с последующим его замещением на HbA. Уже с 1 месяца жизни синтез HbF замедляется, общий объём крови увеличивается, усиливается и синтез HbA, который к трём годам жизни ребёнка доходит до процентного соотношения состава крови взрослого человека. Фетальный гемоглобин от взрослого отличается составом цепей глобина, вместо цепи здесь присутствует тип спирали. HbF, по сравнению с HbA, обладает меньшей степенью устойчивости к изменениям pH крови и колебаниям температуры организма.
- Эмбриональный (HbE). Первичная форма дыхательного белка вырабатывается у эмбриона ещё до формирования плаценты (уже на первой неделе беременности) и продолжается до 6-7 недель. Структура отличается наличием цепей и ζ-типов.
Патологические виды гемоглобина
В ряде случаев под влиянием генетических дефектов возникает аномальный синтез гемоглобиновых клеток. Патологические виды гемоглобина от физиологических отличаются составом полипептидных связей, а точнее, их мутацией.
В результате мутации ДНК, синтез компонентов эритроцитов осуществляется не с глутаминовой, а валиновой аминокислотой. Эта «кадровая» замена приводит к образованию белковой структуры типа 2 с «липким» участком на поверхности, способным присваивать структуры себе подобные. Таким образом, происходит полимеризация HbS-молекул и, как следствие, оседание тяжёлых и плохо транспортируемых эритроцитов в кровеносных сосудах. Данное отклонение носит название «серповидная анемия».
Нормы содержания гемоглобина у человека
Содержание белковых дыхательных структур в крови у людей может отличаться в зависимости от пола, возрастной категории, образа жизни и некоторых других особенностей, как, например, беременность.
Нормальные значения содержания гемоглобина в крови, не считающиеся патологическим отклонением:
- У мужчин — 130-150 г/л.
- У женщин — 120-140 г/л.
- У детей до года 100-140 г/л, причём в первый месяц эти значения могут достигать до 220 г/л за счёт повышенной концентрации фетального гемоглобина. У детей с года до 6 лет — 110-145 г/л, а с 6 года жизни — 115-150 г/л вне зависимости от пола ребёнка.
- При беременности наблюдается снижение концентрация HbA до 110 г/л, что однако не считается анемией.
- У пожилых людей нормой считается тенденция понижения на 5 единиц от заявленной нормы в зависимости от пола пациента.
По возрастному цензу отличается и состав крови, содержащей одновременно разные виды гемоглобина. Так, например, у взрослого человека естественным соотношением является 99% HbA и до 1% HbF. У детей до года процент HbF значительно выше, чем у взрослых, что объясняется постепенным распадом изначально имеющейся формы фетального гемоглобина.
Физиологические формы
Поскольку дыхательный красный пигмент непрерывно участвует в газообменных процессах в организме, то его главным свойством является способность образовывать соединения с молекулами различных газов. В результате подобных реакций создаются физиологические виды гемоглобина, которые считаются нормальным явлением.
- Оксигемоглобин (Hb)– соединение с молекулой кислорода. Процесс происходит в органах дыхания, в альвеолах лёгких. Оксигенированные красные тельца окрашивают кровь в алый цвет, которая называется артериальной и движется от лёгких к тканям, обогащая их кислородом, необходимым для окислительных процессов.
- Дезоксигемоглобин (HbH) – восстановленный гемоглобин образуется в момент, когда красные тельца отдают кислород тканям, но ещё не успели забрать от них углекислый газ.
- Карбоксигемоглобин (Hb) образуется при выведении углекислого газа из тканей и выведении его к лёгким, завершая процесс дыхания человека. Карбоксигемоглобин придаёт венозной крови тёмный цвет – бордовый.

Патологические соединения
Эритроциты могут присоединять не только газы, участвующие в дыхательном процессе, но и другие, образуя патологические виды гемоглобина, представляющие опасность для человеческого здоровья и даже жизни. Эти соединения обладают низкой степенью распада, поэтому приводят к кислородному голоданию тканей и серьёзным нарушениям дыхательного процесса.
- Карбгемоглобин (HbCO) — крайне опасное соединение в крови человека, надышавшегося угарным газом. Блокирует способность красных телец переносить кислород к тканям. Даже незначительная концентрация угарного газа в воздухе 0,07% может привести к летальному исходу.
- Метгемоглобин (HbMet) образуется при отравлении нитробензольными соединениями, примерами которых являются алифатические растворители смол, эфиров, целлюлозы, широко применимые в текстильной промышленности. Нитраты при взаимодействии с гемоглобином преобразуют содержащиеся в геме 2-х валентное железо в 3-х валентное, что также приводит к гипоксии.
Диагностика гемоглобина
Для выявления концентрации глобиновых дыхательных структур в крови человека проводятся качественные и количественные виды анализов. Гемоглобин также исследуется на количество содержания в нём ионов железа.
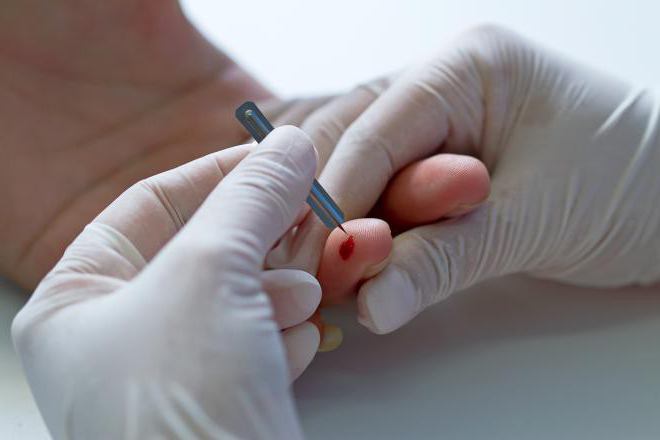
Основным количественным методом определения концентрации гемоглобина сегодня является колориметрический анализ. Он представляет собой исследование цветовой насыщенности биологического материала при добавлении к нему специального реактива.
Качественные методы включают исследование крови на содержание в нём соотношения типов HbA и HbF. Также к качественному анализу относится определение количества содержания в крови молекул гликолизированного гемоглобина (соединения с углеродами) – метод используется для диагностики сахарного диабета.
Отклонение концентрации гемоглобина от нормы
Баланс HbA может варьировать как ниже, так и выше нормы. В любом случае это приводит к негативным последствиям. При понижении HbA ниже установленной нормы возникает патологический синдром, который носит название «железодефицитная анемия». Выражается вялостью, упадком сил, невнимательностью. Негативно влияет на нервную систему, особенно опасен в детском возрасте, так как часто является причиной отставания в психо-моторном развитии.

Повышенный гемоглобин не является отдельным заболеванием, это, скорее, синдром, свидетельствующий о различных патологиях, таких как сахарный диабет, лёгочная недостаточность, порок сердца, заболевания почек, переизбыток фолиевой кислоты или витаминов группы В, онкология и др.
Источник
