Гиперхромия при нормальном гемоглобине
Содержание статьи
Гиперхромия эритроцитов
Содержание
- Описание
- Нормальные значения
- Патогенез
- Причины
- Симптомы
- Лечение
Другие названия и синонимы
Гиперхромазия эритроцитов, повышение цветового показателя крови, повышение цп крови, гиперхромные эритроциты.
Названия
Гиперхромия эритроцитов.
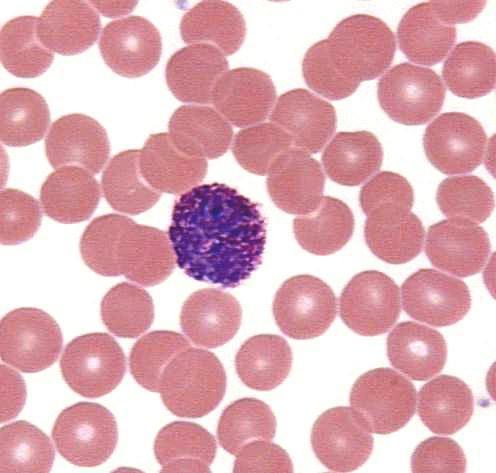 Гиперхромия эритроцитов
Гиперхромия эритроцитов
Описание
Гиперхромная анемия характеризуется резким снижением количества эритроцитов при одновременном увеличении содержания в них гемоглобина.
При микроскопическом изучении морфологии эритроцитов врач не только обращает внимание на размеры и форму кровяных телец, но и отмечает степень окрашивания красных клеток крови. Насыщенная окраска, закрывающая срединное просветление, которое должно быть в норме (нормохромия), в лабораторном деле носит название — гиперхромия. Гиперхромия, как правило, свидетельствует о том, что у человека развивается (или уже набрала полную силу) гиперхромная анемия. Скорее всего, она будет макроцитарной или даже мегалобластной, что в принципе, одно и то же, и что также увидит врач, разглядывая препарат (неестественно увеличенные эритроциты). И все же для окончательного уточнения диагноза понадобятся еще и другие лабораторные (и не только) методы исследования.
Гиперхромия > гиперхромная анемия.
Нормальные значения
Норма цветного показателя и у взрослых, и у детей, исключая малышей до 3 лет, по разным источникам колеблется от 0,8 до 1,1, хотя некоторые авторы утверждают, что 0,8 это уже мало, а 1,1 уже переходит допустимые границы.
Норма ЦП у ребенка до 3 лет несколько ниже и составляет 0,75 — 0,96.
Гиперхромия эритроцитов
Патогенез
Гиперхромия является ведущим лабораторным признаком гиперхромных анемий и чаще всего сочетается с макроцитозом (гиперхромная макроцитарная анемия). В первую очередь в категорию подобных состояний попадают авитаминоз В12 и дефицит фолатов (фолиевой кислоты — витамина B9). Это типичные представители гиперхромных макроцитарных (мегалобластных) анемий. Почему мегалобластных. Потому что клетки значительно увеличены в размерах и представлены мегалобластами и мегалоцитами, а их диаметр (>10мкм) куда больше макроцитов (клетки с диаметром 7-8 микрон — нормоциты, больше 8 микрон — макроциты, меньше 7 мкм — микроциты), то есть, мегалобластная, значит, макроцитарная, но макроцитарная — не всегда значит мегалобластная.
Таким образом, при морфологическом исследовании образцов крови, взятых от больных с гиперхромной макроцитарной анемией, можно обнаружить:
Красные клетки крови (о них, собственно, и речь), насыщенные хромопротеином (гемоглобином) настолько, что он (Hb) стирает центральное просветление — гиперхромия (гиперхромазия).
Диаметр эритроцитов превышает 10 микрон (макроциты и мегалоциты).
Заметны фрагменты красных кровяных телец (шизоцитоз), анизоцитоз (о чем при автоматической обработке пробы свидетельствуют показатели: средний объем эритроцитов — MCV, ширина распределения по объему — RDW, гистограмма), а также изменение формы эритроцитов (пойкилоцитоз).
Нередко можно встретить красные клетки, не потерявшие ядерные субстанции (тельца Жолли, кольца Кебота, полихроматофильные элементы).
Содержание молодых форм эритроцитов — ретикулоцитов, поначалу остается в рамках нормы, однако по мере прогрессирования процесса все больше нарушается дифференцировка и их количество намечает тенденцию к снижению.
При морфологическом изучении нельзя обойти вниманием изменения со стороны белой крови: уменьшение лейкоцитов (нейтрофилов, моноцитов, эозинофилов), отсутствие базофилов, но некоторое повышение лимфоцитов. В иных случаях в кровь приходят молодые предшественники белых клеток крови — миелоциты и юные (сдвиг лейкоцитарной формулы влево).
В тромбоцитарном звене также (в умеренной степени) могут присутствовать неестественные явления (тромбоциты приобретают гигантские размеры, но общее их количество — снижено).
Всю эту ситуацию (и гиперхромию, и макроцитоз, и сдвиг лейкоцитарной формулы) создает мегалобластический тип кроветворения в костном мозге, который является общим признаком всех анемий подобного рода (связанных с нарушением образования ДНК). Анемии эти могут передаваться по наследству или приобретаться в процессе жизни.
Причины
• Авитаминоз В12 формируется от недостатка поступления цианокобаламина с продуктами питания, нарушения всасывания в кишечнике, конкурентного поглощения столь ценного вещества паразитирующими в организме гельминтами, нарушениях функции поджелудочной железы, в результате других заболеваний ЖКТ и воздействия токсических веществ. Какая-то часть в числе всех В12-дефицитных состояний передается по наследству.
• Что касается фолиеводефицитной анемии, то большей степени рискуют вегетарианцы, люди в возрасте, страдающие алкоголизмом люди всех возрастов, а также женщины в период беременности.
• Мегалобластная анемия с гиперхромией имеет место при нарушении активности ферментов, обеспечивающих продукцию пуриновых и пиримидиновых оснований, что нарушает синтез ДНК и РНК.
• Причиной гиперхромии (и макроцитоза) могут стать тяжелые поражения печени, влекущие значительные витаминные нарушения, ведь там (в печени) запасаются многие витамины, в том числе В12 и В9, которые являются участниками синтеза пуриновых и пиримидиновых оснований.
• Появление такого лабораторного признака в красных кровяных тельцах, как гиперхромия, не исключается при миелодиспластическом синдроме или отдельных видах гемолитических анемий, однако данный признак в подобных случаях не является стабильным показателем, все зависит от стадии процесса и его формы.
Симптомы
Общие для всех подобных состояний симптомы (слабость, головные боли, бледность, тахикардия).
И частные — специфические (жжение языка, неуверенность походки).
При В12-дефицитной страдает кровь, желудочно-кишечный тракт и нервная система (триада синдромов), хотя для фолиеводефицитного состояния изменения со стороны нервной системы не характерны.
Лечение
Лечение отдельно гиперхромии, конечно, не предусмотрено. Лечат авитаминоз В12, фолиеводефицитное состояние или (что чаще бывает) — В12-фолиеводефицитную анемию.
Лечение фолиеводефицитной анемии состоит в назначении препаратов витамина В9 (витамин В9 — это и есть фолиевая кислота). Однако следует проявлять осторожность, если нет уверенности, что это именно фолиеводефицитная анемия, потому что применение в подобных случаях витамина В9 может обернуться неприятностями. Болезнь, не связанная с дефицитом фолатов, не только не отступит, а еще больше начнет проявлять себя. В этих ситуациях более оправдано назначение цианокобаламина.
Лечение самого авитаминоза В12 стоит на трех принципах:
1) Дать организму цианокобаламина вволю.
2) Постоянно, не переставая, пополнять запасы недостающего витамина.
3) Всеми силами стараться предотвратить развитие анемии, иначе потом с ней тяжело будет справиться.
Источник
Алгоритм верификации характера анемии на основе корректной трактовки показателей клинического анализа крови
Представлен алгоритм верификации характера анемии на основе трактовки показателей клинического анализа крови
Введение
Анемия — одно из наиболее частых патологических состояний органов кроветворения у детей [1-3]. Основным лабораторным критерием анемии является концентрация гемоглобина ниже нормы. В связи с этим необходимо напомнить, что нормативные значения гемоглобина у детей имеют четкие возрастные особенности (табл. 1). Так, для детей раннего неонатального периода нижняя граница нормы гемоглобина — 170 г/л, на 2-й неделе жизни- 145 г/л, в возрасте 3-4 нед. — 120 г/л. У детей дошкольного возраста анемию констатируют в тех случаях, когда концентрация гемоглобина уменьшается до 110 г/л и ниже, а у школьников младших классов — ниже 115 г/л. В возрасте 13-15 лет и старше в нормативных значениях гемоглобина появляются половые различия: у девушек нижней границей нормы считают концентрацию гемоглобина 120 г/л, у юношей — 130 г/л. Особо следует подчеркнуть, что любые случаи снижения уровня гемоглобина, в т. ч. сопровождающиеся нормальным и даже повышенным количеством эритроцитов в гемограмме, однозначно должны трактоваться как анемия [1-4].
Диагностика
Адекватная коррекция анемии возможна только в том случае, если проводится этиопатогенетическое лечение. В свою очередь, поиску причин анемии способствует корректный анализ изменений гемограммы. Это позволяет не только избежать диагностических ошибок, но и существенно сокращает объем необязательных исследований. Особо следует подчеркнуть, что непременным условием диагностики является проведение так называемого развернутого анализа крови, в котором представлены значения гемоглобина, эритроцитов, эритроцитарных индексов, ретикулоцитов, тромбоцитов и их индексов, лейкоцитов, а также «лейкоцитарная формула» [1, 2, 4-8]. Выявление лабораторных признаков анемии влечет необходимость одновременной оценки значений и других показателей гемограммы. При этом в первую очередь целесообразно уточнить, является ли анемия изолированной или сочетается с лейкопенией и/или тромбоцитопенией. В случае выявления у ребенка 2- или 3-ростковой цитопении план обследования необходимо согласовать с гематологом, т. к. среди возможных причин указанных нарушений могут быть не только витамин В12- и/или фолиеводефицитные состояния, но и более серьезные заболевания (апластическая анемия, лейкоз и др.).
В тех случаях, когда анемия не сопровождается лейко- и/или тромбоцитопенией, вопрос о необходимости привлечения гематолога для курации пациента решается в зависимости от выраженности анемического синдрома. Тяжесть анемии определяется степенью снижения гемоглобина. Так, в постнеонатальном периоде для оценки тяжести анемии у детей традиционно используют критерии, представленные в таблице 2. При этом снижение гемоглобина до 90 г/л рассматривают в качестве признака легкой степени анемии. К анемии средней степени относят случаи, когда концентрация гемоглобина находится в пределах 70-90 г/л. Снижение уровня гемоглобина ниже 70 г/л говорит о тяжелой анемии (см. табл. 2).
Таким образом на первом этапе расшифровки гемограммы, корректный анализ изменений уровней гемоглобина позволяет не только своевременно диагностировать анемию, но и определить степень ее тяжести. Далее необходимо сопоставить уровень гемоглобина с количеством эритроцитов, оценив соответствие их значений, поскольку адекватное функционирование эритроцитов возможно только при строго определенном их насыщении гемоглобином. Степень насыщения эритроцитов гемоглобином оценивают с помощью цветового показателя (ЦП) или используя такие эритроцитарные индексы, как MCH (Mean Corpuscular Hemoglobin) и МСНС (Mean Corpuscular Hemoglobin Сoncentration) (рис. 1). В зависимости от степени насыщения эритроцитов гемоглобином выделяют нормохромию (адекватное насыщение), гипохромию (недостаточное насыщение) и гиперхромию (избыточное насыщение). Соответственно различают нормохромные, гипохромные и гиперхромные анемии.
Особо следует отметить, что наиболее достоверно уровень насыщения эритроцитов гемоглобином отражает индекс МСН. Индекс МСНС определяется не только уровнем гемоглобина и количеством эритроцитов, но и объемом самих эритроцитов (MCV). Так, установлено, что в тех случаях, когда одновременно имеют место микроцитоз эритроцитов и недостаточное их насыщение гемоглобином, значения МСНС могут привести к ошибочному заключению о нормо- или даже гиперхромии. В свою очередь, при макроцитозе эритроцитов и нормальном уровне их насыщения гемоглобином оценка МСНС может привести к ошибочному выводу о гипохромии. Это объясняется тем, что при вычислении данного индекса объем эритроцитов, независимо от его абсолютных значений, принимается за 100%, а непосредственно МСНС характеризует ту часть объема, которую занимает гемоглобин. Поэтому МСНС может как занижать истинное насыщение эритроцитов гемоглобином (при макроцитозе), так и завышать его (при микроцитозе). Приведенные примеры свидетельствуют о низкой специфичности индекса МСНС, что ограничивает его применение для оценки насыщения эритроцитов гемоглобином. В целом МСНС можно использовать только в тех случаях, когда средний объем эритроцитов соответствует нормативным показателям. В связи с этим на практике для оценки насыщения эритроцитов гемоглобином наиболее часто применяют ЦП и индекс МСН.
Адекватная оценка насыщения эритроцитов гемоглобином очень важна для расшифровки генеза анемии, т. к. позволяет определить направление диагностического поиска. Так, при гипохромной анемии дифференциальный диагноз проводят между анемиями, обусловленными железодефицитным состоянием, сидеробластозом и талассемией. Нормохромный характер анемии отмечают при гемолитических состояниях, аплазии костного мозга, злокачественных заболеваниях. В свою очередь, при гиперхромной анемии необходимо исключить витаминодефицитные состояния, т. к. причиной анемии в этом случае может быть недостаточное содержание в организме фолиевой кислоты и/или витамина В12 (рис. 2).
Очень важную информацию для уточнения генеза анемии дает анализ показателя, характеризующего средний объем эритроцитов — MCV (Mean Сorpusculare Volume). Это обусловлено тем, что для целого ряда анемий определенные значения MCV являются патогномоничным признаком (рис. 3). Поэтому уже на первых этапах расшифровки причин анемического синдрома целесообразно выделять, в зависимости от значений MCV, нормоцитарные, микроцитарные и макроцитарные анемии. В тех случаях, когда при анемии выявляется микроцитоз эритроцитов (микроцитарная анемия), необходимо проводить дифференциальный диагноз между такими заболеваниями, как железодефицитная анемия, талассемия, наследственные микроцитарные гемолитические анемии и др. При выявлении макроцитарной анемии исключения требуют витаминодефицитные состояния (дефицит фолиевой кислоты, витамина В12), апластические анемии, дизэритропоэз, миелодиспластический синдром. Следует отметить, что значения среднего объема эритроцитов имеют возрастные различия, и их необходимо учитывать, особенно у детей первого полугодия жизни (табл. 3).
Поиск причин анемии значительно упрощается, если в анализе крови, наряду с показателями среднего объема эритроцитов, насыщения их гемоглобином (ЦП, МСН и МСНС), представлены данные о количестве ретикулоцитов. В связи с тем что гематологические анализаторы, имеющиеся в настоящее время в лечебно-профилактических учреждениях, в большинстве случаев не обладают возможностью подсчета ретикулоцитов, их подсчет проводится классическим методом («микроскопия мазка»), а это возможно только после предварительной договоренности с лабораторий. В то же время гематологические анализаторы последнего поколения позволяют не только определять количество ретикулоцитов, но и представлять данные об уровне их насыщения гемоглобином (Ret-Hb), а также степени их зрелости (LFR, MFR, HFR, IFR) (рис. 4). Уменьшение значений Ret-Hb ниже нормы и увеличение Delta-Hb свидетельствуют о снижении насыщения ретикулоцитов гемоглобином, что способствует выявлению гипохромных состояний на самых ранних стадиях, когда еще не развились анемия и гипохромия эритроцитов [5-8]. Увеличение таких показателей, как MFR, HFR, IFR, отмечается при появлении в кровотоке незрелых форм ретикулоцитов, что отражает расторможение эритроидного ростка костного мозга и может использоваться для оценки эффективности лечения дефицитных анемий (железодефицитной, витамин-В12-дефицитной, фолиеводефицитной) на первых этапах терапии.
Основные причины гиперрегенераторной анемии (анемия с ретикулоцитозом) — гемолиз и постгеморрагические состояния. Постгеморрагическая анемия относится к железодефицитным анемиям, которые характеризуются гипохромией и микроцитозом. Однако в отличие от железодефицитной анемии алиментарного генеза, типичным признаком постгеморрагической анемии является ретикулоцитоз. Увеличение количества ретикулоцитов отмечается также и при гемолитических анемиях. При этом особо следует подчеркнуть, что в определенных случаях (например, при внутрикостномозговом гемолизе, парвовирус-В-19-ассоциированном транзиторном апластическом кризе и др.) гемолитический синдром может не сопровождаться ретикулоцитозом. Речь идет о тех патологических состояниях, когда разрушение предшественников эритроцитов происходит непосредственно в костном мозге. Снижение количества ретикулоцитов отмечается при витаминодефицитных и апластических анемиях, что позволяет характеризовать указанные анемии как гипорегенераторные (см. рис. 4).
Гипохромная анемия
Учитывая, что наиболее часто в педиатрической практике встречаются гипохромные анемии, считаем целесообразным обратить особое внимание именно на эти патологические состояния. Как уже отмечено ранее, гипохромные анемии развиваются при железодефицитных состояниях, талассемии и сидеробластозе.
Основными причинами железодефицитной анемии у детей являются недоношенность, недостаточное поступление железа в организм из-за особенностей диеты (вскармливание младенцев неадаптированными смесями или коровьим молоком; несбалансированное питание, содержащее недостаточное количество мясных продуктов; «мучной рацион»; веганство, вегетариантство и др.), синдром мальабсорбции, кровопотеря и др. Все железодефицитные анемии являются гипохромными и микроцитарными. При этом для железодефицитной анемии, развившейся в результате кровопотери (постгеморрагическая анемия), типичными проявлениями являются не только гипохромия и микроцитоз эритроцитов, но также и повышение уровня ретикулоцитов (гиперрегенераторная анемия), тогда как железодефицитная анемия, в основе которой лежат алиментарные факторы, характеризуется нормальным уровнем ретикулоцитов (норморегенераторная анемия).
Шаблонное представление о гипохромной анемии как проявлении исключительно железодефицитного состояния в ряде случаев становится причиной диагностических ошибок. В связи с этим следует еще раз напомнить, что к гипохромным анемиям, помимо железодефицитных, относятся также талассемия и сидеробластная анемия.
Талассемия, так же как и железодефицитная анемия, характеризуется гипохромией и микроцитозом эритроцитов. Талассемии — группа наследственных заболеваний, обусловленных нарушением синтеза альфа- или бета-цепей гемоглобина. Установлено, что талассемия имеет четкую этническую зависимость. Так, бета-талассемия чаще всего встречается у выходцев из Средиземноморья, Среднего Востока и Индии, а альфа-талассемия — у выходцев из Африки и Юго-Восточной Азии [1-3, 9]. Учитывая это, при выявлении гипохромной, микроцитарной анемии у ребенка с указанной этнической принадлежностью, помимо поиска типичных клинических (легкая иктеричность, гепатоспленомегалия) и лабораторных (мишеневидность эритроцитов) проявлений талассемии, необходимо уточнить семейный анамнез, обращая особое внимание на состояние здоровья ближайших родственников (хроническая анемия, гепатоспленомегалия, холелитиаз с молодого возраста и др.).
Для проведения дифференциального диагноза между железодефицитной анемией и талассемией показано исследование ферростатуса (определение в сыворотке крови железа, железосвязывающей способности, ферритина), осмотической резистентности эритроцитов, типов гемоглобина (электрофорез гемоглобина), молекулярно-генетическое исследование. При этом на первых этапах диагностики в пользу талассемии свидетельствуют нормальные или повышенные уровни сывороточного железа и ферритина, а также повышение осмотической резистентности эритроцитов. У детей в возрасте старше 1 года подтверждением бета-талассемии служит повышение удельного веса фетального гемоглобина.
В основе сидеробластной анемии лежит нарушение эритропоэза, которое обусловлено наследственными или приобретенными дефектами ферментных систем, участвующих в синтезе гема и утилизации железа эритроцитарными клетками. Установлено, что наследственный сидеробластоз встречается редко. При этом отмечена его гетерогенность: встречаются варианты с разным типом наследования, как связанные с полом, так и имеющие аутосомный характер. Развитие приобретенной сидеробластной анемии может быть обусловлено различными заболеваниями и патологическими состояниями (инфекции, хронические воспалительные процессы, системные заболевания органов кроветворения, интоксикация медикаментами или солями свинца и др.), при которых снижается активность ферментов, обеспечивающих включение железа в структуру гемоглобина [1, 2, 10]. Особо следует отметить, что сидеробластная анемия, так же как и талассемия, характеризуется нормальным или повышенным уровнем сывороточного железа и ферритина. Принимая во внимание представленную выше информацию, в диагностически сложных случаях уточнение причин гипохромной анемии невозможно без дополнительного исследования уровня железа, железосвязывающей способности и ферритина сыворотки крови (рис. 5). Важно помнить при этом, что ферритин обладает свойствами белка острой фазы воспаления и поэтому его уровень может быть повышен при воспалительных процессах в организме. В связи с этим одновременно с определением ферритина необходимо исследовать С-реактивный белок.
Лечение
В тех случаях, когда выявляется гипохромная, микроцитарная анемия и имеются точные данные в пользу железодефицитного ее генеза, терапией выбора является применение препаратов железа. При этом в подавляющем большинстве случаев препараты железа назначаются перорально, если нет противопоказаний (синдром мальабсорбции, обострение язвенной болезни желудка и двенадцатиперстной кишки, состояние после резекции желудка и/или тонкой кишки, болезнь Крона) [1, 2, 11-14]. В настоящее время применяются различные препараты железа: солевые, гидроксид-полимальтозные комплексы. Для адекватной коррекции железодефицитной анемии с помощью солевых пероральных препаратов железа рекомендуются следующие суточные дозы (по элементарному железу): детям в возрасте до 3-х лет — 3 мг/кг/сут; детям старше 3-х лет — 45-60 мг/сут; подросткам — до 120 мг/сут. У детей в возрасте 6 лет и старше, а также у подростков для лечения железодефицитной анемии может с успехом применяться Тардиферон — пролонгированный препарат сульфата железа (II). В 1 таблетке препарата Тардиферон содержится 80 мг элементарного железа, что позволяет рекомендовать следующий его режим дозирования: детям от 6 до 10 лет — 1 таблетка в сутки; детям старше 10 лет и подросткам — 1-2 таблетки в сутки [15]. Тардиферон содержит оптимальную комбинацию действующих веществ — двухвалентного железа, аскорбиновой кислоты и мукопротеозы, защищающей органы от негативного воздействия ионов железа и обеспечивающей постепенное высвобождение железа в зоне максимального всасывания. Это значит, что железо в составе препарата равномерно усваивается в течение 12 часов, не создавая пиков, опасных для слизистой оболочки кишечника. Препарат Тардиферон принимают не разжевывая, перед или во время приема пищи, запивая большим количеством воды. Следует помнить: не рекомендуется одновременно с препаратом Тардиферон использовать антациды и тетрациклины; всасывание в кишечнике железа из солевых препаратов уменьшается при одновременном использовании продуктов, содержащих полифенолы (бобов, орехов, чая, кофе, некоторых овощей), фитаты (зерновых, бобовых, овощей, орехов) и большое количество пищевых волокон [1, 4, 9, 11-14].
При правильно установленном диагнозе «железодефицитная анемия», адекватном выборе препаратов железа и корректно подобранной дозе на 10-14-й день терапии в клиническом анализе крови отмечается увеличение ретикулоцитов, а к концу 3-4-й недели лечения — прирост гемоглобина на 10 г/л. Нормализуется уровень гемоглобина через 4-8 нед. от начала терапии, сроки зависят от тяжести железодефицита. Продолжительность применения препаратов железа в полной лечебной дозе также зависит от тяжести анемии. Так, при анемии легкой степени продолжительность терапии составляет 3 мес., при среднетяжелой степени — до 4,5 мес., при тяжелой — до 6 мес. [11]. Если на фоне адекватно проводимой терапии нет позитивных сдвигов гемограммы в декретируемые сроки, следует усомниться в корректности диагноза. Учитывая, что гипохромия эритроцитов встречается не только при железодефицитной анемии, но и при сидеробластозе и талассемии, необходимо исключить указанные патологические состояния (см. рис. 5).
Таким образом, правильная интерпретация значений всех показателей гемограммы дает возможность уже при первичном обращении очертить круг основных причин выявленной анемии и своевременно наметить основные диагностические направления для расшифровки генеза заболевания.
Источник