Холестерин и его формы
Содержание статьи
Хороший, плохой, злой холестерин
Статья на конкурс «био/мол/текст»: Вряд ли сейчас найдется человек, который не слышал, что высокий холестерин — это плохо. Однако столь же мала вероятность встретить человека, который знает, ПОЧЕМУ высокий холестерин — это плохо. И чем определяется высокий холестерин. И что такое высокий холестерин. И что такое холестерин вообще, зачем он нужен и откуда берется.
Итак, история вопроса такова. Давным-давно, в одна тысяча девятьсот тринадцатом году, петербуржский физиолог Аничков Николай Александрович показал: не что иное, как холестерин, вызывает атеросклероз у экспериментальных кроликов, содержащихся на пище животного происхождения [1]. Вообще же, холестерин необходим для нормального функционирования животных клеток и является основной составляющей клеточных мембран , а также служит субстратом для синтеза стероидных гормонов и желчных кислот.
Главный липидный компонент пищевого жира и жировых отложений — это триглицериды, которые представляют собой эфиры глицерина и жирных кислот. Холестерин и триглицериды, будучи неполярными липидными веществами, транспортируются в плазме крови в составе липопротеиновых частиц. Частицы эти подразделяют по размеру, плотности, относительному содержанию холестерина, триглицеридов и белков на пять больших классов: хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП) [2]. Традиционно ЛПНП считается «плохим» холестерином, а ЛПВП — «хорошим» (рис. 1).
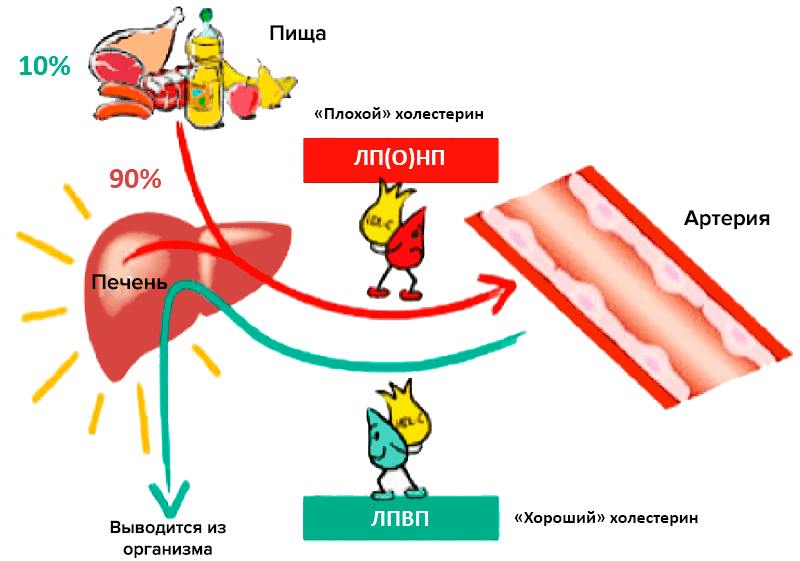
Рисунок 1. «Плохой» и «хороший» холестерины. Участие различных липопротеиновых частиц в транспорте липидов и холестерина.
Схематично структура липопротеина включает неполярное ядро, состоящее по большей части из холестерина и триглицеридов, и оболочку из фосфолипидов и апопротеинов (рис. 2). Ядро — функциональный груз, который доставляется до места назначения. Оболочка же участвует в распознавании клеточными рецепторами липопротеиновых частиц, а также в обмене липидными частями между различными липопротеинами [3].
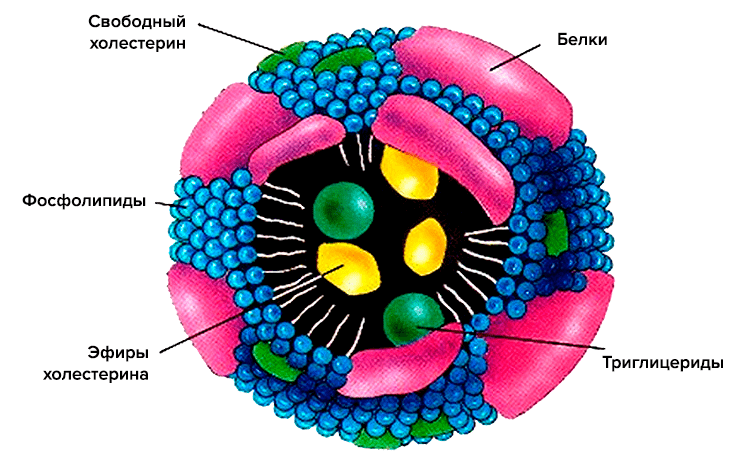
Рисунок 2. Схематическое строение липопротеиновой частицы
Баланс уровня холестерина в организме достигается следующими процессами: внутриклеточный синтез, захват из плазмы (главным образом из ЛПНП), выход из клетки в плазму (главным образом в составе ЛПВП). Предшественник синтеза стероидов — ацетил коэнзим А (CoA). Процесс синтеза включает, по крайней мере, 21 шаг, начиная с последовательного преобразования ацетоацетил CoA. Лимитирующая стадия синтеза холестерина в большой степени определяется количеством холестерина, абсорбируемого в кишечнике и транспортируемого в печень [4]. При недостатке холестерина происходит компенсаторное усиление его захвата и синтеза.
Транспорт холестерина
Систему транспорта липидов можно разделить на две большие части: внешнюю и внутреннюю.
Внешний путь начинается с всасывания в кишечнике холестерина и триглицеридов. Его конечный результат — доставка триглицеридов в жировую ткань и мышцы, а холестерина — в печень. В кишечнике пищевой холестерин и триглицериды связываются с апопротеинами и фосфолипидами, формируя хиломикроны, которые через лимфоток попадают в плазму, мышечную и жировую ткани. Здесь хиломикроны взаимодействуют с липопротеинлипазой — ферментом, который освобождает жирные кислоты. Эти жирные кислоты поступают в жировую и мышечную ткани для накопления и окисления соответственно. После изъятия триглицеридного ядра остаточные хиломикроны содержат большое количество холестерина и апопротеина Е. Апопротеин Е специфически связывается со своим рецептором в клетках печени, после чего остаточный хиломикрон захватывается и катаболизируется в лизосомах. В результате этого процесса освобождается холестерин, который затем преобразуется в желчные кислоты и выводится или участвует в формировании новых липопротеинов, образующихся в печени (ЛПОНП). При нормальных условиях хиломикроны находятся в плазме в течение 1-5 ч. после приема пищи [2], [3].
Внутренний путь. Печень постоянно синтезирует триглицериды, утилизируя свободные жирные кислоты и углеводы. В составе липидного ядра ЛПОНП они выходят в кровь. Внутриклеточный процесс формирования этих частиц схож с таковым для хиломикронов, за исключением различия в апопротеинах. Последующее взаимодействие ЛПОНП с липопротеинлипазой в тканевых капиллярах приводит к формированию остаточных ЛПОНП, богатых холестерином (ЛППП). Примерно половина этих частиц выводится из кровотока клетками печени в течение 2-6 ч. Остальные претерпевают модификацию с замещением оставшихся триглицеридов эфирами холестерина и освобождением от всех апопротеинов, за исключением апопротеина В. В результате формируются ЛПНП, которые содержат ¾ всего плазменного холестерина. Их главная функция — доставка холестерина в клетки надпочечников, скелетных мышц, лимфоцитов, гонад и почек [3]. Модифицированные ЛПНП (окисленные продукты, количество которых возрастает при повышенном содержании в организме активных форм кислорода, так называемом окислительном стрессе) могут распознаваться иммунной системой как нежелательные элементы. Тогда макрофаги их захватывают и выводят из организма в виде ЛПВП. При чрезмерно высоком уровне ЛПНП макрофаги становятся перегруженными липидными частицами и оседают в стенках артерий, образуя атеросклеротические бляшки.
Основные транспортные функции липопротеинов приведены в таблице.
Таблица. Функции липопротеинов [5].
| Класс | Размеры | Функция |
|---|---|---|
| ЛПВП | 4-14 нм | Транспорт холестерина от периферийных тканей к печени |
| ЛПНП | 20-22,5 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛППП | 25-35 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛПОНП | 30-80 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| Хиломикроны | 75-1200 нм | Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень |
Регуляция уровня холестерина
Уровень холестерина в крови в большой степени определяется диетой. Пищевые волокна снижают уровень холестерина, а пища животного происхождения повышает его содержание в крови.
Один из основных регуляторов метаболизма холестерина — рецептор LXR (рис. 3). LXR α и β принадлежат к семейству ядерных рецепторов, которые образуют гетеродимеры с ретиноидным Х рецептором и активируют гены-мишени. Их естественные лиганды — оксистерины (окисленные производные холестерина). Обе изоформы идентичны на 80% по аминокислотной последовательности. LXR-α обнаружен в печени, кишечнике, почках, селезенке, жировой ткани; LXR-β в небольшом количестве обнаруживается повсеместно [6]. Метаболический путь оксистеринов быстрее, чем у холестерина, и поэтому их концентрация лучше отражает краткосрочный баланс холестерина в организме. Существует всего три источника оксистеринов: ферментативные реакции, неферментативное окисление холестерина и поступление с пищей. Неферментативные источники оксистеринов как правило минорные, но в патологических состояниях их вклад возрастает (окислительный стресс, атеросклероз), и оксистерины могут действовать наряду с другими продуктами перекисного окисления липидов [6]. Основное влияние LXR на метаболизм холестерина: обратный захват и транспорт в печень, вывод с желчью, снижение кишечного всасывания. Уровень продукции LXR различается на протяжении аорты; в дуге, зоне турбулентности, LXR в 5 раз меньше, чем в участках со стабильным течением. В здоровых артериях повышение экспрессии LXR в зоне сильного потока оказывает антиатерогенное действие [7].
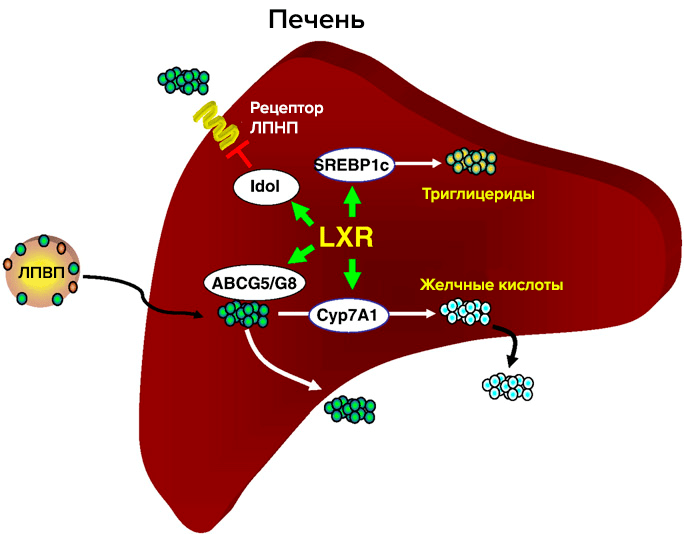
Рисунок 3. Участие рецептора LXR в метаболизме холестерина в печени
Важную роль в метаболизме холестерина и стероидов играет рецептор-«мусорщик» SR-BI (рис. 4). Он был обнаружен в 1996 году как рецептор для ЛПВП [8]. В печени SR-BI отвечает за избирательный захват холестерина из ЛПВП. В надпочечниках SR-BI опосредует избирательный захват этерифицированного холестерина из ЛПВП, который необходим для синтеза глюкокортикоидов. В макрофагах SR-BI связывает холестерин, что является первым этапом в обратном транспорте холестерина. SR-BI также захватывает холестерин из плазмы и опосредует его прямой выход в кишечник [9].
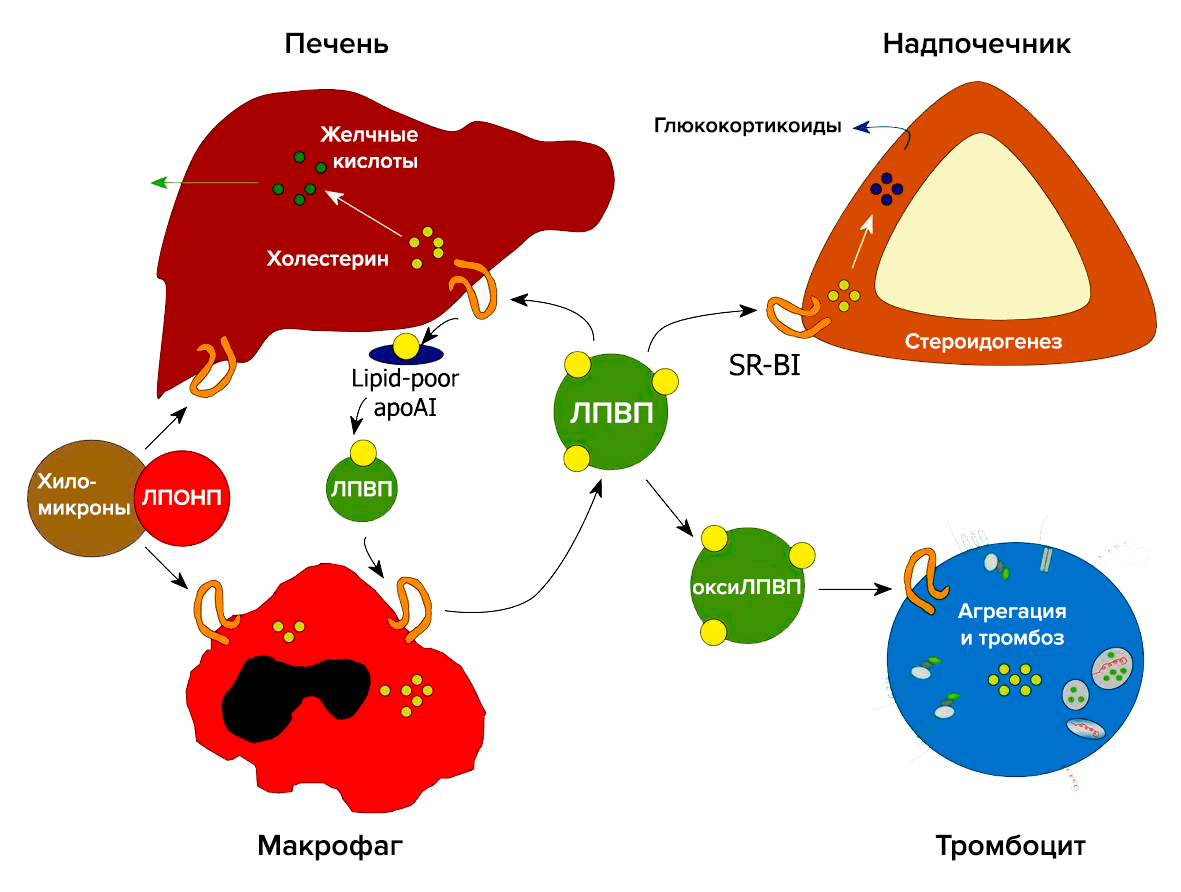
Рисунок 4. Участие рецептора SR-BI в метаболизме холестерина
Выведение холестерина из организма
Классический путь выведения холестерина: транспорт холестерина с периферии в печень (ЛПВП), захват клетками печени (SR-BI), экскреция в желчь и выведение через кишечник, где большая часть холестерина возвращается в кровь [10].
Основная функция ЛПВП — обратный транспорт холестерина в печень. Плазменные ЛПВП являются результатом комплекса различных метаболических событий. Состав ЛПВП очень различается по плотности, физико-химическим свойствам и биологической активности. Это сферические или дисковидные образования. Дисковидные ЛПВП в основном состоят из апопротеина A-I с вложенным слоем фосфолипидов и свободного холестерина. Сферические ЛПВП больше и дополнительно содержат гидрофобное ядро из эфиров холестерина и небольшого количества триглицеридов.
При метаболическом синдроме активируется обмен триглицеридов и эфиров холестерина между ЛПВП и триглицерид-богатыми липопротеинами. В результате содержание триглицеридов в ЛПВП повышается, а холестерина снижается (т.е. холестерин не выводится из организма) [11]. Отсутствие ЛПВП у людей встречается при болезни Tangier, главные клинические проявления которой — увеличенные оранжевые миндалины, роговичная дуга, инфильтрация костного мозга и мукозного слоя кишечника [3].
Если коротко обобщить, то страшен не сам холестерин, который является необходимым компонентом, обеспечивающим нормальную структуру клеточных мембран и транспорт липидов в крови, а кроме того он является сырьем для производства стероидных гормонов. Метаболические расстройства же проявляются при нарушении баланса ЛПНП и ЛПВП , что отражает нарушение системы транспорта липопротеинов, включающей работу печени, образование желчи и участие макрофагов. Поэтому любые заболевания печени, а также аутоиммунные процессы могут вызвать развитие атеросклероза даже при вегетарианской диете. Если мы вернемся к изначальным опытам Н.А. Аничкова по кормлению кроликов пищей, богатой холестерином, то увидим, что холестерин не встречается в естественном рационе кроликов и поэтому, как яд, нарушает работу печени, вызывает сильное воспаление сосудов и, как следствие, образование бляшек.
- Anitschkow N. and Chalatow S. (1983). Classics in arteriosclerosis re: On experimental cholesterin steatosis and its ificance in the origin of some pathological processes by N. Anitschkow and S. Chalatow, translated by Mary Z. Pelias, 1913. Arteriosclerosis, Thrombosis, and Vascular Biology. 3, 178-182;
- Климов А.Н. Причины и условия развития атеросклероза. Превентивная кардиология. М.: «Медицина», 1977. — 260-321 с.;
- Cox R.A. and Garcia-Palmieri M.R. Cholesterol, triglycerides, and associated lipoproteins. Clinical methods: the history, physical, and laboratory examinations (3rd Edition). Boston: Butter-worths, 1990. — 153-160 p.;
- Grundy S.M. (1978). Cholesterol bolism in man. West. J. Med. 128, 13-25;
- Википедия: «Липопротеины»;
- Wójcicka G., Jamroz-Wisniewska A., Horoszewicz K., Beltowski J. (2007). Liver X receptors (LXRs). Part I: Structure, , regulation of activity, and role in lipid bolism. Postepy Hig. Med. Dosw. 61, 736-759;
- Calkin A. and Tontonoz P. (2010). Liver X Receptor aling pathways and atherosclerosis. Arterioscler. Thromb. Vasc. Biol. 30, 1513-1518;
- S. Acton, A. Rigotti, K. T. Landschulz, S. Xu, H. H. Hobbs, M. Krieger. (1996). Identification of Scavenger Receptor SR-BI as a High Density Lipoprotein Receptor. Science. 271, 518-520;
- Vrins C.L.J. (2010). From blood to gut: Direct secretion of cholesterol via transintestinal cholesterol efflux. World J. Gastroenterol. 16, 5953-5957;
- Van der Velde A.E. (2010). Reverse cholesterol transport: From classical view to new insights. World J. Gastroenterol. 16, 5908-5915;
- Wilfried Le Goff, Maryse Guerin, M.John Chapman. (2004). Pharmacological modulation of cholesteryl ester transfer protein, a new therapeutic target in atherogenic dyslipidemia. Pharmacology & Therapeutics. 101, 17-38;
- Липидный фундамент жизни;
- Наночастицами — по «плохому» холестерину!.
Источник
Что такое холестерин
Откуда берется холестерин и нужен ли он нашему организму
Холестерин — это природное химическое соединение, представляет собой спирт, который хорошо растворяется в жирах. Он содержится в мембранах клеток многих животных организмов, в том числе, человека. В основном, холестерин вырабатывается самим организмом (до 80%, что составляет 1,5-2,5 г/сутки)1. Оставшийся поступает с пищей (до 20%). Основной синтез и обмен происходит в печени. Из продуктов питания богаты им мясо, особенно свинина, яйца (желток), сыр, сливочное масло, субпродукты (печень), икра.
Новорожденные дети получают холестерин с грудным молоком, так как для них жизненно важно поступление достаточного количества жира и холестерина. От этого зависит развитие центральной и периферической нервной системы, костно-мышечной системы, функционирование иммунитета и обмена веществ в целом1.
Для взрослых людей холестерин (ХС) не менее важен. Его основная задача — обеспечивать стабильность, прочность и проницаемость клеточных мембран, он относится к их главным структурным элементам. Без него невозможна нормальная работа эритроцитов, нервных клеток (особенно длинных отростков — аксонов), печени, клеток белого вещества мозга. Вторая функция холестерина, от которой зависит жизнедеятельность всего организма — участие в производстве биологически активных веществ, среди которых1:
Опасности низкого уровня ХС1
- 1 Нарушение работы нервной системы — проводимости импульса по волокнам, скорости реакции и т.д.
- 2 Хрупкость костей и нарушение минерального обмена.
- 3 Ранняя менопауза или аменорея (прекращение менструаций) у женщин.
- 4 Импотенция, депрессия и другие расстройства у мужчин.
- 5 Невозможность полноценного усваивания жиров.
Виды холестерина
В организме ХС проходит довольно сложный путь превращений, который обеспечивается холестерин-транспортной системой. В крови ХС находится в связанном состоянии, его транспорт осуществляют белки6.
ХС, который содержится в продуктах питания, всасывается в тонком кишечнике и переносится в печень в составе липопротеидов низкой плотности (ХС-ЛПНП), которые состоят из ХС, триглицеридов и жирных кислот1. Эта же форма белков помогает транспортировать ХС из печени к другим органам. В клетках находятся специальные рецепторы ХС-ЛПНП, соединяясь с которыми, холестерин способен проникнуть внутрь. Избыток ХС удаляется из клетки с другими белками — липопротеидами высокой плотности (ХС-ЛПВП). С ними он поступает обратно в печень, а далее с желчными кислотами в тонкий кишечник6.
Свое название ХС-ЛПНП и ХС-ЛПВП получили из-за особенностей распределения этих белковых соединений при центрифугировании сыворотки. Первые обычно оказываются в верхних слоях, так как имеют небольшую плотность, а вторые оседают, так как они более плотные. Всего существует 5 типов липопротеидов6:
Так происходит определенный круговорот ХС в организме и его экономное расходование, что помогает живым организмам выжить даже в период голода и неравномерного его поступления с пищей.
Даже небольшое превышение нормы холестерина в рационе может привести к значительным нарушениям его обмена и системы регуляции. В этом случае ХС способен накапливаться в тканях, в том числе, в сосудистой стенке, что способствует формированию атеросклеротических бляшек, развитию атеросклероза и, в итоге, к сердечно-сосудистым катастрофам (инфаркту миокарда, инсульту)7.
В 2017 году были приняты Российские национальные рекомендации по диагностике и коррекции нарушений липидного обмена. Согласно им, нормами общего холестерина (ОХС) и его отдельных фракций признаны следующие значения7:
| Параметр | Умеренный и низкий риск | Высокий риск | Очень высокий риск |
|---|---|---|---|
| ОХС | ˂ 5,0 | ˂ 4,5 | ˂ 4,0 |
| ХС-ЛПНП* | ˂ 3,0 | ˂ 2,5 | ≤ 1,5 |
| ХС-ЛПВП | Мужчины ˃ 1,0; женщины ˃ 1,2 | ||
| ТГ | ≤1,7 | ||
| Лп(а), мг/дл** | ˂ 50 | ||
То есть это те показатели, к которым стоит стремиться для профилактики нарушений жирового обмена и снижения риска развития сердечно-сосудистых заболеваний (ССЗ), в первую очередь, атеросклероза.
Риск развития осложнений ССЗ оценивается не только по уровню холестерина, но и по другим показателям (шкала SCORE). К ним относятся: цифры систолического и диастолического давления, наличие болезней сердца и сосудов, сахарного диабета и других хронических заболеваний, поражений органов-мишеней (сердце, мозг, почки), курение, пол, возраст и другие2.
Чем выше у человека риск по ССЗ, тем более низкий уровень липидов у него предпочтителен. Эти значения соответствуют и требованиям современных рекомендаций по лечению и профилактике атеросклероза, принятые в 2016 году Европейским кардиологическим обществом3. А основным показанием к назначению липидоснижающей терапии считают уровень ХС-ЛПНП в плазме крови.
Кроме того, для дополнительной оценки состояния липидного обмена учитывают соотношение уровня ХС-ЛПНП и ХС-ЛПВП, которое характеризует поступление ХС из печени в ткани и обратно. Причем нарушение баланса ХС может быть связано не только с избыточным количества ХС в пище, но и с другими механизмами: дефицитом ХС-ЛПВП или повышенным образованием в печени ХС-ЛПНП, нарушениями в рецепторном аппарате клеток или транспортировке ХС, а также с увеличением его синтеза в печени по тем или иным причинам3.
Теория развития атеросклероза
Учитывая важность атеросклероза в развитии таких серьезных осложнений ИБС, как острый коронарный синдром и инфаркт миокарда, вопросу формирования атеросклеротических бляшек посвящено достаточно много научных работ.
Так, результаты Фремингемского исследования4 позволили создать полноценную концепцию факторов риска атеросклероза. Было доказано, что высокий уровень ХС-ЛПНП и низкий ХС-ЛПВП — это самые мощные факторы, как у женщин, так и мужчин, независимо от возраста.
При избыточном содержании липидов, высоком артериальном давлении, недостаточной физической активности во внутренней стенке сосудов (эндотелии) откладываются ХС-ЛПНП и кальций4. Вокруг таких отложений собираются биологически активные вещества и клетки. В результате формируется бляшка, постепенно перекрывающая просвет сосуда. Ток крови ограничивается, нарушается кровоснабжение органов и тканей.
При стрессе и других неблагоприятных факторах, когда происходит дополнительный спазм сосудов, возможно полное прекращение поступления крови в орган. Больше всего уязвимы сосуды сердца и головного мозга.
Холестерин «плохой» и «хороший» — в чем разница?
Не весь ХС одинаково вреден или полезен. На так называемый «плохой» и «хороший» его делят по отношению к процессам, которые они могут запустить в сосудистой стенке.
ХС-ЛПВП легко могут проникнуть в стенку сосуда, но и свободно покидают ее, поэтому не становятся причиной формирования атеросклеротической бляшки. Кроме того, они способствуют выведению холестерина из тканей. Эти липопротеиды получили название антиатерогенных и считаются «хорошими»4.
ХС-ЛПОНП задерживаются в сосудистой стенке только при окислении, а вот накопление ХС-ЛПНП в эндотелии (внутренней оболочке) сосуда обычно и становится причиной атеросклероза. Это атерогенные липопротеиды или «плохие». На снижение их уровня в первую очередь и направлена холестеринснижающая терапия.
Повышение уровня общего ХС может говорить о нарушении обмена жиров, развитии атеросклероза, ИБС, застоя желчи, ожирения, сахарного диабета и других заболеваний4. Но и значительное его снижение тоже не абсолютный показатель здоровья, так как ХС необходим организму для нормальной работы. Также доказано, что достаточное количество ХС-ЛПВП способствуют профилактике болезни Альцгеймера1, нормализуют работу иммунной системы и обладает противораковыми свойствами. Поэтому полностью исключать жиросодержащие продукты из рациона нельзя.
Как поддерживать нормальный баланс липидов
Чтобы поддерживать низкий уровень ХС-ЛПНП и высокий уровень «хороших» ХС-ЛПВП, специалисты разработали целый комплекс мер2. Основой являются немедикаментозные способы коррекции. К ним относятся:
- 1 Диета3: насыщенные жиры, которые содержаться в сливочном, пальмовом, кокосовом и других твердых маслах, заменяются на полезные поли- и мононенасыщенные жиры (оливковое, льняное масло, морская рыба и т.д.). Также сокращается количество углеводов, особенно простых. На их место должны прийти сложные углеводы из фруктов, овощей, цельнозерновых продуктов. Важно сохранять в рационе достаточное количество клетчатки, которая способна адсорбировать (брать на себя) жиры из кишечника и выводить их, а также способствует нормальной работе желудочно-кишечного тракта. По возможности исключается алкоголь, особенно крепкие напитки. При наличии избыточного веса или ожирения, снижается общая калорийность.
- 2 Адекватные физические нагрузки2. Приветствуются общеукрепляющие кардионагрузки. Это может быть быстрая ходьба, плавание, йога, пилатес и т.д. Для того, чтобы заниматься более интенсивно, необходима консультация кардиолога. В любом случае расход энергии должен соответствовать ее поступлению.
- 3 Устранение других факторов риска2: отказ от курения, контроль и нормализация артериального давления, коррекция сахара в крови, регулярные обследования у кардиолога или терапевта, которые могут оценить результаты исследований и порекомендовать соответствующие методы коррекции липидного обмена. Если риск по сердечно-сосудистым заболеваниям определяется как низкий, то достаточно проходить обследование один раз в год.
Лекарственные методы
Лекарственные методы коррекции гиперлипидемии (повышенного содержания жиров) назначает врач по результатам обследования.
Группы препаратов для снижения уровня липидов3:
- 1 Статины или ингибиторы синтеза холестерина. Снижают концентрацию холестерина за счет торможения ферментов, которые участвуют в процессе его выработки в печени. Одновременно в клеток печени повышается количества рецепторов ХС-ЛПНП, что способствует выведению ХС из тканей.
- 2 Ингибиторы абсорбции (всасывания) ХС в кишечнике. Избирательно снижают всасывание холестерина, входящего в состав ХС-ЛПНП. Снижают ХС-ЛПНП, повышают ХС-ЛПВП.
- 3 Секвестранты желчных кислот. Связывают желчные кислоты в кишечнике и препятствуют их обратному всасыванию в кровоток, тем самым снижая уровень ХС-ЛПНП.
- 4 Фибраты — производные фиброевой кислоты. Снижают выработку жирных кислот, триглицеридов и липопротеидов низкой плотности.
- 5 Омега-3 полиненасыщенные жирные кислоты. Тормозят синтез ХС-ЛПОНП в клетках печени.
- 6 Никотиновая кислота в больших дозах. Уменьшает количество триглицеридов и ХС-ЛПНП в плазме крови, повышает уровень ХС-ЛПВП.
Кроме снижения уровня атерогенных ХС-ЛПНП, важной части коррекции липидного обмена для профилактики сердечно-сосудистых заболеваний является повышение концентрации ХС-ЛПВП. По современным международным рекомендациям уровень липопротеидов высокой плотности не должен быть ниже
1 ммоль/л
у мужчин и
1,2 ммоль/л
— у женщин4.
Снижение влияния любого из факторов развития атеросклероза предупреждает развитие таких серьезных осложнений, как инфаркт миокарда, инсульт и другие сердечно-сосудистые события. Многоцентровые исследования ASCOT-LLA и CARDS доказали эффективность применения статинов для профилактики сердечно-сосудистых заболеваний, а также для улучшения их прогноза6.
Подход к коррекции липидного обмена должен быть индивидуальным и комплексным, а также сопровождаться регулярным контролем. Каждому человеку после 40 нужно знать свое артериальное давление, уровень глюкозы и холестерина в крови также хорошо, как свой возраст. Только так можно добиться нормализации уровней холестерина в плазме крови и предотвратить прогрессирование атеросклероза и других ССЗ.
Источник