Холестерин является предшественником стероидных гормонов
Содержание статьи
интез гормонов коры надпочечников. Стероиды
Синтез гормонов коры надпочечников. Стероиды — производные холестерола
а) Синтез и секреция гормонов коры надпочечников. В коре надпочечников есть три отдельные зоны. На рисунке ниже показано, что кора надпочечников подразделяется на три относительно независимых слоя.
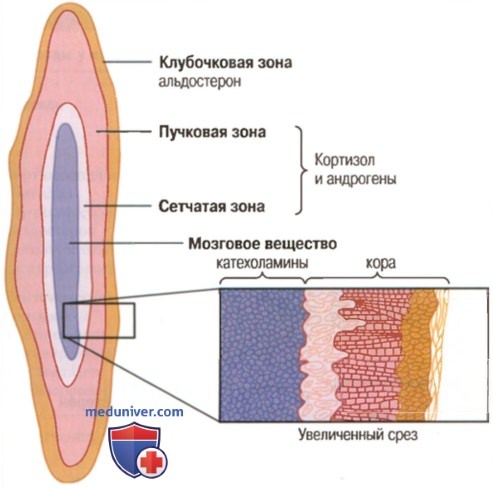
Секреция адренокортикальных гормонов различными зонами коры и секреция катехоламинов мозговым веществом
1. Клубочковая зона — тонкий слой клеток, расположенный непосредственно под капсулой надпочечника, составляющий 15% коры надпочечников. Только клетки этой зоны способны синтезировать существенное количество алъдостерона благодаря присутствию фермента алъдостеронсинтетазы, необходимого для образования альдостерона.
Секреторные процессы этой зоны контролируются главным образом концентрацией ангиотензина II и калия во внеклеточной жидкости, стимулирующих продукцию альдостерона.
2. Пучковая зона — средняя, наиболее широкая зона, которая составляет 75% коры надпочечников и продуцирует глюкокортикоиды, кортизол и кортикостерон наряду с небольшим количеством андрогенов и эстрогенов. Секреция этой зоны коры надпочечников регулируется гипоталамо-гипофизарной системой посредством адренокортикотропного гормона (АКТГ).
3. Сетчатая зона — глубинная зона коры надпочечников, продуцирующая андрогены дегидроэпиандростерон и андростендион наряду с небольшими количествами эстрогенов и некоторых глюкокортикоидов. Регулируют активность этих клеток также АКТГ и другие факторы, например гормон-стимулятор кортикальных андрогенов, выделяемый гипофизом. Механизмы, контролирующие продукцию андрогенов, не так понятны, как механизмы, ответственные за продукцию глюко- и минералокортикоидов.
Продукция альдостерона и кортизола регулируется независимо друг от друга. Так, ангиотензин II, особенно активно стимулирующий выброс альдостерона и благодаря которому наблюдается гипертрофия клубочковой зоны, неэффективен по отношению к двум другим зонам.
Сходным образом АКТГ, повышающий секрецию кортизола и андрогенов надпочечниками, вызывающий гипертрофию пучковой и сетчатой зон, оказался малоэффективным или даже не действенным по отношению к клубочковой зоне.
б) Гормоны коры надпочечников — стероиды, производные холестерола. Стероидные гормоны человека, включая гормоны коры надпочечников, синтезируются из холестерола. Приблизительно 80% холестерола, используемого для синтеза стероидов, обеспечиваются липопротеинами низкой плотности, циркулирующими в плазме крови, хотя клетки коры надпочечников могут заново синтезировать небольшое количество холестерола из ацетата.
ЛПНП, содержащие холестерол в высокой концентрации, диффундируют из плазмы в интерстициальное пространство и прикрепляются к рецепторам, содержащимся в структурах, названных окаймленными ямками, на мембранах адренокортикальных клеток. Затем окаймленные ямки погружаются внутрь путем эндоцитоза, образуя везикулы, сливающиеся в итоге с лизосомами клеток, и высвобождают холестерол, используемый для синтеза стероидных гормонов.
Транспорт холестерола в адреналовые клетки регулируется механизмом обратной связи, который может заметно менять количество имеющегося холестерола для синтеза гормонов. Например АКТГ, который стимулирует синтез стероидных гормонов надпочечников, увеличивает количество рецепторов для ЛПНП наряду с активацией ферментов, высвобождающих холестерол их ЛПНП.
Как только холестерол попадает в клетку, он доставляется в митохондрии, где расщепляется ферментом холестеролдесмолазой, образуя прегненолон; этот этап лимитирует скорость возможного образования стероидов (для облегчения понимания просим вас изучить рисунок ниже).
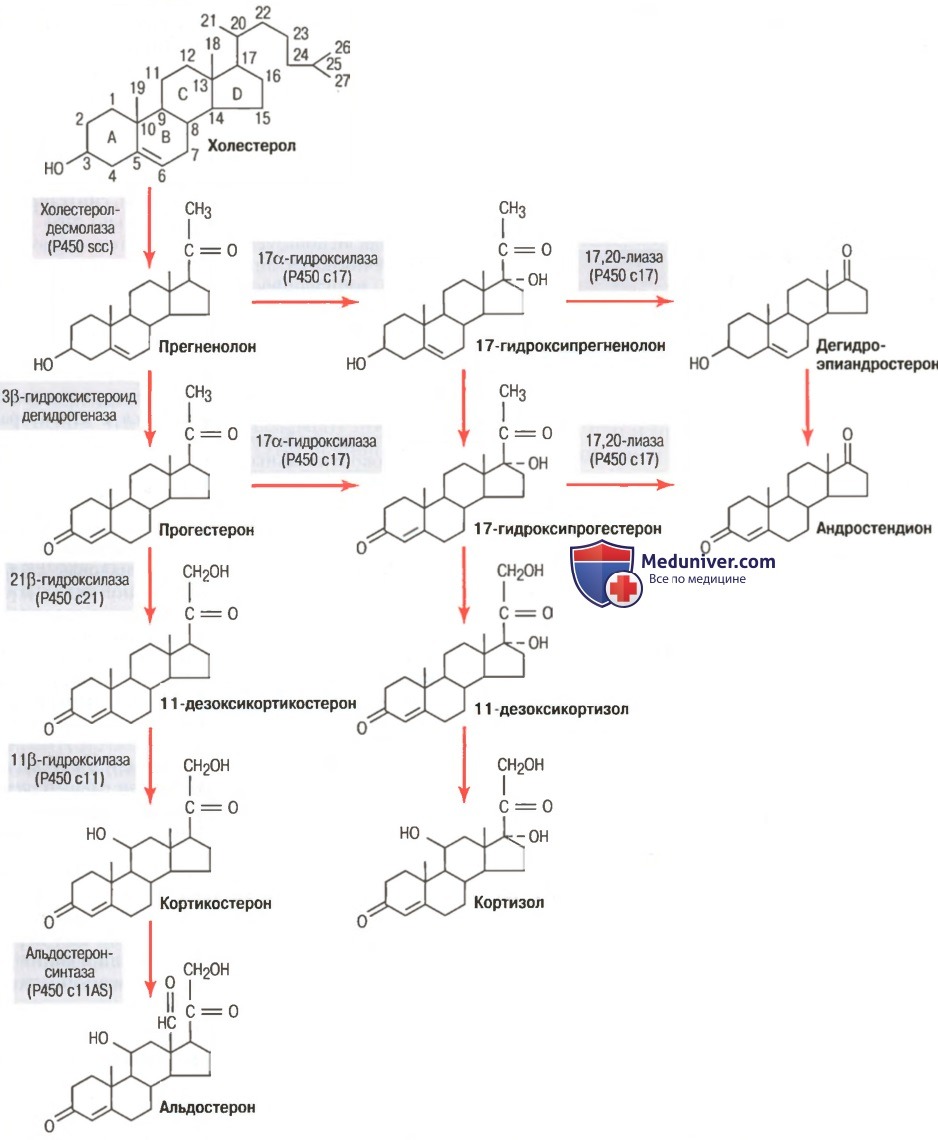
Пути синтеза стероидных гормонов коры надпочечников. Ферменты выделены серым фоном
Во всех трех зонах коры надпочечников этот начальный этап синтеза стероидов стимулируется разными факторами, что определяет в итоге, какие гормоны будут преобладать: альдостерон или кортизол.
Например, как АКТГ, стимулирующий секрецию кортизола, так и ангиотензин II, стимулирующий секрецию альдостерона, ускоряют превращение холестерола в прегненолон.
Видео физиология гормонов надпочечника — профессор, д.м.н. П.Е. Умрюхин
— Также рекомендуем «Синтез стероидов коры надпочечников. Минералокортикоиды и глюкокортикоиды»
Оглавление темы «Гормоны глюкокортикоидов»:
1. Диагностика гипертиреоидизма. Гипотиреоидизм при эндемическом коллоидном зобе
2. Идиопатический нетоксический коллоидный зоб. Микседема
3. Кретинизм. Гормоны надпочечников
4. Синтез гормонов коры надпочечников. Стероиды — производные холестерола
5. Синтез стероидов коры надпочечников. Минералокортикоиды и глюкокортикоиды
6. Адренокортикальные гормоны. Дефицит минералокортикоидов
7. Физиологические функции альдостерона. Влияние альдостерона на почки
8. Избыток альдостерона. Влияние альдостерона на железы
9. Регуляция секреции альдостерона. Обратная связь альдостерона
10. Функции глюкокортикоидов. Кортизол и обмен углеводов
Источник
СТЕРОИДНЫЕ ГОРМОНЫ
СТЕРОИДНЫЕ ГОРМОНЫ — обширная группа полициклических соединений, обладающих высокой биологической активностью и образующихся в организме человека и животных из общего предшественника — холестерина. В мед. практике многие С. г. и их синтетические аналоги используются как лекарственные средства. Важнейшим общим свойством С. г. является способность непосредственно проникать в цитоплазму клеток, взаимодействовать там с внутриклеточными белками-рецепторами и в комплексе с ними переходить в ядро. Основной молекулярный механизм действия этих гормонов на метаболизм клеток состоит в избирательной регуляции процессов транскрипции (см.).
Единство полиморфного класса С. г. обусловлено присутствием в их молекулах стеранового ядра, что лежит в основе общности свойств этих гормонов и их динамики в организме. Формирование различных типов биол. активности С. г. определяется комплексом модификаций в структуре C17-стеранового ядра. Все С. г. циркулируют в крови в комплексе со специфическими транспортными белками плазмы крови и метаболизируются во многих случаях по сходным или идентичным путям. С. г. липофильны, легко диффундируют через клеточные мембраны. Они синтезируются в стероидогенных железах из холестерина (см.); их биосинтез, как правило, контролируется тройными гормонами гипофиза (см.), функционально связанными с нейросекреторными структурами мозга.
К С. г. относятся производные:
1) прегнана (C21) — прогестины (см.), кортикостероиды (см.) — глюкокортикоидные гормоны (см.) и минералокортикоидные гормоны (см.);
2) андростана (С19) — андрогены (см.);
3) эстрана (С18) — эстрогены (см.);
4) холестана (С27) — гормональные формы витамина D3 (см. Кальциферолы) и гормоны насекомых и ракообразных — экдизоны.
К прогестинам (см.) относятся прогестерон (см.) и два его производных, секретируемые яичниками (см.), плацентой (см.) и семенными пузырьками (см.). Их биосинтез специфически стимулируется лютеинизирующим гормоном (см.) гипофиза и хорионическим гонадотропином (см.) плаценты. Основные физиол. эффекты прогестинов: стимуляция беременности, регуляция половых циклов, стимуляция оогенеза, формирование белочной оболочки яйца, дифференцировка молочных желез, антиандрогенное и антиэстрогенное действие, натрийуретический эффект. Природные и синтетические прогестины широко используются в акушерско-гинекологической практике в качестве лекарственных средств.
Кортикостероиды секретируются корковым веществом надпочечников (см.) в форме глюкокортикоидов — кортизона (см.) и кортикостерона (см.) и минералокортикоида — альдостерона (см.). Специфическим стимулятором биосинтеза глюкокортикоидов является адренокортикотропный гормон (см.) гипофиза, а регуляторами биосинтеза альдостерона — ангиотензин, ионы К+ и Na+, серотонин (см.). Основные физиол. эффекты глюкокортикоидов: регуляция углеводного и белкового обмена, организация процессов неспецифической адаптации, антивоспалительный и антиаллергический эффекты, эффект посредников для ряда гормонов и медиаторов, влияние на обмен ионов Na+ и К+. Глюкокортикоиды широко применяются в клин, практике в качестве лекарственных средств при лечении ряда эндокринных и аллергических заболеваний, коллагеновых болезней, шока и т. д. Основные физиол. эффекты минералокортикоидов: задержка в организме ионов Na+ и воды, выведение ионов К+ и Н+. Минералокортикоиды используют при лечении аддисоновой болезни, сольтеряющей форме врожденной дисфункции коры надпочечников, при к-рых они незаменимы, и др.
К андрогенам относятся тестостерон (см.) , его активные метаболиты 5-альфа-дигидротестостерон и 5-альфа-андростандиол и другие гормоны. Тестостерон синтезируется семенниками и яичниками под специфическим контролем лютеинизирующего гормона. В корковом веществе надпочечников под контролем АКТГ образуются малоактивные андрогены, способные отчасти активироваться в периферических тканях. Основные физиол. эффекты андрогенов: программирование вторичных половых признаков мужского пола и регуляция активности органов мужской половой сферы, общий анаболический эффект, антиэстрогенное действие. Тестостерон и его аналоги применяют в клин, андрологии в качестве специфических стимуляторов. Синтетические производные андрогенов (стероидные анаболические средства) используют при лечении кахексии, ожогов, травм, гипофизарного нанизма и т. д.
Эстрогены секретируются яичниками, плацентой и семенниками в виде эстрадиола (наиболее активного гормона), эстрона и эстриола под контролем лютеинизирующего гормона и хорионического гонадотропина. Нек-рая часть эстрогенов образуется на периферии из андрогенов. Основные физиол. эффекты эстрогенов: программирование и регуляция проявления вторичных женских половых признаков, стимуляция роста и развития женских половых органов и формирования белочной оболочки яйца, торможение оогенеза, сенсибилизация тканей к действию ряда гормонов, антиандрогенный эффект. Препараты эстрогенов широко применяют в акушерско-гинекологической практике в качестве лекарственных средств.
Гормональные формы витамина D3 образуются в печени и почках из этого витамина, поступающего с пищей, под контролем паратгормона (см.), кальцитонина (см.), ионов Ca2+ и нек-рых анионов. Основным физиол. эффектом гормональных форм витамина D3 является регуляция обмена кальция (см.) и фосфора (см.), они обладают также антирахитическим действием. В клин, практике для лечения рахита (см.) используют витамины группы D — предшественники их гормональных форм. У личинок насекомых и у ракообразных образуются С. г. экдизоны под контролем специфических тройных нейрогормонов. Основными физиол. эффектами экдизонов являются стимуляция линьки, индуцирование окукливания и метаморфоза насекомых.
Библиография: Биохимия гормонов и гормональной регуляции, под ред. Н. А. Юдаева, М., 1976; Розен В. Б. Основы эндокринологии, М., 1980; Розен В. Б. и Смирнов А. Н. Рецепторы и стероидные гормоны, М., 1981, библиогр.; Физер Л. и Физер М. Стероиды, пер. с англ., М., 1964; Физиология эндо-кринной системы, под ред. В. Г. Баранова и др., JI., 1979; X е ф т м а н Э. М. Биохимия стероидов, пер. с англ., М., 1972, библиогр.; Endocrinology, ed. by L. J. De Groot a. o., v. 1—3, N. Y., 1979; Hormones in blood, ed. by G. H. Gray a. V. H. T. James, L.— N. Y., 1979.
В. Б. Розен.
Источник: Большая Медицинская Энциклопедия (БМЭ), под редакцией Петровского Б.В., 3-е издание
Рекомендуемые статьи
Источник
ХОЛЕСТЕРИНОВЫЙ ОБМЕН
ХОЛЕСТЕРИНОВЫЙ ОБМЕН (греческий chole желчь + stereos твердый) — совокупность реакций биосинтеза холестерина (см.) и его распада в организме человека и животных. В организме человека за сутки около 500 мг холестерина окисляется в желчные кислоты, примерно такое же количество стеринов экскретируется с фекалиями, около 100 мг выделяется с кожным салом, небольшое количество холестерина (около 40 мг) используется для образования кортикоидных и половых гормонов, а также витамина D3, 1—2 мг холестерина выводится с мочой. У кормящих женщин с грудным молоком выделяется 100— 200 мг холестерина в сутки. Эти потери восполняются за счет синтеза холестерина в организме (у взрослого человека в сутки около 700—1000 мг) и поступления его с пищей (300— 500 мг). Холестерин, а также часть холестерина, поступившего в просвет кишечника с желчью, всасывается в тонкой кишке в форме жировых мицелл (см. Жировой обмен). Эфиры холестерина предварительно гидролизуются при действии холестеринэстеразы (см.) панкреатического и кишечного соков. В стенке тонкой кишки холестерин используется для образования хиломикронов (см. Липопротеиды), в составе которых он поступает сначала в лимфатическую систему, а затем в кровяное русло.
В капиллярах жировой и некоторых других тканей в результате воздействия на хиломикроны липопротеид-липазы образуются частицы, обогащенные эфирами холестерина и фосфолипидами, получившие название ремнантных (остаточных) частиц. Эти частицы задерживаются в печени, где подвергаются распаду. Освободившийся при этом холестерин наряду с холестерином, синтезированным в печени, образует так называемый общий пул печеночного холестерина, который используется по мере необходимости для образования липопротеидов (см.).
Установлено, что у человека и некоторых животных липопротеиды низкой плотности транспортируют холестерин в органы и ткани, причем захват липоиротеидных частиц клетками этих органов и тканей осуществляется при участии специфических рецепторов. Холестерин, доставленный в клетку в составе липопротеидных частиц, идет на покрытие потребностей клетки (образование мембран при делении клетки, синтез стероидных гормонов и др.). Избыточная часть неэтерифицированного (свободного) холестерина превращается в его эфиры при действии содержащегося в клетке фермента — холестеролацилтрансферазы (КФ 2.3.1.26). Обратный транспорт неэтерифицированного холестерина из различных органов и тканей в печень осуществляется липопротеидами высокой плотности, причем в кровяном русле происходит этерификация захваченного холестерина при участии лецитина и фермента холестерин-лецитин — ацилтрансферазы (КФ 2.3.1.43). Доставленный таким путем в печень холестерин идет на образование желчных кислот (см.).
Синтез холестерина

Общая схема биосинтеза холестерина
Синтез холестерина осуществляется в клетках почти всех органов и тканей, однако в значительных количествах он образуется в печени (80%), стенке тонкой кишки (10%) и коже (5%). К. Блох, Ф. Линен и др. показали основные реакции биосинтеза холестерина (их не менее 30). Сложный процесс биосинтеза холестерина можно разделить на три стадии: 1) биосинтез мевалоновой кислоты; 2) образование сквалена из мевалоновой кислоты; 3) циклизация сквалена и образование холестерина (см. схему).
Считают, что главным источником образования мевалоновой кислоты в печени является ацетил-КоА, а в мышечной ткани — лейцин. И то и другое соединения в результате ряда энзиматических реакций образуют бета-гидрокси-бета-метилглутарил-КоА (ГМГ-КоА), который затем восстанавливается в мевалоновую кислоту. В последнее время показано, что в синтез мевалоновой кислоты в печени может включаться и малонил-КоА.
Реакцией, определяющей скорость биосинтеза холестерина в целом, является восстановление ГМГ-КоА в мевалоновую кислоту; этот процесс катализирует фермент НАДФ-Н2-зависимая ГМГ-КоА-редуктаза (КФ 1.1.1.34). Именно этот фермент подвержен воздействиям со стороны ряда факторов. Так, активность ГМГ-КоА-редуктазы повышается (или содержание ее в печени возрастает) и скорость синтеза холестерина в целом увеличивается при действии ионизирующего излучения, введении тиреоидных гормонов, поверхностно-активных веществ, холестирамина, а также при гипофизэктомии. Угнетение синтеза холестерина отмечается при голодании, тиреоидэктомии и при поступлении в организм пищевого холестерина. Последний угнетает активность (или синтез) фермента ГМГ-КоА-редуктазы.
Синтез холестерина в стенке тонкой кишки регулируется исключительно концентрацией желчных кислот. Так, отсутствие их в кишечнике при наличии наружного желчного свища ведет к повышению синтеза холестерина в тонкой кишке в 5—10 раз.
На второй стадии синтеза происходит фосфорилирование мевалоновой кислоты при участии АТФ и образование нескольких фосфорилированные промежуточных продуктов (см. Фосфорилирование). При декарбоксилировании одного из них образуется изопентенил-пирофосфат, часть которого превращается в диметилаллил-пирофосфат. Взаимодействие этих двух соединений приводит к образованию димера — геранил-пирофосфата, содержащего 10 атомов углерода. Геранил-пирофосфат конденсируется с новой молекулой изопентенил-пирофосфата и образует тример — фарнезил-пирофосфат, содержащий 15 атомов углерода. Эта реакция идет с отщеплением молекулы пирофосфата. Затем две молекулы фарнезил-пирофосфата конденсируются, теряя каждая свой пирофосфат, и образуют гексамер сквален, содержащий 30 атомов углерода.
Третья стадия синтеза включает окислительную циклизацию сквалена, сопровождающуюся миграцией двойных связей и образованием первого циклического соединения — ланостерина. Ланостерин уже имеет гидроксильную группу в положении 3 и три лишние (по сравнению с холестерином) метильные группы. Дальнейшее превращение ланосте-рина может совершаться двумя путями, причем и в том и в другом случае промежуточными продуктами являются соединения стериновой природы. Более доказанным считается путь через 24, 25-дигидроланостерин и ряд других стеринов, включая 7-дигидрохолестерин, служащий непосредственным предшественником холестерина. Другой возможный путь — превращение ланостерина в зимостерин, а затем в десмостерин, из которого при восстановлении образуется холестерин.
Если суммировать общий итог всех реакций биосинтеза холестерина, то он может быть представлен в следующем виде:
18CH3CO-S-KoA + 10(H+) + 1/2O2 —> C27H46O + 9CO2 + 18KoA-SH. Источником углерода холестерина является ацетил-КоА (им может быть также малонил-КоА и лейцин), источником водорода — вода и никотин-амида дениндинуклеотидфосфат, а источником кислорода — молекулярный кислород.
Начиная со сквалена и кончая холестерином все промежуточные продукты биосинтеза нерастворимы в водной среде, поэтому они участвуют в конечных реакциях биосинтеза холестерина в связанном со сквален или стеринпереносящими белками состоянии. Это позволяет им растворяться в цитоплазме клетки и создает условия для протекания соответствующих реакций. Холестерин-переносящий белок обеспечивает также перемещение стеринов внутри клетки, что имеет важное значение для вхождения его в мембрану клетки, а также для транспорта в клеточные системы, осуществляющие катаболизм холестерина.
Катаболизм холестерина протекает в печени (окисление его в желчные кислоты), в надпочечниках и плаценте (образование из холестерина стероидных гормонов), в тестикулярной ткани и яичниках (образование половых гормонов). При биосинтезе холестерина в коже на завершающей стадии образуется небольшое количество 7-дегидрохолестерина. Под влиянием УФ-лучей он превращается в витамин D3.
Своеобразные превращения претерпевает холестерин в толстой кишке. Речь идет о той части пищевого холестерина или холестерина, поступившего в кишечник с желчью, которая не подверглась всасыванию. Под влиянием микробной флоры толстой кишки происходит восстановление холестерина и образование так наз. нейтральных стеринов. Главным их представителем является копростерин. Экспериментальные исследования, проведенные с использованием радиоизотопных и других методов, показали, что скорость обновления холестерина в различных органах и тканях неодинакова; наиболее высока она в надпочечниках и печени и чрезвычайно низка в мозге взрослых животных.
Патология холестеринового обмена
Нарушения холестеринового обмена обычно связаны с дисбалансом между количеством синтезируемого в организме и поступающего с пищей холестерина, с одной стороны, и количеством холестерина, подвергающегося катаболизму,— с другой. Эти нарушения проявляются в изменении уровня холестерина в плазме крови, которые классифицируются как гиперхолестеринемия или гипохолестеринемия (для взрослого населения высокоразвитых стран величины выше 270 мг/100 мл и ниже 150 мг/100 мл соответственно).
Гиперхолестеринемия может быть первичной (наследственной или алиментарной) и вторичной, обусловленной различными заболеваниями. Наследственная (семейная) гиперхолестеринемия характеризуется высоким уровнем холестерина и липопротеидов низкой плотности (ЛПНГЛ в плазме крови. При гомозиготной гиперхолестеринемии уровень холестеринемии может достигать 700— 800 мг/100 мл, а при гетерозиготной — 300—500 мг/100 мл. В основе наследственной гиперхолестеринемии лежит генетически обусловленное отсутствие (у гомозигот) или недостаток (у гетерозигот) специфических рецепторов к липопротеидам низкой плотности у клеток, вследствие чего резко снижается захват и последующий катаболизм этих богатых холестерином липопротеидов клетками паренхиматозных органов и тканей. В результате пониженного захвата и снижения катаболизма липопротеидов низкой плотности развивается гиперхолестеринемия (см.). Последняя приводит к раннему развитию атеросклероза (см.) и его клинических проявлений — ишемической болезни сердца (см.), преходящей ишемии мозга (см. Инсульт) и др. Особенно тяжело протекает атеросклероз при гомозиготной форме; у таких больных часто наблюдается ксантоматоз (см.), липоидная дуга роговицы (отложение холестерина в роговицу глаз), инфаркт миокарда в юношеском возрасте.
Распространенность гомозиготной формы гиперхолестеринемии невелика (примерно один случай на 1 млн. жителей). Чаще встречается гетерозиготная форма — один случай на 500 жителей.
Алиментарная гиперхолестеринемия характеризуется повышенным уровнем холестерина в плазме крови вследствие длительного потребления больших количеств пищи, богатой холестерином (куриные желтки, икра, печень, животные жиры и др.). Алиментарная гиперхолестеринемия той или иной степени выраженности характерна для жителей высокоразвитых индустриальных стран. Согласно популяционным исследованиям имеется прямая зависимость между уровнем холестерина в крови и распространенностью ишемической болезни сердца.
В эксперименте на различных животных (кролики, морские свинки, обезьяны) показано, что введение массивных доз холестерина с пищей приводит к резко выраженной гиперхолестеринемии и быстрому развитию атеросклероза. Экспериментальные модели гиперхолестеринемии и атеросклероза, впервые предложенные H. Н. Аничковым и С. С. Халатовым (1913), широко используются в научных исследованиях.
Вторичная гиперхолестеринемия встречается при гипотиреозе (см.), сахарном диабете (см. Диабет сахарный), нефротическом синдроме (см.), подагре (см.) и др. и нередко сопровождается развитием атеросклероза (см. Гиперхолестеринемия).
Выделяют первичную и вторичную гипохолестеринемию. Первичная гипохолестеринемия характерна для наследственного заболевания — абеталипопротеинемии (см.). При этой болезни отмечается почти полное отсутствие в плазме крови липопротеидов низкой плотности (у гомозигот) или значительное их снижение (у гетерозигот). Уровень общего холестерина не превышает 75 мг/ 100 мл. Гомозиготная форма болезни протекает исключительно тяжело. В основе абеталипопротеинемии лежит генетически обусловленное нарушение синтеза апопротеина В — главного белка липопротеидов низкой плотности.
Вторичные гипохолестеринемии наблюдаются при кахексии, гипертиреоидизме, аддисоновой болезни и паренхиматозных заболеваниях печени, при ряде инфекционных болезней и интоксикациях (см. Гипохолестеринемия). При недостаточной активности в плазме крови фермента лецитин — холестерин -ацилтрансферазы, или ЛХАТ (наследственная ЛXАТ-недостаточность), ответственного за этерификацию холестерина плазмы, наблюдается накопление неэтерифицированного холестерина в мембранах эритроцитов и клетках почек, печени, селезенки, костного мозга, роговицы глаза. Резко снижается доля этерифицированного холестерина в плазме крови и одновременно повышается уровень неэтерифицированного холестерина и лецитина. У больных с наследственной ЛXAT-недостаточностыо стенки артерий и капилляров подвержены деструктивным изменениям, что связано с отложением в них липидов. Наиболее тяжелые изменения происходят в сосудах почечных клубочков, что приводит к развитию почечной недостаточности (см.).
Одним из распространенных нарушений холестериновый обмен. является образование желчных камней, основной составной частью которых является холестерин (см. Желчнокаменная болезнь). Образование желчных камней происходит вследствие выкристаллизовывания холестерина при относительно высокой его концентрации в желчи и относительно низкой концентрации в ней желчных кислот и фосфолипидов, обладающих способностью растворять холестерин. Исследования показали, что имеется прямая связь между уровнем холестерина в плазме крови и распространенностью холестероза (см.) и желчнокаменной болезни.
Библиогр.: Климов А. Н, и Н икульчева Н. Г. Липопротеиды, дислипопротеидемии и атеросклероз, Л., 1984; Полякова Э. Д. Пути биосинтеза холестерина в печени и их регуляция, в кн.: Липиды, структура,биосинтез, превращения и функции, под ред. С. Е. Северина, с. 131, М., 1977;она же, Регуляция содержания холестерина в клетке, в кн.: Биохимия липидов и их роль в обмене веществ, под ред.С. Е. Северина, с. 120, М., 1981; Финагин Л. К. Обмен холестерина и его регуляция, Киев, 1980; Lipids and lipidoses, ed. by G. Schettler, B.— Heidelberg, 1967; Sodhi H. S., Kudchod-k a r B. J. a. Mason D. T. Clinical methods in study of cholesterol metabolism, Basel a. o., 1979.
A. H. Климов
Источник