Холестерин синтез биологическая роль
Содержание статьи
Биологическая роль холестерина — Студопедия
Кафедра медицинской химии
Реферат
Строение и биологическая роль холестерина.
Гиперхолестеринемия и атеросклероз.
(обзор литературы)
Выполнила:
студентка 2 курса
медико-профилактического факультета
специальности «Медицинская биохимия», 1 группы
Бабаха Вероника Александровна
Научный руководитель:
канд. хим. наук, доцент, Терах Е.И.
Новосибирск – 2015
Содержание
Введение………………………………………………………………………………………………….3
Строение холестерина…………………………………………………………4
Биологическая роль……………………………………………………………5
Гиперхолестеринемия…………………………………………………………6
Лечение гиперхолестеринемии……………………………………………….7
Профилактикагиперхолестеринемии……………………………………….8
Атеросклероз……………………………………………………………………8
Клиническая картина………………………………………………………….9
Последствия атеросклероза…………………………………………………..10
Основные принципы лечения…………………………………………………12
Заключение…………………………………………………………………….13
Список литературы……………………………………………………………14
Введение
Холестерин – загадка современной науки. О нем написаны тонны научной литературы. Загадочности поубавилось, но проблемы, связанные с холестерином, остались.
В 1769 г. Пулетье де ла Саль получил из желчных камней плотное белое вещество, обладавшее свойствами жиров. В чистом виде холестерин был выделен химиком, членом национального Конвента и министром просвещения Антуаном Фуркруа в 1789 г. В 1815 г. Мишель Шеврёль, так же выделивший это соединение, назвал его холестерином. В 1859 г. Марселен Бертло доказал, что холестерин принадлежит к классу спиртов, после чего французы переименовали его в «холестерол». В ряде языков сохранилось старое название – холестерин[1].
Особое же внимание к холестерину было привлечено, когда обнаружилось, что большая часть населения в той или иной степени больна атеросклерозом (поражением сосудов в результате отложения в них холестерина).
Так для чего и зачем нужен холестерин и какова его биологическая роль? Этот вопрос интересует не только научных работников, но и тех, кому врачи посоветовали следить за его уровнем и беречь здоровье.
Строение холестерина
Холестерин (холестерол)– органическое соединение, жирорастворимый спирт, относящийся к классу стероидов. Молекулярная формула С27Н46О.
Углеродный скелет холестерина состоит их четырех колец: три кольца содержат по 6 атомов углерода и одно пять. От него отходит длинная боковая цепь. Нерастворим в воде, но может образовывать с ней коллоидные растворы, растворим в жирах и органических растворителях.
В чистом виде представляет собой мягкое белое вещество (жирные на ощупь жемчужные кристаллы в виде игл) без запаха и вкуса[2].
Это соединение обнаруживается в организме, как в виде свободного стерина, так и в форме сложного эфира с одной из длинноцепочечных жирных кислот. Свободный холестерин – компонент всех клеточных мембран и та основная форма, в которой холестерин присутствует в большинстве тканей. Исключение представляют кора надпочечников, плазма и атероматозные бляшки, где преобладают эфиры холестерина – холестериды.
Свободный холестерин – компонент всех клеточных мембран и та основная форма, в которой холестерин присутствует в большинстве тканей. Исключение представляют кора надпочечников, плазма и атероматозные бляшки, где преобладают эфиры холестерина.
Холестерин не растворим в воде, поэтому в организме его нельзя встретить в одиночестве, он передвигается с помощью различных белков. Комплексы, получающиеся в результате такого соединения, называются липопротеинами. Они имеют сферическую форму – внутри находится холестериновый эфир и триглицериды, а оболочка состоит из белка[3].
Биологическая роль холестерина
Около 80% холестерина вырабатывается самим организмом (печенью, кишечником, почками, надпочечниками, половыми железами), 20% поступает с пищей. В организме человека холестерин бывает в свободной форме- 80%, в связанной форме- 20%.
Холестерин необходим для выработки витамина D, который участвует в регуляции обмена кальция и фосфора в организме. Используется надпочечниками для синтеза адренокортикотропных гормонов, яичниками для образования эстрогенов и прогестерона (женские половые гормоны), семенниками для синтеза тестостерона (мужские половые гормоны). Играет важную роль в деятельности синапсов головного мозга и иммунной системы, включая защиту от раковых заболеваний.
Холестерин используется для синтеза холевой кислоты в печени даже в большем количестве, чем для образования клеточных мембран. Более 80% холестерина превращается в холевую кислоту. Ее синтез наряду с использованием некоторых других веществ, приводит к образованию солей желчных кислот, которые обеспечивают переваривание и всасывание жиров.
Так же холестерин служит строительным материалом для клеточных оболочек, делая их прочными и эластичными[4].
Гиперхолестеринемия
Гиперхолестеринемия– повышение уровня холестерина в крови. Является основным фактором риска развития атеросклероза. Так же может стать причиной таких заболеваний как ишемическая болезнь сердца, диабет, желчнокаменная болезнь, ожирение.
Распространенность в различных странах: Япония – 7%, Италия – 13%, Греция – 14%, США – 39%, Украина – 25%.
Выделяют первичную и вторичную формы гиперхолестеринемии.
Причиной возникновения первичной гиперхолестеринемии(не является следствием каких-либо заболеваний) получение по наследству от одного или обоих родителей аномального гена, который отвечает за синтез холестерина. Вторичные(развивается вследствие некоторых заболеваний) гиперхолестеринемии вызывают такие состояния как гипотиреоз (снижение функции щитовидной железы), сахарный диабет, обструктивные заболевания печени (заболевания, при которых нарушается отток из печени желчи), например, желчнокаменная болезнь (образование камней в желчном пузыре).
В развитии и прогрессировании гиперхолестеринемии являются те же факторы, что и при атеросклерозе, такие как малоподвижный образ жизни( гиподинамия), злоупотребление жирной, богатой холестерином пищей, злоупотребление алкоголем, курение.
В группу риска по гиперхолестеринемии входят лица мужского пола, мужчины старше 45 лет; люди, страдающие ожирением[5].
Гиперхолестеринемия чаще выявляется случайно, при лабораторных методах обследования, таких как биохимический анализ крови. В норме показатель холестерина в крови у женщин 1,92-4,51 ммоль/л; у мужчин 2,25-4,82 ммоль/л. Согласно официальным рекомендация Всемирной Организации Здравоохранения «нормальные» значения жировых фракций в крови должный быть таковы:
1. Общий холестерин- меньше 5,2 ммоль/л
2. Холестерин липопротеинов низкой плотности- меньше 3-3,5 ммоль/л
3. Холестерин липопротеинов высокой плотности- больше 1,0 ммоль/л
4. Триглицериды – 2,0 ммоль/л [6].
Внешние проявления гиперхолестеринемии являются ксантомы- плотные узелки, содержащие холестерин , над сухожилиями пациента, например, на кисти; ксантелазмы – отложение холестерина под кожей век в виде плоских узелков желтого цвета или не отличающихся по цвету от других участков кожи;липоидная дуга роговицы – белый либо серовато-белый ободок отложившегося холестерина по краям роговицы глаза. Появление липоидной дуги роговицы в возрасте до 50 лет свидетельствует о наличии наследственной гиперхолестеринемии[5].
Источник
Холестерин, строение, биологическая роль, биосинтез и распад холестерина в организме человека
Холестерин является одноатомным циклическим спиртом, который в тканях легко образует ХОЛЕСТЕРИДЫ. В организм человека поступает в составе пищи и синтезируется г.о. в печени, тонком отделе кишечника и коже.
Биологическая роль холестерина:
1.Структурная. Свободный холестерин является, обязательным структурным компонентом мембран клеток.
2.Метаболическая. Холестерин является предшественником биологически активных веществ: витамина D3,СТЕРОИДНЫХ гормонов (АНДРОГЕНОВ, ЭСТРОГЕНОВ, КОРТИКОИДОВ) При окислении холестерина в печени при участии ЦИТОХРОМА Р-450 образуются желчные кислоты. В свободном виде холестерин транспортируется по организму с помощью транспортных ЛИПОПРОТЕИНОВ крови. Источники холестерина:
1. Пища. За сутки в организм взрослого человека поступает 0,3гр. холестерина.
2. У человека в среднем с массой 65-70кг за сутки синтезируется 3.5 -4,2гр. холестерина. Печень занимает главное место в синтезе холестерина (85%), холестерин синтезируется в кишечнике (10%) и коже (5%). Процесс биосинтеза многоступенчат:
Образовавшийся в результате распада мембранных ЛИПИДОВ, а также излишки холестерина с помощью ЛПВП доставляется для окисления в печень, и в составе желчных кислот удаляется из организма с каловыми массами. При поражении печени и кишечника нарушается образование и транспорт ЛП крови. При поражении печени и желчевыводяицих путей нарушается образование и экскреция желчных кислот, участвующих в переваривании жиров пищи. В случае нарушения оттока желчи происходит насыщение её холестерином, что ведёт в этих условиях к застою и образованию холестериновых камней. Развивается ЖЕЛЧЕКАМЕННАЯ БОЛЕЗНЬ. В крови отмечается ГИПЕРХОЛЕСТЕРИНЕМИЯ.
Витамины, их характеристика, отличительные признаки витаминов. Номенклатура и классификация витаминов. Роль витаминов в обмене веществ. Причины недостаточной обеспеченности организма витаминами. Понятие о гипо-, гипер- и авитаминозах. Причины гиповитаминозов.
Русский врач ЛУНИН в эксперименте на животных установил, что животные, которых кормили казеином, жирами, лактозой, водой и минеральными солями болели и погибали, в отличие от животных, получавших свежее молоко. В 1911г. учёный ФУНД выделил и кристаллизовал азотсодержащее вещество, которое вылечивало экспериментальную бери-бери. Это вещество он назвал ВИТАМИНОМ (амином жизни).
Витамины — это НМС различного строения, синтез которых в организме отсутствует или ограничен. Особенности витаминов:
-не синтезируются в организме или синтезируются в недостаточном количестве;
-не выполняют пластической функции, т.е. не являются структурным компонентом клеток;
-не выполняют энергетической функции;
-выполняют специфические функции, которые не могут быть восполнены другими соединениями;
-при дефиците витаминов в организме развивается патологическое состояние с характерными клиническими признаками;
-витамины — это метаболиты, суточная потребность в которых выражается в миллиграммах, микрограммах или ME.
КЛАССИФИКАЦИЯ ВИТАМИНОВ. жирорастворимые (A, D, E, К) и водорастворимые (РР, С, В1, В2, ВЗ, В6, В10, В12, Н).. НОМЕНКЛАТУРА: Каждый витамин имеет:
o буквенное название: аскорбиновая кислота — вит.С; ретинол — вит.А.
o химическое название: вит.В1 -тиамин.
· 3. Клиническое название, которое формируется из клинической картины патологического состояния, которое развивается при дефиците витамина в организме с приставкой «анти»: Вит.D — антирахитический; Вит.С — антискорбутный.
ФУНКЦИИ ВИТАМИНОВ В ОРГАНИЗМЕ.
o Выделяют группу энзимовитаминов — это предшественники коэнзимов или простетических групп ферментов:
· Функциональное производное вит. РР: НАД и НАДФ. Функциональное производное вит.В2: ФМН и ФАД.
o Гормоновитамины: последовательная активация вит.DЗ приводит к образованию кальцитриола.
o Редоксвитамины или витамины- антиоксиданты — это вещества, которые препятствуют развитию процессов свободно-радикального окисления. Это природные оксиданты: Е, С, А.
o Участвуют в синтезе медиаторов (вит.С — серотонин), стероидных гормонов.
Витаминные коферменты
Тиаминсодержащие (вит. B1) — тиаминмонофосфат (ТМФ), тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ)
Флавиновые (вит В2 — рибофлавин) — флавинмононуклетид (ФМН), флавинадениндинуклеотид (ФАД)
Никотинамидные (содержат вит. РР или Никотинамид) — никотинамидадениндинуклеотид (НАД),
никотинамидадениндинуклеотидфосфат (НАДФ)
В результате многочисленных исследований витаминной обеспеченности было установлено, что глубокий дефицит витаминов наблюдается менее чем у 20% населения, а содержание витаминов ниже нормы наблюдается у 50 — 90% населения. Содержание витаминов определяется в крови. Недостаточная витаминная обеспеченность проявляется: (1) повышенная утомляемость; (2) повышенная сонливость; (3) повышенная восприимчивость к заболеваниям; (4) повышена частота сердечно-сосудистых заболеваний; (5) повышение тяжести переноса заболеваний. При этом отсутствует специфическая клиническая симптоматика, как при гиповитаминозах. Причины недостаточной витаминной обеспеченности:
1. Снижение затрат энергии в современных условиях, следовательно, необходимость снижение
потребления пищи.
2. Повышение потребления рафинированных продуктов, калорийных, но бедных витаминами.
3. Использование консервированных продуктов длительного хранения. Выход:
1. Витаминизация пищи.
2. Поливитамины с не менее 8-9 компонентами.
Рацион современного человека, достаточный по калорийности, не может удовлетворить потребность организма в витаминах и микроэлементах.
АВИТАМИНОЗ — это патологическое состояние, которое развивается в результате отсутствия витаминов организме, характеризуется чёткой клинической симптоматикой.
ГИПЕРВИТАМИНОЗ — это состояние, связанное с избытком витамина в организме человека. Растворимые в воде витамины, не накапливаются в организме, их избыток выводится из организма с мочой. Жирорастворимые витамины депонируются
ГИПОВИТАМИНОЗ — патологическое состояние, связанное с недостатком витаминов в организме. В зависимости от причины гиповитаминоз может быть:
1. Первичный (ЭКЗОГЕННЫЙ), связанный с дефицитом витаминов в употребляемой пище.
2. Вторичный, связанный с причинами эндогенного характера:
-нарушение всасывания витаминов в ЖКТ;
-недостаточный синтез витаминов микрофлорой кишечника (вит.В и вит.К), например,
-при дисбактериозе;
-поступление в пищу пищевых или лекарственных антивитаминов, которые препятствуют активации и всасыванию витаминов;
— нарушение активации при усвоении витаминов в организме при патологии печени и почек;
-относительная недостаточность из-за, беременности, кормлении грудью, требующие повышенного количества витаминов.
Источник
Синтез холестерола должен быть согласован с его выведением
Синтез холестерола в организме составляет примерно 0,5-0,8 г/сут, примерно 50% образуется в печени, около 15% в кишечнике. Все клетки организма способны синтезировать холестерол. Поступление с пищей составляет около 0,4 г/сут.
Единственным реальным способом выведения холестерола является желчь – до 1 г/сут.
Биосинтез холестерола
Биосинтез холестерола происходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА, поступающий сюда из митохондрий в составе цитрата, также как при синтезе жирных кислот. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН.
Образование холестерола идет более чем в 30 реакциях, которые можно сгруппировать в несколько этапов.
1. Синтез мевалоновой кислоты.
Первые две реакции синтеза совпадают с реакциями кетогенеза, но после синтеза 3-гидрокси-3-метилглутарил-SКоА вступает в действие фермент гидроксиметил-глутарил-SКоА-редуктаза (ГМГ-SКоА-редуктаза), образующая мевалоновую кислоту.
2. Синтез изопентенилдифосфата. На этом этапе при использовании АТФ мевалоновая кислота трижды фосфорилируется. Затем промежуточный продукт декарбоксилируется и дефосфорилируется с получением изопентенилдифосфата.
3. После объединения трех молекул изопентенилдифосфата (если не считать промежуточных превращений) синтезируется фарнезилдифосфат.
4. Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата.
5. После сложных реакций линейный сквален циклизуется в ланостерол.
6. Удаление лишних метильных групп, восстановление и изомеризация молекулы приводит к появлению холестерола.
Регуляция синтеза
Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза, активность которой может изменяться в 100 и более раз.
1. Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. Это помогает поддерживать внутриклеточное содержание холестерола постоянным.
2. Регуляция транскрипции гена ГМГ-SКоА-редуктазы (в печени) – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента.
3. Ковалентная модификация при гормональной регуляции:
- Инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние.
Важным следствием такой регуляции является активация кетогенеза при отсутствии инсулина.
- Глюкагон и адреналин посредством аденилатциклазного механизма активируют протеинкиназу А, которая фосфорилирует фермент и переводит его в неактивную форму.
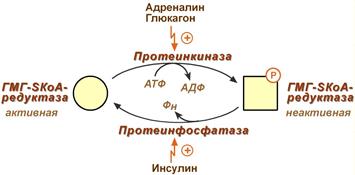
Регуляция активности гидроксиметилглутарил-S-КоА-редуктазы
Кроме указанных гормонов, на ГМГ-SКоА-редуктазу действуют эстрогены и тиреоидные гормоны (повышают активность) и глюкокортикоиды (снижают активность).
Изменение транскрипции гена ГМГ-КоА редуктазы (генетическая регуляция) осуществляется стерол-регулируемым элементом в ДНК (SREBP, sterol regulatory element-binding protein) с которым способны связываться белки — факторы SREBP. Эти факторы при достаточном количестве холестерина в клетке закреплены в мембране ЭПР. Когда уровень холестерина падает, факторы SREBP активируются под действием специфичных протеаз комплекса Гольджи, передвигаются в ядро, взаимодействуют на ДНК с участком SREBP и стимулируют биосинтез холестерина.
Скорость биосинтеза холестерола также зависит от концентрации специфического белка-переносчика, обеспечивающего связывание и транспорт гидрофобных промежуточных метаболитов синтеза.
Источник
холестериды, всасывание холестерина
Переваривание
холестеридов и всасывание холестерина.
Понятие об экзогенном и эндогенном
холестерине.
Холестерин
в организме человека бывает 2 видов:
1) холестерин,
поступающий с пищей через ЖКТ и называемый
экзогенный
2) холестерин,
синтезируемый из Ац – КоА — эндогенный.
С пищей
ежедневно поступает ≈ 0,2 – 0,5 г,
синтезируется ≈ 1 г (почти все клетки
за исключением эритроцитов синтезируют
холестерин, 80% холестерина синтезируется
в печени.)
Взаимоотношения
экзо и эндогенного холестерина в
определенной степени конкурентные –
холестерин пищи ингибирует его синтез
в печени.
В составе
пищи холестерин находится в основном
в виде эфиров. Гидролиз эфиров холестерола
происходит под действием холестеролэстеразы.
Продукты гидролиза всасываются в составе
смешанных мицелл.

Всасывание
холестерина происходит в основном в
тощей кишке (пищевой холестерин
всасывается почти полностью – если в
пище его не очень много)
Всасывание
холестерина осуществляется только
после эмульгирования эфиров холестерина.
Эмульгаторами являются желчные кислоты,
моно- и диглицериды и лизолецитины.
Холестериды гидролизуются холестеринэстеразой
поджелудочной железы.
Пищевой и
эндогенный холестерин находится в
просвете кишечника в неэстерифицированной
форме в составе сложных мицелл (желчные,
жирные кислоты, лизолецитин), причем
поступают в состав слизистой кишечника
не вся мицелла целиком, а ее отдельные
фракции.
Поглощение
холестерина из мицелл – пассивный
процесс, идущий по градиенту концентрации.
Поступивший в клетки слизистой холестерин
этерифицируется холестеринэстеразой
или АХАТ (у человека это в основном
олеиновая кислота). Из клеток слизистой
кишечника холестерин поступает в лимфу
в составе ХМ, из них он переходит в ЛНП
и ЛВП. В лимфе и крови 60-80% всего холестерина
находится в этерифицированном виде.
Процесс
всасывания холестерина из кишечника
зависит от состава пищи: жиры и углеводы
способствуют его всасыванию, растительные
стероиды (структурные аналоги) блокируют
этот процесс. Большое значение принадлежит
желчным кислотам (все функции активируют
– улучшают эмульгирование, всасывание).
Отсюда значение лекарственных веществ,
блокирующих всасывание желчных кислот.
Основные
этапы синтеза холестерина. Химизм
реакции образования мевалоновой кислоты.
Ключевой фермент синтеза холестерина.
Представьте схематически скваленовый
путь синтеза холестерина
Ключевой
фермент биосинтеза холестерина —
ГМГ-редуктаза
Локализация:печень,кишечник,кожа
Реакции
синтеза холестерола происходят в
цитозоле клеток. Это один из самых
длинных метаболических путей в организме
человека.
Источник-ацетил-КоА
1 этап-Образование
мевалоната
Две молекулы
ацетил-КоА конденсируются ферментом
тиолазой с образованием ацетоацетил-КоА.
Фермент
гидроксиметилглутарил-КоА-синтаза
присоединяет третий ацетильный остаток
с образованием ГМГ-КоА
(3-гидрокси-3-метилглутарил-КоА).
Следующая
реакция, катализируемая ГМГ-КоА-редуктазой,
является регуляторной в метаболическом
пути синтеза холестерола. В этой реакции
происходит восстановление ГМГ-КоА до
мевалоната с использованием 2 молекул
NADPH. Фермент ГМГ-КоА-редуктаза —
гликопротеин, пронизывающий мембрану
ЭР, активный центр которого выступает
в цитозоль.
2 этап —
Образование
сквалена
На втором
этапе синтеза мевалонат превращается
в пятиуглеродную изопреноидную структуру,
содержащую пирофосфат — изопентенилпирофосфат.
Продукт конденсации 2 изопреновых единиц
— геранилпирофосфат. Присоединение ещё
1 изопреновой единицы приводит к
образованию фарнезилпирофосфата —
соединения, состоящего из 15 углеродных
атомов. Две молекулы фарнезилпирофосфата
конденсируются с образованием сквалена
— углеводорода линейной структуры,
состоящего из 30 углеродных атомов.
3 этап —
Образование холестерола
На третьем
этапе синтеза холестерола сквален через
стадию образования эпоксида ферментом
циклазой превращается в молекулу
ланостерола, содержащую 4 конденсированных
цикла и 30 атомов углерода. Далее происходит
20 последовательных реакций, превращающих
ланостерол в холестерол. На последних
этапах синтеза от ланостерола отделяется
3 атома углерода, поэтому холестерол
содержит 27 углеродных атомов.

Биологическая роль холестерина. Пути
использования холестерина в различных
тканях. Биосинтез желчных кислот.
Часть
холестеринового фонда в организме
постоянно окисляется, преобразуясь в
различного рода стероидные соединения.
Основной путь окисления холестерина —
образование желчных кислот. На эти цели
уходит от 60 до 80% ежедневно образующегося
в организме холестерина. Второй путь —
образование стероидных гормонов (половые
гормоны, гормоны коры надпочечников и
др.). На эти цели уходит всего 2-4%
холестерина, образующегося в организме.
Третий путь — образование в коже витамина
ДЗ под действием ультрафиолетовых
лучей.
Еще одним
производным холестерина является
холестанол. Его роль в организме пока
еще не выяснена. Известно лишь, что он
активно накапливается в надпочечниках
и составляет 16% от всех находящихся там
стероидов. С мочой у человека выделяется
около 1 мг холестерина в сутки, а со
слущивающимся эпителием кожи теряется
до 100 мг/сут.
Желчные
кислоты являются основным компонентом
билиарной секреции, они образуются
только в печени. Синтезируются в печени
из холестерина.
В
организме синтезируется за сутки
200-600 мг желчных кислот. Первая реакция
синтеза-образование
7-альфа-гидроксихолестерола-является
регуляторной.Фермент-7-альфа-гидроксилаза,ингибируется
конечным продуктом-желчными
кислотами.7-альфа-гидроксилаза представляет
собой одну из форм цитохрома п450 и
использует атом кислорода как один из
субстратов. Один атом кислорода из О2
включается в гидроксильную группу в 7
положении, а другой восстанавливается
до воды. Последующие реакции синтеза
приводят к формированию 2 видов желчных
кислот:холевой и хондезоксихолевой(первичные
желчные кислоты)

Особенности
обмена холестерина в организме человека.
Роль липопротеинлипазы, печеночной
липазы, липопротеинов, ЛХАТ, апопротеинов
в транспорте холестерина в крови: альфа-
и бета-холестерин, коэффициент
атерогенности, АХАТ, накопление
холестерина в тканях. Пути распада и
выведения холестерина
В организме
человека содержится 140-190 г холестерина
и около 2 г образуется ежедневно из
жиров,углеводов, белков. Чрезмерное
поступление холестерина с пищей приводит
к отложению его в сосудах и может
способствовать развитию атеросклероза,
а также нарушению функции печени и
развитию желчно-каменной болезни.
Ненасыщенные жирные кислоты ( линолевая,
линоленовая) затрудняют всасывание
холестерина в кишечнике, тем самым
способствуя уменьшению его содержания
в организме. Насыщенные жирные кислоты
(пальмитиновая, стеариновая) являются
источником образования холестерина.
Липопротеинлипаза
(ЛПЛ) — фермент, относящийся к классу
липаз. ЛПЛ расщепляет триглицериды
самых крупных по размеру и богатых
липидами липопротеинов плазмы крови —
хиломикронов и липопротеинов очень
низкой плотности (ЛПОНП или ЛОНП)). ЛПЛ
регулирует уровень липидов в крови, что
определяет её важное значение в
атеросклерозе.
Печёночная
липаза — один из ферментов липидного
метаболизма. Эта липаза по ферментативному
действию похожа на панкреатическую
липазу. Однако в отличие от панкреатической
липазы ПЛ синтезируется в печени и
секретируется в кровь. Печёночная липаза
после секреции связывается со стенкой
сосуда (почти исключительно в печени)
и расщепляет липиды липопротеинов.
Печёночная
липаза работает в кровотоке в тандеме
с липопротеинлипазой. Липопротеинлипаза
расщепляет липопротеины, богатые
триглицеридами (липопротеины очень
низкой плотности и хиломикроны), до их
остатков. Остатки липопротеинов являются
в свою очередь субстратом для печёночной
липазы. Таким образом, в результате
действия печёночной липазы образуются
атерогенные липопротеины низкой
плотности, которые поглощаются печенью.
(ЛВП) — Транспорт
холестерина от периферийных тканей к
печени
(ЛНП) —
Транспорт холестерина, триацилглицеридов
и фосфолипидов от печени к периферийным
тканям
ЛПП (ЛСП) —
Транспорт холестерина, триацилглицеридов
и фосфолипидов от печени к периферийным
тканям
(ЛОНП)-Транспорт
холестерина, триацилглицеридов и
фосфолипидов от печени к периферийным
тканям
Хиломикроны -Транспорт
холестерина и жирных кислот, поступающих
с пищей, из кишечника в периферические
ткани и печень
Лецитинхолестеринацилтрансфераза
(ЛХАТ)- является ферментом метаболизма
липопротеинов. ЛХАТ связан с поверхностью
липопротеинов высокой плотности, которые
содержат аполипопротеин A1 — активатор
этого фермента. Холестерин, превращённый
в эфиры холестерина, благодаря высокой
гидрофобности перемещается с поверхности
липопротеина в ядро, освобождая место
на поверхности частицы для захвата
нового свободного холестерина. Таким
образом, эта реакция является исключительно
важной для процесса очищения периферических
тканей от холестерина (обратный транспорт
холестерина). Частица ЛПВП в результате
увеличивается в диаметре или в случае
насцентных ЛПВП превращается из
дисковидной в сферическую.
Апопротеины
формируют структуру липоппротеинов,взаимодействуют
с рецепторами на поверхности клеток и
таким образом определяют какими тканями
будет захватываться данный тип
липопротеидов, служат ферментами или
активаторами ферментов, действующих
на липопротеины.
АХАТ
катализирует эстерификацию холестерола
. Свободный холестерол выходит в
цитоплазму , где ингибирует ГМГ-CoA-редуктазу
и de novo синтез холестерола и активирует
АХАТ . У человека, однако, из-за низкой
активности АХАТ в печени холестерол
поступает в плазму в составе ЛПОНП
преимущественно в свободном виде.
Нарушение
обмена холестерола и холестеридов
проявляется прежде всего накоплением
их в тканях (кумулятивные холестерозы),
особенно в стенке артерий и в коже.
Основной причиной накопления холестерола
в тканях является недостаточность
механизма его обратного транспорта.
Ключевым фактором системы обратного
транспорта холестерола (с периферии в
печень, откуда его излишки удаляются
из организма с желчью) являются
липопротеины высокой плотности, точнее
входящий в их состав белок апопротеин
А. Частицы липопротеинов высокой
плотности собирают холестерол не только
в интерстициальном секторе, но и внутри
клеток. У человека (а также высших обезьян
и свиней) существует видовая (характерная
для всех представителей вида)
недостаточность апопротеина А и,
соответственно, липопротеинов высокой
плотности. Животные с высоким содержанием
этих липопротеинов не страдают
холестериновым диатезом, даже при
постоянном употреблении богатой
холестеролом пищи. Некоторые люди также
отличаются довольно высокой концентрацией
апопротеина А («синдром долголетия»).
Из организма
человека ежедневно выводится около 1 г
холестерола. Приблизительно половина
этого количества экскретируется с
фекалиями после превращения в желчные
кислоты . Оставшаяся часть выводится в
виде нейтральных стероидов. Большая
часть холестерола, поступившего в желчь,
реабсорбируется; считается, что по
крайней мере часть холестерола,
являющегося предшественником фекальных
стеролов , поступает из слизистой
оболочки кишечника . Основным фекальным
стеролом является копростанол , который
образуется из холестерола в нижнем
отделе кишечник а под действием
присутствующей в нем микрофлоры .
Значительная доля солей желчных кислот
, поступающих с желчью, всасывается в
кишечнике и через воротную вену
возвращается в печень , где снова
поступает в желчь. Этот путь транспорта
солей желчных кислот получил название
кишечно-печеночной циркуляции . Оставшаяся
часть солей желчных кислот, а также их
производные выводятся с фекалиями. Под
действием кишечных бактерий первичные
желчные кислоты превращаются во
вторичные.
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник