Инфаркт миокарда и гемоглобин
Содержание статьи
Острый инфаркт миокарда
Инфаркт миокарда — это заболевание, сопровождающееся некрозом одного или нескольких участков сердечной мышцы в результате острого нарушения кровотока в коронарных артериях, питающих миокард. Острый инфаркт миокарда без подъема сегмента ST и инфаркт миокарда с подъемом сегмента ST являются разновидностями острого коронарного синдрома, который включает также нестабильную стенокардию.
Инфаркт миокарда — ведущая причина смертности в большинстве стран, в том числе в России. Своевременная госпитализация во многих случаях позволяет предотвратить необратимые повреждения сердечной мышцы, однако часто пациенты неправильно оценивают возникающие симптомы и пытаются справиться с ними самостоятельно, что приводит к позднему обращению к врачу. Поэтому при острой боли в груди или других тревожных симптомах необходимо как можно раньше проконсультироваться со специалистом.
Риск инфаркта миокарда повышается с возрастом — чаще заболевают люди старше 60 лет. Однако в последнее время увеличилось количество ранних инфарктов миокарда — у людей моложе 40 лет. Среди пациентов младше 70 лет преобладают мужчины, однако после 70 количество мужчин и женщин с инфарктом миокарда становится одинаковым. Это может быть связано с защищающим действием эстрогенов (женских половых гормонов), которые снижают вероятность атеросклероза — главного фактора риска развития сердечного приступа.
Прогноз инфаркта миокарда зависит от обширности поражения сердечной мышцы, наличия сопутствующих заболеваний, времени обращения за медицинской помощью и возраста пациента. Смертность при остром инфаркте миокарда достигает 30 %.
Синонимы русские
Сердечный приступ, ИМ.
Синонимы английские
Heart attack, acute myocardial infarction, MI, myocardial infarction.
Симптомы
Основным симптомом острого инфаркта миокарда является резкая боль в груди, которая чаще всего ощущается как резкое сдавливание. Она продолжается обычно дольше 15 минут и не купируется приемом нитроглицерина. Боль может распространяться на левое плечо, лопатку, шею, нижнюю челюсть, может сопровождаться холодным потом, тошнотой и рвотой, потерей сознания. В некоторых случаях боль имеет нетипичную локализацию — в животе, в позвоночнике, левой или даже правой руке.
Иногда инфаркту предшествуют неспецифические симптомы: в течение нескольких дней до сердечного приступа человек может ощущать слабость, недомогание, дискомфорт в области груди.
Инфаркт может не сопровождаться характерным болевым синдромом и проявляться лишь такими признаками, как одышка, учащенное сердцебиение, слабость, тошнота. Неявная симптоматика инфаркта миокарда особенно характерна для женщин.
Таким образом, основными симптомами острого инфаркта миокарда являются:
- боль в груди,
- одышка,
- холодный пот,
- чувство страха,
- потеря сознания,
- тошнота, рвота.
Общая информация о заболевании
Инфаркт миокарда развивается в результате нарушения кровоснабжения сердечной мышцы, что приводит к недостатку кислорода и питательных веществ и некрозу (омертвению) участка миокарда. Основной причиной нарушения кровотока в сосудах, питающих миокард, является атеросклероз коронарных артерий — отложение атеросклеротических бляшек, состоящих в основном из холестерина, на внутренней поверхности сосудов. Затем происходит разрастание соединительной ткани (склероз) стенки сосуда и формирование отложений кальция (кальциноз) с дальнейшей деформацией и сужением просвета сосуда вплоть до полной закупорки. Впоследствии в атеросклеротической бляшке может развиваться так называемое асептическое воспаление, которое при воздействии провоцирующих факторов (физической нагрузке, повышении артериального давления и др.) способно приводить к надрыву бляшки. В области повреждения скапливаются тромбоциты, выделяются биологически активные вещества, которые еще больше усиливают адгезию (слипание) форменных элементов крови, и в итоге образуется тромб, закупоривающий просвет коронарной артерии. Возникновению тромба также способствует повышенная свертываемость крови. В случае, если кровоток в сосудах не восстанавливается в ближайшие шесть часов, происходят необратимые изменения в тканях миокарда.
Редко инфаркт миокарда случается при резком спазме или тромбоэмболии патологически неизмененных коронарных артерий, однако это наблюдается лишь в 5 % случаев.
Чаще всего инфаркт миокарда локализуется в передней стенке левого желудочка, реже — в задней стенке левого желудочка и межжелудочковой перегородки. Инфаркт в области правого желудочка возникает редко. Выделяют трансмуральный и субэндокардиальный инфаркт миокарда. При трансмуральном патологические изменения затрагивают всю стенку сердца, при субэндокардиальном — от ? до ½ толщины стенки. Существует также деление на инфаркт миокарда без подъема сегмента ST и инфаркт миокарда с подъемом сегмента ST. Наличие изменений сегмента S-T на электрокардиограмме позволяет заподозрить полную закупорку коронарной артерии и обширное повреждение миокарда с более высоким риском развития необратимого некроза тканей. Подъем сегмента S-T не наблюдается при частичной закупорке артерии — это может говорить об инфаркте миокарда без подъема сегмента S-T или нестабильной стенокардии. Однако лишь при инфаркте миокарда изменяется активность кардиальных энзимов.
При нарушении кровоснабжения миокарда гибель клеток начинается, прежде всего, в области эндокарда, а затем зона повреждения распространяется по направлению к перикарду. Обширность поражения зависит от степени закупорки артерии, ее длительности, системы коллатерального кровообращения.
Некроз в тканях сердечной мышцы вызывает острую боль. Обширное повреждение миокарда может приводить к нарушению сократительной функции сердца, что проявляется острой левожелудочковой недостаточностью с развитием отека легких и кардиогенного шока. Кардиогенный шок, в свою очередь, усугубляет течение инфаркта миокарда за счет ухудшения коронарного кровообращения. В результате возникают тяжелые нарушения ритма сердца, в том числе фибрилляция предсердий.
Трансмуральный инфаркт в некоторых случаях может приводить к разрыву стенки сердца или к аневризме — локальному истончению и выпячиванию участка миокарда.
Кто в группе риска?
Основной причиной развития инфаркта миокарда (до 90 % всех случаев) является атеросклероз. Поэтому факторы риска развития атеросклероза увеличивают и вероятность развития сердечного приступа. В группу риска входят:
- мужчины старше 45 лет и женщины старше 65 лет,
- страдающие ожирением, дислипидемией, артериальной гипертензией, сахарным диабетом,
- люди, родственники которых страдают сердечно-сосудистыми заболеваниями и/или перенесли инфаркт миокарда,
- курильщики,
- ведущие малоподвижный образ жизни,
- употребляющие наркотики (кокаин, амфетамины могут спровоцировать спазм коронарных артерий),
- испытывающие сильный стресс.
Диагностика
Острый инфаркт миокарда во многих случаях протекает малосимптомно или атипично, что затрудняет его диагностику. Существует ряд заболеваний, проявления которых зачастую могут быть схожи с проявлениями сердечного приступа: аневризма аорты, стенокардия, заболевания печени и желчевыводящих путей, депрессия, эзофагит и другие. Поэтому при подозрении на инфаркт миокарда необходимо провести ряд лабораторных и инструментальных исследований, позволяющих отличить инфаркт миокарда от другой патологии и выявить обширность и локализацию повреждения, продолжительность ишемии, постинфарктные осложнения. Кроме того, важно распознать признаки сопутствующих заболеваний: патологии почек и дыхательной системы, сахарного диабета, анемии. Все это определяет дальнейшую схему лечения и прогноз заболевания.
Лабораторная диагностика
- Общий анализ крови. При остром инфаркте миокарда может наблюдаться лейкоцитоз. Количество лейкоцитов увеличивается со второго часа после возникновения нарушений кровообращения и достигает пика на 2-4-е сутки. Важно обратить внимание и на количество эритроцитов, так как анемия усугубляет кислородное голодание сердечной мышцы.
- Лейкоцитарная формула. Возможен лейкоцитоз со сдвигом лейкоцитарной формулы влево и анэозинофилией.
- Скорость оседания эритроцитов (СОЭ). Повышение СОЭ свидетельствует об остром воспалительном процессе.
- Тропонин I (количественно) — белок, который участвует в мышечном сокращении. При сердечном приступе его уровень обычно повышается начиная с 4-6-го часа, максимум на 2-е сутки и нормализуется в течение 6-8 дней от начала заболевания.
- Миоглобин. Это белок, который содержится в мышечной ткани, в том числе в миокарде. При инфаркте миокарда уровень миоглобина увеличивается в течение 4-6 часов.
- Аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ). При инфаркте миокарда уровень этих ферментов является показателем обширности повреждения сердечной мышцы.
- Креатинкиназа MB. Увеличение ее концентрации специфично для повреждения сердечной мышцы. Ее уровень возрастает с первых часов и сохраняется повышенным в течение 2-3 суток.
- Лактатдегидрогеназа (ЛДГ) общая — фермент, который содержится практически во всех клетках организма и участвует в утилизации глюкозы. Уровень ЛДГ повышается при инфаркте миокарда, патологии печени, крови, почек. При инфаркте миокарда остается повышенным в течение 10-14 дней.
- Лактатдегидрогеназа 1, 2 (ЛДГ, 1, 2 фракции). Формы фермента лактатдегидрогеназы, которые содержатся в основном в клетках сердца, коркового вещества почек, печени. Эти показатели могут быть использованы для оценки обширности поражения при инфаркте миокарда.
- Антитромбин III. Синтезируется в клетках эндотелия сосудов и клетках печени, участвует в инактивации ряда факторов свертывания крови. Уменьшение количества антитромбина III говорит о повышенном риске тромбоза. Понижен его уровень при тромбоэмболии, атеросклерозе.
- Волчаночный антикоагулянт, скрининговый тест (LA1). Волчаночный антикоагулянт представляет собой комплекс антител против фосфолипидов. Их наличие может свидетельствовать об аутоиммунных заболеваниях, а также является признаком повышенного риска тромбообразования.
- Протромбиновый индекс (ПИ), международное нормализованное отношение — МНО). Анализ используется для оценки внешнего пути свертывания крови и активности I, II, V, VII, X факторов свертывания. Гиперкоагуляция увеличивает риск образования тромбов. При инфаркте миокарда протромбиновый индекс может быть повышен.
- Гликированный гемоглобин (HbA 1c, гликозилированный гемоглобин, гликогемоглобин). Образуется при присоединении глюкозы к гемоглобину. Данный показатель позволяет оценить количество глюкозы в крови на протяжении последних 120 дней — это средняя продолжительность жизни эритроцита. Высокий уровень гликированного гемоглобина говорит о высокой концентрации глюкозы за последние три месяца и свидетельствует о большой вероятности осложнений сахарного диабета, который, в свою очередь, увеличивает риск инфаркта миокарда. Тест на гликированный гемоглобин используется для оценки эффективности лечения и прогноза инфаркта миокарда у пациентов с сахарным диабетом.
- Глюкоза в плазме. Также используется для диагностики сахарного диабета.
- Железо в сыворотке. Железо входит в состав цитохромов и участвует в клеточном дыхании. При инфаркте миокарда уровень железа может быть повышен.
- Электролиты сыворотки. При остром инфаркте миокарда может меняться уровень натрия, калия, магния, кальция, хлора. Однако это происходит не всегда, при неосложненном течении инфаркта миокарда уровень электролитов может быть не изменен.
- Мочевая кислота в сыворотке. При нарушении кровоснабжения миокарда происходит некроз клеток сердечной мышцы с распадом органических веществ и выделением продуктов распада, в том числе мочевой кислоты. Это, в свою очередь, провоцирует развитие воспаления в зоне повреждения миокарда. Таким образом, уровень мочевой кислоты при обширном инфаркте миокарда может быть повышен.
- С-реактивный белок, количественно. При инфаркте миокарда бывает повышен за счет воспалительной реакции.
- Триглицериды. Образуются в кишечнике из жиров пищи. Депонируются в жировой ткани и расходуются клетками по мере необходимости для получения энергии. Повышенный уровень триглицеридов может свидетельствовать о высоком риске атеросклероза.
- Холестерол общий. Это соединения, которые участвуют в формировании атеросклеротических бляшек. Его концентрация может быть увеличена при инфаркте миокарда, возникшем в результате атеросклероза коронарных артерий.
- Холестерол — липопротеины высокой плотности (ЛПВП) — фракция общего холестерина, которая препятствует формированию атеросклеротических бляшек.
- Холестерол — липопротеины низкой плотности (ЛПНП) — фракция холестерола, участвующая в формировании атеросклеротических бляшек.
- Холестерол — липопротеины очень низкой плотности (ЛПОНП). Это липопротеины, которые образуются в печени. Являются переносчиками фосфолипидов, триглицеридов, холестерола. При попадании из печени в кровь подвергаются химическим превращениям с образованием липопротеинов низкой плотности
- Коэффициент атерогенности. Это соотношение «вредных» (ЛПНП, ЛПОНП, триглицеридов) и «полезных» липопротеинов (ЛПВП). Повышение коэффициента атерогенности говорит о высоком риске развития атеросклероза.
Другие методы исследования
- Электрокадиография (ЭКГ). Позволяет подтвердить диагноз «инфаркт миокарда», определить локализацию и степень повреждения сердечной мышцы, выявить признаки нарушения сердечного ритма.
- Рентгенография органов грудной клетки. Используется для выявления аневризмы сердца.
- Ультразвуковое исследование сердца. Позволяет выявить участок поражения миокарда, оценить сократительную способность сердца.
Лечение
Терапия назначается индивидуально в зависимости от возраста пациента, тяжести состояния и обширности поражения сердечной мышцы. Огромное значение имеет восстановление кровоснабжения миокарда в течение первых 12 часов после появления первых признаков инфаркта миокарда. Это может предотвратить или уменьшить степень некроза тканей. Основными направлениями терапии при остром инфаркте миокарда являются купирование болевого синдрома, тромболитическая и антикоагулянтная терапия, снижение нагрузки на миокард, предупреждение и лечение возникших осложнений.
Профилактика
Здоровое питание с низким содержанием насыщенных жиров и большим количеством овощей и фруктов.
Достаточная физическая активность.
Отказ от алкоголя и курения.
Своевременное прохождение профилактических медицинских осмотров для выявления заболеваний, повышающих риск развития инфаркта миокарда.
Рекомендуемые анализы
- Общий анализ крови
- Лейкоцитарная формула
- Скорость оседания эритроцитов (СОЭ)
- Тропонин I (количественно)
- Миоглобин
- Аланинаминотрансфераза (АЛТ)
- Аспартатаминотрансфераза (АСТ)
- Антитромбин III
- Волчаночный антикоагулянт, скрининговый тест (LA1)
- Коагулограмма № 1 (протромбин (по Квику), МНО)
- Гликированный гемоглобин (HbA 1c)
- Глюкоза в плазме
- Железо в сыворотке
- Калий, натрий, хлор в сыворотке
- Креатинкиназа MB
- Лактатдегидрогеназа (ЛДГ) общая
- Мочевая кислота в сыворотке
- С-реактивный белок, количественно
- Триглицериды
- Холестерол общий
- Холестерол — липопротеины высокой плотности (ЛПВП)
- Холестерол — липопротеины низкой плотности (ЛПНП)
- Холестерол — липопротеины очень низкой плотности (ЛПОНП)
- Коэффициент атерогенности
- Лабораторная диагностика острого коронарного синдрома и инфаркта миокарда (оптимальный)
- Лабораторная диагностика острого коронарного синдрома и инфаркта миокарда (минимальный)
- Лабораторное обследование сердца и сосудов
Источник
Ишемическая болезнь сердца и анемия
Ишемическая болезнь сердца (ИБС) — патология, в основе которой лежит поражение миокарда, обусловленное недостаточным его кровоснабжением. Атеросклеротическое сужение коронарных артерий является патогенетической основой ИБС, но для развития ишемии миокарда требуется еще дополнительный фактор, ведущий к нарушению баланса пропускной способности коронарных артерий и потребности миокарда в кислороде.
Чаще всего это увеличение работы ЛЖ (тахикардия, повышение систолического АД) или недостаточность коронарного кровотока (тромбообразование в венечных артериях, спазм). Реже как факторы, способствующие развитию или прогрессированию ИБС, рассматриваются снижение перфузионного давления (ДАД) или нарушение кислород-транспортной функции крови и т. д.
Для наглядности приводим выписки из историй болезни пациентов, у которых эти факторы играли роль «запускающего механизма». Мнение о том, что штаны принято носить только мужчинам, а женщины должны быть утонченные и элегантные, отдавая предпочтение юбкам и платьям, в нынешнее время абсолютно не актуально.
Клинический случай 1
Больной Ш., 84 года, был госпитализирован в мае 2013 г. с жалобами на давящие боли за грудиной при небольшой физической нагрузке и в покое.
Более 30 лет регистрируются высокие цифры АД (до 200/120 мм рт. ст.), сахарный диабет 2-го типа.
4 мес. назад перенес острый инфаркт миокарда без зубца Q боковой стенки левого желудочка. При коронарографии: передняя межжелудочковая ветвь (ПМЖВ) левой коронарной артерии (ЛКА) стенозирована в проксимальной трети на 50%, в дистальной трети — последовательные стенозы 30-50%; огибающая артерия (ОА) стенозирована в средней трети на 70%, правая коронарная артерия (ПКА) субокклюзирована в передней трети, окклюзирована в средней трети, дистальная часть слабо контрастируется по меж- и интраартериальным анастомозам. Выполнено стентирование средней трети ОА. Реканализацию ПКА выполнить не удалось.
Обращено внимание на наличие гипохромной анемии легкой степени (гемоглобин -106 г/л). Проведенное обследование возможного источника кровотечения не выявило. Выписан в удовлетворительном состоянии с рекомендацией приема ацетилсалициловой кислоты и клопидогрела, сахароснижающей терапии, препаратов железа.
Дома рекомендованные препараты принимал нерегулярно, врача не посещал.
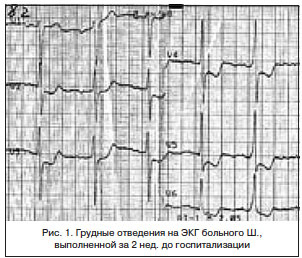
Около 2 мес. назад отметил нарастание слабости. Стали беспокоить редкие приступы загрудинных болей. На ЭКГ от 10.05.13 г.: на фоне синусового ритма с ЧСС 75 уд./мин — выраженная депрессия сегмента ST в отведениях V2-6 (рис. 1). От предложенной госпитализации отказался.
Последние 2 нед. участились приступы загрудинных болей давящего характера, они стали возникать при минимальной физической нагрузке и в покое, сублингвальный прием нитроглицерина оказывал кратковременное действие, появилось чувство нехватки воздуха. Обратился в поликлинику, откуда был доставлен в ЦКБ с диагнозом «ИБС, прогрессирующая стенокардия».
При поступлении: кожные покровы бледные. Отеков нет. ЧД — 18 в 1 мин. Дыхание жесткое. Пульс — 72, АД — 140/70 мм рт. ст. на обеих руках. Систолический шум в точке Боткина и на верхушке, проводящийся в левую подмышечную область.
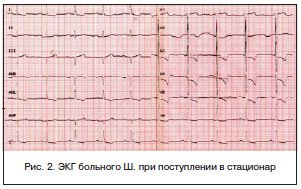
ЭКГ при поступлении (рис. 2): синусовый ритм с ЧСС 59 уд./мин, замедление атриовентрикулярной проводимости (PQ — 0,24 с). Замедление проводимости по левому предсердию и желудочку. Гипертрофия левого желудочка. Нарушение реполяризации в V2-5.
ЭхоКГ: гипертрофия миокарда ЛЖ (ММЛЖ — 240 г). Утолщение межжелудочковой перегородки (МЖП), более выраженное в базальной части (1,6-1,8 см), без признаков обструкции выходного отдела ЛЖ. Толщина ЗСЛЖ — 1,5 см. Сократительная способность миокарда ЛЖ удовлетворительная (ФВ по Тейхольцу — 63%), КСР — 3,6 см, КДР — 5,5 см, ЛП — 5,1 см. Зон нарушенной кинетики не выявлено. Изменение диастолической функции ЛЖ по первому типу.
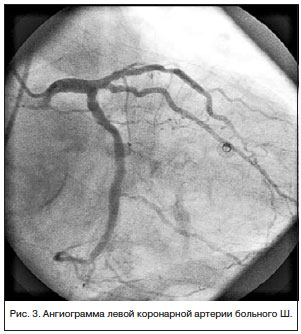
В экстренном порядке выполнена коронароангиография (КАГ) (рис. 3): ствол ЛКА не изменен. ПМЖВ стенозирована на границе передней и средней третей на 50%, на протяжении дистальной трети — последовательные стенозы 30-60%. 1ДВ — анатомически некрупная, стенозирована в устье на 80%, окклюзирована в средней трети, дистальная часть слабо контрастируется по интерартериальным коллатералям. ВТК стенозирована в устье до 50%. ОВ анатомически крупная, проходима на всем протяжении, ранее имплантированные стенты — без стенотических изменений. ПКА субокклюзирована в передней трети, окклюзирована в средней трети, дистальная часть слабо контрастируется по меж- и интраартериальным анастомозам. Сбалансированный тип коронарного кровоснабжения.
Учитывая отсутствие динамики стенозов-КА по сравнению с КАГ от января 2013 г., чрескожное коронарное вмешательство не проводилось.
В анализе крови: гемоглобин — 61 г/л, эритроциты — 2,30×10*12, ЦП — 0,8, гематокрит — 18,5, лейкоциты — 7,7×10*9.
Кардиоспецифические ферменты (КФК МВ, тропонин Т) находились в пределах референсных значений.
В анализе мочи: удельный вес — 1020, белок — 0,15, лейкоциты — 0-5 в поле зрения, эритроциты — 100-150 в поле зрения.
Дополнительный целенаправленный расспрос позволил выяснить, что на протяжении последних 4 мес. неоднократно были эпизоды выделения темно-красной мочи, иногда длившиеся по несколько дней (макрогематурия?).
Убедительных данных, говорящих об остром очаговом поражении миокарда, на момент госпитализации не получено. Учитывая наличие анемии тяжелой степени, произведена трансфузия отмытых эритроцитов (1150 мл за 2 сут) с положительным эффектом: уровень гемоглобина повысился до 100 г/л, число эритроцитов — до 3,59×10*12, гематокрит — до 29,4.
На ЭКГ через 1 сут после последней гемотранфузии отмечается нормализация конечной части желудочковых комплексов в грудных отведениях (в V4 — зубец Т слабоотрицательный).
Самочувствие пациента значительно улучшилось: в течение последующих 3 сут при расширении двигательного режима до уровня физических нагрузок, соответствующих 3 функциональному классу, боли в грудной клетке не возникали, выраженность одышки существенно уменьшилась, объем нагрузок ограничивался главным образом мышечной утомляемостью. Эпизоды макрогематурии не повторялись. В удовлетворительном состоянии больной переведен для дообследования в урологическое отделение.
Клинический случай 2
Больной К., 50 лет, госпитализирован в стационар в декабре 2014 г. с клиникой прогрессирования стенокардии напряжения, одышки, возникающих при минимальной физической нагрузке, в покое, с нарастанием общей слабости в течение последнего месяца.
В анамнезе: АГ с максимально известными значениями АД 200/100 мм рт. ст. давностью более 15 лет; регулярно принимает антигипертензивные препараты, однако контроль АД нерегулярный. В 2002 г. перенес ОИМ, в этом же году выполнено аортокоронарное шунтирование (АКШ) ПМЖА, ПКА, ОА. В 2009 г. развилась клиника прогрессирующей стенокардии, в связи с чем выполнено стентирование шунта к ОВ ЛКА. В мае 2014 г. — повторный ОИМ задней стенки левого желудочка, проводился системный тромболизис, чрескожное коронарное вмешательство с реканализацией и стентированием АКШ к ОА. После выписки и до настоящей госпитализации — состояние стабильное.
Сопутствующие заболевания: сахарный диабет 2-го типа, мочекаменная болезнь, хронический геморрой, железодефицитная анемия легкой степени регистрируется с 2009 г. (препараты железа не принимал).
При поступлении: кожные покровы бледные, сухие. ЧД — 18 уд./мин. Дыхание жесткое, небольшое количество свистящих хрипов на выдохе. Тоны сердца глухие. ЧСС -76 уд./мин. АД — 150/90 мм рт. ст. на обеих руках.
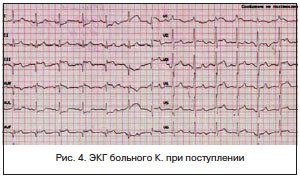
ЭКГ зарегистрирована на фоне болевого приступа (рис. 4): ритм синусовый, ЧСС — 88 уд./мин, смещение сегмента ST вверх от изолинии в отведениях III, aVF, V1. В отведениях I и aVL смещение сегмента ST книзу от изолинии. Зубец Q длительностью 0,04 с во II, III, aVF отведениях.
ЭхоКГ: гипертрофия миокарда ЛЖ (ММЛЖ — 213 г, МЖП — 1,5 см, ЗСЛЖ — 1,2 см). Дилатация левого предсердия (5,3×6,1 см). Нарушение диастолической функции левого желудочка по первому типу. Гипокинез диафрагмального, заднебазального и заднебоковых сегментов. ФВ — 54% по Тейхольцу.
В общем анализе крови: гемоглобин — 70 г/л, эритроциты — 4,29×10*12, гематокрит -23,5, ЦП — 0,48, гипохромия, анизоцитоз, пойкилоцитоз (овалоциты, мишеневидные эритроциты), лейкоциты — 5,9×10*9. Сывороточное железо — 1,9.
Кардиоспецифические ферменты (КФК МВ, тропонин Т) находились в пределах референсных значений.
Таким образом, убедительных данных, свидетельствующих об остром очаговом поражении миокарда, на момент госпитализации не получено. Высказано предположение, что причиной прогрессирования стенокардии являлась тяжелая железодефицитная анемия, вероятнее всего, постгеморрагическая. Проведена трансфузия эритроцитной взвеси 630 мл за первые сутки, начато парентеральное введение препаратов железа.
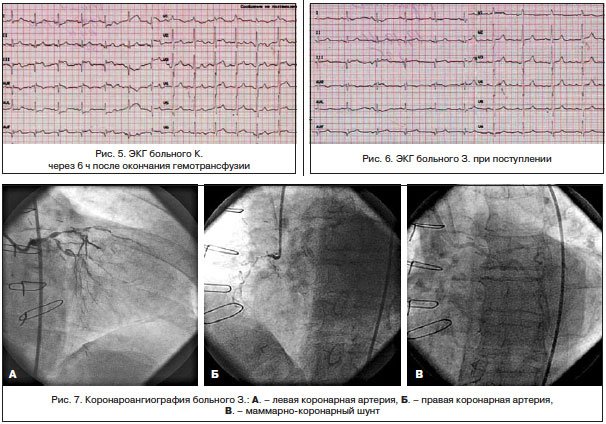
Трансфузионную терапию перенес хорошо. Ангинозные боли не рецидивировали. На ЭКГ, зарегистрированной после гемотрансфузии (рис. 5): ЧСС — 62 уд./мин. Сегмент ST вернулся к изолинии.
В анализе крови спустя 1 сут: уровень гемоглобина возрос до 105 г/л, число эритроцитов — до 5,71×10*12, гематокрит — 38,3, ЦП — 0,55, гипохромия, анизоцитоз сохраняются. Лейкоциты — 8×10*9.
В течение 3 сут пациент находился в ОРИТ, антиангинальной терапии не требовалось, т. к. приступы стенокардии не рецидивировали.
Проводился поиск возможного источника кровопотери, онкопоиск: при колоноскопии выявлен хронический комбинированный геморрой 3 ст. Другой патологии, которая могла бы объяснить наличие анемии, не найдено.
Проводилось постепенное расширение двигательного режима. Физические нагрузки, соответствующие уровню 3 функционального класса, приступов стенокардии и ЭКГ-признаков ишемии миокарда не вызывают.
Через 12 дней в стабильном состоянии пациент выписан для дальнейшего лечения в амбулаторных условиях. Хирургом рекомендовано выполнение в плановом порядке дезартеризации геморроидальных узлов под ультразвуковым контролем.
Клинический случай 3
Больной З., 82 года, госпитализирован в стационар с жалобами на дискомфорт за грудиной, нехватку воздуха, возникающие без четкой связи с физической нагрузкой, длительностью до 4-5 мин, накануне был затяжной приступ длительностью более 1 ч, выраженную слабость, потливость. Настоящее ухудшение состояния отмечает в течение последних 3 дней на фоне появившейся гипотонии.
В течение 2 нед. до госпитализации принимал по поводу дорсалгии нестероидные противовоспалительные препараты (НПВП) (кеторолак). 4 дня назад отметил появление учащенного жидкого стула темной окраски, необычно низкое АД — 80/40 мм рт. ст.
В 1995 г. перенес ОИМ нижней стенки ЛЖ. В этом же году выполнено маммарно-коронарное шунтирование ПМЖА, АКШ ЗБВ ОА и ПКА. В 2003 г. — линейное аортобедренное шунтирование синтетическим протезом слева. Ранний послеоперационный период осложнился развитием повторного ОИМ нижней стенки ЛЖ.
С 2009 г. — пароксизмы мерцательной тахиаритмии.
Постоянно принимает бисопролол — 2,5 мг/сут, периндоприл — 5 мг/сут, аторвастатин — 20 мг/сут, варфарин — 5 мг/сут. Контроль МНО не проводился более года.
При поступлении: кожные покровы и видимые слизистые бледные. Число дыханий — 20 в 1 мин. Дыхание ослабленное, жесткое. Тоны сердца глухие, ритмичные. ЧСС — 76 уд./мин. АД — 110/70 мм рт. ст.
Лабораторные данные: гемоглобин — 91 г/л, эритроциты — 3,93×10*12, гематокрит — 33,0, ЦП — 0,84, лейкоциты — 10,2-10,6×10*9, тромбоциты — 223×10*9, анизоцитоз, анизохромия.
Кардиоспецифические ферменты: КФК — 268 при поступлении, через 10 ч — 319, КФК МВ — 30 при поступлении, через 10 ч — 42, тропонин Т при поступлении — 177, через 10 ч — 538.
Сывороточное железо — 13 мкмоль, белки транспорта железа в границах нормы. Коагулограмма: АЧТВ — нет коагуляции, МНО — нет коагуляции, фибриноген — 3,3 г/л, Д-димер — 1147.
ЭКГ (рис. 6) при поступлении: синусовый ритм, АВ-блокада I ст., рубцовые изменения нижней стенки ЛЖ, смещение сегмента ST во II, III и avF отведениях, высокий R — в V1-2. Архив ЭКГ не предоставлен.
ЭхоКГ: склероз и кальциноз стенок аорты, кольца и створок АК. ММЛЖ — 204 г, толщина МЖП — 1,0 см, ЗСЛЖ — 1,0 см. Дилатация левых отделов сердца (ЛП — 4,5×5,5 см, левый желудочек: КСО — 92, КДО — 171). Относительная недостаточность МК II степени. Гипокинез среднего заднего и заднебокового сегментов ЛЖ. Снижение глобальной сократительной способности миокарда ЛЖ (ФВ по Тейхольцу — 47%). Диастолическая дисфункция левого желудочка первого типа.
С учетом жалоб, анамнеза, лабораторно-инструментальных данных у больного диагностирован повторный ОИМ диафрагмальной и заднебазальной локализации.
Не исключалось состоявшееся желудочно-кишечное кровотечение на фоне приема НПВП и орального антикоагулянта, в связи с чем экстренно выполнена ЭГДС: эндоскопические признаки хронического эзофагита, язва нижней трети пищевода Forrest II C. Острая язва желудка Forrest II B (без признаков продолжающегося кровотечения). Язва привратника Forrest I B (с признаками продолжающегося кровотечения). После эндоскопического инъекционного гемостаза кровотечение остановлено.
Причиной ОИМ, вероятно, явилась гипотония и анемия на фоне желудочно-кишечного кровотечения. Начата консервативная гемостатическая, противоязвенная терапия. От проведения КАГ с возможным чрескожным коронарным вмешательством решено воздержаться до стабилизации состояния.
На фоне лечения цифры АД стабилизировались на уровне 120/85 мм рт. ст., уровень гемоглобина повысился до 110 г/л, возросло число эритроцитов — до 5,71×10*12, гематокрит — 38,3, ЦП — 0,55, лейкоциты — 8×10*9, гипохромия, анизоцитоз сохраняются.
Уровень активности КФК снизился до 113 ед, МВ КФК — до 12,7, тропонина Т — до 225.
ЭГДС через 2 сут: язва нижней трети пищевода Forrest III, острая язва желудка Forrest III, язва привратника Forrest II С (отсутствие признаков кровотечения, появление в области дна фибрина).
На 3-й день пребывания в стационаре возобновились кратковременные приступы сжимающих болей за грудиной (2 приступа: во время приема пищи и при попытке сесть в кровати).
По экстренным показаниям выполнена коронароангиография (рис. 7): ствол ЛКА стенозирован на протяжении передней и средней трети до 70%, субокклюзирован в дистальной трети с переходом на устья ОВ и ПМЖВ; ПМЖВ субокклюзирована в устье, стенозирована в передней трети на 80%, окклюзирована в средней трети, дистальная часть контрастируется по функционирующему маммарно-коронарному шунту. ОВ субокклюзирована в устье, стенозирована в передней трети на 80%; ПКА субокклюзирована на протяжении передней и средней трети, окклюзирована на границе средней и дистальной третей, дистальная часть контрастируется по межартериальным анастомозам.
Правый тип коронарного кровоснабжения.
Маммарно-коронарный шунт из правой маммарной артерии в дистальной трети ПМЖВ проходим. Шунты к ОА и ПКА не визуализируются.
Попытка реканализации стенозированных артерий — без успеха в связи с выраженным кальцинозом.
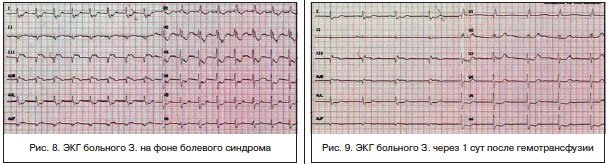
В течение последующих суток — состояние с отрицательной динамикой: в виде учащения кратковременных приступов стенокардии, сопровождающихся выраженными ЭКГ-признаками ишемии миокарда (рис. 8). Отмечено снижение гемоглобина со 110 до 87 г/л, гематокрита — до 26,0.
Кардиоспецифические ферменты в пределах нормальных значений. ЭхоКГ: размер левых отделов сердца прежний, новых участков нарушения движений стенок ЛЖ не выявлено.
Гастроскопия: активное кровотечение из острого дефекта слизистой кардиоэзофагеального перехода (Forrest I). Эндоскопическая остановка кровотечения.
После переливания 600 мл эритроцитной взвеси состояние с положительной динамикой: ангинозные боли и ЭКГ-признаки ишемии миокарда не рецидивируют (рис. 9), восстановление уровня гемоглобина (110 г/л), эритроцитов (3,85×10*12), гематокрита -33,7.
При контрольной ЭГДС через 10 дней положительная динамика — уменьшение в размерах язвенных дефектов без признаков кровотечения.
На фоне терапии ингибиторами протонной помпы, β-блокаторами, клопидогрелом 75 мг/сут показатели красной крови стабильны, двигательный режим расширен и по уровню нагрузок соответствует 3 ФК.
ХМЭКГ: ритм синусовый, ЧСС (за сут/днем/ночью): 78/77/78 уд/мин, максимальная ЧСС — 99 уд/мин, минимальная — 64 уд/мин. Отмечается появление депрессии сегмента ST при увеличении ЧСС свыше 90 уд/мин.
Приведенные случаи демонстрируют возможность проявления коронарной недостаточности на фоне снижения кислород-транспортной способности крови как у пациентов с тяжелым, так и умеренным поражением коронарного русла. Устранение анемии во всех трех случаях способствовало повышению коронарного резерва и стабилизации состояния.
Источник