Из холестерина образуется редуктаза
Содержание статьи
Синтез холестерола должен быть согласован с его выведением
Синтез холестерола в организме составляет примерно 0,5-0,8 г/сут, примерно 50% образуется в печени, около 15% в кишечнике. Все клетки организма способны синтезировать холестерол. Поступление с пищей составляет около 0,4 г/сут.
Единственным реальным способом выведения холестерола является желчь – до 1 г/сут.
Биосинтез холестерола
Биосинтез холестерола происходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА, поступающий сюда из митохондрий в составе цитрата, также как при синтезе жирных кислот. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН.
Образование холестерола идет более чем в 30 реакциях, которые можно сгруппировать в несколько этапов.
1. Синтез мевалоновой кислоты.
Первые две реакции синтеза совпадают с реакциями кетогенеза, но после синтеза 3-гидрокси-3-метилглутарил-SКоА вступает в действие фермент гидроксиметил-глутарил-SКоА-редуктаза (ГМГ-SКоА-редуктаза), образующая мевалоновую кислоту.
2. Синтез изопентенилдифосфата. На этом этапе при использовании АТФ мевалоновая кислота трижды фосфорилируется. Затем промежуточный продукт декарбоксилируется и дефосфорилируется с получением изопентенилдифосфата.
3. После объединения трех молекул изопентенилдифосфата (если не считать промежуточных превращений) синтезируется фарнезилдифосфат.
4. Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата.
5. После сложных реакций линейный сквален циклизуется в ланостерол.
6. Удаление лишних метильных групп, восстановление и изомеризация молекулы приводит к появлению холестерола.
Регуляция синтеза
Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза, активность которой может изменяться в 100 и более раз.
1. Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. Это помогает поддерживать внутриклеточное содержание холестерола постоянным.
2. Регуляция транскрипции гена ГМГ-SКоА-редуктазы (в печени) – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента.
3. Ковалентная модификация при гормональной регуляции:
- Инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние.
Важным следствием такой регуляции является активация кетогенеза при отсутствии инсулина.
- Глюкагон и адреналин посредством аденилатциклазного механизма активируют протеинкиназу А, которая фосфорилирует фермент и переводит его в неактивную форму.
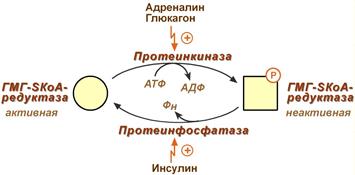
Регуляция активности гидроксиметилглутарил-S-КоА-редуктазы
Кроме указанных гормонов, на ГМГ-SКоА-редуктазу действуют эстрогены и тиреоидные гормоны (повышают активность) и глюкокортикоиды (снижают активность).
Изменение транскрипции гена ГМГ-КоА редуктазы (генетическая регуляция) осуществляется стерол-регулируемым элементом в ДНК (SREBP, sterol regulatory element-binding protein) с которым способны связываться белки — факторы SREBP. Эти факторы при достаточном количестве холестерина в клетке закреплены в мембране ЭПР. Когда уровень холестерина падает, факторы SREBP активируются под действием специфичных протеаз комплекса Гольджи, передвигаются в ядро, взаимодействуют на ДНК с участком SREBP и стимулируют биосинтез холестерина.
Скорость биосинтеза холестерола также зависит от концентрации специфического белка-переносчика, обеспечивающего связывание и транспорт гидрофобных промежуточных метаболитов синтеза.
Источник
ХОЛЕСТЕРИНОВЫЙ ОБМЕН — Большая Медицинская Энциклопедия
ХОЛЕСТЕРИНОВЫЙ ОБМЕН (греческий chole желчь + stereos твердый) — совокупность реакций биосинтеза холестерина (см.) и его распада в организме человека и животных. В организме человека за сутки около 500 мг холестерина окисляется в желчные кислоты, примерно такое же количество стеринов экскретируется с фекалиями, около 100 мг выделяется с кожным салом, небольшое количество холестерина (около 40 мг) используется для образования кортикоидных и половых гормонов, а также витамина D3, 1—2 мг холестерина выводится с мочой. У кормящих женщин с грудным молоком выделяется 100— 200 мг холестерина в сутки. Эти потери восполняются за счет синтеза холестерина в организме (у взрослого человека в сутки около 700—1000 мг) и поступления его с пищей (300— 500 мг). Холестерин, а также часть холестерина, поступившего в просвет кишечника с желчью, всасывается в тонкой кишке в форме жировых мицелл (см. Жировой обмен). Эфиры холестерина предварительно гидролизуются при действии холестеринэстеразы (см.) панкреатического и кишечного соков. В стенке тонкой кишки холестерин используется для образования хиломикронов (см. Липопротеиды), в составе которых он поступает сначала в лимфатическую систему, а затем в кровяное русло.
В капиллярах жировой и некоторых других тканей в результате воздействия на хиломикроны липопротеид-липазы образуются частицы, обогащенные эфирами холестерина и фосфолипидами, получившие название ремнантных (остаточных) частиц. Эти частицы задерживаются в печени, где подвергаются распаду. Освободившийся при этом холестерин наряду с холестерином, синтезированным в печени, образует так называемый общий пул печеночного холестерина, который используется по мере необходимости для образования липопротеидов (см.).
Установлено, что у человека и некоторых животных липопротеиды низкой плотности транспортируют холестерин в органы и ткани, причем захват липоиротеидных частиц клетками этих органов и тканей осуществляется при участии специфических рецепторов. Холестерин, доставленный в клетку в составе липопротеидных частиц, идет на покрытие потребностей клетки (образование мембран при делении клетки, синтез стероидных гормонов и др.). Избыточная часть неэтерифицированного (свободного) холестерина превращается в его эфиры при действии содержащегося в клетке фермента — холестеролацилтрансферазы (КФ 2.3.1.26). Обратный транспорт неэтерифицированного холестерина из различных органов и тканей в печень осуществляется липопротеидами высокой плотности, причем в кровяном русле происходит этерификация захваченного холестерина при участии лецитина и фермента холестерин-лецитин — ацилтрансферазы (КФ 2.3.1.43). Доставленный таким путем в печень холестерин идет на образование желчных кислот (см.).
Синтез холестерина

Общая схема биосинтеза холестерина
Синтез холестерина осуществляется в клетках почти всех органов и тканей, однако в значительных количествах он образуется в печени (80%), стенке тонкой кишки (10%) и коже (5%). К. Блох, Ф. Линен и др. показали основные реакции биосинтеза холестерина (их не менее 30). Сложный процесс биосинтеза холестерина можно разделить на три стадии: 1) биосинтез мевалоновой кислоты; 2) образование сквалена из мевалоновой кислоты; 3) циклизация сквалена и образование холестерина (см. схему).
Считают, что главным источником образования мевалоновой кислоты в печени является ацетил-КоА, а в мышечной ткани — лейцин. И то и другое соединения в результате ряда энзиматических реакций образуют бета-гидрокси-бета-метилглутарил-КоА (ГМГ-КоА), который затем восстанавливается в мевалоновую кислоту. В последнее время показано, что в синтез мевалоновой кислоты в печени может включаться и малонил-КоА.
Реакцией, определяющей скорость биосинтеза холестерина в целом, является восстановление ГМГ-КоА в мевалоновую кислоту; этот процесс катализирует фермент НАДФ-Н2-зависимая ГМГ-КоА-редуктаза (КФ 1.1.1.34). Именно этот фермент подвержен воздействиям со стороны ряда факторов. Так, активность ГМГ-КоА-редуктазы повышается (или содержание ее в печени возрастает) и скорость синтеза холестерина в целом увеличивается при действии ионизирующего излучения, введении тиреоидных гормонов, поверхностно-активных веществ, холестирамина, а также при гипофизэктомии. Угнетение синтеза холестерина отмечается при голодании, тиреоидэктомии и при поступлении в организм пищевого холестерина. Последний угнетает активность (или синтез) фермента ГМГ-КоА-редуктазы.
Синтез холестерина в стенке тонкой кишки регулируется исключительно концентрацией желчных кислот. Так, отсутствие их в кишечнике при наличии наружного желчного свища ведет к повышению синтеза холестерина в тонкой кишке в 5—10 раз.
На второй стадии синтеза происходит фосфорилирование мевалоновой кислоты при участии АТФ и образование нескольких фосфорилированные промежуточных продуктов (см. Фосфорилирование). При декарбоксилировании одного из них образуется изопентенил-пирофосфат, часть которого превращается в диметилаллил-пирофосфат. Взаимодействие этих двух соединений приводит к образованию димера — геранил-пирофосфата, содержащего 10 атомов углерода. Геранил-пирофосфат конденсируется с новой молекулой изопентенил-пирофосфата и образует тример — фарнезил-пирофосфат, содержащий 15 атомов углерода. Эта реакция идет с отщеплением молекулы пирофосфата. Затем две молекулы фарнезил-пирофосфата конденсируются, теряя каждая свой пирофосфат, и образуют гексамер сквален, содержащий 30 атомов углерода.
Третья стадия синтеза включает окислительную циклизацию сквалена, сопровождающуюся миграцией двойных связей и образованием первого циклического соединения — ланостерина. Ланостерин уже имеет гидроксильную группу в положении 3 и три лишние (по сравнению с холестерином) метильные группы. Дальнейшее превращение ланосте-рина может совершаться двумя путями, причем и в том и в другом случае промежуточными продуктами являются соединения стериновой природы. Более доказанным считается путь через 24, 25-дигидроланостерин и ряд других стеринов, включая 7-дигидрохолестерин, служащий непосредственным предшественником холестерина. Другой возможный путь — превращение ланостерина в зимостерин, а затем в десмостерин, из которого при восстановлении образуется холестерин.
Если суммировать общий итог всех реакций биосинтеза холестерина, то он может быть представлен в следующем виде:
18CH3CO-S-KoA + 10(H+) + 1/2O2 —> C27H46O + 9CO2 + 18KoA-SH. Источником углерода холестерина является ацетил-КоА (им может быть также малонил-КоА и лейцин), источником водорода — вода и никотин-амида дениндинуклеотидфосфат, а источником кислорода — молекулярный кислород.
Начиная со сквалена и кончая холестерином все промежуточные продукты биосинтеза нерастворимы в водной среде, поэтому они участвуют в конечных реакциях биосинтеза холестерина в связанном со сквален или стеринпереносящими белками состоянии. Это позволяет им растворяться в цитоплазме клетки и создает условия для протекания соответствующих реакций. Холестерин-переносящий белок обеспечивает также перемещение стеринов внутри клетки, что имеет важное значение для вхождения его в мембрану клетки, а также для транспорта в клеточные системы, осуществляющие катаболизм холестерина.
Катаболизм холестерина протекает в печени (окисление его в желчные кислоты), в надпочечниках и плаценте (образование из холестерина стероидных гормонов), в тестикулярной ткани и яичниках (образование половых гормонов). При биосинтезе холестерина в коже на завершающей стадии образуется небольшое количество 7-дегидрохолестерина. Под влиянием УФ-лучей он превращается в витамин D3.
Своеобразные превращения претерпевает холестерин в толстой кишке. Речь идет о той части пищевого холестерина или холестерина, поступившего в кишечник с желчью, которая не подверглась всасыванию. Под влиянием микробной флоры толстой кишки происходит восстановление холестерина и образование так наз. нейтральных стеринов. Главным их представителем является копростерин. Экспериментальные исследования, проведенные с использованием радиоизотопных и других методов, показали, что скорость обновления холестерина в различных органах и тканях неодинакова; наиболее высока она в надпочечниках и печени и чрезвычайно низка в мозге взрослых животных.
Патология холестеринового обмена
Нарушения холестеринового обмена обычно связаны с дисбалансом между количеством синтезируемого в организме и поступающего с пищей холестерина, с одной стороны, и количеством холестерина, подвергающегося катаболизму,— с другой. Эти нарушения проявляются в изменении уровня холестерина в плазме крови, которые классифицируются как гиперхолестеринемия или гипохолестеринемия (для взрослого населения высокоразвитых стран величины выше 270 мг/100 мл и ниже 150 мг/100 мл соответственно).
Гиперхолестеринемия может быть первичной (наследственной или алиментарной) и вторичной, обусловленной различными заболеваниями. Наследственная (семейная) гиперхолестеринемия характеризуется высоким уровнем холестерина и липопротеидов низкой плотности (ЛПНГЛ в плазме крови. При гомозиготной гиперхолестеринемии уровень холестеринемии может достигать 700— 800 мг/100 мл, а при гетерозиготной — 300—500 мг/100 мл. В основе наследственной гиперхолестеринемии лежит генетически обусловленное отсутствие (у гомозигот) или недостаток (у гетерозигот) специфических рецепторов к липопротеидам низкой плотности у клеток, вследствие чего резко снижается захват и последующий катаболизм этих богатых холестерином липопротеидов клетками паренхиматозных органов и тканей. В результате пониженного захвата и снижения катаболизма липопротеидов низкой плотности развивается гиперхолестеринемия (см.). Последняя приводит к раннему развитию атеросклероза (см.) и его клинических проявлений — ишемической болезни сердца (см.), преходящей ишемии мозга (см. Инсульт) и др. Особенно тяжело протекает атеросклероз при гомозиготной форме; у таких больных часто наблюдается ксантоматоз (см.), липоидная дуга роговицы (отложение холестерина в роговицу глаз), инфаркт миокарда в юношеском возрасте.
Распространенность гомозиготной формы гиперхолестеринемии невелика (примерно один случай на 1 млн. жителей). Чаще встречается гетерозиготная форма — один случай на 500 жителей.
Алиментарная гиперхолестеринемия характеризуется повышенным уровнем холестерина в плазме крови вследствие длительного потребления больших количеств пищи, богатой холестерином (куриные желтки, икра, печень, животные жиры и др.). Алиментарная гиперхолестеринемия той или иной степени выраженности характерна для жителей высокоразвитых индустриальных стран. Согласно популяционным исследованиям имеется прямая зависимость между уровнем холестерина в крови и распространенностью ишемической болезни сердца.
В эксперименте на различных животных (кролики, морские свинки, обезьяны) показано, что введение массивных доз холестерина с пищей приводит к резко выраженной гиперхолестеринемии и быстрому развитию атеросклероза. Экспериментальные модели гиперхолестеринемии и атеросклероза, впервые предложенные H. Н. Аничковым и С. С. Халатовым (1913), широко используются в научных исследованиях.
Вторичная гиперхолестеринемия встречается при гипотиреозе (см.), сахарном диабете (см. Диабет сахарный), нефротическом синдроме (см.), подагре (см.) и др. и нередко сопровождается развитием атеросклероза (см. Гиперхолестеринемия).
Выделяют первичную и вторичную гипохолестеринемию. Первичная гипохолестеринемия характерна для наследственного заболевания — абеталипопротеинемии (см.). При этой болезни отмечается почти полное отсутствие в плазме крови липопротеидов низкой плотности (у гомозигот) или значительное их снижение (у гетерозигот). Уровень общего холестерина не превышает 75 мг/ 100 мл. Гомозиготная форма болезни протекает исключительно тяжело. В основе абеталипопротеинемии лежит генетически обусловленное нарушение синтеза апопротеина В — главного белка липопротеидов низкой плотности.
Вторичные гипохолестеринемии наблюдаются при кахексии, гипертиреоидизме, аддисоновой болезни и паренхиматозных заболеваниях печени, при ряде инфекционных болезней и интоксикациях (см. Гипохолестеринемия). При недостаточной активности в плазме крови фермента лецитин — холестерин -ацилтрансферазы, или ЛХАТ (наследственная ЛXАТ-недостаточность), ответственного за этерификацию холестерина плазмы, наблюдается накопление неэтерифицированного холестерина в мембранах эритроцитов и клетках почек, печени, селезенки, костного мозга, роговицы глаза. Резко снижается доля этерифицированного холестерина в плазме крови и одновременно повышается уровень неэтерифицированного холестерина и лецитина. У больных с наследственной ЛXAT-недостаточностыо стенки артерий и капилляров подвержены деструктивным изменениям, что связано с отложением в них липидов. Наиболее тяжелые изменения происходят в сосудах почечных клубочков, что приводит к развитию почечной недостаточности (см.).
Одним из распространенных нарушений холестериновый обмен. является образование желчных камней, основной составной частью которых является холестерин (см. Желчнокаменная болезнь). Образование желчных камней происходит вследствие выкристаллизовывания холестерина при относительно высокой его концентрации в желчи и относительно низкой концентрации в ней желчных кислот и фосфолипидов, обладающих способностью растворять холестерин. Исследования показали, что имеется прямая связь между уровнем холестерина в плазме крови и распространенностью холестероза (см.) и желчнокаменной болезни.
Библиогр.: Климов А. Н, и Н икульчева Н. Г. Липопротеиды, дислипопротеидемии и атеросклероз, Л., 1984; Полякова Э. Д. Пути биосинтеза холестерина в печени и их регуляция, в кн.: Липиды, структура,биосинтез, превращения и функции, под ред. С. Е. Северина, с. 131, М., 1977;она же, Регуляция содержания холестерина в клетке, в кн.: Биохимия липидов и их роль в обмене веществ, под ред.С. Е. Северина, с. 120, М., 1981; Финагин Л. К. Обмен холестерина и его регуляция, Киев, 1980; Lipids and lipidoses, ed. by G. Schettler, B.— Heidelberg, 1967; Sodhi H. S., Kudchod-k a r B. J. a. Mason D. T. Clinical methods in study of cholesterol metabolism, Basel a. o., 1979.
A. H. Климов
Источник
Синтез холестерина в печени, клетке
Информация носит справочный характер. Не занимайтесь самодиагностикой и самолечением. Обращайтесь ко врачу.
Поскольку вещество принадлежит к классу спиртов, единственно правомочным является термин «холестерол», название же «холестерин» (буквально «твёрдая желчь» ввиду его первоначального выделения из желчных камней) закрепилось за соединением в силу традиции – впервые полученное в 1769 году французским химиком Пулетье де ля Саль, оно проявляло явные свойства жиров, к коим и было первоначально причислено.
Ввиду некоторых добросовестных заблуждений учёных, холестерин был на долгие годы объявлен для здоровья организма «врагом №1», что вызвало настоящий переворот в пищевой промышленности, фармакологии и методах лечения – одновременно с обезжиренными продуктами в мир явилась новые препараты и методики, способные существенно снизить концентрацию соединения в крови, а вместе со всем этим – и аппараты контроля за «вредителем», чтобы его можно было всегда держать в узде.
Поскольку лучшим способом проверить вредоносность того или иного фактора является метод его изъятия из обращения, это и было проделано – в итоге весь мир теперь пожинает катастрофические плоды «обезжиривающей диеты», а учёные вынуждены оправдываться и обещать всё исправить. Но сделать это можно, лишь разобравшись в происхождении и истинной роли вещества в организме.
Основные функции холестерина
Помимо того, что он является непременным компонентом (стабилизатором текучести) цитоплазматической мембраны, обеспечивая жёсткость её двойного слоя за счёт более компактного размещения фосфолипидных молекул, холестерин проявляет себя как фактор-регулятор проницаемости клеточных стенок, препятствуя гемолизу крови (воздействию гемолитических ядов на мембраны эритроцитов).
Еще он служит исходной субстанцией для производства соединений стероидной группы:
- гормонов-кортикостероидов;
- половых гормонов;
- желчных кислот;
- витаминов D-группы (эргокальциферорола и холекальциферола).
Учитывая важность для организма каждого из этой группы веществ, становится понятен вред бесхолестериновой диеты либо искусственного снижения уровня этого вещества в крови.
Ввиду нерастворимости в воде эта субстанция может быть транспортирована кровью лишь в связке с белками-транспортёрами (аполипопротеинами), при соединении с которыми образуются липопротеиновые комплексы.
По причине существования целого ряда различных аполипопротеинов (с различием молекулярной массы, степенью их тропности к холестерину, а также ввиду способности образованного комплекса к растворению в крови, и наличия обратных свойств – к выпадению холестериновых кристаллов с образованием атеросклеротической бляшки) выделяют категории липопротеинов:
- высокой плотности (ЛПВП, или высокомолекулярные, или HDL-липопротеины);
- низкой плотности (ЛПНП, или низкомолекулярные, или LDL-липопротеины);
- очень низкой плотности (ЛПОНП, крайне низкомолекулярные, или VLDL- категория липопротеинов);
- хиломикроны.
К тканям периферии холестерин поступает связанным с хиломикронами, ЛПНП либо ЛПОНП, в печень (с последующими удалением из организма) – путём транспортировки аполипопротеинами категории ЛПВП.

Особенности синтеза
Для того чтобы из холестерина образовались либо атеросклеротические бляшки (становящиеся одновременно и «заплатками» на повреждённой стенке артерии, и внутренними «распорками» в той зоне, где без них атрофия мышечного слоя должна бы привести к её окклюзии – спадению участка), либо гормоны, либо иная продукция, он в организме должен сначала синтезироваться в одном из трёх мест:
- коже;
- кишечнике;
- печени.
Поскольку клетки печени (их цитозоль и гладкий эндоплазматический ретикулюм) являются главными поставщиками соединения (в 50% и свыше того), следует рассмотреть синтез вещества именно с позиции совершающихся в ней реакций.
Синтез холестерина происходит в 5 этапов – с последовательным образованием:
- мевалоната;
- изопентенилпирофосфата;
- сквалена;
- ланостерина;
- собственно холестерина.
Цепочка превращений была бы невозможной без участия ферментов, катализирующих каждую из стадий процесса.
Видео о синтезе холестерина:
Ферменты, принимающие участие в образовании вещества
На первом этапе (состоящем из трёх операций), ацетил-CoA-ацетилтрасферазой (тиолазой) первоначально инициируется создание ацетоацетил-CoA (здесь и далее CoA – коэнзим А) путём слияния 2 молекул ацетил-CoA. Далее при участии ГМГ-CoA-синтазы (гидроксиметил-глутарил-CoA-синтазы) становится возможным синтез из ацетоацетила-CoA и ещё одной молекулы ацетил-CoA ꞵ-гидрокси-ꞵ-метилглутарил-CoA.
При восстановлении ГМГ (ꞵ-гидрокси-ꞵ-метил-глутарил-CoA) путём отщепления фрагмента HS-CoA с участием НАДФ-зависимой гидроксиметил-глутарил-CoA-редуктазы (ГМГ-CoA-редуктазы) образуется первый промежуточный продукт – предшественник холестерина (мевалонат).
На этапе синтеза изопентинилпирофосфата осуществляются четыре операции. На 1 и 2 мевалонат при посредстве мевалонаткиназы (а затем фосфомевалонаткиназы) путём дважды повторяющегося фосфорилирования превращается в 5-фосфомевалонат, а далее в 5-пирофосфомевалонат, на 3 стадии (фосфорилировании по 3-му углеродному атому) становящемуся 3-фосфо-5-пирофосфомевалонатом (при участии фермента киназы).
Последняя операция – это декарбоксилирование и дефосфорилирование с образованием изопентинилпирофосфата (инициированное участием фермента пирофосфомевалонат-декарбоксилазы).
При синтезе сквалена происходит первоначальная изомеризация изопентенилпирофосфата в диметилаллилпирофосфат (под влиянием изопентилфосфатизомеразы), затем изопентенилпирофосфат конденсируется с диметилаллилпирофосфатом (образуется электронная связь между C5 первой и C5 второй субстанций) с образованием геранилпирофосфата (и отщеплением пирофосфатной молекулы).
На следующей стадии образуется связь между C5 изопентенилпирофосфата и C10 геранилпирофосфата – в результате конденсации первого со вторым происходит образование фарнезилпирофосфата и отщеплением следующей молекулы пирофосфата от C15.
Завершается данный этап конденсацией двух фарнезилпирофосфатных молекул в зоне C15— C15 (по принципу «головой-к-голове») с отщеплением сразу 2 молекул пирофосфата. Для конденсации обеих молекул используются области пирофосфатных групп, одна из которых сразу отщепляется, что приводит к возникновению прескваленпирофосфата. При восстановлении НАДФН (с отщеплением второго пирофосфата) эта промежуточная субстанция (под влиянием сквален-синтазы) обращается в скавален.
В синтезе ланостерина присутствуют 2 операции: первая завершается образованием эпоксида сквалена (под действием скваленэпоксидазы), вторая – циклизацией эпоксида сквалена в конечный продукт этапа – ланостерин. Перемещением метильной группы от C14 на C13, а от C8 на C14 ведает оксидосквален-ланостерин-циклаза.
Последний этап синтеза включает в себя последовательность из 5 операций. В результате окисления C14 -метильной группы ланостерина возникает соединение, именуемое 14-десметилланостерином. После удаления ещё двух метильных групп (на C4) вещество становится зимостеролом, а в результате перемещения двойной связи C8=С9 в позицию C8=С7 происходит образование δ-7,24- холестадиенола (под действием изомеразы).
После перемещения двойной связи С7=C8 в позицию С5=С6 (с образованием десмостерола) и восстановлением двойной связи в боковой цепи образуется конечное вещество – холестерин (вернее, холестерол). «Руководит» финальной стадией синтеза холестерина фермент δ-24-редуктаза.
Что влияет на тип холестерина?
 Учитывая малую растворимость низкомолекулярных липопротеидов (ЛПНП), их склонность к выпадению в осадок холестериновых кристаллов (с образованием в артериях бляшек атеросклероза, повышающих вероятность сердечных и сосудистых осложнений), липопротеиды данной категории часто называют «вредным холестерином», в то время как липопротеиды с высоким молекулярным весом (ЛПВП) с противоположными свойствами (без риска атерогенности) принято именовать холестерином «полезным».
Учитывая малую растворимость низкомолекулярных липопротеидов (ЛПНП), их склонность к выпадению в осадок холестериновых кристаллов (с образованием в артериях бляшек атеросклероза, повышающих вероятность сердечных и сосудистых осложнений), липопротеиды данной категории часто называют «вредным холестерином», в то время как липопротеиды с высоким молекулярным весом (ЛПВП) с противоположными свойствами (без риска атерогенности) принято именовать холестерином «полезным».
Принимая во внимание относительность этого суждения (в организме не может быть как чего-либо безусловно полезного, так и исключительно вредного), тем не менее в настоящий момент для лиц с высокой склонностью к сосудистой патологии предлагаются меры контроля и снижения уровня ЛПНП до оптимальных показателей.
При цифре свыше 4,138 ммоль/л рекомендован подбор диеты для снижения их уровня до 3,362 (либо менее того), уровень свыше 4,914 служит показанием для назначения терапии по искусственному их снижению приёмом лекарственных препаратов.
К повышению в крови фракции «вредного холестерина» приводят факторы:
- низкой активности тела (гиподинамии);
- переедания (пищевой зависимости), а также его последствий – избытка массы либо ожирения;
- несбалансированности диеты – с преобладанием трансжиров, легкоусвояемых углеводов (сладостей, сдобы) в ущерб содержанию пектиновых веществ, клетчатки, витаминов, микроэлементов, жирных кислот полиненасыщенного состава;
- наличия привычных бытовых интоксикаций (курения, употребления спирта в виде различных напитков, злоупотребления лекарственными средствами).
Не менее мощное влияние оказывает наличие хронической соматической патологии:
- желчнокаменной болезни;
- эндокринных расстройств с гиперпродукцией гормонов коры надпочечников, дефицитом тиреоидных либо половых гормонов, либо сахарного диабета;
- почечной и печёночной недостаточности с расстройствами отдельных этапов синтеза «полезных» липопротеидов, происходящего в данных органах;
- наследственно обусловленных дислипопротеинемий.
Состояние холестеринового обмена напрямую зависит от состояния микрофлоры кишечника, способствующей (либо препятствующей) всасыванию пищевых жиров, а также участвующей в синтезе, трансформации, либо разрушении стеролов экзогенного или эндогенного происхождения.
И наоборот, к снижению показателя «вредного» холестерина приводят:
- занятия физкультурой, играми, танцами;
- ведение здоровой жизни без курения и алкоголя;
- правильная пища без избытка легкоусвояемых углеводов, с малым содержанием животных жиров насыщенного состава – но с достаточным содержанием клетчатки, жирных кислот полиненасыщенного состава, липотропных факторов (лецитина, метионина, холина), микроэлементов, витаминов.
Видео от эксперта:
Как происходит процесс в организме?
С потребляемой пищей в организм поступают лишь около 20% холестерина – остальные 80% он вырабатывает сам, помимо печени процесс синтеза производится гладким эндоплазматическим ретикулюмом клеток:
- кишечника;
- надпочечных желёз;
- почек;
- половых желёз.
Помимо описанного выше классического механизма создания молекулы холестерола, возможно её построение и иным, не мевалонатным методом. Так, одним из вариантов является образование вещества из глюкозы (происходящее при посредстве других ферментов и при других условиях существования организма).
Источник