Изменение первичной структуры гемоглобина
Содержание статьи
5.Варианты первичной структуры и свойств гемоглобина,гемоглабинопатии.
Hb взрослого
организма состоит, как упомянуто выше,
из двух α- и двух β-цепей (α2β2). Наряду с
этой основной формой (HbA1)
в крови присутствуют незначительные
количества второй формы с более высоким
сродством к O2, у второй β-цепи заменены
δ-цепя-ми (HbA2,
α2δ2). Две другие формы Hb встречаются
только в эмбриональном периоде развития.
В первые три месяца образуются
эмбриональные гемоглобины состава
α2ε2-P
и α2γ2-F.
Затем вплоть до рождения доминирует
фетальный гемоглобин (HbF),
который постепенно заменяется на первом
месяце жизни на HbА. Эмбриональный и
фетальный гемоглобины обладают более
высоким сродством к О2 по сравнению с
HbА, так как они должны переносить кислород
из системы материнского кровообращения.
Классическим
примером наследственной гемоглобинопатии
является серповидно-клеточная анемия.
При этой патологии эритроциты в условиях
низкого парциального давления кислорода
принимают форму серпа. Гемоглобин S
после отдачи кислорода в тканях он
превращается в плохо растворимую
дез-окси-форму и начинает выпадать в
осадок в виде веретенообразных
кристаллоидов, названных тактоидами.
Последние деформируют клетку и приводят
к массивному гемолизу. Болезнь протекает
остро, и дети, гомозиготные по мутантному
гену, часто умирают в раннем возрасте.
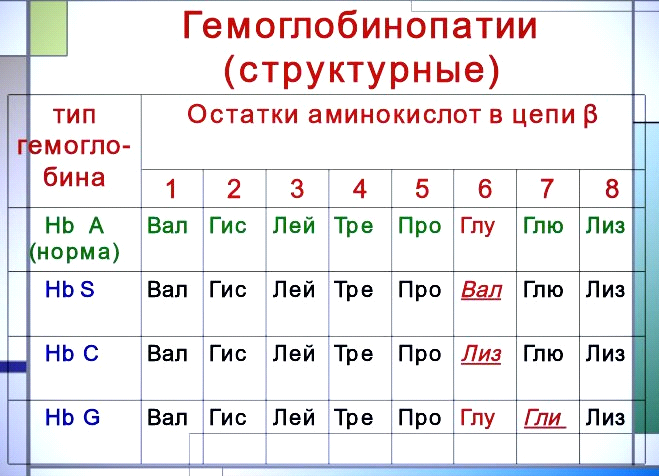
Химический дефект при серповидно-клеточной
анемии был раскрыт В. Ингремом и сводится
к замене единственной аминокислоты, а
именно глутаминовой,
в 6-м положении с N-конца на валин в β-цепях
молекулы гемоглобина HbS. Это результат
мутации в молекуле ДНК, кодирующей
синтез β-цепи гемоглобина.

Вопрос
№ 6
Схема
связывания газов гемоглобином. Карбокси
– и метгемоглобин.
Связывание
газов гемоглобином
□Оксигемоглобин
Hb O2 (Fe2+)
□Карбоксигемоглобин Hb CO
(Fe2+)
□Карбгемоглобин Hb-NH-COOH
(Fe2+)
□Метгемоглобин Мet
Hb(Fe3+)
Карбоксигемоглобин (HbCO) —
прочное соединение гемоглобина и
угарного газа. Избыток карбоксигемоглобина
в крови приводит к кислородному голоданию,
головокружению, тошноте, рвоте или даже
смерти, так как угарный газ, связанный
с гемоглобином, лишает его возможности
присоединять к себе кислород.
МЕТГЕМОГЛОБИН
— форма гемоглобина, в которой железо
гема окислено до Fe (III); не способен
переносить кислород. Образование
метгемоглобина в организме (напр., при
отравлениях нитратами, анилином) приводит
к кислородному голоданию.
Вопрос
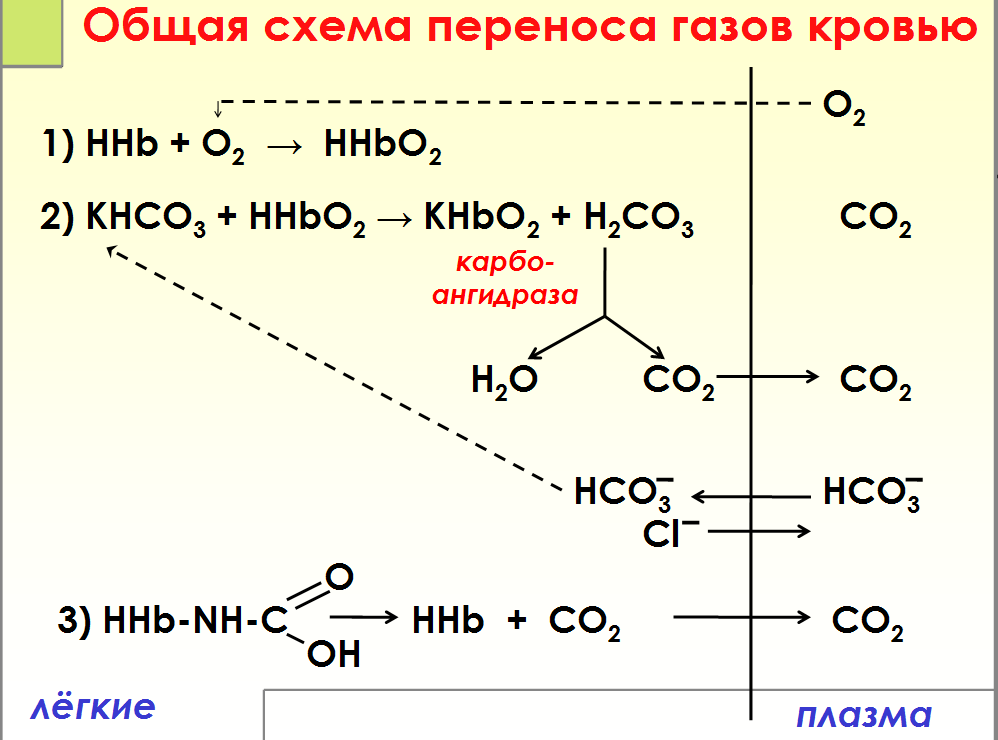
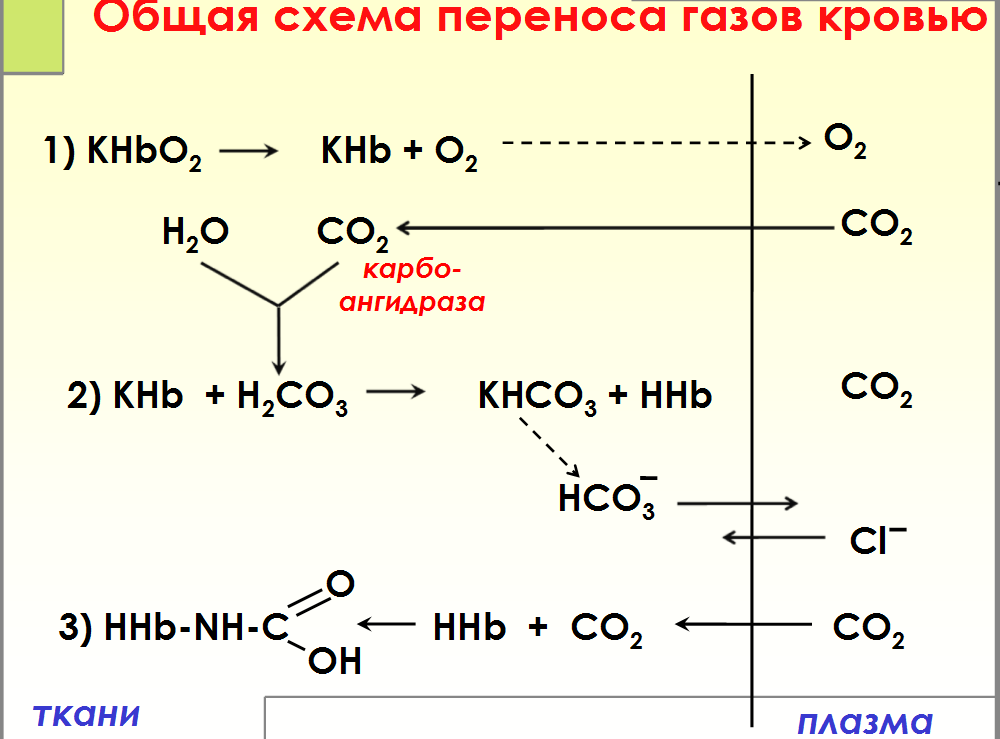
№ 7
Транспорт
кровью кислорода и двуокиси углерода(
схема)
Вопрос
№ 8
Биосинтез
гема. (формулы, ферменты) и его регуляция.
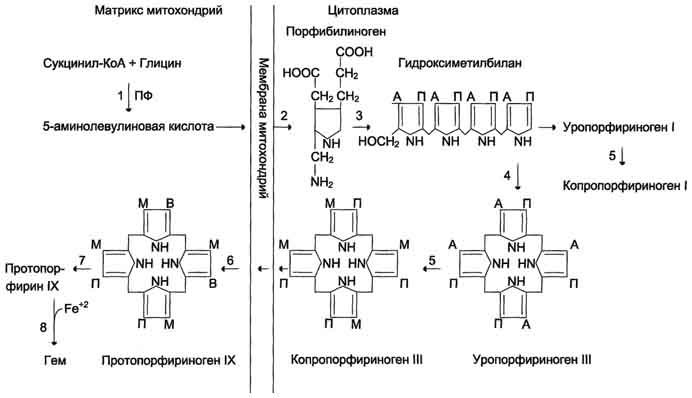
Рис.
13-2. Синтез гема. Цифрами
на схеме указаны ферменты: 1 —
аминолевулинатсинтаза; 2 —
аминолевулинатдегидратаза; 3 —
порфобилиногендезаминаза; 4 — уропорфириноген
III косинтаза; 5 — уропорфириногендекарбоксилаза;
6 — копропорфи-риноген III оксидаза; 7 —
протопорфириногеноксидаза; 8 —
феррохелатаза. Буквами обозначены
заместители в пиррольных кольцах: М —
метил, В — винил, П — остатки пропионовой
кислоты, А — ацетил, ПФ — пиридоксальфосфат.
Донором железа служит депонирующий
железо в клетках белок ферритин.
Регуляторную
реакцию синтеза гема катализирует
пиридоксальзависимый фермент
аминолевулинатсинтаза. Скорость реакции
регулируется аллостерически и на уровне
трансляции фермента.
Аллостерическим
ингибитором и корепрессором синтеза
аминолевулинатсинтазы является гем
(рис. 13-5).
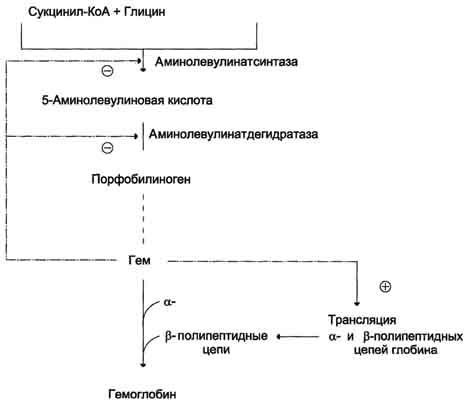
Рис.
13-5. Регуляция синтеза гема и гемоглобина. Гем
по принципу отрицательной обратной
связи ингибирует аминолевулинатсинтазу
и аминолевулинатдегидратазу и является
индуктором трансляции α- и β-цепей
гемоглобина
В
ретикулоцитах синтез этого фермента
на этапе трансляции регулирует железо.
На участке инициации мРНК, кодирующей
фермент, имеется
последовательность
нуклеотидов, образующая шпилечную
петлю, которая называется железочувствительным
элементом (от англ, iron-responsive
element, IRE)
(рис. 13-6).
При
высоких концентрациях железа в клетках
оно образует комплекс с остатками
цистеина регуляторного железосвязывающего
белка. Взаимодействие железа с регуляторным
железосвязывающим белком вызывает
снижение сродства этого белка к
IRE-элементу мРНК, кодирующей
аминолевулинатсинтазу, и продолжение
трансляции (рис. 13-6, А). При низких
концентрациях железа железосвязывающий
белок присоединяется к железо-чувствительному
элементу, находящемуся на 5′-нетранслируемом
конце мРНК, и трансляция аминолевулинатсинтазы
тормозится (рис. 13-6, Б).
Аминолевулинатдегидратаза
также аллостерически ингибируется
гемом, но так как активность этого
фермента почти в 80 раз превышает
активность аминолевулинатсинтазы, то
это не имеет большого физиологического
значения.
Дефицит
пиридоксальфосфата и лекарственные
препараты, которые являются его
структурными аналогами, снижают
активность аминолевулинатсинтазы.
Вопрос
№ 9
Нарушение
биосинтеза гема. Порфирии
Порфирии
– заболевания, обусловленные нарушениями
начальных этапов синтеза гема и
сопровождающиеся накопление порфиринов
и их предшественников.
Первичные –
генетический дефект ферментов синтезаВторичные –
нарушения регуляции биосинтезаНаследственные:
Эритропоэтические
уропорфирия
протопорфирия
Печёночные
острая перемежающаяся
порфириякопропорфирия
урокопропорфирия
Смешанные
Наследственные
и приобретённые нарушения синтеза гема,
сопровождающиеся повышением содержания
порфириногенов, а такие продуктов их
окисления в тканях и крови и появлением
их в моче, называют порфириями.
Наследственные
порфирии обусловлены генетическими
дефектами ферментов, участвующих в
синтезе гема, за исключением
аминолевулинатсинтазы. При этих
заболеваниях отмечают снижение
образования гема. Поскольку гем —
аллостерический ингибитор
аминолевулинатсинтазы, то активность
этого фермента повышается, и это приводит
к накоплению промежуточных продуктов
синтеза гема — аминолевулиновой кислоты
и порфириногенов.
В зависимости от
основной локализации патологического
процесса различают печёночные и
эритропоэтические наследственные
порфирии. Эритропоэтические порфирии
сопровождаются накоплением порфиринов
в нормобластах и эритроцитах, а печёночные
— в гепатоцитах.
При тяжёлых формах
порфирии наблюдают нейропсихические
расстройства, нарушения функций РЭС,
повреждения кожи. Порфириногены не
окрашены и не флуоресцируют, но на свету
они легко превращаются в порфирины.
Последние проявляют интенсивную красную
флуоресценцию в ультрафиолетовых лучах.
В коже на солнце в результате взаимодействия
с порфиринами кислород переходит в
синглетное состояние. Синглетный
кислород вызывает ускорение ПОЛ клеточных
мембран и разрушение клеток, поэтому
порфирии часто сопровождаются
фотосенсибилизацией и изъязвлением
открытых участков кожи. Нейропсихические
расстройства при порфириях связаны с
тем, что аминолевулинат и порфириногены
являются нейротоксинами.
Иногда
при лёгких формах наследственных
порфирии заболевание может протекать
бессимптомно, но приём лекарств,
являющихся индукторами синтеза
аминолевулинатсинтазы, может вызвать
обострение болезни. Индукторами синтеза
аминолевулинатсинтазы являются такие
известные лекарства, как сульфаниламиды,
барбитураты, диклофенак, вольтарен,
стероиды, гестагены. В некоторых случаях
симптомы болезни не проявляются до
периода полового созревания, когда
повышение образования β-стероидов
вызывает индукцию синтеза
аминолевулинатсинтазы. Порфирии
наблюдают и при отравлениях солями
свинца, так как свинец нгибирует
аминолевулинатдегидратазу и феррохелатазу.
Некоторые галогенсодержащие гербициды
и инсектициды являются индукторами
синтеза аминолевулинатсинтазы, поэтому
попадание их в организм сопровождается
симптомами порфирии.
Вопрос
№ 10
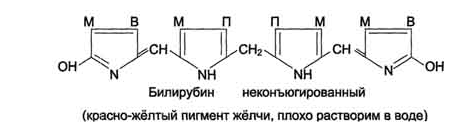
Схема
распада гемоглобина. «Непрямой»
билирубин.
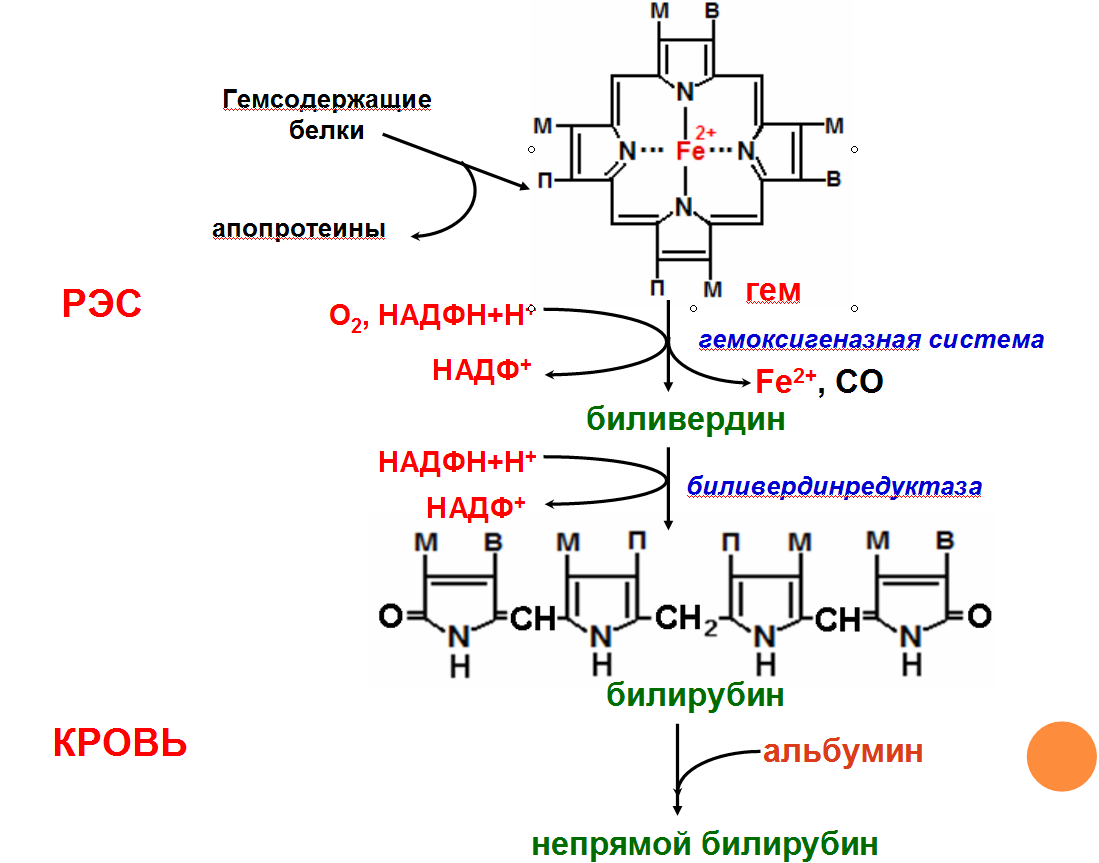
Катаболизм
гема
Первая
реакция катаболизма гема происходит
при участии NADPH-зависимого ферментативного
комплекса гемоксигеназы. Ферментная
сисгема локализована в мембране ЭР, в
области электронтранспортных цепей
микросомального окисления. Фермент
катализирует расщепление связи между
двумя пиррольными кольцами, содержащих
винильные остатки, — таким образом,
раскрывается структура кольца (рис.
13-11). В ходе реакции образуются линейный
тетрапир-рол — биливердин(пигмент
жёлтого цвета) и монооксид углерода
(СО), который получается из углерода
метениловой группы. Гем индуцирует
транскрипцию гена гемоксигеназы,
абсолютно специфичной по отношению к
тему.
Ионы
железа, освободившиеся при распаде
гема, могут быть использованы для синтеза
новых молекул гемоглобина или для
синтеза других железосодержащих белков.
Биливердин восстанавливается до
билирубина NADPH-зависимым
ферментом биливердинредуктазой.Билирубин
образуется не только при распаде
гемоглобина, не также при катаболизме
других гемсодержащю белков, таких как
цитохромы и миоглобин. При распаде 1 г
гемоглобина образуется 35 мг билирубина,
а в сутки у взрослого человека — примерно
250-350 мг билирубина. Дальнейший метаболизм
билирубина происходит в печени
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Гемоглобин
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
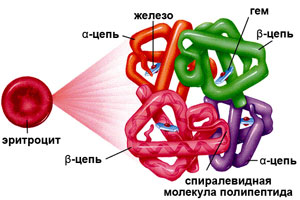 Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA — взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин | |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) — гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
Как же это происходит? Почему в легких гемоглобин забирает, а в тканях отдает кислород?
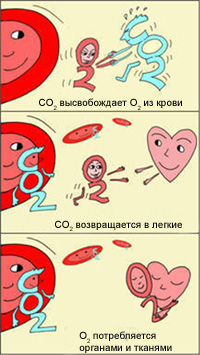 Эффект Бора
Эффект Бора
Эффект был описан датским физиологом Христианом Бором https://en.wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
Христиан Бор заявил, что при большей кислотности (более низкое значение рН, например, в тканях) гемоглобин будет меньше связываться с кислородом, что позволит его отдать.
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.
 Какой уровень гемоглобина в норме?
Какой уровень гемоглобина в норме?
В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
Заболевания, связанные с изменением количества или структуры гемоглобина
- Повышение уровня гемоглобина наблюдается при эритроцитозах, обезвоживании.
- Снижение уровня гемоглобина наблюдается при различных анемиях.
- При отравлении угарным газом образуется карбгемоглобин (не путайте с карбоксигемоглобином!), который не может присоединять кислород.
- Под действием некоторых веществ образуется метгемоглобин.
- Изменение структуры гемоглобина называется гемоглобинопатией. Самые известные и частые заболевания этой группы – серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина. См.гемоглобинопатии на сайте Всемирной организации здравоохранения https://www.who.int/mediacentre/factsheets/fs308/ru/index.html
Знаете ли Вы?
- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина – содержащий медь гемоцианин.

Другие статьи раздела
Распространенный возбудитель инфекций дыхательных путей (фарингиты, синуситы, отиты, бронхиты и пневмонии). Анализы на антитела используются для диагностики инфекции Chlamydophila pneumoniae при длительных инфекциях дыхательных путей.
Mycoplasma pneumoniae — возбудитель пневмонии человека, острых респираторных заболеваний (ОРЗ), заболеваний верхних дыхательных путей (фарингита, бронхита), а также некоторых нереспираторных заболеваний.
Азооспермия (azoospermia) — отсутствие сперматозоидов в эякуляте
Бактерии – одноклеточные микроорганизмы, некоторые из которых могут вызывать заболевания.
Mycoplasma pneumoniae (микоплазма пневмонии), Chlamydohpila pneumoniae (хламидофила пневмонии, прежнее название Chlamydia pneumoniae)
Гипофиз – непарная железа внутренней секреции, расположенная на основании головного мозга в костном кармане – гипофизарной ямке турецкого седла. Гипофиз вырабатывает гормоны, оказывающие влияние на работу всего организма – рост и развитие, обмен веществ, половую функцию.
Повышенный рост волос (гирсутизм) может быть следствием не только повышенного уровня андрогенов (см. «гиперандрогения»), но и высокой активности 5-альфа-редуказы в коже (фермента волосяных фолликулов, превращающего тестостерон в гораздо более активный дигидротестостерон.
По данным ВОЗ (Всемирная организация здравоохранения) заболеваемость в России составляет более 50 человек на 100 000 населения. Имеет важное значение то, что у женщин значительно чаще чем у мужчин (50-90% против 10%) возможно бессимптомное течение заболевания.
Делеция (ген.) – вид хромосомных мутаций, при котором происходит потеря какого-либо участка хромосомы.
Механизм обратной связи – система, которая используется организмом для контроля некоторых функций и поддержания состояния постоянства организма. Механизм обратной связи использует один из продуктов пути обмена веществ, обычно конечный продукт, для контроля активности пути обмена веществ и регуляции количества этого продукта. Обратная связь может быть отрицательной и положительной.
Источник
ГЕМОГЛОБИНОПАТИИ
Гемоглобинопатии (haemoglobinopathia, ед. ч.; гемоглобин + греч. pathos страдание, болезнь; син. гемоглобиноз) — группа наследственных заболеваний, обусловленных наличием в эритроцитах аномальных гемоглобинов либо угнетением синтеза полипептидных цепей нормальных гемоглобинов. К Гемоглобинопатиям причисляют как выраженные патологические состояния, протекающие чаще с гемолитической анемией (см.), так и многочисленные случаи латентного носительства аномальных гемоглобинов или генов талассемии (см.).
После работ Л. Полинга, Итано (H. A. Itano) и сотр. (1949), посвященных гемоглобину S, и открытий в области биохимической генетики Гемоглобинопатии стали рассматривать как разновидность молекулярной патологии. В 1950 г. Итано и Дж. Нил описали аномальный гемоглобин С, в 1951 г. Итано описал аномальный гемоглобин D. В 1954 г. гемоглобин E одновременно, но независимо друг от друга описали Чернов, Минних и Чонгчареонсук (А. I. Chernoff, V. Minnich, S. Chongchareonsuk) и Итано, Берджер, Стерджен (W. R. Berger, P. Sturgeon). Гемоглобин G описали Эдингтон (G. М. Edington) и Г. Леманн в 1954 г. Известны также аномальные гемоглобины H, I, J, К, L, M, N, О, P, Q и др.
В мире насчитывают ок. 100 млн. человек — носителей аномальных гемоглобинов, однако эти цифры следует, по-видимому, считать заниженными вследствие несовершенства методов выявления аномальных гемоглобинов и недостаточной информации о распространении Гемоглобинопатий в различных областях земного шара.
Географическое распространение
В распространении Гемоглобинопатий имеют значение такие факторы, как принадлежность к определенным расовым и этническим группам, частота браков между кровными родственниками, миграция населения, заболеваемость тропической малярией. Вариации в синтезе гемоглобина встречаются преимущественно у жителей стран Южной Европы (побережье Средиземного моря), Африки и Азии или у выходцев из этих стран, среди негритянского населения Северной и Южной Америки. Более распространены Г. в зоне так наз. малярийного пояса земного шара, т. е. тропической, и несколько меньше — в субтропической зоне. Встречаются они и в некоторых южных республиках СССР (Азербайджан, Таджикистан).
Серповидная аномалия эритроцитов наиболее распространена в тропической Африке, странах Средиземноморья, Ближнего и Среднего Востока, Индии. Полагают, что только в тропической Африке насчитывают до 40 млн. человек — носителей аномального гемоглобина S. Не менее частой является, по-видимому, и талассемия. Носительство аномальных гемоглобином С и E более локализовано. Гетерозиготных носителей аномального гемоглобина С — более 7 млн. в Западной Африке и ок. 0,5 млн. среди негров США. В Юго-Восточной Азии (Индокитай, Таиланд, Бирма, Индонезия, Индия, Бангладеш и юж. районы Китая) носителей аномального гемоглобина E более 30 млн. человек. Основной очаг аномального гемоглобина D находится в Северо-Западной Индии, где количество гетерозиготных носителей определяется в несколько миллионов человек. Единичные случаи описаны в Северной и Западной Африке, Малой Азии и среди негритянского населения США. Очаги (бета-талассемии и спорадические случаи гемоглобинопатий S, С, D, E и альфа-талассемии обнаружены среди населения Азербайджана, Таджикистана и некоторых районов Кавказа.
Этиология и патогенез
Аномалия гемоглобина может возникать либо в результате качественных изменений его первичной структуры и функции, либо количественного уменьшения синтеза нормальных цепей глобина (см. Гемоглобин, генетика гемоглобина). Известно свыше 250 аномальных гемоглобинов; теоретически в молекуле гемоглобина возможно более 4000 различных точковых мутаций [Бил (D. Beale), Г. Леманн, 1965], из которых с помощью современных методов могут быть дифференцированы с нормальным гемоглобином только ок. 1500. В это число включены мутации типа чистых аминокислотных замещений, при этом не рассматриваются возможные аномалии вследствие делеций (см.), расщепления полипептидных цепей и др.
Возникновение Гемоглобинопатий обусловлено мутацией на уровне структурных или регуляторных генов, управляющих синтезом полипептидных цепей глобина. Мутации на уровне структурных генов характерны для истинных Г.: серповидноклеточная анемия, С-, D-, E- и М-гемоглобинопатии и заболевания, обусловленные наличием нестабильных гемоглобинов. Мутации на уровне регуляторных генов обнаруживаются при талассемиях, гемоглобинопатиях H и Bart.
У гомозиготных носителей генов обычно продолжительность жизни эритроцитов с патологическим гемоглобином укорочена, а в некоторых случаях нарушен и эритропоэз. Гетерозиготные носители аномальных гемоглобинов, кроме гемоглобинов H и Bart, вариантов M-гемоглобинопатий, а также носители нестабильных гемоглобинов в обычных условиях жизни являются практически здоровыми людьми.
Большинство Г. наследуется в соответствии с законами Менделя по кодоминантному аутосомному типу, не сцепленному с полом.
Классификация гемоглобинопатий
Классификация гемоглобинопатий [по Гюнсу (E. R. Huehns) в модификации Ю. Н. Токарева] создана на основе результатов специальных биохимических и генетических исследований.
I. Гемоглобинопатии, обусловленные аномалией первичной структуры молекулы гемоглобина («качественные» Г.): 1) серповидноклеточная болезнь, ее варианты (S-гемоглобинопатии: S-талассемия, SD, SC и др.); 2) Lepore-гемоглобинопатия, возникающая вследствие расщепления частей бета- и дельта-цепей глобина; 3) Г. гомозиготные (С-, D- и Е-); 4) M-гемоглобинопатии; 5) Г., обусловленные наличием нестабильных гемоглобинов (гемоглобинов, неустойчивых к воздействию окислителей, нагреванию и др.); 6) Г. бессимптомные (G-гемоглобинопатии и др.).
II. Гемоглобинопатии, вызванные нарушением синтеза полипептидных цепей гемоглобинов («количественные» Г., или талассемии): 1) Г., вызванные нарушением синтеза α-цепи глобина (альфа-талассемия и заболевания, обусловленные наличием гемоглобинов H и Bart); 2) Г., вызванные нарушением синтеза β и δ-цепей глобина (β-талассемия, β,δ-талассемия); 3) бессимптомное наследственное персистирование фетального гемоглобина, т. е. генетически обусловленное увеличенное содержание гемоглобина F у взрослых.
III. Смешанная группа — двойные гетерозиготные состояния по гену талассемии и гену одной из «качественных» Г.
Клиническая картина
Клиническая картина отличается выраженным полиморфизмом. Для серповидноклеточной анемии (см.) и талассемии (см.) характерно развитие тяжелой гемолитической анемии. Ряд известных сейчас Г. клинически не проявляется; варианты гемоглобина при них скорее являются необычными (семейными), чем патологическими.
Lepore-гемоглобинопатия клинически сходна с талассемией.
Гомозиготная гемоглобинопатия C (CC) характеризуется легкой гемолитической анемией со спленомегалией, умеренной желтухой и билирубинемией, нормобластной гиперплазией костного мозга. В периферической крови множество мишеневидных клеток и выраженные морфологические изменения эритроцитов (анизо- и пойкилоцитоз, полихроматофилия), аномальный гемоглобин С составляет св. 90%, нормальный гемоглобин А отсутствует, содержание гемоглобина F в пределах нормы или несколько увеличено (5—7%). Гемолитические кризы с анемией возникают чаще у беременных женщин.
Гомозиготная гемоглобинопатия D (DD) протекает бессимптомно. В единичных случаях наличие аномального гемоглобина D (DD) может проявляться легкой анемией, микросфероцитозом эритроцитов, повышением осмотической резистентности, укорочением продолжительности жизни эритроцитов.
Гомозиготная гемоглобинопатия E (ЕЕ) по клиническому течению очень сходна с гомозиготной гемоглобинопатией С.
У больных М-гемоглобинопатиями ведущим клиническим признаком является врожденный цианоз вследствие повышенного метгемоглобинообразования (см. Метгемоглобинемия).
Для большинства вариантов Г., обусловленных наличием нестабильных гемоглобинов, характерны хроническая несфероцитарная гемолитическая анемия с периодическим выделением темной мочи (вследствие наличия в ней дипирролов) и выраженный полиморфизм клин, проявлений — от бессимптомных до тяжелых форм.
В мазках периферической крови — гипохромия и морфол, изменения эритроцитов — анизо- и пойкилоцитоз, мишеневидность, наличие телец Гейнца и базофильная пунктация (см. Эритроциты). Гемолиз внутриклеточного типа происходит преимущественно в селезенке, что клинически выражается спленомегалией. Другие признаки (ретикулоцитоз, повышение непрямого билирубина и др.) неспецифичны. Г., обусловленные нестабильными гемоглобинами, следует дифференцировать с гемолитическими и гипохромными анемиями другой этиологии и прежде всего с железо дефицитными анемиями. Ценными в диагностике последних являются пробы на термолабильность гемоглобина [Дейси (J. V. Dacie) с соавт., 1964], обнаружение телец Гейнца, выявление в моче дипирролов. Интенсивность аутогемолиза повышена, она уменьшается при добавлении к крови in vitro глюкозы [I тип гемолиза по Селвину (J. G. Selwyn) и Дейси]. Электрофорез гемоглобина не всегда позволяет выявить аномалию, т. к. некоторые нестабильные гемоглобины имеют нормальную (как у гемоглобина А) электрофоретическую подвижность.
Диагноз
Диагноз ставится на основании клинических и лабораторных признаков повышенного гемолиза (см.). Имеет значение выявление морфол, изменений эритроцитов. Подтверждается диагноз данными электрофореза гемоглобина (при структурных Г.: S, С, D, E и др.), пробой на щелочную устойчивость эритроцитов (при подозрении на наличие гемоглобина F), на стабильность гемоглобинов (при подозрении на наличие нестабильных гемоглобинов)
Лечение
Лечение больных Г. в основном симптоматическое, причем выбор метода зависит от степени активности и стадии развития (криз, ремиссия) заболевания. Могут быть применены методы терапии наследственных гемолитических анемий, однако с поправками и дополнениями, обусловленными особенностями данной разновидности аномального гемоглобина (изменения в обмене железа, наличие у некоторых больных гемолитического синдрома с признаками гиперспленизма). При Г. в период криза необходим постельный режим, диета, богатая белками и витаминами; гемотрансфузии (предпочтительна эритроцитарная масса) назначают при концентрации гемоглобина ниже 8—9 г%. Введение в организм препаратов, связывающих и экскретирующих железо (десферал и др.), целесообразно для профилактики гемосидероза.
Вопросы лечения гемолитических анемий, обусловленных нестабильными гемоглобинами, недостаточно изучены. Эффективны иногда стероидные гормоны. Показаниями к спленэктомии являются рефрактерность к обычным методам терапии, тяжелое течение заболевания с выраженным гемолизом, признаки гиперспленизма и секвестрации эритроцитов преимущественно в селезенке. В период ремиссии больные Гемоглобинопатией подлежат диспансерному наблюдению с санацией инфекционных очагов и своевременному лечению интеркуррентных инфекций. Наблюдение за больными должно быть усилено при беременности, в стрессовых ситуациях (хирургическая операция и др.).
Прогноз зависит от вида Г. и клинического течения заболевания.
Профилактика
Необходимы медико-генетические консультации с целью предупреждения браков между гетерозиготными носителями генов аномальных гемоглобинов или с целью предупреждения (при согласии родителей) рождения больного ребенка. Согласно рекомендациям ВОЗ в районах, эндемичных по аномальным гемоглобинам, должны быть созданы специализированные клиники (диспансеры) с медико-генетическими консультациями. Такие центры в СССР созданы при институтах гематологии и переливания крови (Москва, Баку, Ташкент, Тбилиси).
Гемоглобинопатии у детей протекают тяжело, особенно гомозиготные формы — серповидноклеточная анемия, большая талассемия. Диагностируются начиная с шестимесячного возраста, т. е. в период замены гемоглобина F гемоглобином А.
Физическое развитие больных Г. детей замедляется. Характерен их внешний вид, обусловленный изменением костей и увеличением живота за счет гепатоспленомегалии.
Лечение
Дети, больные серповидноклеточной анемией, нуждаются в гемотрансфузиях при уменьшении уровня гемоглобина ниже 8— 9 г%. Больным талассемией переливают эритроцитарную массу даже при незначительном уменьшении содержания гемоглобина.
Больные Гемоглобинопатией дети подлежат диспансерному наблюдению гематолога, плановой иммунизации, им профилактически вводят гамма-глобулин й назначают препараты фолиевой к-ты для предупреждения ее дефицита в организме. В лечении (и профилактике кризов) Г. у детей большое значение имеет осведомленность родителей о природе Г. и их контакт с врачом.
Прогноз
Без надлежащего ухода и лечения большинство больных детей погибает в возрасте 2—5 лет. Особенно тяжело протекают Г. при сочетании их с нарушениями питания (белково-калорийная недостаточность, Квашиоркор и др.) и присоединении интеркуррентных инфекций (корь, пневмония, острые респираторные заболевания).
Библиография: Алексеев Г. А. и Токарев Ю. Н. Гемоглобинопатии, М., 1969; Эфроимсон В. П. Иммуногенетика, с. 161, М., 1971; Beale D. a. Lehmann H. Abnormal haemoglobins and the genetic code, Nature (Lond.), v. 207, p. 259, 1965; Hutchison H. E. An introduction to the haemoglobinopathies and the methods used for their recognition, L., 1967; Jonxis J. H. P. a. Huisman Т. H. J. A laboratory manual on abnormal haemoglobins, Oxford, 1968; Lehmann H. a. Huntsman R. G. Man’s haemoglobins, Philadelphia, 1974; Necheles T. F., Allen D. M. a. Finkel H. E. Clinical disorders of hemoglobin, structure and synthesis, N. Y., 1969; Treatment of haemoglobinopathies and allied disorders, techn. rep. ser. № 509, Geneva, WHO, 1972.
Ю. H. Токарев.
Источник