Этапы биосинтеза холестерина в организме
Содержание статьи
Синтез холестерола должен быть согласован с его выведением
Синтез холестерола в организме составляет примерно 0,5-0,8 г/сут, примерно 50% образуется в печени, около 15% в кишечнике. Все клетки организма способны синтезировать холестерол. Поступление с пищей составляет около 0,4 г/сут.
Единственным реальным способом выведения холестерола является желчь – до 1 г/сут.
Биосинтез холестерола
Биосинтез холестерола происходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА, поступающий сюда из митохондрий в составе цитрата, также как при синтезе жирных кислот. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН.
Образование холестерола идет более чем в 30 реакциях, которые можно сгруппировать в несколько этапов.
1. Синтез мевалоновой кислоты.
Первые две реакции синтеза совпадают с реакциями кетогенеза, но после синтеза 3-гидрокси-3-метилглутарил-SКоА вступает в действие фермент гидроксиметил-глутарил-SКоА-редуктаза (ГМГ-SКоА-редуктаза), образующая мевалоновую кислоту.
2. Синтез изопентенилдифосфата. На этом этапе при использовании АТФ мевалоновая кислота трижды фосфорилируется. Затем промежуточный продукт декарбоксилируется и дефосфорилируется с получением изопентенилдифосфата.
3. После объединения трех молекул изопентенилдифосфата (если не считать промежуточных превращений) синтезируется фарнезилдифосфат.
4. Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата.
5. После сложных реакций линейный сквален циклизуется в ланостерол.
6. Удаление лишних метильных групп, восстановление и изомеризация молекулы приводит к появлению холестерола.
Регуляция синтеза
Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза, активность которой может изменяться в 100 и более раз.
1. Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. Это помогает поддерживать внутриклеточное содержание холестерола постоянным.
2. Регуляция транскрипции гена ГМГ-SКоА-редуктазы (в печени) – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента.
3. Ковалентная модификация при гормональной регуляции:
- Инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние.
Важным следствием такой регуляции является активация кетогенеза при отсутствии инсулина.
- Глюкагон и адреналин посредством аденилатциклазного механизма активируют протеинкиназу А, которая фосфорилирует фермент и переводит его в неактивную форму.
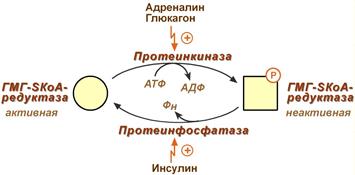
Регуляция активности гидроксиметилглутарил-S-КоА-редуктазы
Кроме указанных гормонов, на ГМГ-SКоА-редуктазу действуют эстрогены и тиреоидные гормоны (повышают активность) и глюкокортикоиды (снижают активность).
Изменение транскрипции гена ГМГ-КоА редуктазы (генетическая регуляция) осуществляется стерол-регулируемым элементом в ДНК (SREBP, sterol regulatory element-binding protein) с которым способны связываться белки — факторы SREBP. Эти факторы при достаточном количестве холестерина в клетке закреплены в мембране ЭПР. Когда уровень холестерина падает, факторы SREBP активируются под действием специфичных протеаз комплекса Гольджи, передвигаются в ядро, взаимодействуют на ДНК с участком SREBP и стимулируют биосинтез холестерина.
Скорость биосинтеза холестерола также зависит от концентрации специфического белка-переносчика, обеспечивающего связывание и транспорт гидрофобных промежуточных метаболитов синтеза.
Источник
биохимия, обмен и его регуляция
В организме человека происходит ежеминутно много биохимических реакций и обменных процессов. Метаболизм не останавливается ни на секунду.
Многие биохимические процессы возглавляют клетки печени, и несут за них ответственность. Основная функция клеток печени — это синтез холестерола.
От данного процесса зависит выработка стероидного типа половых гормонов, преобразование солнечной энергии в витамин Д, и транспортировка питания во все клетки организма при помощи холестериновых молекул.
В чем суть процесса выработки молекул холестерина?
Многие продукты питания наполняют организм холестерином — это продукты животного происхождения, а также транс-жиры, которые находятся в большом количестве в полуфабрикатах промышленного производства, а также в продуктах быстрого питания (фаст-фудах).
Если употреблять такие продукты безмерно, тогда концентрация в составе крови молекул холестерина станет высокой и придётся прибегать к медикаментозному решению гиперхолестеринемии.
Холестерин, который попадает в организм с продуктами питания, имеет низкую молекулярную плотность, что и привод к оседанию такого холестерина на внутренних оболочках сосудов, что провоцирует развитие холестериновой бляшки и патологии атеросклероз.
Повышение индекса холестерина в составе крови происходит не только по причине попадания его извне, но и от нарушения в процессе синтезирования молекул липопротеидов клетками печени.
Синтез холестеринак содержанию ↑
Синтез холестерола в печени
Синтез холестерола в составе организма составляет приблизительно 0,50 -0,80 грамм в сутки.
Распределяется синтез молекул холестерина в организме:
- 50,0% вырабатывается клетками печени;
- 15,0% — 20,0% — отделами тонкого кишечника;
- 10,0% — синтезируется корой надпочечников и клетками кожных покровов.
Все клетки в человеческом организме имеют способность к синтезу липопротеидов.
С продуктами питания поступает в организм молекулы холестерина до 20,0% от всего общего объема — приблизительно 0,40 грамм в сутки.
Выводится за пределы организма липопротеиды при помощи жёлчной кислоты, и в сутки утилизация молекул холестерола жёлчью — не больше, чем 1,0 грамм.
к содержанию ↑
Биосинтез липопротеидов в составе организма
Биосинтез молекул липидов происходит в эндоплазматическом отделе — ретикулуме. Основой для всех атомов молекул углерода является вещество ацетил-SКоА, которое поступает в эндоплазму из митохондрий в молекулах цитрата.
При биосинтезе молекул липопротеидов принимают участие 18 молекул АТФ, а также участниками синтеза становятся 13 молекул НАДФН.
Процесс образования холестерина проходит не менее 30 этапов и реакций в организме.
Поэтапный синтез липопротеидов можно распределить по группам:
вставить активная подсказка — уровень сахара
- Синтез мевалоновой кислоты происходит в процессе кетогенеза первых двух реакций, а после третьего этапа идёт реакция 3-гидрокси-3-метилглутарил-SКоА с молекулой ГМГ-SКоА-редуктазы. От этой реакции и происходит синтезирование мевалонат. Для этой реакции необходимо достаточного количества глюкозы в составе крови. Восполнить ее можно при помощи сладких продуктов и злаковых культур;
- Синтез изопентенилдифосфата происходит после присоединения фосфата к молекулам мевалоновой кислоты и их дегидрации;
- Синтез фарнезилдифосфат происходит после соединения трёх молекул изопентенилдифосфата;
- Синтезирование сквалена — это связывание 2-х молекул фарнезилдифосфата;
- Происходит реакция перехода сквалена в молекулу ланостерола;
- После удаления ненужных метильных групп и происходит преобразование холестерола.
к содержанию ↑
Регуляция процесса синтеза липопротеидов
Регуляторным элементом в процессе синтеза является фермент гидроксиметилглутарил-SКоА-редуктазы. Способность данного фермента изменять активность более чем в 100 раз.
Регуляция активности фермента происходи по нескольким принципам:
- Регуляция синтезирования на метаболическом уровне. Данный принцип работает «от обратного», фермент ингибируется холестеролом, что дает возможность поддерживать постоянное внутриклеточное его содержание;
- Ковалентная гормональная регуляция.
Регуляция на гормональном уровне происходит по таким этапам:
- Повышение содержания в организме гормона инсулина, активирует протеин-фосфатазу, что провоцирует увеличение активности главного фермента ГМГ-SКоА-редуктазы;
- Гормон глюкагон и гормон адреналин имеют свойства активировать элемент протеинкиназы А, которая фосфорилирует фермент ГМГ-SКоА-редуктазы и снижает их активность;
- Активность синтезирования холестерола зависит от концентрации в составе крови специального белка-транспортировщика, что своевременно связывает промежуточные реакции метаболитов.
Регуляция активности гидроксиметилглутарил-S-КоА-редуктазык содержанию ↑
Использование холестерина организмом
Синтезируемый в клетках печени холестерин, необходим организму для различных жизненно важных процессов:
- Находясь в каждой мембране клеток, молекулы холестерина укрепляют их и делают эластичными;
- При помощи липопротеинов, сосудистые оболочки увеличивают свою проницаемость, что защищает их от внешнего воздействия;
- Без помощи липопротеидов надпочечники не производят выработку стероидного типа половых гормонов;
- При помощи липидов происходит продуцирование желчной кислоты и предотвращает желчный пузырь от камнеобразования в нем;
- Липопротеиды связывают между собой клетки нейронов в спинном и в головном мозге;
- При помощи липопротеидов происходит укрепление оболочки нервных волокон;
- С помощью холестерола происходит выработка витамина Д, что помогает усваиваться кальцию и предотвращает разрушение костных тканей.
Холестерол помогает производить надпочечниками синтез таких групп гормонов:
- Группа кортикостероидов;
- Группа гормонов глюкокортикоидов;
- Группа минералокортикоидов.
Холестерол помогает производить надпочечниками синтез групп гормонов
Данные гормоны обеспечивают процессы гормонального регулирования репродуктивных органов человека.
Молекулы холестерина после синтеза в клетках печени попадают в эндокринный орган надпочечники и способствуют выработке гормонов и поддержанию баланса в гормональной сфере.
к содержанию ↑
Выработка молекул витамина Д происходит от солнечного света, который проникает в холестерин, находящийся под кожей. В этот момент и происходит синтез витамина Д, который очень важен для усваивания организмом минералов кальция.
Все виды липопротеидов, после синтеза транспортируются по организму системой кровотока.
Витамин Д может преобразовываться только липопротеидами высокой молекулярной плотности, а низкомолекулярные липиды становятся причиной развития патологии атеросклероз, потому что имеют свойства оседать на внутренних оболочках артерий в виде холестериновых бляшек, которые разрастаясь и провоцируют данную патологию.
Иногда холестериновые бляшки можно наблюдать у человека под кожными покровами на кистях рук.
Метаболизм витамина Дк содержанию ↑
Нарушения в процессе синтеза липопротеидов
Во многих обменных процессах в организме может произойти сбой и нарушение. Такие нарушения могут произойти и в липидном обмене. Причин достаточно много и они имеют экзогенную и эндогенную этиологию.
К эндогенным причинам нарушения синтеза липопротеидов относятся:
- Возраст человека. После 40 лет в организме человека происходит затухание выработки половых гормонов и нарушается гормональный фон, а также к 45 — 50 годам происходит замедление всех обменных процессов, что может внести разлад и в липидный обмен;
- Половой признак — мужчины больше подвержены накапливанию холестерина, чем женщины. Женщины до климактерического периода и менопаузы, защищены выработкой половых гормонов, от накопления липопротеинов;
- Генетическая наследственная предрасположенность. Развитие семейной гиперхолестеремии.
К экзогенным причинам липидного сбоя относятся факторы, что зависят от стиля жизни больного, а также сопутствующие патологии, способствующие нарушению в синтезе молекул холестерина:
- Никотиновая зависимость;
- Хроническая алкогольная зависимость;
- Неправильное питание может привести к повышенному содержанию в организме холестерина и накопления его не только в составе крови;
- Малоподвижный образ жизни становится причиной замедленных обменных процессов и синтеза липопротеидов;
- Гипертоническая болезнь — высокое давление в системе кровотока дает предпосылки тому, чтобы сосудистые оболочки пропитывались липидными жирами, которые впоследствии формируют холестериновую бляшку;
- Заболевание дислипидемия — это нарушение в липидном обмене. При патологии происходит дисбаланс между липопротеидами ВП, липидами НП, а также уровень содержания в составе крови триглицеридов;
- Патология ожирение;
- Сахарный диабет. При гипергликемии нарушается метаболизм и обмен липидами.
Патология ожирениек содержанию ↑
Дефицит в организме молекул полезного холестерола
Существуют патологии, которые снижают концентрацию высокомолекулярного холестерина в составе крови по причине снижения синтеза молекул ЛПВП.
Это может привести к патологиям в щитовидной железе, может значительно повлиять на уровень сахара в составе крови и спровоцировать сахарный диабет, а также стать причиной многих заболеваний системы кровотока и сердечного органа.
Последствиями низкой концентрации высокомолекулярного холестерина могут быть:
- Патология рахит, которая развивается в детском возрасте по причине сниженного синтеза витамина Д и не усвояемости молекул кальция;
- Раннее старение клеток организма. Без своевременной подачи холестерина в клеточные мембраны, происходит их разрушение и запускается процесс старения;
- Резкое снижение массы тела, которое происходит от недостаточного синтеза молекул холестерина, и нарушения в липидном обмене;
- Болезненность в мышечных тканях от недостатка в клетках мышц липидов;
- Боли в сердечном органе, что могут спровоцировать сердечный приступ.
Откорректировать индекс высокомолекулярного холестерина можно при помощи диетического питания, в состав которого входит морская рыба, различные растительные масла, а также кисломолочная продукция.
И не стоит забывать о свежих фруктах, зелени и овощах — они должны преобладать в рационе диеты.
к содержанию ↑
Фотогалерея: Недостаток полезного холестерина
к содержанию ↑
Превышение нормы липопротеидов
Если в человеческом организме происходит усиленный синтез высокомолекулярного липопротеида, тогда это также может негативно сказаться на здоровье.
Повышенная концентрация грозит развитием таких патологий:
- Развивается цирроз клеток печени;
- Риск развития гепатита;
- Увеличение массы тела;
- Нарушение во всем обмене липидов;
- Процессы воспаления в системе кровотока, а также в печеночном органе.
Также от переизбытка молекул холестерина ЛПВП и ЛПНП происходит оседание молекул на стенках артериальных оболочек, образуя холестериновые бляшки, которые влияют на движение крови в русле, по причине сужения артериального просвета.
Также от нарушения в синтезе холестерола, происходит неправильная работа желчного органа, что приводит к камнеобразованию в нем.
к содержанию ↑
Видео: Холестерин — бомба замедленного действия!
к содержанию ↑
Заключение
Синтез холестерола в печени — это очень сложный процесс, который происходит в организме постоянно и не прерываясь.
Если происходят нарушения в липидном обмене, или в процессе синтезирования липопротеидов, тогда существует высокий риск развития патологии атеросклероз, которая прогрессируя, приводит к более тяжелым заболеваниям, что могут спровоцировать преждевременную смерть.
Нарушения в липидном обмене, также влияют на работу сердечного органа и на функциональность клеток печени.
Постоянная корректировка холестерина при помощи диеты, позволит поддерживать липидный обмен в пределах нормы.
Загрузка…
Источник
Основные этапы биосинтеза холестерина
Реакции синтеза мевалоновой кислоты
Схема реакций синтеза холестерола
2. Синтез изопентенилдифосфата . На этом этапе при использовании АТФ мевалоновая кислота трижды фосфорилируется. Затем промежуточный продукт декарбоксилируется и дефосфорилируется с получением изопентенилдифосфата.
3. После объединения трех молекул изопентенилдифосфата (если не считать промежуточных превращений) синтезируется фарнезилдифосфат .
4. Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата.
5. После сложных реакций линейный сквален циклизуется в ланостерол .
6. Удаление лишних метильных групп, восстановление и изомеризация молекулы приводит к появлению холестерола .
Регуляция синтеза
Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза , активность которой может изменяться в 100 и более раз.
1. Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. Это помогает поддерживать внутриклеточное содержание холестерола постоянным.
2. Регуляция транскрипции гена ГМГ-SКоА-редуктазы (в печени) – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента.
3. Ковалентная модификация при гормональной регуляции:
- Инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние.
- Глюкагон и адреналин посредством аденилатциклазного механизма активируют протеинкиназу А, которая фосфорилирует фермент и переводит его в неактивную форму.
Регуляция активности гидроксиметилглутарил-S-КоА-редуктазы
Кроме указанных гормонов, на ГМГ-SКоА-редуктазу действуют тиреоидные гормоны (повышают активность) и глюкокортикоиды (снижают активность).
Изменение транскрипции гена ГМГ-КоА редуктазы (генетическая регуляция) осуществляется стерол-регулируемым элементом в ДНК (SREBP, sterol regulatory element-binding protein) с которым способны связываться белки — факторы SREBP. Эти факторы при достаточном количестве холестерина в клетке закреплены в мембране ЭПР. Когда уровень холестерина падает, факторы SREBP активируются под действием специфичных протеаз комплекса Гольджи, передвигаются в ядро, взаимодействуют на ДНК с участком SREBP и стимулируют биосинтез холестерина.
Скорость биосинтеза холестерола также зависит от концентрации специфического белка-переносчика, обеспечивающего связывание и транспорт гидрофобных промежуточных метаболитов синтеза.
источник
Основные этапы биосинтеза холестерина
Холестерин — важная составная часть клеточных мембран животных клеток (см. с. 218). Суточная потребность в холестерине (1 г) может в принципе покрываться за счет биосинтеза . При смешанной диете примерно половина суточной нормы холестерина синтезируется в кишечнике, коже и главным образом в печени (примерно 50%), а остальной холестерин поступает с пищей. Значительная часть холестерина включена в липидный слой плазматических мембран. Большое количество холестерина расходуется в биосинтезе желчных кислот (см. с. 306), часть выделяется с желчью. Ежесуточно из организма выводится примерно 1 г холестерина. Очень небольшая часть холестерина используется для биосинтеза стероидных гормонов (см. с. 364).
Биосинтез холестерина, кап и всех изопреноидов, начинается с ацетил-КоА (см. с. 58). Углеродный скелет С 27 -стерина строится из С 2 -звеньев в длинной и сложной последовательности реакций. Биосинтез холестерина можно разделить на четыре этапа. На первом этапе ( 1 ) из трех молекул ацетил-КоА образуется мевалонат (С 6 ). На втором этапе ( 2 ) мевалонат превращается в «активный изопрен», изопентенилдифосфат . На третьем этапе ( 3 ) шесть молекул изопрена полимеризуются с образованием сквалена (С 30 ). Наконец, сквален циклизуется с отщеплением трех атомов углерода и превращается в холестерин ( 4 ). На схеме представлены только наиболее важные промежуточные продукты биосинтеза.
1. Образование мевалоната. Превращение ацетил-КоА в ацетоацетил-КоА и затем в З-гидрокси-З-метилглутарил-КоА (3-ГМГ-КоА) соответствует пути биосинтеза кетоновых тел (подробно см. рис. 305), однако этот процесс происходит не в митохондриях, а в эндоплазматическом ретикулуме (ЭР). 3-ГМГ-КоА восстанавливается с отщеплением кофермента А с участием 3-ГМГ-КоА-редуктазы , ключевого фермента биосинтеза холестерину (см. ниже). На этом важном этапе путем репрессии биосинтеза фермента (эффекторы: гидроксистерины), а также за счет взаимопревращения молекулы фермента (эффекторы: гормоны) осуществляется регуляция биосинтеза холестерина. Например, фосфорилированная редуктаза представляет собой неактивную форму фермента; инсулин и тироксин стимулируют фермент, глюкагон тормозит; холестерин, поступающий с пищей, также подавляет 3-ГМГ-КоА-редуктазу.
2. Образование изопентенилдифосфата. Мевалонат за счет декарбоксилирования с потреблением АТФ превращается в изопентенилдифосфат , который и является тем структурным элементом, из которого строятся все изопреноиды (см. рис. 59).
3. Образование сквалена. Изопентенилдифосфат подвергается изомеризации с образованием диметилаллилдифосфата. Обе С 5 -молекулы конденсируются в геранилдифосфат и в результате присоединения следующей молекулы изопентенилдифосфата образуют фарнезилдифосфат. При димеризации последнего по типу « голова к голове » образуется сквален. Фарнезилдифосфат является также исходным соединением для синтеза других полиизопреноидов, таких, как долихол и убихинон (см. с. 58).
4. Образование холестерина. Сквален, линейный изопреноид, циклизуется с потреблением кислорода в ланостерин, С 30 -стерин, от которого на последующих стадиях, катализируемых цитохромом Р450 , отщепляются три метильные группы, вследствие чего образуется конечный продукт — холестерин.
Описанный путь биосинтеза локализован в гладком ЭР. Синтез идет за счет энергии, освобождающейся при расщеплении производных кофермента А и энергетически богатых фосфатов. Восстановителем при образовании мевалоната и сквалена, а также на последних стадиях биосинтеза холестерина является НАДФН + Η + . Для этого пути характерно то, что промежуточные метаболиты можно подразделить на три группы: производные кофермента А, дифосфаты и высоко липофильные соединения (от сквалена до холестерина), связанные с переносчиками стеринов.
источник
холестериды, всасывание холестерина
Переваривание холестеридов и всасывание холестерина. Понятие об экзогенном и эндогенном холестерине.
Холестерин в организме человека бывает 2 видов:
1) холестерин, поступающий с пищей через ЖКТ и называемый экзогенный
2) холестерин, синтезируемый из Ац – КоА — эндогенный.
С пищей ежедневно поступает ≈ 0,2 – 0,5 г, синтезируется ≈ 1 г (почти все клетки за исключением эритроцитов синтезируют холестерин, 80% холестерина синтезируется в печени.)
Взаимоотношения экзо и эндогенного холестерина в определенной степени конкурентные – холестерин пищи ингибирует его синтез в печени.
В составе пищи холестерин находится в основном в виде эфиров. Гидролиз эфиров холестерола происходит под действием холестеролэстеразы. Продукты гидролиза всасываются в составе смешанных мицелл.
Всасывание холестерина происходит в основном в тощей кишке (пищевой холестерин всасывается почти полностью – если в пище его не очень много)
Всасывание холестерина осуществляется только после эмульгирования эфиров холестерина. Эмульгаторами являются желчные кислоты, моно- и диглицериды и лизолецитины. Холестериды гидролизуются холестеринэстеразой поджелудочной железы.
Пищевой и эндогенный холестерин находится в просвете кишечника в неэстерифицированной форме в составе сложных мицелл (желчные, жирные кислоты, лизолецитин), причем поступают в состав слизистой кишечника не вся мицелла целиком, а ее отдельные фракции.
Поглощение холестерина из мицелл – пассивный процесс, идущий по градиенту концентрации. Поступивший в клетки слизистой холестерин этерифицируется холестеринэстеразой или АХАТ (у человека это в основном олеиновая кислота). Из клеток слизистой кишечника холестерин поступает в лимфу в составе ХМ, из них он переходит в ЛНП и ЛВП. В лимфе и крови 60-80% всего холестерина находится в этерифицированном виде.
Процесс всасывания холестерина из кишечника зависит от состава пищи: жиры и углеводы способствуют его всасыванию, растительные стероиды (структурные аналоги) блокируют этот процесс. Большое значение принадлежит желчным кислотам (все функции активируют – улучшают эмульгирование, всасывание). Отсюда значение лекарственных веществ, блокирующих всасывание желчных кислот.
Основные этапы синтеза холестерина. Химизм реакции образования мевалоновой кислоты. Ключевой фермент синтеза холестерина. Представьте схематически скваленовый путь синтеза холестерина
Ключевой фермент биосинтеза холестерина — ГМГ-редуктаза
Реакции синтеза холестерола происходят в цитозоле клеток. Это один из самых длинных метаболических путей в организме человека.
1 этап-Образование мевалоната
Две молекулы ацетил-КоА конденсируются ферментом тиолазой с образованием ацетоацетил-КоА.
Фермент гидроксиметилглутарил-КоА-синтаза присоединяет третий ацетильный остаток с образованием ГМГ-КоА (3-гидрокси-3-метилглутарил-КоА).
Следующая реакция, катализируемая ГМГ-КоА-редуктазой, является регуляторной в метаболическом пути синтеза холестерола. В этой реакции происходит восстановление ГМГ-КоА до мевалоната с использованием 2 молекул NADPH. Фермент ГМГ-КоА-редуктаза — гликопротеин, пронизывающий мембрану ЭР, активный центр которого выступает в цитозоль.
2 этап — Образование сквалена
На втором этапе синтеза мевалонат превращается в пятиуглеродную изопреноидную структуру, содержащую пирофосфат — изопентенилпирофосфат. Продукт конденсации 2 изопреновых единиц — геранилпирофосфат. Присоединение ещё 1 изопреновой единицы приводит к образованию фарнезилпирофосфата — соединения, состоящего из 15 углеродных атомов. Две молекулы фарнезилпирофосфата конденсируются с образованием сквалена — углеводорода линейной структуры, состоящего из 30 углеродных атомов.
3 этап — Образование холестерола
На третьем этапе синтеза холестерола сквален через стадию образования эпоксида ферментом циклазой превращается в молекулу ланостерола, содержащую 4 конденсированных цикла и 30 атомов углерода. Далее происходит 20 последовательных реакций, превращающих ланостерол в холестерол. На последних этапах синтеза от ланостерола отделяется 3 атома углерода, поэтому холестерол содержит 27 углеродных атомов.
Биологическая роль холестерина. Пути использования холестерина в различных тканях. Биосинтез желчных кислот.
Часть холестеринового фонда в организме постоянно окисляется, преобразуясь в различного рода стероидные соединения. Основной путь окисления холестерина — образование желчных кислот. На эти цели уходит от 60 до 80% ежедневно образующегося в организме холестерина. Второй путь — образование стероидных гормонов (половые гормоны, гормоны коры надпочечников и др.). На эти цели уходит всего 2-4% холестерина, образующегося в организме. Третий путь — образование в коже витамина ДЗ под действием ультрафиолетовых лучей.
Еще одним производным холестерина является холестанол. Его роль в организме пока еще не выяснена. Известно лишь, что он активно накапливается в надпочечниках и составляет 16% от всех находящихся там стероидов. С мочой у человека выделяется около 1 мг холестерина в сутки, а со слущивающимся эпителием кожи теряется до 100 мг/сут.
Желчные кислоты являются основным компонентом билиарной секреции, они образуются только в печени. Синтезируются в печени из холестерина.
В организме синтезируется за сутки 200-600 мг желчных кислот. Первая реакция синтеза-образование 7-альфа-гидроксихолестерола-является регуляторной.Фермент-7-альфа-гидроксилаза,ингибируется конечным продуктом-желчными кислотами.7-альфа-гидроксилаза представляет собой одну из форм цитохрома п450 и использует атом кислорода как один из субстратов. Один атом кислорода из О2 включается в гидроксильную группу в 7 положении, а другой восстанавливается до воды. Последующие реакции синтеза приводят к формированию 2 видов желчных кислот:холевой и хондезоксихолевой(первичные желчные кислоты)
Особенности обмена холестерина в организме человека. Роль липопротеинлипазы, печеночной липазы, липопротеинов, ЛХАТ, апопротеинов в транспорте холестерина в крови: альфа- и бета-холестерин, коэффициент атерогенности, АХАТ, накопление холестерина в тканях. Пути распада и выведения холестерина
В организме человека содержится 140-190 г холестерина и около 2 г образуется ежедневно из жиров,углеводов, белков. Чрезмерное поступление холестерина с пищей приводит к отложению его в сосудах и может способствовать развитию атеросклероза, а также нарушению функции печени и развитию желчно-каменной болезни. Ненасыщенные жирные кислоты ( линолевая, линоленовая) затрудняют всасывание холестерина в кишечнике, тем самым способствуя уменьшению его содержания в организме. Насыщенные жирные кислоты (пальмитиновая, стеариновая) являются источником образования холестерина.
Липопротеинлипаза (ЛПЛ) — фермент, относящийся к классу липаз. ЛПЛ расщепляет триглицериды самых крупных по размеру и богатых липидами липопротеинов плазмы крови — хиломикронов и липопротеинов очень низкой плотности (ЛПОНП или ЛОНП)). ЛПЛ регулирует уровень липидов в крови, что определяет её важное значение в атеросклерозе.
Печёночная липаза — один из ферментов липидного метаболизма. Эта липаза по ферментативному действию похожа на панкреатическую липазу. Однако в отличие от панкреатической липазы ПЛ синтезируется в печени и секретируется в кровь. Печёночная липаза после секреции связывается со стенкой сосуда (почти исключительно в печени) и расщепляет липиды липопротеинов.
Печёночная липаза работает в кровотоке в тандеме с липопротеинлипазой. Липопротеинлипаза расщепляет липопротеины, богатые триглицеридами (липопротеины очень низкой плотности и хиломикроны), до их остатков. Остатки липопротеинов являются в свою очередь субстратом для печёночной липазы. Таким образом, в результате действия печёночной липазы образуются атерогенные липопротеины низкой плотности, которые поглощаются печенью.
(ЛВП) — Транспорт холестерина от периферийных тканей к печени
(ЛНП) — Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
ЛПП (ЛСП) — Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
(ЛОНП)-Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
Хиломикроны -Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень
Лецитинхолестеринацилтрансфераза (ЛХАТ)- является ферментом метаболизма липопротеинов. ЛХАТ связан с поверхностью липопротеинов высокой плотности, которые содержат аполипопротеин A1 — активатор этого фермента. Холестерин, превращённый в эфиры холестерина, благодаря высокой гидрофобности перемещается с поверхности липопротеина в ядро, освобождая место на поверхности частицы для захвата нового свободного холестерина. Таким образом, эта реакция является исключительно важной для процесса очищения периферических тканей от холестерина (обратный транспорт холестерина). Частица ЛПВП в результате увеличивается в диаметре или в случае насцентных ЛПВП превращается из дисковидной в сферическую.
Апопротеины формируют структуру липоппротеинов,взаимодействуют с рецепторами на поверхности клеток и таким образом определяют какими тканями будет захватываться данный тип липопротеидов, служат ферментами или активаторами ферментов, действующих на липопротеины.
АХАТ катализирует эстерификацию холестерола . Свободный холестерол выходит в цитоплазму , где ингибирует ГМГ-CoA-редуктазу и de novo синтез холестерола и активирует АХАТ . У человека, однако, из-за низкой активности АХАТ в печени холестерол поступает в плазму в составе ЛПОНП преимущественно в свободном виде.
Нарушение обмена холестерола и холестеридов проявляется прежде всего накоплением их в тканях (кумулятивные холестерозы), особенно в стенке артерий и в коже. Основной причиной накопления холестерола в тканях является недостаточность механизма его обратного транспорта. Ключевым фактором системы обратного транспорта холестерола (с периферии в печень, откуда его излишки удаляются из организма с желчью) являются липопротеины высокой плотности, точнее входящий в их состав белок апопротеин А. Частицы липопротеинов высокой плотности собирают холестерол не только в интерстициальном секторе, но и внутри клеток. У человека (а также высших обезьян и свиней) существует видовая (характерная для всех представителей вида) недостаточность апопротеина А и, соответственно, липопротеинов высокой плотности. Животные с высоким содержанием этих липопротеинов не страдают холестериновым диатезом, даже при постоянном употреблении богатой холестеролом пищи. Некоторые люди также отличаются довольно высокой концентрацией апопротеина А («синдром долголетия»).
Из организма человека ежедневно выводится около 1 г холестерола. Приблизительно половина этого количества экскретируется с фекалиями после превращения в желчные кислоты . Оставшаяся часть выводится в виде нейтральных стероидов. Большая часть холестерола, поступившего в желчь, реабсорбируется; считается, что по крайней мере часть холестерола, являющегося предшественником фекальных стеролов , поступает из слизистой оболочки кишечника . Основным фекальным стеролом является копростанол , который образуется из холестерола в нижнем отделе кишечник а под действием присутствующей в нем микрофлоры . Значительная доля солей желчных кислот , поступающих с желчью, всасывается в кишечнике и через воротную вену возвращается в печень , где снова поступает в желчь. Этот путь транспорта солей желчных кислот получил название кишечно-печеночной циркуляции . Оставшаяся часть солей желчных кислот, а также их производные выводятся с фекалиями. Под действием кишечных бактерий первичные желчные кислоты превращаются во вторичные.
источник
Adblock
detector
Источник