Как холестерин попадает в печень
Содержание статьи
Как связаны функции печени и холестерин?
Автор Хусаинов Руслан Халилович На чтение 3 мин. Опубликовано 19.06.2018 15:19 Обновлено 19.06.2018 15:19
Большая часть холестерина вырабатывает печень и он необходим для нашего здоровья. Но некоторые формы холестерина могут вызывать проблемы со здоровьем, включая повреждение печени.
Холестерин — жировая молекула, которая содержится в некоторых продуктах, а также в печени. Существуют два основных типа холестерина: липопротеины высокой плотности (ЛПВП) и липопротеины низкой плотности (ЛПНП) .
- ЛПНП должен быть менее 100 мг / дл
- ЛПВП должен составлять более 40 мг / дл
ЛПВП переносится из клеток организма в печень. Печень расщепляет их или выводит из организма в виде отходов.
Эта функция полезна для организма, поэтому ЛПВП иногда называют «хорошим холестерином».
ЛПНП переносятся из печени в клетки. Клетки используют холестерин, но слишком много его остается в артериях. Это может вызвать проблемы со здоровьем, поэтому врачи иногда называют ЛПНП «плохим холестерином».
Холестерин может накапливаться в артериях, в результате чего просвет их сужается, что ограничивает подачу крови и кислорода в органы. Сужение просвета артерий также увеличивает риск образования тромбов. Если кровоток к сердцу ограничен, то это может увеличить риск развития ишемической болезни сердца, сердечных приступов и сердечной недостаточности.
Если ограничен кровоток в головной мозг, то увеличивается риск развития инсульта.
Почему печень вырабатывает много плохого холестерин?
Существует множество различных заболеваний печени. Гепатиты, связанные с алкоголем, а также неалкогольная жировая болезнь печени являются одними из наиболее распространенных заболеваний печени.
Болезнь печени вызывает ее повреждение, и печень не в состоянии адекватно функционировать. Одной из функций печени является расщепление холестерина. Если печень не работает должным образом, это может привести к увеличению холестерина в организме.
Неалкогольная жировая болезнь печени может увеличить риск проблем со здоровьем, таких как инсульт или диабет. Если заболевание обнаружено на ранней стадии, то возможно предотвратить ухудшения.
Повышение холестерина — симптомы
Обычно высокий уровень холестерина не вызывает никаких симптомов. Но простой анализ крови покажет уровень холестерина.
Врач может рекомендовать тест на уровень холестерина, если у человека есть в семейном анамнезе заболевания сердца, диабет и избыточный вес.
Для диагностики заболевания печени обычно используется биопсия печени и тест на функции печени. При биопсии берется крошечный кусок ткани печени, чтобы проверить на наличие болезни. Тест на функцию печени — это анализ крови, который измеряет уровень белка и ферменты в крови. Уровни белков и ферментов могут показать, повреждена ли печень.
Лечение
Человек может изменить образ жизни и принимать препараты для снижения уровня холестерина. Как правило, ему будет предложено сначала изменить диету и выполнять физические упражнения. Если он имеет избыточный вес, то ему может быть рекомендовано снижение веса.
Наиболее распространенными препаратами для снижения уровня холестерина являются статины, которые человек должен принимать всю жизнь. Статины — это препараты, которые блокируют химическое вещество в печени, продуцирующее холестерин.
Лечение печени зависит от типа заболевания. Обычно оно связано с изменением образа жизни, препаратами, иногда прибегают к трансплантации печени, если печень повреждена.
Человеку, страдающему алкогольной болезнью печени, обычно рекомендуют отказ от алкоголя. Употребление достаточного количества белка и углеводов в составе сбалансированной диеты может помочь поддерживать нормальный вес.
Профилактика
- Можно предотвратить проблемы со здоровьем, такие как повреждение печени, путем снижения высокого уровня ЛПНП.
- Изменения диеты и физические упражнения помогут человеку управлять высоким уровнем холестерина.
Источник
Холестерин и неалкогольная жировая болезнь печени
Неалкогольная жировая болезнь печени (НАЖБП) характеризуется накоплением печеночных липидов при отсутствии значительного потребления алкоголя. Есть ли связь между холестерином и неалкогольной жировой болезнью печени?
Факторы риска НАЖБП
Факторы риска для этого заболевания сходны с факторами сердечно-сосудистых заболеваний и включают:
- ожирение,
- инсулинрезистентность,
- гипертонию,
- дислипидемию (повышенный уровень липидов в крови человека),
- повышенный уровень жиров (холестерина и триглицеридов).
В развитие НАЖБП и ее прогрессирование в неалкогольный стеатогепатит (НАСГ) вовлечено множество механизмов, но молекулярные, генетические и биохимические пути остаются не полностью изученными, несмотря на значительные усилия понять роль метаболизма жирных кислот и триглицеридов.
Роль холестерина и других липидов в развитии НАЖБП
Чтобы лучше понять роль липидов (группа органических соединений, включающая жир и жироподобные вещества, в том числе и холестерин) в развитии НАЖБП, в исследованиях особую роль отводили изучению печеночного свободного холестерина. Проводился сравнительный анализ клеток здоровой печени и клеток печени, пораженной НАЖБП. У пациентов с НАЖБП была выявлена повышенная концентрация свободного холестерина и других липидов в печени.
Проведенные исследования также подразумевают связь диетического холестерина с риском смерти и госпитализации из-за рака печени. Роль диетического холестерина также исследовалась в мышиных моделях неалкогольной жировой болезни печени.
Исследование метаболизма холестерина при НАЖБП и НАСГ
Также проводилось масштабное исследование, которое проанализировало параметры метаболизма холестерина при НАЖБП и НАСГ. Авторы изучили четыре группы пациентов:
- первая группа — худощавые люди (контрольная группа),
- вторая группа — люди с ожирением (контрольная группа),
- третья группа — пациенты с НАЖБП,
- четвертая группа — пациенты с НАСГ.
По результатам исследования у пациентов с НАЖБП выявлено увеличении экспрессии фермента, ограничивающего скорость в синтезе холестерина по сравнению с пациентами контрольной группы нормального сложения и контрольной группы с ожирением.
Кроме того, полученные данные выявили значительную корреляцию между содержанием данного фермента в печеночной области и свободным холестерином, а также была продемонстрирована взаимосвязь между активностью фермента и НАЖБП.
Результаты данных исследований подчеркивают важность регуляции метаболизма холестерина в печени для развития и прогрессирования НАЖБП и НАСГ и предлагают новые пути для дальнейших исследований.
Исследования также выявили, что пациенты, которые принимают статины (липидснижающие препараты), по-разному реагируют на них:
- у пациентов с НАЖБП, получающих статины, не наблюдалось увеличение экспрессии ЛПНП (липопротеины низкой плотности, «плохой» холестерин),
- у пациентов с НАСГ, которые не получали статины, наблюдалось увеличение экспрессии ЛПНП.
Эти данные повышают вероятность того, что пациенты с НАЖБП по-разному реагируют на терапию статинами по сравнению с контрольными группами, и что нарушение экспрессии ЛПНП может ограничивать гиполипидемический эффект статинов. Эти данные требуют дальнейшего изучения, поскольку люди с НАЖБП страдают повышенным риском сердечно-сосудистых осложнений и пользуются эффективной гиполипидемической терапией.
Почему эти исследования так важны?
В конечном счете, эти и другие исследования могут позволить улучшить терапию неалкогольной жировой болезни печени для снижения уровня заболеваемости у большого числа людей, которым грозит опасность сопутствующих осложнений в ближайшие годы.
Источник
Холестерин и гомоцистеин – враги или друзья?
Все о холестерине
Светлана Филипповна, так что же такое холестерин и насколько он необходим организму?
Как таковой холестерин — это водонерастворимый спирт и он так же необходим организму, как и углеводы, поскольку клетки используют холестерин для строительства мембран и производят из него гормоны, желчные кислоты и витамин Д3. Проблема возникает только тогда, когда образуется его избыток.
Каким образом холестерин попадает в наш организм?
Холестерин содержится в продуктах животного происхождения, поэтому рекламы, кричащие о том, что «в нашем подсолнечном масле нет холестерина» можно пропускать мимо ушей — его там не может быть априори. Но надо сказать, что усваивается организмом из того, что мы употребляем в пищу, дай бог 10%! Печень сама синтезирует холестерин, причем около 80%. Он ей нужен! Ведь с его помощью обновляются эритроциты, тромбоциты, соединительные ткани. Иногда по высокому уровню холестерина можно предположить опухолевидное образование, потому что при его росте организм начинает синтезировать очень большое количество холестерина, так как холестерин является строителем даже такой ткани.
А какой уровень холестерина приносит вред организму?
Все дело в том, что холестерин соединяется в крови с липопротеидами высокой и низкой плотности. Липопротеиды высокой плотности, соединяясь с холестерином, переносятся в печень и благополучно там перерабатываются, а вот липопротеиды низкой плотности вместе с холестерином переносятся в сосуды и оказывают повреждающее действие на эндотелий сосудистой стенки. Получается, что высокое содержание холестерина не полезно для организма.
Вообще у каждого свой индивидуальный уровень холестерина, нельзя классифицировать всех в группы, так как у всех разный метаболизм, поэтому лечение, при необходимости, назначается только после полного обследования. Ведь у человека могут существовать и врожденные проблемы. Приведу пример. Холестерин переносится транспортным белком, который находится в составе липопротеида низкой плотности, а в этом транспортном белке, допустим, существует какой-то генетический дефект, значит он не перенесется туда с той скоростью, которая необходима, значит он не построит эту мембрану так, как нужно, раз он не построит эту мембрану так как нужно, все это будет накапливаться в организме. В этом случае к определенному возрасту это может привести к самым плачевным результатам.
Каждый должен понимать, что к холестерину необходимо относиться очень настороженно, следить за его уровнем. Если у человека повышенный уровень холестерина, он не должен оставаться равнодушным к этому факту, не оставлять это без внимания. В случае его повышения доктора обычно прописывают статины. Что такое статины? Представим себе вещество, из которого начинает образовываться холестерин — пройдет 22 реакции прежде чем он окончательно сформируется, а статины действуют на фермент в самом начале, тем самым уничтожая холестерин.
А низкий уровень холестерина оказывает влияние на организм?
Хороший вопрос и одновременно непростой. Низкий уровень холестерина значительно повышает риск смерти пожилых людей. К такому выводу пришли ученые из Гавайского университета. Пока ученые не могут объяснить полученные данные. Однако уже сейчас понятно, что в борьбе с холестерином у пожилых людей следует проявлять осторожность.
Высокий уровень холестерина опасен для тех, кто молод?
Первые признаки атеросклероза уже могут быть обнаружены в 25-30 лет, Кроме того, нарушения обмена холестерина могут быть врожденными. И тогда необходим постоянный контроль за его уровнем. Поддержание нормального уровня холестерина является одним из главных путей профилактики болезней сердца. Это положение в кардиологии остается в силе и на сегодняшний день.
Светлана Филипповна, так каково же потенциальное оружие против холестерина?
Следить за массой тела. Чем вы полнее, тем больше холестерина производит организм. Прием витаминов С, Е, кальция значительно повышает уровень липидов высокой плотности. Не стоит забывать о чае, рисовых и овсяных отрубях.
Внимание! Гомоцистеин!
В последнее время стали много говорить о гомоцистеине и особенно о его роли
в развитии атеросклероза. Что это за гомоцистеин?
Можно сказать, что у холестерина появился конкурент — гомоцистеин. В отличие от холестерина он не содержится в продуктах, а образуется в нашем организме из незаменимой аминокислоты — метионина. Гомоцистеин повышается при недостатке витаминов группы В и фолиевой кислоты. А вот избыток его в организме создает проблемы: он первым внедряется в эндотелий (стенку) сосудов и повреждает ее и только потом «за дело» берется холестерин.
Какие факторы, помимо недостатка витаминов, способствуют повышению гомоцистеина?
Это генетические факторы, обусловленные патологией ферментов. В связи с этим нарушается метаболизм гомоцистеина и его уровень повышается. Нельзя забывать и пациентов, у которых с возрастом нарушена функция почек, так как гомоцистеин выводится в основном почками.
А какое влияние оказывает высокий уровень гомоцистеина на организм?
Помимо маркера витаминной недостаточности, высокий его уровень оказывает влияние на свертывающую систему, создавая предпосылки для возникновения тромботического состояния, тормозя работу противосвертывающей системы. Возникает порочный круг самых разнообразных взаимоотношений гомоцистеина со свертывающей системой, что в дальнейшем требует тщательного клинического и лабораторного обследования. Согласитесь с тем, что гомоцистеин не так уж прост!
Скажите, существуют ли какие-то нормы содержания гомоцистеина в крови?
Ввиду того, что даже маленькие количества гомоцистеина могут оказать достаточно сильное действие на сосуды, нормы практически не существует. Ведь концентрация его в крови в 1000 меньше, чем холестерина, а вреда больше почти во столько же раз Хотя, конечно, лабораторные нормы есть.
Задумаемся о диагностике
Поскольку речь шла о проблемах свертывающей системы, то на какие лабораторные параметры следует обратить внимание пациенту в первую очередь?
На протромбиновый индекс, тромбин и тромбоциты. Если эти показатели в пределах нормы, то можно спокойно жить дальше, а если нет, то вместе с клиницистом попытаться проанализировать, с чем это могло быть связано. У гомоцистеина есть одна особенность — угнетать действие естественного антикоагулянта (антитромбина — Ш), тем самым способствовать увеличению тромбина в крови и активации процессов свертывания. А вот приведет ли это к тромботическому состоянию, надо анализировать дальше.
Вообще любой пациент, особенно старше 45-50 лет, должен быть заинтересован в подробном лабораторном обследовании, а также своевременном определении уровня холестерина в крови.
В многопрофильной Клинике ЦЭЛТ вы всегда можете пройти все необходимые обследования. По самой современной расширенной схеме мы можем полностью представить вам полный спектр липидного профиля, который включает в себя: холестерин, липиды низкой плотности, высокой плотности, аполипротеиды, также вы всегда можете узнать уровень гомоцистеина. Напоминаю вам, что эти биохимические анализы следует сдавать натощак, желательно с утра, анализы вы получите уже на следующий день.
Желаю всем крепкого здоровья и хороших показателей крови. Не шутите с ними, проявите к ним внимание и проживете до 100 лет!
Источник
Глава 4 Печень и обмен холестерина
Глава 4
Печень и обмен холестерина
Эволюционная роль холестерина заключается в том, что он служит каркасом клеточных мембран человека. Все цитоплазматические мембраны и мембраны органелл клеток млекопитающих и человека в основном состоят из фосфолипидов, гликолипидов и холестерина. Фосфолипиды являются пластичной, жидкой и фунциональной частью мембран, взаимодействуют с включенными в мембрану ферментами и рецепторами (рис. 12). Холестерин образует каркас клеточной мембраны, занимая свободное пространство между нерастворимыми в воде хвостами фосфолипидов и не позволят им изгибаться. Мембраны с низким содержанием холестерина — более гибкие и функционально активные, с высоким содержанием холестерина — более жесткие и инертные. Свободный (не этерифицированный и не связанный с липопротеидами) холестерин может свободно проникать в клеточные мембраны и образовывать эфиры с жирными кислотами, входящими в состав фосфолипидов, нарушая их функциональное состояние. Именно образование этого резервного компартмента холестерина, как и дефицит эссенциальных фосфолипидов, приводит к снижению вязкости и текучести, «старению» клеточных мембран и коррелирует с выраженностью атеросклероза. Таким образом, борьба с излишками холестерина в тканях и циркуляцией свободного холестерина в плазме для человека является эволюционной задачей, которую здоровый и молодой организм успешно решает путем его этерификации, включения в ЛПВП и транспортировки в печень для утилизации.
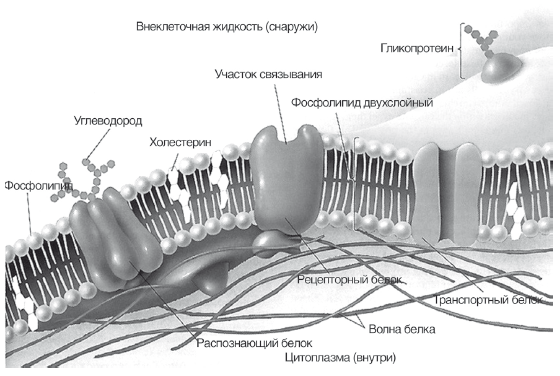
Рис. 12.
Виртуальная модель цитоплазматической мембраны клетки человека
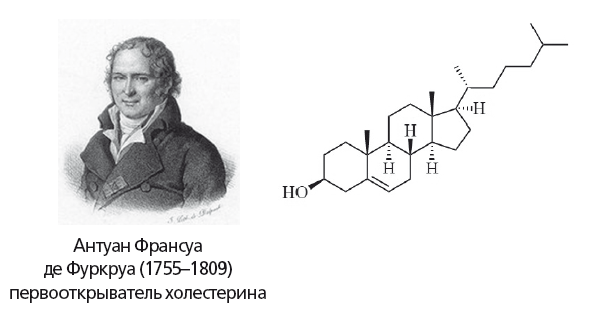
Рис. 13.
Формула холестерина. Холестерин обеспечивает стабильность клеточных мембран в широком интервале температур. Он необходим для выработки витамина D, стероидных и половых гормонов, а также для деятельности синапсов головного мозга и иммунной системы, включая защиту от рака
В 1769 году Пулетье де ла Саль из желчных камней получил плотное белое вещество («жировоск»), обладавшее свойствами жиров. В 1815 году Мишель Шеврёль также выделил это соединение и назвал его холестерином («холе» — желчь, «стерин» — жирный). Однако формулу и химические свойства холестерина установил Антуан Франсуа де Фуркруа. Холестерин и фосфолипиды (98 % их — фосфатидилхолин) составляют липидный комплекс желчи.
В сухом остатке желчи фосфатидилхолин (ФХ) составляет 22 %, а ХС — 4 %. В сутки через каналикулярную мембрану гепатоцита путем активного транспорта переносчиком фосфолипидфлиппазой (MDR3) или в составе фосфолипиднохолестериновых пузырьков и мицелл переносится 1,8-8,2 г ФХ. В кишечнике ФХ желчи расщепляется до лизофосфолипидов и реабсорбируется. Основная функция ФХ заключается в солюбилизации практически нерастворимого в воде ХС путем формирования ядра устойчивых простых (ФХ + холестерин, диаметр до 3 нм) или смешанных мицелл (ФХ + холестерин + желчные кислоты, диаметр 3-6 нм), а также везикул (ФХ + холестерин + желчные кислоты, диаметр 25-130 нм).
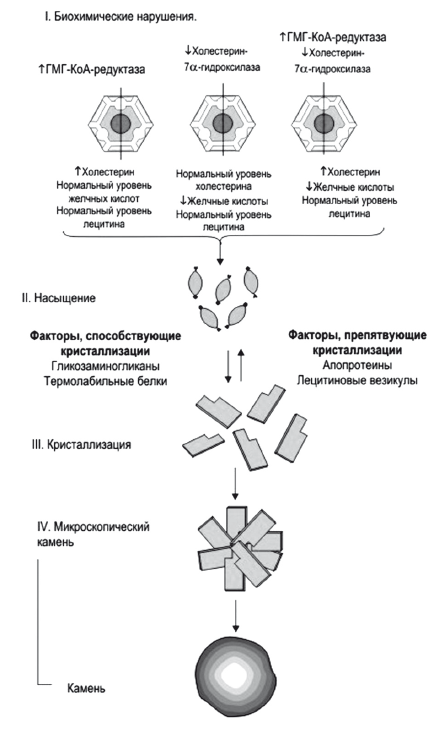
Рис. 14.
Растворимость холестерина в желчи
Потребность в холестерине в организме и печени зависит от активности человека — настройки симпато-адреналовой системы — человеку холестерин жизненно необходим для синтеза прогестерона, стероидных и половых гормонов, деятельности синапсов головного мозга, выработки витамина D. При стрессе и длительном напряжении в организме печень синтезирует много холестерина, который не весь расходуется на синтетические процессы и остается в виде эфиров в цитоплазме гепатоцита. Кроме того, длительное физическое и нервно-психическое напряжение может создать избыток холестерина в тканях преимущественно в форме ЛПНП. Высокое содержание (> 2 %) холестерина в пище также увеличивает фракцию ЛПНП и ЛПВП. При высоком содержании холестерина в пище синтез эндогенного холестерина в печени и других тканях ингибируется по механизму обратной связи.
В норме утилизация избытка холестерина касается только ЛПНП. Захват печенью циркулирующих в плазме ЛПНП — процесс активного транспорта через синусоидальную мембрану гепатоцита. После захвата ЛПНП скавендер-рецепторами гепатоцита они транспортируются в лизосомы, где из них высвобождается свободный холестерин, который используется для синтеза желчных кислот, стероидных гормонов и нейтральных стероидов или секретируется в желчь. Активная экскреция в желчь является основным физиологическим способом выведения избытков холестерина у человека (рис. 15). В сутки у человека образуется 500-1000 мл желчи. При относительно постоянном дебите желчи из организма человека в норме выводится до 1 г продуктов метаболизма холестерина в сутки.
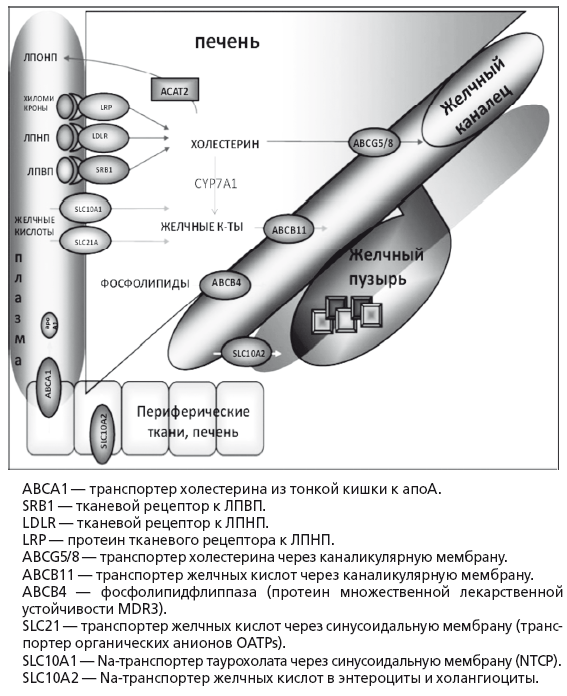
Рис. 15.
Транспорт основных метаболитов в печени (по Marschall HU, Einaon С, 2007)
Приблизительно половина этого количества экскретируется с фекалиями после превращения в желчные кислоты, оставшаяся часть представляет собой нейтральные стероиды. Холестерин секретируется в желчь активно, в желчные канальцы его переносит специальный насос ABCG5/8 (25). Поскольку холестерин не растворим в воде, его удержание в жидкой фракции желчи прямо зависит от концентрации эмульгирующих его желчных кислот и эссенциальных фосфолипидов — преимущественно ФХ, который обеспечивает его растворимость путем образования мицелл. При недостатке желчных кислот образуются более крупные частицы — везикулы, состоящие из лецитина и холестерина. При недостатке ФХ происходит кристаллизация холестерина и образуется желчный камень. Дефицит ФХ в желчи возникает при низком поступлении эссенциальных фосфолипидов или основной функциональной части — незаменимых полиненасыщенных жирных кислот (ПНЖК) в рационе питания. Относительный дефицит эссенциальных фосфолипидов также создается при их высоком потреблении гепатоцитами или другими тканями организма в печени при хронических воспалительных заболеваниях или интоксикациях, в частности, при хронической алкогольной интоксикации. Секреция в желчь холестерина, желчных кислот и ФХ — это энерго- и взаимозависимый, сложный процесс, который может нарушаться при первичном токсическом и аутоиммунном поражении гепатоцитов и холангиоцитов, а также лекарственном или инфекционном холестазе. Увеличение содержания холестерина в желчи форсирует синтез и секрецию в желчь эссенциальных фосфолипидов и базовых желчных кислот, без которых в желчи невозможно поддержание холестерина в растворимой форме и последовательно приводит к увеличению содержания всех этих веществ в тонкой кишке, крови воротной вены и фекалиях.
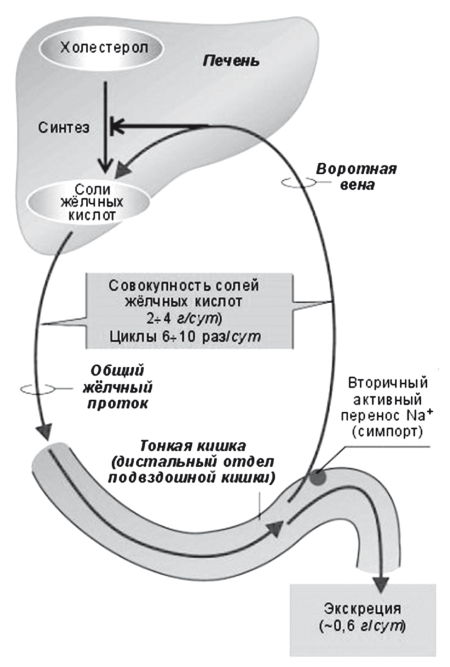
Рис. 16.
Схема энтерогепатической циркуляции желчных кислот
В процессе пассажа химуса по ЖКТ на всем протяжении кишечника всасывается до 90 % «съеденного» холестерина и реабсорбируется около 98 % желчных кислот и около 50 % холестерина, экскретированного с желчью. Оставшееся количество под действием микрофлоры толстой кишки превращается в стеролы, либо выводится с фекалиями, потому что связано с плохо растворимыми желчными кислотами (например, с литохолевой). Энтерогепатическая циркуляция желчных кислот протекает настолько эффективно, что суточная потеря желчных кислот с фекалиями составляет не более 500-1000 мг. Для восполнения потери первичные желчные кислоты — у человека холевая и хенодезоксихолевая кислоты — посредством фермента 7?-гидроксилазы (СУР7А1) постоянно синтезируются из холестерина в эндоплазматическом ретикулуме гепатоцитов, конъюгируются с глицином или таурином и активно секретируются в желчные канальцы (рис. 15). При помощи CYP7a в гепатоцитах из холестерина ежедневно синтезируются около 500 мг новых желчных кислот взамен тех, что были выведены с фекалиями (около 5 % общего пула). Этот метаболический путь является основным не только для синтеза желчных кислот, но и для утилизации избытков холестерина, поскольку приводит к утилизации около 80 % холестерина, циркулирующего в плазме (рис. 17).
Вторичные и третичные желчные кислоты: дезоксихолевая, литохолевая (около 1 % от общего пула желчных кислот) и урсодезоксихо-левая (< 3 % от общего пула желчных кислот) кислоты (УДХК) образуются из первичных желчных кислот под действием бактерий в толстой кишке и также частично реабсорбируются. Этот процесс тонко регулируется по механизму обратной связи — желчные кислоты синтезируются в гепатоците в точном соответствии с их потерей с фекалиями в энтерогепатической циркуляции. Интересно, что синтез желчных кислот более активно протекает в гепатоцитах III зоны печеночной дольки. Напротив, желчные кислоты, реабсорбируемые из кишечника и плазмы, концентрируются в гепатоцитах перипортальной зоны [36].
При увеличении потребности в синтезе нового холестерина в гепатоците активируется ген, кодирующий активность ключевого фермента ГМГ-КоА-редуктазы (рис. 17). Синтез первичных желчных кислот резко уменьшается. Это приводит к уменьшению секреции желчных кислот в желчь и снижению растворимости холестерина в желчи, притом что его концентрация в желчи увеличивается. В общем смысле этот механизм всегда сопутствует прогрессирующему атерогенезу, пожилому возрасту и терапии статинами. Таким образом, неудивительно, что у европейцев с сердечно-сосудистой патологией частота ЖКБ в 1,5 раза превышает среднюю во взрослой популяции, а в возрасте старше 71 года ЖКБ болеют около 14,3 % населения Европы и чаще — мужчины с ССЗ [36]. У представителей некоторых рас и этнических групп возможно также генетически детерминированное увеличение активности ГМГ-КоА-редуктазы: например, известна зависимость частоты ЖКБ от степени экспрессии американо-индейского гена. Накопление холестерина в гепатоцитах также может происходить при DOWN-регуляции CYP7a/
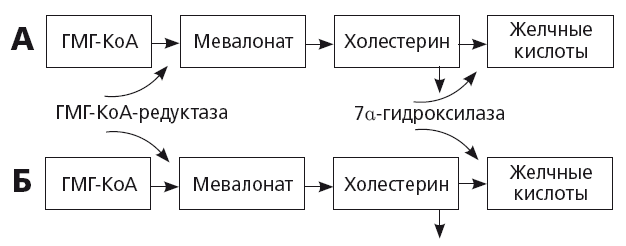
Рис. 17.
Регуляция секреции холестерина и желчных кислот у здоровых людей (А) и пациентов с ожирением и желчнокаменной болезнью (Б) [36]
Установлено, что активность CYP7a увеличивается при уровне холестерина в рационе более 2 %, и происходит это посредством активации ядерных рецепторов LXR, регулирующих экспрессию гена, кодирующего активность этого фермента. Напротив, активная реабсорбция желчных кислот из кишечника тормозит CYP7a и синтез желчных кислот по механизму отрицательной обратной связи и приводит к накоплению холестерина в гепатоцитах. Цель этого тонкого механизма — защита гепатоцитов и холангиоцитов от избыточного накопления желчных кислот, обладающих токсичным детергентным действием.
На первый взгляд, это плохо и тоже должно увеличивать литогенность желчи вследствие снижения секреции желчных кислот. Однако in vivo так не происходит. Изучение молекулярных механизмов ауторегуляции синтеза желчных кислот недавно привело к более тонкому пониманию ключевого регулирующего влияния желчных кислот на метаболизм холестерина, триглицеридов и самих себя. В 1999 году две независимые группы исследователей: в Японии — Makishima М. и соавторы и в Великобритании — Parks D.J. и соавторы почти одновременно опубликовали результаты исследований, впервые показавших, что соли желчных кислот являются прямыми активаторами ядерных рецепторов FXRa (NR1H4), которые регулируют экспрессию генов, участвующих в секреции, транспорте и метаболизме первичных желчных кислот, холестерина и триглицеридов как в гепатоцитах, так и в плазме. Посредством активации FXR желчными кислотами, поступающими из энтерогепатической циркуляции, и происходит подавление синтеза новых желчных кислот в цитозоле гепатоцита (рис. 18).
Активация FXR предотвращает накопление ТГ и ЛПОНП в печени, висцеральной клетчатке и плазме. При этом в печени действительно накапливается холестерин, который в данный момент «не нужен» для синтеза желчных кислот. Однако одновременно стимуляция FXR активирует экскрецию не этерифицированного холестерина в желчь при помощи переносчика ABCG5/8 [60]. Стимуляция FXR также увеличивает скорость захвата желчных кислот из плазмы посредством переносчиков ОАТР (SLC21) и NTCP (SLC10A1) и активирует экскрецию солей желчных кислот в первичные желчные канальцы переносчиком BSEP (АВСВ11). Одновременно стимуляция FXR активирует переносчик MDR3, секретирующий в желчь ФХ.
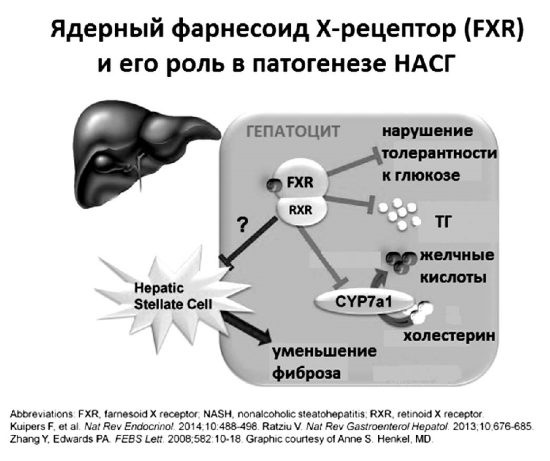
Рис. 18.
Ядерный фарнесоид Х-рецептор (FXR) и его роль в патогенезе НАСГ
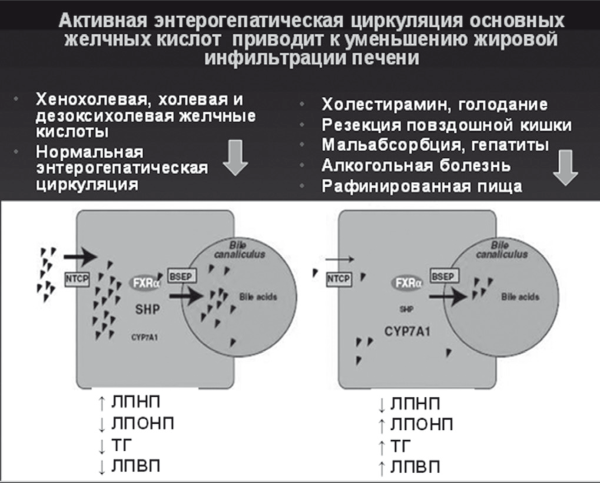
Рис. 19.
Эндокринная функция желчных кислот (модифицировано по S.M. Нouten, М. Watanabe, J. Auwerx, 2006)
Интегрально-активная энтерогепатическая циркуляция обеспечивает включение многокомпонентного механизма защиты гепатоцитов от токсичности желчных кислот при одновременном уменьшении сатурации холестерина в желчи и снижении риска образования желчных камней [60]. Позднее было установлено, что эндогенные желчные кислоты также являются сигнальными молекулами для синергичных FXR рецепторов TGR5 к G-протеину, которые находятся в тонкой кишке и опосредуют секрецию инкретинов. Стимуляция TGR5 желчными кислотами активирует активность щитовидной железы и энергообмен посредством увеличения секреции глюкагонподобных пептидов, которые препятствуют инсулинорезистентности [61]. В эксперименте на мышах оказалось, что добавление холевой кислоты к высококалорийному рациону позволяет предотвратить ожирение и развитие инсулинорезистентности путем увеличения липолиза в бурой жировой клетчатке. Таким образом, высокая реабсорбция желчных кислот при активной физиологической энтерогепатической циркуляции — как это происходит после приема холегенной и богатой жирами пищи — приводит к уменьшению синтеза желчи и накоплению в гепатоците ЛПНП, при одновременном уменьшении содержания ТГ и ЛПВП. Напротив, уменьшение всасывания желчных кислот (например, при голодании, применении секвестрантов, диарее любого происхождения) является сигналом к увеличению синтеза желчных кислот, для чего гепатоцит активно накапливает ТГ, ЛПОНП и ЛПВП. Другими словами, сбалансированный рацион питания, содержащий пищевые жиры и холеретики, служит надежной профилактикой образования желчных камней и развития жировой инфильтрации печени с дислипидемией и инсулинорезистентностью [60, 61].
Источник