Как изменится сродство гемоглобина к кислороду
Содержание статьи
родство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.
Оглавление темы «Вентиляция легких. Перфузия легких кровью.»: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. — Также рекомендуем «Углекислый газ. Транспорт углекислого газа.» |
Источник
иссоциация оксигемоглобина и ее зависимость. Эффект Бора
Диссоциация оксигемоглобина и ее зависимость. Эффект Бора
а) Факторы, сдвигающие кривую диссоциации оксигемоглобина. Их значение для транспорта кислорода. Кривые диссоциации оксигемоглобина (для облегчения понимания просим вас изучить рисунки ниже) справедливы для нормальной крови со средними показателями. Однако существует ряд факторов, которые могут сдвигать эту кривую в одну или другую сторону. На рисунке видно, что при некотором закислении крови со снижением рН от нормального уровня 7,4 до 7,2 кривая диссоциации смещается в среднем на 15% вправо, а повышение уровня рН от нормального уровня 7,4 до 7,6 смещает кривую на такое же расстояние влево.
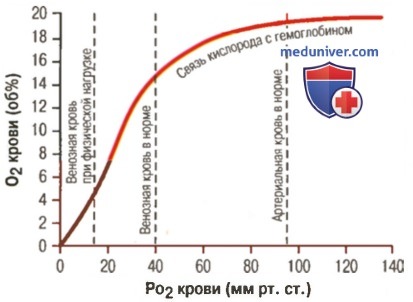
Влияние PO2 крови на количество связанного гемоглобина на 100 мл крови
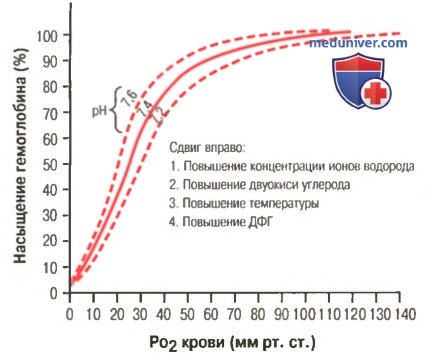
Сдвиг кривой диссоциации оксигемоглобина вправо в результате повышения концентрации ионов водорода (снижения pH). ДФГ — 2,3-дифосфоглицерат
Кроме изменений рН известны и другие факторы, которые могут сдвигать кривую диссоциации. Назовем три, действие которых сдвигает кривую вправо: (1) повышение концентрации двуокиси углерода; (2) повышение температуры крови; (3) повышение концентрации 2,3-дифосфоглицерата — метаболически важного фосфата, который в зависимости от метаболических условий присутствует в крови в разных концентрациях.
б) Повышение снабжения тканей кислородом в случаях, когда двуокись углерода и ионы водорода сдвигают кривую диссоциации оксигемоглобина. Эффект Бора. Сдвиг кривой диссоциации оксигемоглобина в ответ на повышение содержания двуокиси углерода и ионов водорода в крови имеет существенное влияние, выражающееся в ускорении высвобождения кислорода из крови в тканях и увеличении оксигенации крови в легких. Это называют эффектом Бора и объясняют его следующим образом.
При прохождении крови через ткань двуокись углерода диффундирует из клеток ткани в кровь. В результате в крови увеличивается PO2, а затем концентрации угольной кислоты (H2CO3) и ионов водорода. Эти изменения сдвигают кривую диссоциации оксигемоглобина вправо и вниз (для облегчения понимания просим вас изучить рисунок выше), уменьшая сродство кислорода к гемоглобину, и в результате увеличивается выход кислорода в ткани.
При диффузии двуокиси углерода из крови в альвеолы происходят процессы обратного направления — в результате в крови снижаются PCO2 и концентрация ионов водорода, сдвигая кривую диссоциации оксигемоглобина влево и вверх. При этом значительно увеличивается количество кислорода, связывающегося с гемоглобином при любом существующем уровне альвеолярного PO2, что увеличивает транспорт кислорода к тканям.
в) Сдвиг кривой диссоциации оксигемоглобина под влиянием дифосфоглицерата. Нормальное содержание ДФГ в крови вызывает постоянный небольшой сдвиг кривой диссоциации оксигемоглобина вправо. В случае гипоксического состояния, продолжающегося более нескольких часов, концентрация ДФГ в крови значительно возрастает, и кривая диссоциации оксигемоглобина сдвигается вправо еще больше.
В присутствии такой концентрации ДФГ кислород в тканях высвобождается при PO2, превышающем нормальный уровень на 10 мм рт. ст., поэтому в некоторых случаях такой механизм с участием ДФГ может оказаться важным для адаптации к гипоксии, особенно если причиной гипоксии является уменьшение в ткани кровотока.
г) Сдвиг кривой диссоциации во время физической нагрузки. Во время физической нагрузки некоторые факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина вправо, поэтому активные, выполняющие физическую работу мышечные волокна получают дополнительное количество кислорода. В свою очередь, работающие мышцы высвобождают большое количество двуокиси углерода; это в совокупности с действием некоторых других кислот, высвобождающихся мышцами, повышает концентрацию ионов водорода в крови капилляров мышц.
Кроме того, во время работы температура мышцы часто повышается на 2-3°С, что может еще больше увеличивать доставку кислорода мышечным волокнам. Все эти факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина в крови капилляров мышц вправо. Сдвиг вправо означает высвобождение кислорода гемоглобином в мышце при достаточно высоком уровне PO2 (40 мм рт. ст.) даже в случаях, когда из него уже высвободилось 70% кислорода. Сдвиг кривой в другую сторону показывает, что в легких присоединилось дополнительное количество кислорода из альвеолярного воздуха.
— Также рекомендуем «Участие кислорода в метаболизме. Метаболическое потребление кислорода»
Оглавление темы «Кислород и его доставка в организме»:
1. Диффузия газов через дыхательную мембрану. Дыхательная мембрана
2. Емкость дыхательной мембраны. Диффузионная емкость для кислорода
3. Вентиляционно-перфузионный коэффициент. Парциальное давление кислорода и двуокиси углерода
4. Концепция физиологического шунта. Концепция физиологического мертвого пространства
5. Обмен кислорода в организме. Транспорт кислорода из легких в ткани
6. Транспорт кислорода артериальной кровью. Диффузия кислорода
7. Гемоглобин. Роль гемоглобина в транспорте кислорода
8. Коэффициент использования кислорода. Сохранение постоянства кислорода в тканях
9. Диссоциация оксигемоглобина и ее зависимость. Эффект Бора
10. Участие кислорода в метаболизме. Метаболическое потребление кислорода
Источник
Кривая диссоциации гемоглобина


Мы поможем в написании ваших работ!

Мы поможем в написании ваших работ!

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
Сродство гемоглобина к кислороду возрастает по мере последовательного связывания молекул кислорода, что придает кривой диссоциации оксигемоглобина сигмовидную или S-образную форму (рис.). Эта кривая, соотносящая SaO2 с РаО2, важна для анализа процесса кислородного транспорта к периферическим тканям.
Верхняя часть кривой (РаО2 > 60 мм рт.ст.) плоская. Это указывает на то, что SaO2 остается относительно постоянной, несмотря на значительные колебания РаО2. Повышение кислородного транспорта может быть достигнуто только за счет увеличения содержания гемоглобина (например, при переливании крови) или растворения в крови кислорода (например, при кислородной терапии).
Крутые средняя и нижняя части кривой иллюстрируют то положение, что, хотя SaO2 падает (когда РаО2 оказывается ниже 60 мм рт, ст.), насыщение гемоглобина кислородом продолжается, поскольку градиент РО2 между альвеолами и капиллярами сохранияется. Периферические ткани в этих условиях могут продолжать извлекать достаточное количество кислорода, несмотря на снижение капиллярного РО2.
РаО2, при котором гемоглобин насыщен кислородом на 50 % (при 37°С и рН 7,4), известно как Р50. Это общепринятая мера сродства гемоглобина к кислороду. Р50 крови человека в норме составляет 26,6 мм рт.ст. Однако оно может изменяться при различных метаболических и физиологических условиях, воздействующих на процесс связывания кислорода гемоглобином.
Когда сродство гемоглобина к кислороду падает, кислород с большей легкостью переходит в ткани, и наоборот. Повышение Р50 определяет сдвиг кривой диссоциации оксигемоглобина вправо (рис). Сродство гемоглобина к кислороду снижается, указывая, что теперь требуется более высокое РаО2 для поддержания SaO2 на прежнем уровне. Более низкое сродство гемоглобина к кислороду означает повышенное высвобождение кислорода в тканях.
Сдвиг кривой диссоциации влево и соответствующее снижение Р50 указывают на повышенное сродство гемоглобина с кислородом и меньшее его высвобождение в тканях. На Р50 и положение кривой диссоциации гемоглобина влияют несколько факторов:
1. Концентрация ионов водорода. Снижение рН сдвигает кривую вправо, повышение рН – влево. Изучение изменений уровней углекислого газа и ионов водорода в легких и периферических тканях облегчает анализ влияния рН на кривую диссоциации. Образовавшийся в ходе обмена веществ в периферических тканях углекислый газ диффундирует в крови на уровне капилляров. Когда тканевое РСО2 растет, концентрация ионов водорода повышается и рН в тканях падает. Сродство гемоглобина к кислороду при этом уменьшается, что способствует его высвобождению. В легких РСО2 падает и рН увеличивается; сродство гемоглобина к кислороду повышается и связывание кислорода гемоглобином возрастает.
2. Концентрация углекислого газа. Углекислый газ оказывает двоякое действие на кривую диссоциации оксигемоглобина. С одной стороны, содержание углекислого газа влияет на внутриклеточный рН. С другой стороны, накопление СО2 вызывает образование карбаминовых соединений вследствие его взаимодействия с аминогруппами гемоглобина. Эти карбаминовые соединения служат в качестве аллостерических эффекторов молекулы гемоглобина и непосредственно влияют на связывание кислорода. Низкий уровень карбаминовых соединений вызывает сдвиг кривой вправо и снижение сродства гемоглобина к кислороду, что сопровождается увеличением высвобождения кислорода в тканях. По мере роста РаСО2 сопутствующее ему увеличение карбаминовых соединений сдвигает кривую влево, повышая связывание кислорода гемоглобином.
3. Концентрация органических фосфатов. Органические фосфаты, в частности 2,3-дифосфоглицерат (2,3-ДФГ), образуются в эритроцитах в процессе гликолиза. Концентрация органических фосфатов в эритроците в несколько раз выше, чем концентрация АТФ. В эритроците нет митохондрий, в которых происходит окислительное фосфорилирование, поэтому в нем в качестве энергетического субстрата используется 2,3-ДФг. Продукция 2,3-ДФГ увеличивается во время гипоксии, что является важным механизмом адаптации. Ряд условий, вызывающих снижение кислорода в периферических тканях, таких как анемия, острая кровопотеря, хроническое заболевание легких, застойная сердечная недостаточность, пребывание на больших высотах, характеризуются увеличением продукции органических фосфатов в эритроцитах. При этом уменьшается сродство гемоглобина к кислороду и повышается его высвобождение в тканях. И, наоборот, при некоторых патологических состояниях, таких как септический шок и гипофосфатемия, наблюдается низкий уровень 2,3-ДГФ, что приводит к сдвигу кривой диссоциации оксигемоглобина влево.
4. Температура. Температура тела влияет на кривую диссоциации оксигемоглобина менее выражено, чем факторы, описанные выше. Гипертермия вызывает повышение Р50, то есть сдвиг кривой вправо, что является благоприятной приспособительной реакцией на повышенный кислородный запрос клеток при лихорадочных состояниях. Гипотермия, напротив, снижает Р50, то есть сдвигает кривую диссоциации влево.
5. Окись углерода. Этот газа быстро диффундирует через альвеолярно-капиллярную мембрану и связывается с гемоглобином, занимая место кислорода. Сродство гемоглобина к СО в 240 раз превосходит таковое для О2. СО, связываясь с гемоглобином (образуется карбоксигемоглобин), ухудшает оксигенацию периферических тканей посредством двух механизмов: СО непосредственно уменьшает кислородную емкость крови, снижая количество гемоглобина, доступного для связывания кислорода, и СО снижает Р50 и сдвигает кривую диссоциации оксигемоглобина влево. Важным следствием этих механизмов для клиники является то, что при высоких уровнях карбоксигемоглобина может наблюдаться тяжелая тканевая гипоксия, несмотря на нормальное РаО2.
6. Метгемоглобинемия. Окисление части двухвалентного железе гемоглобина до трехвалентного приводит к образованию метгемоглобина. В норме у здоровых людей метгемоглобин составляет менее 3 % общего гемоглобина. Низкий его уровень поддерживается внутриклеточными ферментными механизмами восстановления. Метгемоглобинемия может наблюдаться как следствие врожденной недостаточности этих восстановительных ферментов или образования аномальных молекул гемоглобина, резистентных к ферментативному восстановлению (например, гемоглобин М). Некоторые лекарства, обладающие оксидантными свойствами (например, противомалярийные средства и местные анестетики), также вызывают метгемоглобинемию. Метгемоглобин сдвигает кривую диссоциации оксигемоглобина влево, блокируя высвобождение кислорода в периферических тканях.
7. Прочие гемоглобины. Описано множество генетических вариантов молекул гемоглобина с неизмененным сродством к кислороду. Фетальный гемоглобин (HbF), однако, является примечательным исключением. Гемоглобин F имеет две γ-цепи, а не β-цепи, характерные для HbA. Кривая диссоциации оксигемоглобина для HbF сдвинута влево. Возможно, это происходит из-за того, что 2,3-ДФГ не способен связаться в γ-цепями, что обеспечивает высокое сродство гемоглобина к кислороду. Данное обстоятельство имеет существенное значение для плода, когда РаО2 низкое и плацентарное поглощение кислорода возрастает за счет высокого сродства к О2.
Источник

