Как поднять гемоглобин при миеломе
Содержание статьи
Лечение миеломы: как лечить? Методы лечения, химиотерапия при миеломе
Миелома — зло злокачественная опухоль, которая происходит из клеток лимфоидной ткани, а если быть точным — из плазматических клеток. Для нее характерны следующие признаки:
- Инфильтрация костного мозга злокачественным клоном плазматических клеток. В норме в костном мозге располагается около 5 % плазмоцитов, но при миеломе их количество превышает 10%.
- В костях возникают очаги деструкции — из-за токсического действия опухолевых клеток происходит расплавление костной ткани. Это могут быть единичные очаги, либо диффузное поражение.
- В крови и моче обнаруживается специфический белок. У него много названий — М-белок, М-градиент, М-протеин, М-компонент и др. Это моноклональный иммуноглобулин, который имеет высокую молекулярную массу и негативно влияет на весь организм.
Причины миеломной болезни
Причиной миеломы является злокачественное перерождение клеток-предшественниц В-лимфоцитов, при этом образуются специфические мутации. Причины образования данных мутаций пока неизвестны. Пока речь идет только о факторах риска, при наличии которых вероятность развития заболевания увеличивается:
- Мужской пол.
- Возраст старше 40 лет.
- Негроидная раса.
- Наличие в анамнезе моноклональной гаммапатии. У 1% таких пациентов обязательно развивается миелома.
- Наличие вторичных иммунодефицитных состояний. К вторичным иммунодефицитам приводит иммуносупрессивная терапия, показанная при трансплантации органов, химиотерапия при злокачественных заболеваниях, ВИЧ и др.
- Наличие миеломы у кровных родственников.
- Наличие в анамнезе радиационного воздействия, в том числе прохождение лучевой терапии.
Виды миеломы
Миелома представляет разнородную группу заболеваний, часть из которых могут долгое время протекать относительно доброкачественно, а другие приводят к быстрому ухудшению состояния больного.
- Симптоматическая миелома. В данном случае имеется развернутая клиническая картина заболевания, с наличием характерных симптомов и признаков, полученных с помощью инструментального обследования.
- Вялотекущая, или тлеющая миелома. При ней нет повреждения костей, но в плазме крови обнаруживается М-протеин в концентрациях, превышающих 30г/л, или в костном мозге количество плазматических клеток превышает 10%.
- Плазмоцитома. Имеется единичный очаг миеломы в костях (солитарная плазмоцитома), либо во внутренних органах — экстрамедуллярная плазмоцитома.
Есть также редкие варианты множественной миеломы:
- Несекретирующая миелома.
- Биклональная миелома.
- Плазмоклеточный лейкоз и др.
Стадии болезни
1 стадия. Имеется анемия легкой степени (гемоглобин не менее 100г/л), кальций остается в норме, количество очагов остеодеструкции не превышает 5, уровень М-протеина низкий.

2 стадия. Анемия усугубляется, гемоглобин может опуститься до 85г/л, повышается уровень кальция до 3 ммоль/л, увеличивается количество очагов расплавления кости (их уже более 5, но менее 20), повышается уровень М-белка, а в моче определяется протеин Бенс-Джонса в количестве 4-12 г/сутки.
3 стадия выставляется, когда есть хотя бы один из следующих признаков:
- Тяжелая анемия, при которой гемоглобин не превышает 85 г/л.
- Уровень кальция в сыворотке крови превышает 3 ммоль/л.
- Уровень М-протеина более 70 г/л.
- Более 30 остеолитических очагов.
Проявления и осложнения миеломы
Проявление заболевания зависит от его стадии. В некоторых случаях оно может никак не проявлять себя, но по мере нарастания опухолевой массы, заболевание будет прогрессировать. При миеломе возникают следующие симптомы:
- Боли в костях. Сначала они носят периодический характер, могут возникать при изменении положения тела. По мере прогрессирования остеодеструкции, боль становится постоянной и очень сильной. В ряде случаев ее характеризуют как нестерпимую.
- Патологические переломы. Возникают без действия выраженного травмирующего фактора. Поскольку при миеломе происходит остеолизис и резорбция кости, нередки спонтанные переломы. Наиболее опасны переломы позвоночника, поскольку они могут приводить к параличам и парезам.
- При потере костной массы происходит «проседание» позвонков, которое сопровождается ущемлением корешков спинномозговых нервов и развитием неврологической симптоматики — боли, парезы, чувство онемения и даже параличи.
- Увеличение кальция в крови (за счет его выхода из костной ткани). При этом наблюдается тошнота, рвота и общая слабость. При выраженной гиперкальциемии может возникнуть спутанность сознания, сопор и даже кома.
- Поражение почек. М-белок имеет большую молекулярную массу, поэтому «забивает» почечные канальцы, что приводит к развитию почечной недостаточности. Ситуацию усугубляет гиперкальциемия, амилоидоз и инфекционные осложнения, которые характерны для миеломы.
- Когда М-белок в крови превышает 50г/л, развивается синдром гипервязкости крови. Он характеризуется кровотечениями, нарушением зрения и сознания.
- Симптомы, характерные для угнетения мозгового кроветворения: анемии, инфекции, кровотечения.
Рецидивируют ли миеломы
К сожалению, на сегодняшний день миелома является неизлечимым заболеванием. Даже после самого мощного лечения — тандемной высокодозной полихимиотерапии с трансплантацией стволовых клеток все равно развивается рецидив. Задача лечения отсрочить его развитие и затормозить прогрессирование заболевания.
Диагностика миеломы
- Лабораторные анализы:
- Общий анализ крови — определение уровня гемоглобина, подсчет лейкоцитарной формулы. Характерным, но не ключевым признаком миеломы является значительное увеличение СОЭ, у 70% больных оно превышает 30 мм/час, у отдельных пациентов — 100мм/час.
- Анализ мочи — определение уровня общего белка и М-протеина в частности.
- Биопсия костного мозга. Проводится подсчет миелограммы с определением процентного количества плазматических клеток, а также молекулярно-генетические тесты, которые позволяют выявить характерные для миеломы мутации.
- Иммунофенотипирование — позволяет выявить клон опухолевых клеток в пунктате костного мозга.
- Рентгенологические методы исследования, в частности рентген костей или компьютерная томография костей. Эти исследования позволяют выявить очаги остеодеструкции и определить их количество.
- МРТ проводится при наличии неврологической симптоматики для оценки поражения корешков спинномозговых нервов опухолевой массой или разрушенным позвонком. Также МРТ является обязательным исследованием при подозрении на солитарную миелому костей.
Лечение
На сегодняшний день лекарств, которые могли бы полностью излечить миелому, нет. Основные усилия направлены на достижение ремиссии и ее пролонгирование. Схема лечения миеломы будет определяться возрастом пациента и его состоянием. Используется несколько подходов к терапии:
- Стандартная химиотерапия с использованием мелфалана, преднизолона и бортезомиба. Такое лечение миеломы показано ослабленным пациентам и людям старше 65 лет, которые не смогут перенести более серьезное лечение. Для пациентов с тяжелой почечной недостаточностью проводят лечение с использованием бортезомиба и дексаметазона. В ряде случаев дексаметазон можно заменить на преднизолон, чтобы снизить токсическое действие. Также используются схемы лечения, включающие талидомид.
- Высокодозная полихимиотерапия. Наилучшие результаты достигаются при применении высокодозной полихимиотерапии (ВПХ) с последующей трансплантацией гемопоэтических стволовых клеток (ТГСК). Такое лечение показано пациентам младше 65 лет, а также пациентам 65- 70 лет при удовлетворительном состоянии и отсутствии противопоказаний. Возрастные ограничения обусловлены высокими рисками трансплантат-ассоциированной летальности, которая в данном случае может достигать 8%. Почечная недостаточность, даже в терминальной стадии, не является противопоказанием к ВПХ с аутотрансплантацией стволовых клеток при наличии в центре возможностей для проведения гемодиализа.
Схема лечения ВПХТ включает несколько этапов:
1 этап индукционный. На этапе индукции ремиссии рекомендуется применять трехкомпонентные схемы, не включающие мелфарман. Обычно это схемы PAD и VCD, но может использоваться и VD. При достижении полной ремиссии или очень хорошей ремиссии, пациенты направляются в трансплантационный центр для проведения ТГСК. Если опухоль оказалась резистентной, назначают терапию второй линии. Если и после нее нет хорошего эффекта, рассматривают вариант высокодозной полихимиотерапии.

2 этап лечения — трансплантационный. Он, в свою очередь, состоит из нескольких этапов:
- Мобилизация гемопоэтических стволовых клеток (ГСК). На этом этапе необходимо собрать, выделить и заготовить достаточное количество CD 34+. Обычно их выделяют из крови (периферические ГСК), но при необходимости допускается забор из костного мозга. Для мобилизации СК применяется химиотерапия циклофосфаном + гранулоцитарный колониестимулирующий фактор (он провоцирует пролиферацию стволовых клеток). Если не удалось собрать достаточное количество СК, или при проведении повторной мобилизации, вместо циклофосфана используют плериксафор.
- Предтрансплантационное кондиционирование. Этот этап должен начинаться не позже 6 недель после забора ГСК. Его целью является улучшение качества противоопухолевого ответа, которого добились на индукционном этапе. Кондиционирование проводится с использованием высоких доз мелфалана.
- После этого проводится ТГСК, которая для пациента выглядит, как обычное переливание крови.
- При миеломе лечение может включать две ТГСК. Такой режим называется тандемная ТГСК. При этом, повторная трансплантация планируется в период 3-6 месяцев после первой (оптимальные сроки — 3 месяца). Особенно она актуальна для пациентов, не достигших полной ремиссии. Помимо трансплантации собственных СК, по показаниям могут применяться СК донора.
Поддерживающая терапия
Поддерживающая терапия назначается как после ТГСК, так и после стандартной ХТ. Ее целью является уничтожение остаточного клона миеломных клеток. Используется леналидомид или бортезомиб.
Хирургическое лечение при миеломе
Хирургическое лечение используется в качестве паллиативных вмешательств при патологических переломах, компрессии спинного мозга или корешков спинногмозговых нервов . С этой целью проводятся различные реконструктивные операции, призванные устранить компрессию и зафиксировать костные отломки в нужном положении. Также могут быть проведены профилактические операции, при которых кости укрепляют с помощью металлических конструкций, не дожидаясь их переломов.
В ряде случаев при солитарной плазмоцитоме операция может применяться как самостоятельное лечение.
Как узнать, что лечение работает
Для оценки эффективности лечения, разработаны специальные критерии, включающие определение плазматических клеток в костном мозге, М-белка в крови и моче, а также количество очагов остеодеструкции. По этим критериям выделяют следующие формы ответа:
- Полная ремиссия — количество ПК входит в норму и не превышает 5%, в сыворотке и моче отсутствует М-белок, нет новых очагов остеодеструкции.
- Почти полная ремиссия — критерии такие же, как у ПП, но при использовании иммунофиксации в моче определяется М-белок.
- Очень хорошая частичная ремиссия — М-белок в крови снижается на 90% от исходного уровня или определяется только с помощью иммунофиксации.
- Частичная ремиссия — М-белок в крови снижается на 50% от исходного уровня, в моче — на 90%. Если это солитарная плазмоцитома, очаги также должны уменьшится на 50%.
Также могут быть варианты минимального ответа, стабилизации процесса, прогрессирования и развития рецидива.
Что будет, если лечение не дает результатов
Если опухоль резистентна к терапии первой линии, используют препараты второй линии с другим механизмом действия. Например, если в первой схеме применялся бортезумаб, его меняют на леналидомид.
При развитии рецидивов, возможно назначение ХТ первой линии, а также использование препаратов с более высокой противоопухолевой активностью в отношении миеломы — помалидомид, карфилзомиб и др.
Побочные эффекты от лечения миеломы
Побочные эффекты при лечении миеломы аналогичны таковым при любой химиотерапии. Сюда входят:
- Тошнота.
- Рвота.
- Общая слабость.
- Общетоксическое действие.
- Диареи.
- Анемии.
- Иммунодефициты.
- Кровотечения.
Боль при миеломе
Костные боли при миеломе являются очень серьезной проблемой. Для их купирования и предупреждения дальнейшей резорбции кости применяют бисфосфонаты. Препаратом выбора является золедроновая кислота. Также для устранения боли используется лучевая терапия и сильные анальгетики, вплоть до наркотических препаратов.
Продолжительность жизни при болезни
Продолжительность жизни определяется формой заболевания, его стадией и ответом на лечение. Тлеющая миелома может годами не прогрессировать и не угрожать жизни пациента. При активной миеломе средняя продолжительность жизни при 1 стадии составляет 6-7 лет, при 2 стадии — 3-4 года, при 3 — 2 года.
Источник
имиотерапия миеломы и ее эффективность
Химиотерапия миеломы и ее эффективностьЕсли у больного миеломой проявляются такие опасные признаки заболевания, как обезвоживание организма, гиперкальциемия или сдавление позвоночника, то первичное лечение должно быть направлено на корректировку нарушений метаболизма или серьезного локального поражения. В этом случае, в первую очередь, следует использовать терапевтические методы, позволяющие восполнить потерю жидкости и нормализовать уровень кальция, а также локальное облучение, и в ряде случаев лиминэктомию. Однако у большинства больных клинические симптомы развиваются медленно, и в отличие от описанных случаев, требующих неотложного вмешательства, врач имеет достаточно времени для того, чтобы до начала лечения подтвердить предварительный диагноз. Несмотря на успехи, достигнутые в последнее время в области разработки лекарственных средств, все еще достаточно часто используется традиционный препарат мелфалан, который назначается перорально. Особенно часто мелфалан выписывают пожилым или ослабленным больным. В результате лечения средняя выживаемость больных увеличивается с 6-12 месяцев (без лечения) до 2-3 лет. Доза препарата варьирует от 6 до 10 мг/м2. Мелфалан назначается в течение 4-7 дней через каждые 46 недель. При одновременном приеме преднизолона ремиссия наступает несколько быстрее. Обычно доза преднизолона составляет 60-80 мг/м и назначается частями, вместе с Н2-антагонистом ранитидином (150 мг два раза в день). Несмотря на использование более сложных рецептур, не совсем ясно, обеспечивают ли они большую выживаемость больных, хотя имеются сообщения об их более высокой эффективности. Обычно больные хорошо переносят пероральное назначение мелфалана и преднизолона, однако со временем у них увеличивается риск развития острого миелобластного лейкоза, что связано с длительным лечением мелфаланом. У большинства больных (более 80%) лекарственное лечение приводит к снижению симптоматики, особенно болей, слабости и гиперкальциемии. Обычно уровень парапротеина снижается после первых трех циклов приема препаратов, однако восстановление функциональных свойств нормальных иммуноглобулинов обычно требует длительного времени и происходит не всегда. Другие показатели, такие как уровень гемоглобина, альбумина и мочевины в крови, как правило возвращаются к уровню нормы, и их можно использовать для наблюдения за ходом лечения.
Если больные хорошо реагируют на химиотерапию, то после проведения 6-9 курсов нет необходимости продолжать лечение, поскольку оно не приводит к увеличению лечебного эффекта. К этому времени у них достигается «фаза плато», в течение которой уровень парапротеина более не снижается, и поэтому лечение можно не продолжать. В случае, если болезнь прогрессирует, необходимо выбрать другую тактику лечения. В течение последних 15 лет велись поиски таких средств лекарственного лечения, которые позволили бы добиться продолжительной ремиссии у большинства больных, а также увеличить их выживаемость. Было испытано много химиотерапевтических рецептур. Обычно в их состав входят алкалоиды винки, различные алкилирующие агенты и доксорубицин, которые применяются совместно с преднизолоном и дексаметазоном, причем два последних компонента назначаются в высоких дозах. Иногда используют иммуномодуляторы, например левамизол (особенно в США) и а-интерферон. Последний эффективен в лечении больных миеломой, хотя результаты остаются противоречивыми. Альтернативная, более удобная рецептура интенсивной терапии включает дексаметазон и идарубицин в высоких дозах, которые назначаются перорально, иногда вместе с талидоимидом. Так, рецептура, известная под названием Z-Dex, состоит из идарубицина 10 мг/м2, который назначается на 4 дня при ежедневном приеме, и дексаметазон, назначаемый на тот же срок в ежедневной дозе 40 мг. Курс лечения продолжается 3 недели. Хотя есть много данных о более высокой эффективности сложных рецептур, интенсивное (месячное) лечение мелфаланом и преднизолоном дает такие же результаты. При этом у больных проявляется меньше побочных эффектов. Методы интенсивной терапии труднее использовать для лечения больных пожилого возраста, поскольку у них развивается много побочных эффектов. Для лечения с использованием одной из хорошо известных рецептур (VAD), состоящей из винкристина, доксорубицина (парентерально) и дексамета-зона (в больших дозах), больным требуется вводить катетер Хикмана. Кроме того, они должны долгое время находиться в стационаре, что делает процедуру гораздо менее удобной для широкого применения. В то же время для больных молодого возраста подходят рецептуры более интенсивной терапии. К числу их относятся АВСМ (доксорубицин, ВХНМ, циклофосфамид и мелфалан), VAD или VMCP-VBAP (винкристин, циклофосфамид, мелфалан и преднизолон с периодической заменой на винкристин, ВХНМ, доксорубицин и преднизолон). В этой категории больных также оказались перспективными результаты лечения высокими дозами мелфалана, в том числе совместно с пересадкой аутологичного костного мозга (ВМТ). После проведения одного курса лечения по этой схеме примерно у трети больных отмечалась полная ремиссия, сопровождающаяся исчезновением малигнизированных плазматических клеток из костного мозга и нормализацией его функции, а также снижением содержания парапротеина до нулевого уровня. Во многих случаях также восстанавливались функции иммунной системы, чего не наблюдается после применения стандартных схем лечения. В одном из клинических испытаний, проведенных во Франции, сравнивались результаты, полученные при использовании стандартной и интенсивной схем. Интенсивная схема лечения включала назначение препаратов в высоких дозах и пересадку аутологичного костного мозга. Интенсивная схема оказалась эффективной в 81% случаев (у 22% больных был получен 100%-й эффект). При назначении стандартной схемы лечебный эффект проявлялся у 57% больных и лишь у 5% он достигал 100%. Пятилетняя безболезненная выживаемость у больных, прошедших курс интенсивной терапии, составляла 52%, в то время как в группе, леченной по стандартной схеме, этот показатель не превышал 12%. Эти впечатляющие данные, несомненно, коренным образом изменят существующие схемы лекарственного лечения миеломы, тем более, что для пациентов моложе 65-летнего возраста уже широко применяется пересадка аутологичных стволовых клеток. Пересадка аллогенного костного мозга (если найден подходящий донор) может оказаться эффективной для больных молодого возраста, хотя пока нет единого мнения по этому вопросу. Для предотвращения развития анемии стали чаще использовать эритропоэтин (ЭПО); это позволяет избежать многократных переливаний крови.
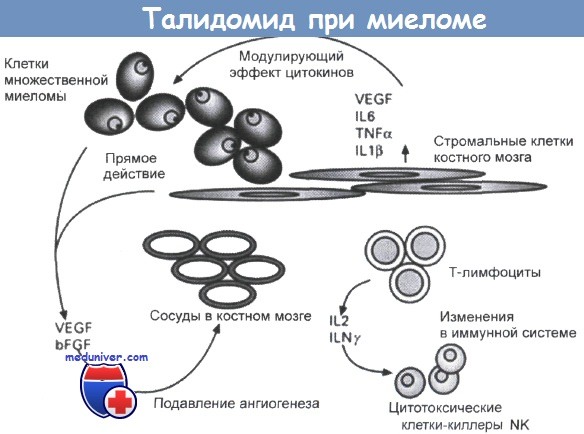
В таблице ниже обобщены все приведенные выше результаты по лекарственному лечению множественной миеломы с учетом противоречивых данных, полученных при пересадке костного мозга. После прохождения курса первичного лечения необходимо тщательно наблюдать за больными, поскольку обычно лечение необходимо продолжать. Правда, в отдельных случаях повторный курс может потребоваться через много месяцев или лет. Если лечение оказалось эффективным и закончилось, то в случае рецидива целесообразно использовать прежнюю схему, которая часто оказывается столь же эффективной, как и при первичном лечении. При рецидивах в плазме крови обычно увеличивается содержание моноклонального Ig. Впрочем, у некоторых больных этого не происходит, однако у них снова развивается характерная симптоматика. Если у больных наблюдается анемия, инфекции или болезненные поражения костей, то им следует назначить курс поддерживающей терапии, включающий антибиотики и переливание крови, или проводить паллиативное лечение. Повторная химиотерапия миеломы остается малоэффективной, хотя имеются сообщения о положительных результатах, полученных при использовании комбинации доксорубицина, винкристина, нитрозомочевин и других препаратов. Сказанное справедливо и в отношении 25% больных, у которых при первичном лечении не отмечался терапевтический эффект (так называемая первичная устойчивость). Обычно повторная химиотерапия дает кратковременный результат, который достигается ценой развития у больных более тяжелых побочных эффектов, чем те, которые наблюдаются при лечении мелфаланом и преднизолоном. При назначении курса повторной химиотерапии больным пожилого возраста всегда необходим взвешенный подход, и вначале следует убедиться в том, что схема первичного лечения не дает результатов. В последнее время в схему повторной химиотерапии для лечения больных с рецидивами миеломы включают талидоимид. Этому препарату с противоречивой характеристикой нашли новое применение. Талидоимид снижает уровень парапротеина в крови и моче, и его можно назначать перорально в ежедневной дозе 200 мг, причем для устойчивых больных доза может быть увеличена до 800 мг. В ряде случаев препарат применяют в составе рецептуры совместно с циклофосфамидом и дексаметазоном (CDT). Талидоимид характеризуется умеренной токсичностью, по крайней мере, если назначается в дозах менее 600 мг. Этот антиангиогенный препарат перорального применения может использоваться в качестве поддерживающего средства при лечении миеломы, и сейчас проводятся соответствующие клинические испытания. На рисунке представлена схема, иллюстрирующая механизм цитотоксического действия талидоимида. Недавно опубликовано обнадеживающее сообщение об эффективности адресной биологической терапии. Больным, находящимся на последней стадии рецидивирующей миеломы, назначали препарат бортезомиб, являющийся ингибитором ферментов протеосом. В одном из циклов испытаний сравнивали результаты лечения с помощью стандартной схемы с применением дексаметазона, и при назначении бортезомиба. Лечение бортезомибом привело к потрясающим результатам: спустя год после окончания лечения были живы 89% больных. Эти результаты послужили основанием для включения бортезомиба в схему лечения прогрессирующей миеломы в случаях, когда назначение, по крайней мере, двух различных химиотерапевтических рецептур оказывается неэффективным. Вопросы и ответы по химиотерапии миеломы
— Также рекомендуем «Лучевая терапия миеломы и ее эффективность» Оглавление темы «Миелома и макроглобулинемии»:
|
Источник