Комплексное соединение гемоглобина с
Содержание статьи
Комплексные соединения Гемоглобин Hb 4 O

Комплексные соединения
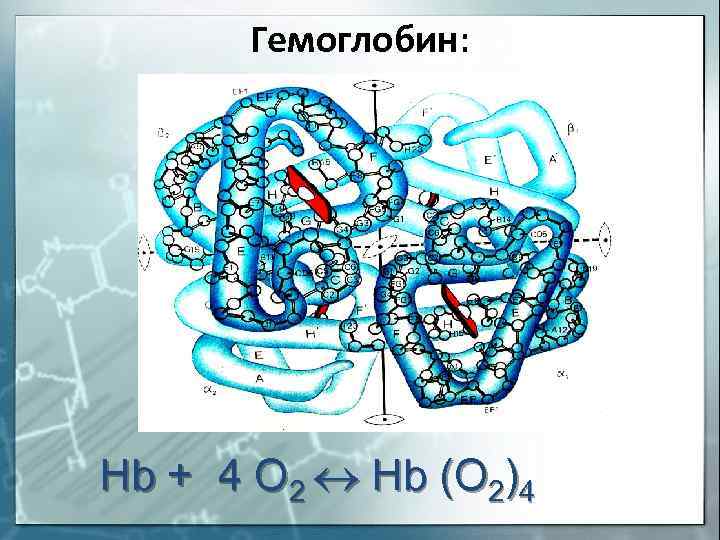
Гемоглобин: Hb + 4 O 2 Hb (O 2)4
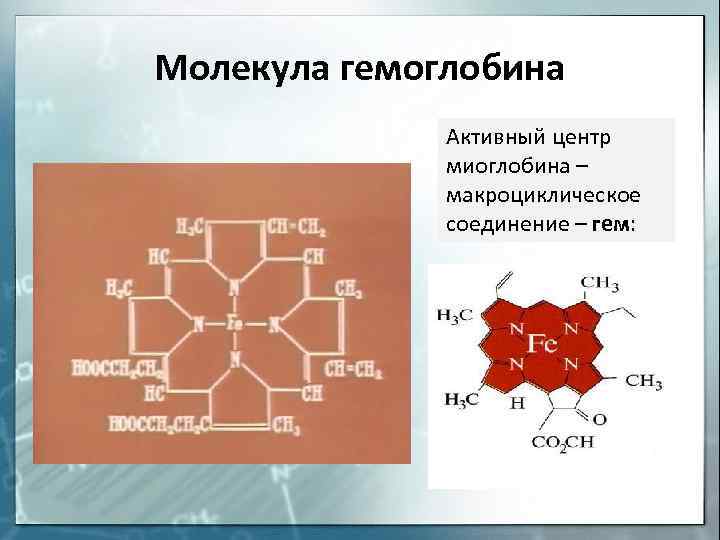
Молекула гемоглобина Активный центр миоглобина – макроциклическое соединение – гем:
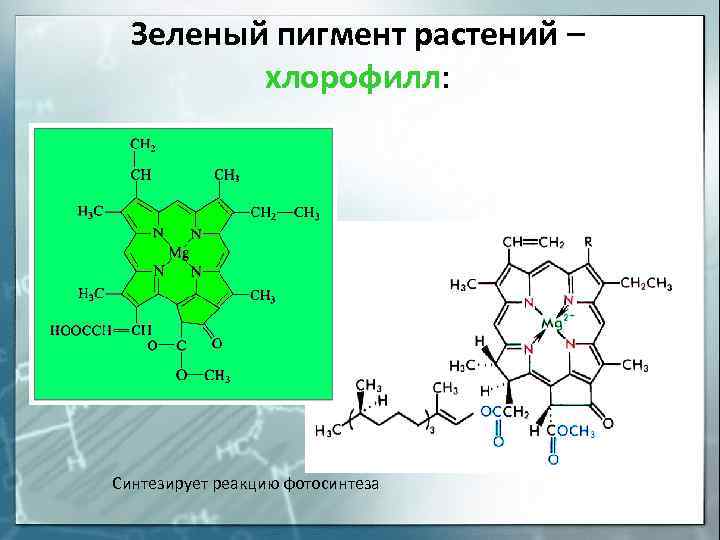
Зеленый пигмент растений – хлорофилл: Синтезирует реакцию фотосинтеза
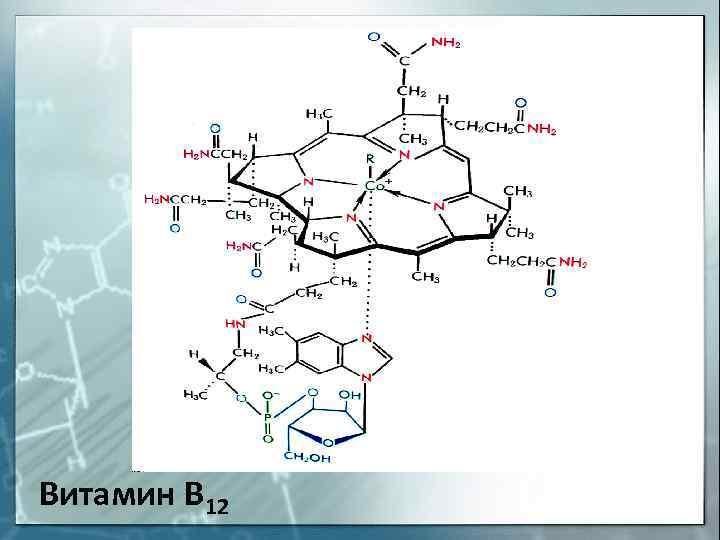
Витамин В 12
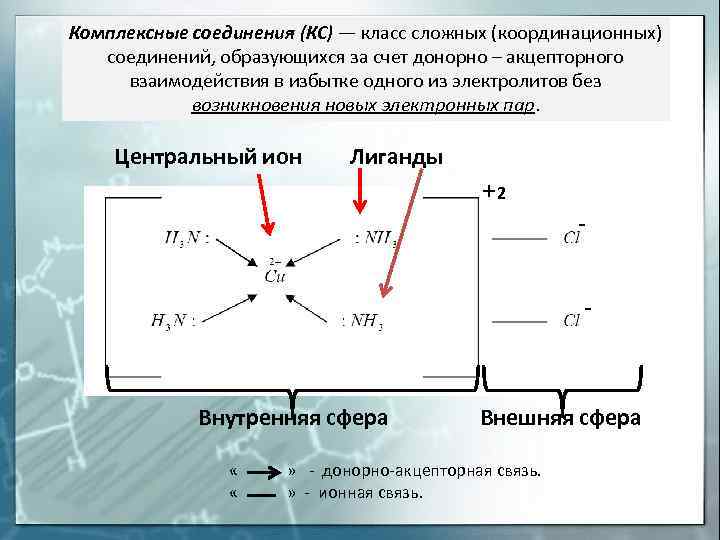
Комплексные соединения (КС) — класс сложных (координационных) соединений, образующихся за счет донорно – акцепторного взаимодействия в избытке одного из электролитов без возникновения новых электронных пар. Центральный ион Лиганды 2 Внутренняя сфера Внешняя сфера « » — донорно-акцепторная связь. « » — ионная связь.
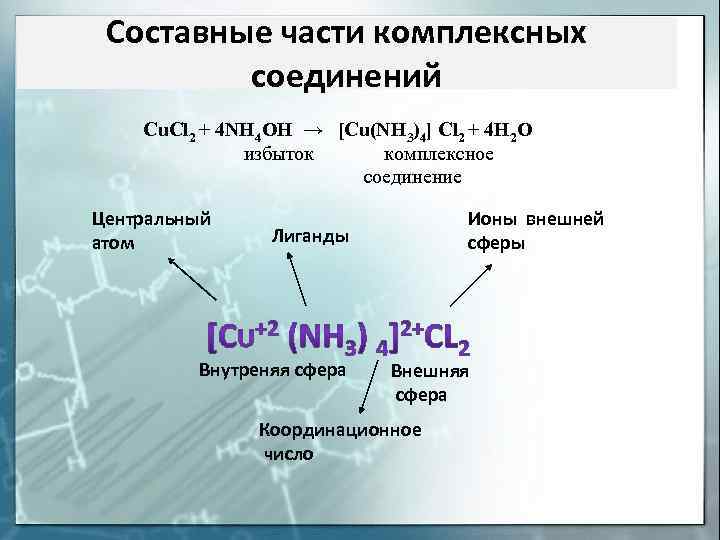
Составные части комплексных соединений Cu. Cl 2 + 4 NH 4 OH → [Cu(NH 3)4] Cl 2 + 4 H 2 O избыток комплексное соединение Центральный атом Ионы внешней сферы Лиганды Внутреняя сфера Внешняя сфера Координационное число

Характеристики комплексов Заряд комплексного иона равен алгебраической сумме зарядов (или степеней окисления) комплексообразователя и лигандов. Z = Zко +∑Zлиг Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с донорными атомами лигандов, т. е. координационное число (КЧ). Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости (Kн).

Ковалентная (диссоциация по типу слабого электролита) Ионная связь (диссоциация по типу сильного электролита) [Cu(NH 3)4] Cl 2 → [Cu(NH 3)4]2+ + 2 Cl–

Внешняя сфера комплексного соединения – ионы и (или) молекулы, не находящиеся в непосредственной химической связи с комплексообразователем, но нейтрализующие заряд комплексного иона (внутренней сферы) Внутренняя (координационная) сфера комплексного соединения – совокупность комплексообразователя и непосредственно с ним связанных лигандов Лиганды — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно–акцепторной связью. Центральный атом (комплексообразователь) – выполняет роль акцептора электронных пар и поэтому комплексообразователем могут быть любые частицы, имеющие вакантные орбитали.

комплексообразователи Типичными комплексообразователями являются катионы d- и f- элементов, имеющие вакантные орбитали, например Ag+, Au+, Cu 2+, Zn 2+, Cd 2+, Hg 2+, Fe 3+, Co 2+, Ni 2+, Pt 4+, La 3+, Eu 2+, Th 4+, U 4+ и нейтральные атомы металлов того же типа, например Co, Ni, Fe.
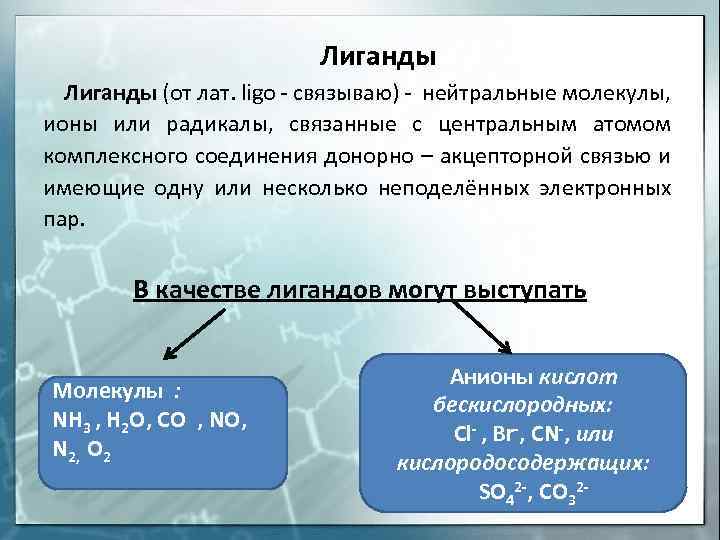
Лиганды (от лат. ligo — связываю) — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно – акцепторной связью и имеющие одну или несколько неподелённых электронных пар. В качестве лигандов могут выступать Молекулы : NH 3 , H 2 O, CO , NO, N 2, O 2 Анионы кислот бескислородных: Cl- , Br-, CN-, или кислородосодержащих: SO 42 -, CO 32 —
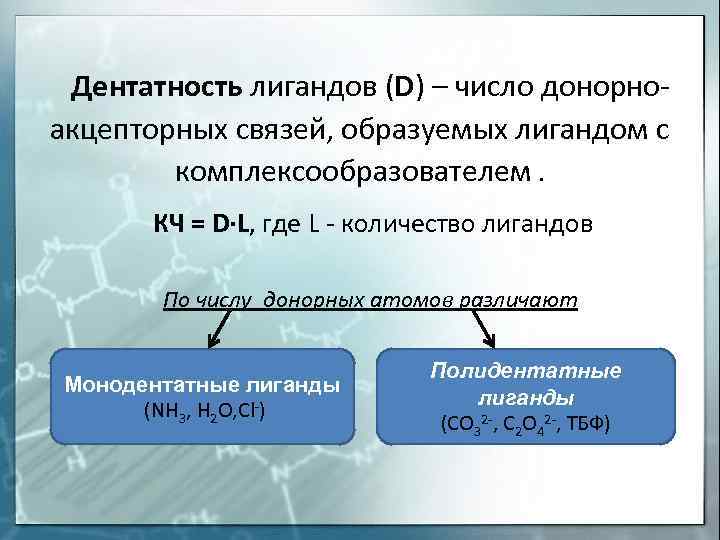
Дентатность лигандов (D) – число донорноакцепторных связей, образуемых лигандом с комплексообразователем. КЧ = D∙L, где L — количество лигандов По числу донорных атомов различают Монодентатные лиганды (NH 3, H 2 O, Cl-) Полидентатные лиганды (CO 32 -, C 2 O 42 -, ТБФ)
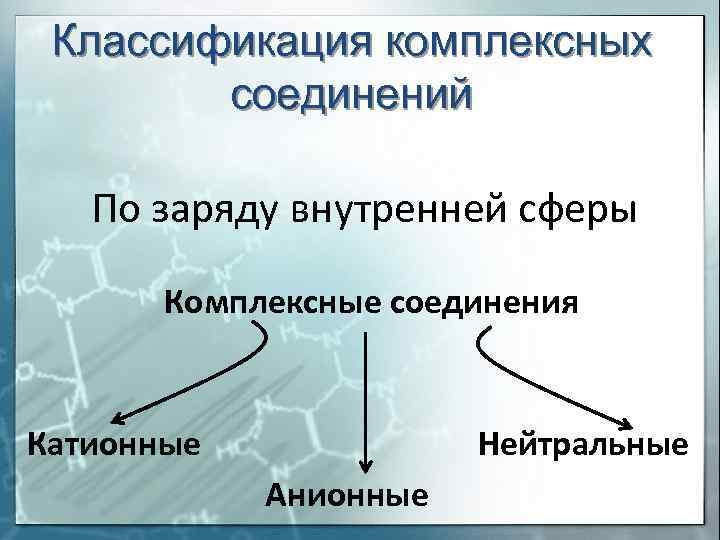
Классификация комплексных соединений По заряду внутренней сферы Комплексные соединения Катионные Нейтральные Анионные
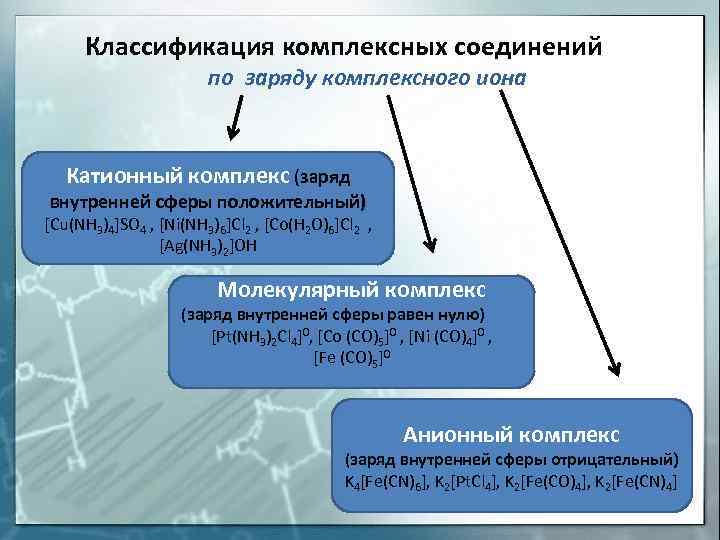
Классификация комплексных соединений по заряду комплексного иона Катионный комплекс (заряд внутренней сферы положительный) [Cu(NH 3)4]SO 4 , [Ni(NH 3)6]Cl 2 , [Co(H 2 O)6]Cl 2 , [Ag(NH 3)2]OH Молекулярный комплекс (заряд внутренней сферы равен нулю) [Pt(NH 3)2 Cl 4]0, [Co (CO)5]0 , [Ni (CO)4]0 , [Fe (CO)5]0 Анионный комплекс (заряд внутренней сферы отрицательный) K 4[Fe(CN)6], K 2[Pt. Cl 4], K 2[Fe(CO)4], K 2[Fe(CN)4]
![2+ 3 - [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4 2+ 3 - [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4](https://present5.com/presentation/-42515008_134710477/image-16.jpg)
2+ 3 — [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4 Cl 2] Cl [Pt(NH 3)2 Cl 2] 0 3 — [Fe(CO)5] K 3 [Fe(CN) 6]
![[Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2 [Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2](https://present5.com/presentation/-42515008_134710477/image-17.jpg)
[Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2 Cl 2] Дихлородиамминплатина [Cr(H 2 O)2(NH 3)3 Cl]Br 2 Бромид хлородиакватриамминхрома (III)

Двойные соли • Двойные соли являются сильными электролитами и в растворах диссоциируют полностью, т. к. связи между катионами металла и анионами кислотного остатка носят ионный характер: • KAl(SO 4)2 → K+ + Al 3+ + 2 SO 42 —

Образование комплексных соединений Реакции комплексообразования: 1. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 2. Ni. Cl 2 + 4 NH 4 OH → [(Ni(NH 3 )4]Cl 2 + 4 H 2 O 3. UO² 2 – катион, который способен образовывать комплексы анионного типа (КЧ=8) Na 2 U 2 O 7↓ + 6 Na 2 CO 3 + 3 H 2 O → 2 Na 4[UO 2(CO 3)3] 2 UO 2 SO 4 + K 4[Fe(CN)6] → (UO 2)2[Fe(CN)6] ↓ + 2 K 2 SO 4 Cu. SO 4 + K 4[Fe(CN)6] → Cu 2[Fe(CN)6]↓ + 2 H 2 SO 4
![Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30 Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30](https://present5.com/presentation/-42515008_134710477/image-20.jpg)
Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30 2 ст. [Cu(NH 3)3]2+ = [Cu(NH 3)2]2+ + NH 30 3 ст. [Cu(NH 3)2]2+ = [Cu(NH 3)]2+ + NH 30 4 ст. [Cu(NH 3)]2+ = Cu 2+ + NH 30 Общий процесс диссоциации комплекса: ∑ [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30
![Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ = Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ =](https://present5.com/presentation/-42515008_134710477/image-21.jpg)
Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30

Свойства константы нестойкости 1. Константы нестойкости характеризуют относительную устойчивость внутренней координационной сферы комплексов 2. Чем меньше КН , тем прочнее комплекс. 3. По КН, можно рассчитать концентрацию свободных ионов комплексообразователя в растворе комплексного соединения. 4. Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть трудно растворимое соединение или более устойчивый комплекс.
![сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7 сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7](https://present5.com/presentation/-42515008_134710477/image-23.jpg)
сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7 ∙ 10 -8 K[Ag(CN)2] , Kн = 1, 0 ∙ 10 -21 Допустим, что исходная концентрация этих комплексов равна 1 моль/л. Тогда: C(NH 3) = 2 x, C(CN-) = 2 x, C[Ag(NH 3)2]+ = 1 -x, C[Ag(CN)2]- = 1 -x. Так как x

По константе нестойкости и заданной начальной концентрации комплекса можно рассчитать концентрацию комплексообразователя и лигандов. Для корректности расчетов возьмем раствор с избытком лигандов. K 4[Fe(CN)6] → 4 K ++ [Fe(CN)6]4 — ; C = 0, 1 M; Kн = 1, 0 ∙ 10 -37 ; избыток KCN →K+ + CN 0, 1 M 0, 1 M 1 M 1 M Fe [(CN)6]4 — Fe 2+ + 6 CN 0, 1 — x x 6 x+1 исходя из значений константы нестойкости x

Пространственное строение комплексов Геометрическая форма комплексов – это координационный многогранник, образованный в результате определенного расположения лигандов относительно комплексообразователя. Тип гибридизации определяется числом гибридных орбиталей, их формой, направлением в пространстве, взаимным влиянием друг на друга и определенную форму комплекса. Между координационным числом, типом гибридизации и формой есть взаимосвязь:

Пространственное строение комплексов Связь между координационным числом, типом гибридизации и формой:
![Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4 Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4](https://present5.com/presentation/-42515008_134710477/image-27.jpg)
Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4 d 10 5 s 1 — электронная конфигурация атома серебра Ag+ [ ]4 d 10 5 s 0 — электронная конфигурация иона серебра Вакантные 5 s- и 5 p- орбитали иона серебра являются акцепторами электронных пар атомов азота молекул аммиака (доноров) .
![Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) - электронная конфигурация атома бора Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) - электронная конфигурация атома бора](https://present5.com/presentation/-42515008_134710477/image-28.jpg)
Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) — электронная конфигурация атома бора — электронная конфигурация катиона бора
![Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ - плоскоквадратная) Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ - плоскоквадратная)](https://present5.com/presentation/-42515008_134710477/image-29.jpg)
Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ — плоскоквадратная)
![Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– - октаэдрическое) Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– - октаэдрическое)](https://present5.com/presentation/-42515008_134710477/image-30.jpg)
Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– — октаэдрическое)
![Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– - октаэдрическое) Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– - октаэдрическое)](https://present5.com/presentation/-42515008_134710477/image-31.jpg)
Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– — октаэдрическое)
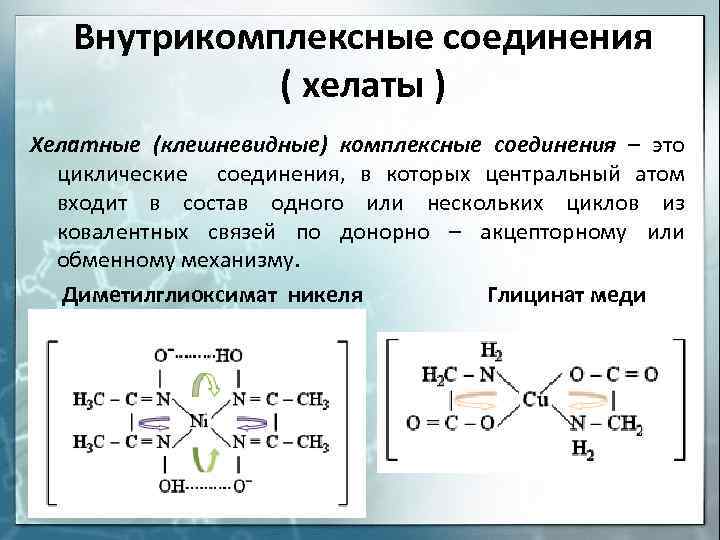
Внутрикомплексные соединения ( хелаты ) Хелатные (клешневидные) комплексные соединения – это циклические соединения, в которых центральный атом входит в состав одного или нескольких циклов из ковалентных связей по донорно – акцепторному или обменному механизму. Диметилглиоксимат никеля Глицинат меди
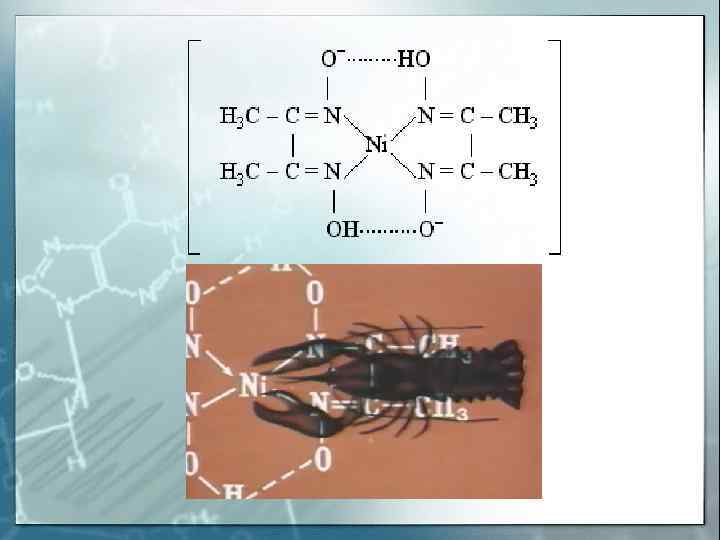
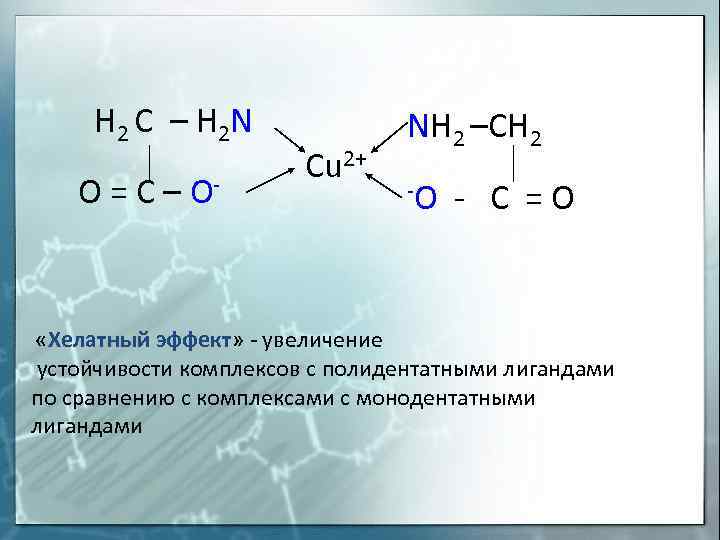
H 2 C – H 2 N O = C – O- «Хелатный Cu 2+ NH 2 –CH 2 -O — C = O эффект» — увеличение устойчивости комплексов с полидентатными лигандами по сравнению с комплексами с монодентатными лигандами
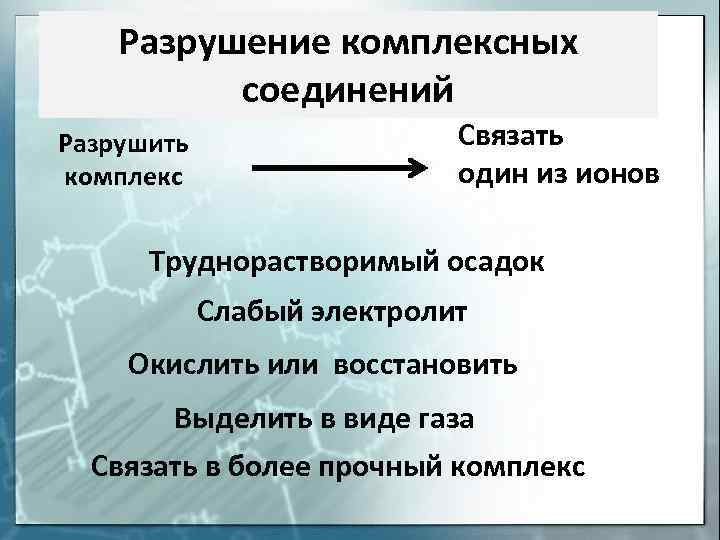
Разрушение комплексных соединений Разрушить комплекс Связать один из ионов Труднорастворимый осадок Слабый электролит Окислить или восстановить Выделить в виде газа Связать в более прочный комплекс
![[Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка + [Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка +](https://present5.com/presentation/-42515008_134710477/image-37.jpg)
[Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка + HNO 3 + KCN NH 4 NO 3 Образование более прочного комплекса Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть: трудно растворимое соединение или более устойчивый комплекс.
![[Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9, [Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9,](https://present5.com/presentation/-42515008_134710477/image-38.jpg)
[Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9, 3 ·10 -8 ПРAg. I = 1, 5·10 -16 [Ag (NH 3)2]++2 CN- = [Ag(CN)2]- +2 NH 3 Кн = 8·10 -22

Химические свойства комплексных соединений. Реакции комплексообразования: Ni. Cl 2 + 4 NH 4 OH → [Ni(NH 3 )4]Cl 2 + 4 H 2 O Реакции обмена с сохранением внутренней сферы комплекса: 4 Fe. Сl 3 + 3 K 4[Fe(CN)6] → Fe 4[Fe(CN)6]3↓ + 12 K Cl
![Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H](https://present5.com/presentation/-42515008_134710477/image-40.jpg)
Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H 2 O → Cu. S↓ + Na 2 SO 4 + 4 NH 3 Реакция замещения лигандов во внутренней сфере: K 3[Fe. F 6] + 6 KSCNизб → K 3[Fe(SCN)6] +6 KF

Окислительно – восстановительные реакции с участием комплексных соединений сопровождаются изменением степени окисления комплексообразователя :
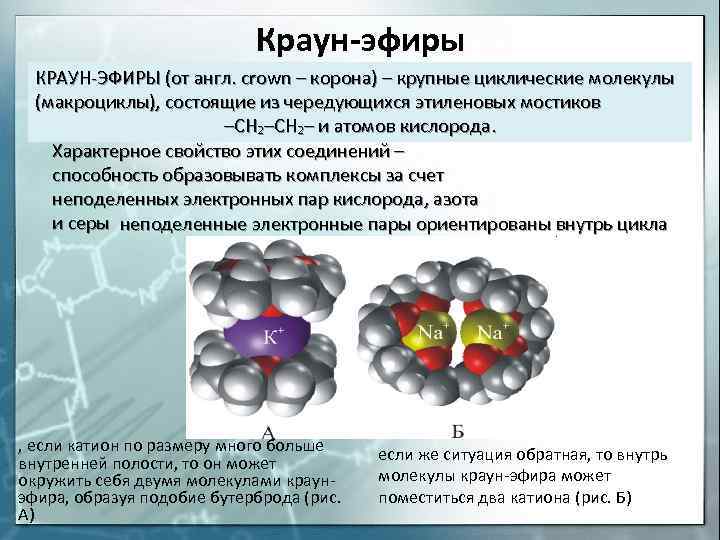
Краун-эфиры КРАУН-ЭФИРЫ (от англ. crown – корона) – крупные циклические молекулы (макроциклы), состоящие из чередующихся этиленовых мостиков –СН 2– и атомов кислорода. Характерное свойство этих соединений – способность образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы неподеленные электронные пары ориентированы внутрь цикла , если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краунэфира, образуя подобие бутерброда (рис. А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. Б)
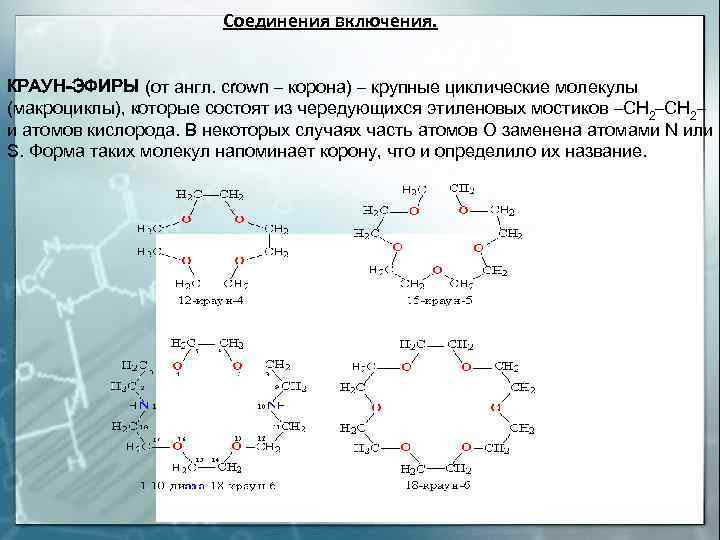
Соединения включения. КРАУН-ЭФИРЫ (от англ. crown – корона) – крупные циклические молекулы (макроциклы), которые состоят из чередующихся этиленовых мостиков –СН 2– и атомов кислорода. В некоторых случаях часть атомов О заменена атомами N или S. Форма таких молекул напоминает корону, что и определило их название.

Реакции комплексообразования. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 оранж. Hg. I 2 ↓ + 2 KI (р-р. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый Суммарная реакция: Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый
Источник
гемоглобин как хелатное комплексное соединение
Хелаты и внутрикомплексные соединения
Циклические комплексные соединения, в образовании которых принимают участие полидентатные лиганды, называются хелатами. Полидентатные лиганды обычно представляют собой многоатомные спирты, амины и их производные. Электронодонорные атомы лиганда (N, O, S и др.) расположенные на некотором расстоянии друг от друга, за счет донорно-акцепторных связей образуют с комплексообразователем циклы (один или несколько). Обычно встречаются пяти- и шестичленные циклы, реже — четырехчленные.
Например, 1,2-диаминоэтан, в котором два донорных атома разделены двумя СН2-группами
с ионами кобальта Со 3+ образует хелатный комплекс:
Хелатные комплексы отличаются повышенной прочностью. Это относится как к термической прочности, так и к устойчивости внутренней сферы в водных растворах. О последнем свидетельствует сравнение величин констант нестойкости хелатного комплекса кобальта с 1,2-диаминоэтаном и иона гексамминкобальта (III), кото-рые, соответственно, равны 2×10 — 49 и 7×10 — 36 . В обоих случаях имеется связь кобальта с азотом. Разница заключается лишь в том, что в первом случае образуется циклическая структура, а во втором — нет.
Если помимо координационной связи, полидентатный лиганд связан с комплексообразователем еще и ковалентной связью, то образуется дополнительный хелатный цикл. Такие соединения называются внутрикомплексными. Соединения, которые образуют внутрикомплексные соединения с ионами металлов, называются комплексоны. Такими свойствами, например, обладают органи-ческие производные аминополикарбоновых кислот:
На практике чаще используется трилон Б, так как эта динатриевая соль лучше растворима в воде по сравнению с ЭДТА. Трилон Б образует прочные растворимые в воде комплексы с катионами металлов, так как кроме двух ковалентных связей (при замещении ионов водорода в -СООН группах) образуются две дополнительные координационные связи с участием неподеленных пар электронов атомов азота:
где Me — Mg 2+ , Ca 2+ , Sr 2+ , Ba 2+ , Mn 2+ Fe 2+ , Cu 2+ , Zn 2+ , Pb 2+ и др.
В случае трехвалентных комплексообразователей (Al 3+ , Ga 3+ , Ce 3+ и др.) комплексы имеют более сложное октаэдрическое строение.
Внутрикомплексные соединения четырехвалентных металлов отличаются тем, что не имеют внешней сферы, т.е. не являются электролитами.
К внутрикомплексным соединениям относятся многие биоло-гические комплексы, например, хлорофилл (комплексообразователь — Mg 2+ ), гемоглобин (Fe 2+ ), витамин В12 (Co 3+ ) и многие другие.
Комплексоны используют в медицинской практике. Например, при отравлениях тяжелыми металлами (Pb 2+ , Hg 2+ ) для их связывания и выведения из организма применяют ЭДТА. Трилон Б применяется при заболеваниях, связанных с избыточным отложением солей кальция в организме (артриты, артрозы, отложение кальция в почках, венах, мышцах). Трилон Б также используют как антикоагулянт при консервировании крови.
Комплексонометрия
Метод объемного анализа, в котором в качестве рабочих раст-воров (титрантов) используют растворы комплексонов, называется комплексонометрией. Метод применяют для определения концентрации ионов металлов в растворах, в том числе в биологических жидкостях, сточных водах и т. д.
В частности, комплексонометрию используют для определения общей жесткости воды. Жесткость воды, как известно, обусловлена присутствием солей кальция и магния — гидрокарбонатов, хлоридов, сульфатов, и др. Различают временную жесткость, вызванную нали-чием гидрокарбонатов, и постоянную, причиной возникновения которой является, в основном, присутствие хлоридов и сульфатов. Общая жесткость воды складывается из временной и постоянной жесткости и выражается суммарной молярной концентрацией эквивалента катионов Ca 2+ и Mg 2+ (ммоль/л). Использование жесткой воды приводит к образованию накипи в котлах и отопительных приборах, повышает расход моющих средств. Верхний предел жесткости воды в системах водоснабжения составляет, как правило, 7 ммоль/л.
Точку эквивалентности в методекомплексонометрии фиксируют при помощи металлоиндикаторов (эриохром черный Т, мурексид и др.). Металлоиндикаторы представляют собой однозамещенные соли слабых многоосновных органических кислот.
Так, эриохром черный Т имеет структуру:
которую можно кратко представить как NaH2Ind.
Кислотность этого соединения обусловлена наличием фенольных групп, величины
которых равны 7,7 и 9,5. В водных растворах этот индикатор может находится в виде трех форм, соотношение которых зависит от pH среды. Это находит отражение в изменении окраски раствора:
Н2Ind — ⇄ Н
+ HInd 2 — ⇄ 2Н + Ind 3 — .
Отличительной особенностью этих соединений является способ-ность образовывать с ионами металлов окрашенные, малопрочные и растворимые в воде комплексы. Так, при добавлении эриохрома черного Т к водопроводной воде при рН = 7÷11 образуется красный комплекс индикатора с ионами Са 2+ и Mg 2+ :
HInd 2 — (cиний) + Ca 2+ ⇄ [CaInd] — (красный) + H +
HInd 2 — (cиний) + Mg 2+ ⇄ [MgInd] — (красный) + H +
Образующиеся при этом ионы H + нейтрализуются аммиачным буфером и в системе поддерживается постоянство pH на уровне 7÷11.
Полученные при этом комплексы характеризуются меньшей прочностью по сравнению с внутрикомплексными соединениями. Действительно, значения
[MgInd] — и [MgTr] 2 — соответственно равны 2,8·10 5 и 5·10 8 . Поэтому при добавлении трилона Б конкуренцию за ионы Ме 2+ выигрывает комплексон, так при этом образуется более прочный комплекс:
Ме 2+ + H2Tr 2 —
MeTr 2 — + 2H +
В точке эквивалентности ярко окрашенный комплекс металла с индикатором полностью разрушается и индикатор выделяется в индивидуальной форме:
МеInd — + H2Tr 2 —
MeTr 2 — + HInd 2 — + H + ,
цвет которой определяется рН раствора.
Таким образом, если применять индикатор эриохром черный Т, то точку эквивалентности можно зафиксировать по переходу окраски раствора из красной в синюю.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома — страшная бессонница, которая потом кажется страшным сном. 9099 —
| 7340 — или читать все.
источник
Комплексное соединение гемоглобин. Обратимые и необратимые реакции.
Описание презентации по отдельным слайдам:
«Комплексное соединение – гемоглобин. Обратимые и необратимые химические реакции»
Цель исследования: изучение строения и биохимических свойств гемоглобина как жизненно важного комплексного соединения с точки зрения обратимых и необратимых реакций.
Задачи: • изучить историю возникновения и развития координационной теории; • изучить строение и классификацию комплексного соединения – гемоглобина; • исследовать биохимические свойства комплексного соединения – гемоглобина; • провести качественные реакции; • получить комплексные соединения гемоглобина и сравнить их прочность; • исследовать обратимые и необратимые реакции, лежащие в основе биохимических свойств комплексного соединения гемоглобина крови.
Объект исследования: комплексное соединение – гемоглобин крови теленка. Предмет исследования: строение и свойства гемоглобина. Методы исследования: анализ, синтез, аналогия, моделирование, обобщение, вывод, эксперимент, наблюдение.
Гипотеза: комплексное соединение — гемоглобин, являясь составной частью крови, может вступать в обратимые и необратимые реакции с различными веществами.
Актуальность: Гемоглобин – комплексное соединение, какое химическое строение имеет гемоглобин, какие изменения происходят с гемоглобином под воздействием различных факторов и какое влияние эти изменения оказывают на жизнедеятельность организмов. Решение этой проблемы можно ярко показать на примере комплексного соединения – гемоглобина крови, что и определяет выбор темы исследования.
Новизна: до настоящего времени в нашем образовательном учреждении не проводились исследования по данной тематике; гемоглобин, как комплексное соединение, представляет интерес при изучении отдельных тем биологии и химии; в открытом доступе мало или вообще отсутствуют теоретические и практические данные по изучаемой тематике.
Практическая значимость: исследовав состав и биохимические свойства гемоглобина, можно дать рекомендации по соблюдению здорового образа жизни, по рациональному отношению к своему здоровью и раннему выявлению заболеваний, употреблению продуктов питания повышающих уровень гемоглобина в организме.
История развития координационной теории Первый период. С древних времен и до начала 18 века ученые и ремесленники использовали и даже синтезировали комплексные соединения, хотя и неосознанно. С начала 18 века до 1893 года идет целенаправленный синтез комплексных соединений. С 1893 года по 1940 год – создание, обоснование и победа координационной теории А. Вернера. С 1940 года и по настоящее время – современный период укрепления и всестороннего развития координационной теории.
Комплексное соединение – гемоглобин. Строение
Производные гемоглобина Дезоксигемоглобин; Оксигемоглобин (HbO2); Карбоксигемоглобин (HbCO); Метгемоглобин (мет-Hb; pH 7,0-7,4); Циан-метгемоглобин (CN-мет-Hb).
Метаболизм гемоглобина Молодые формы эритроцитов: нормобласты; эритробласты; ретикулоциты. , Функции гемоглобина буферные свойства гемоглобина, поддержание кислотно –щелочного равновесия в организме участие в газообмене между организмом и внешней средой
Клинические показания гемоглобина
Продукты с высоким содержанием железа
Продукты с высоким содержанием железа
Специальные рецепты для повышения гемоглобина Стакан грецких орехов и стакан сырой гречневой крупы перемолоть, добавить стакан меда, все перемешать, каждый день есть по столовой ложке. Грецкие орехи, курага, мед, изюм – все в пропорции 1:1 – перемолоть и тщательно перемешать, есть по 1-3 столовые ложки в день(один из лучших рецептов не только для поднятия гемоглобина, но и для обеспечения организма необходимыми витаминами). По 1 стакану чернослива, кураги, грецких орехов, изюма перемолоть, добавить мед, добавить 1-2 лимона со шкуркой (вместо лимона можно добавить сок алоэ), есть по 1-3 столовые ложки в день.
Опыт 1. Свертывание белка гемоглобина под действием спирта. Реактивы и оборудование: Спирт 96%-ный, 40%-ный раствор спирта, кровь теленка; пробирки химические или пробирки химические для микрореакций. В две пробирки помещаем 3 мл крови теленка. В первую приливаем 96%-ный спирт, во вторую – 40% спирт. В обеих пробирках наблюдается коагуляция белка. Однако с чистым спиртом коагуляция идет сильнее и красная пигментация почти исчезает, в отличие от второй пробирки, где красная пигментация сохраняется.
Опыт 2. Свертывание белка гемоглобина под действием соляной кислоты. Реактивы и оборудование: 10%-ная кислота соляная, 0,5 %-ная кислота соляная, кровь теленка; пробирки химические или пробирки химические для микрореакций. В три пробирки помещаем по 1 мл крови теленка. Первую пробирку оставляем для контроля, во вторую пробирку добавляем 0,5 %-ный раствор соляной кислоты, в третью – 10%-ный раствор соляной кислоты. При добавлении 10%-ного раствора наблюдается полная коагуляция белка гемоглобина с исчезновением кроваво-красного окрашивания. При использовании соляной кислоты, разбавленной в 20 раз, также наблюдается коагуляция белка и изменения окраски, но в значительно меньшей степени.
Опыт 3. Свертывание белка гемоглобина под действием растворов солей тяжелых металлов. Реактивы и оборудование: 1%-ный раствор ацетата свинца, 1%-ный раствор сульфата меди (II), 1%-ный раствор хлорида бария, кровь теленка; пробирки химические или пробирки химические для микрореакций. В три пробирки помещаем по 5 мл крови теленка. Первую пробирку добавляем ацетат свинца, во вторую — соль хлорида бария, в третью – соль сульфата меди (II). При добавлении растворов солей меди и свинца, наблюдается полная коагуляция белка гемоглобина. При действии раствора соли бария коагуляция не наблюдается
Опыт 4. Качественная реакция на ионы Fe2+ гемоглобина. Реактивы и оборудование: 1%-ные растворы: KSCN, К3[Fe(CN)6], К4[Fe(CN)6], кровь теленка; пробирки химические или пробирки химические для микрореакций. В три пробирки помещаем по 1 мл крови теленка. Первую пробирку добавляем раствор KSCN, во вторую — К4[Fe(CN)6], в третью – К3[Fe(CN)6]. В первых двух пробирках не происходит изменение окраски раствора. В третьей наблюдается появление сине-зеленого окрашивания.
Опыт 5. Отделение белковой части крови и проверка наличия свободного от гемоглобина железа. Реактивы и оборудование: Кровь теленка, 1%-ный раствор К3[Fe(CN)6]; пробирки химические или пробирки химические для микрореакций. В две пробирки наливаем одинаковое количество крови. Первую пробирку оставляем как контрольную, а вторую добавляем соляную кислоту. Свернувшийся белок гемоглобина отделяем от жидкости. Проводим качественную реакцию на ионы Fe (II), не связанные с гемоглобином крови. Изменение окраски в типичную темно-синюю для ионов Fe (II) не наблюдается.
Опыт 6. Равновесие в системе: венозная кровь ↔ артериальная кровь. Реактивы и оборудование: Кровь теленка; пробирки химические или пробирки химические для микрореакций. В две пробирки наливаем одинаковое количество крови. Первую пробирку оставляем как контрольную, а вторую интенсивно встряхиваем. При встряхивании пробирки с кровью в течение 5 минут, кровь приобретает алую окраску, характерную для артериальной крови. Через 30 минут после встряхивания, кровь вновь приобретает темную окраску, характерную для венозной крови.
Опыт 7. Получение равновесного комплекса карбоксигемоглобина. Реактивы и оборудование: Для получения кислорода СО (конц. Н2SO4 и муравьиная кислота), кровь теленка; пробирки химические или пробирки химические для микрореакций. В две пробирки помещаем кровь теленка. Через одну пробирку с кровью пропускаем газ СО в течении 5 минут, а другую оставляем для сравнения. В пробирке образуется комплекс вишневого цвета карбоксигемоглобин HbCO.
Опыт 8. Обратимые процессы комплекса карбоксигемоглобина. Реактивы и оборудование: Для получения кислорода O2 (Н2О2 и MnO2), карбоксигемоглобин (получен в опыте 7), кровь теленка; пробирки химические или пробирки химические для микрореакций. Через карбоксигемоглобин, полученный в опыте 7, пропускаем кислород в течении 10 минут. Вторая пробирка с кровью теленка — для контроля. В первой пробирке наблюдается восстановление до цвета контрольного образца крови в течении 3 часов.
Опыт 9. Равновесие в системе лекарственного железосодержащего лекарственного препарата мальтофер. Реактивы и оборудование: Мальтофер (активное вещество железо (III) гидроксид полимальтозат), 10%-ный раствор НCl, 1%-ные растворы: KSCN, К3[Fe(CN)6], К4[Fe(CN)6]; пробирки химические или пробирки химические для микрореакций. В три пробирки наливаем одинаковое количество препарата мальтофера. В первую пробирку добавляем KSCN, вторую — К4[Fe(CN)6], в третью — К3[Fe(CN)6]. Никаких видимых изменений окраски не наблюдается
Выводы: 1. Изучили историю возникновения и развития координационной теории. 2. Изучили строение и классификацию комплексного соединения – гемоглобина. Строение комплекса гемоглобина соответствует основным положениям теории Вернера. В составе гемоглобина отсутствует ион Fe3+. Наличие белка подтверждено в опытах с соляной кислотой и этиловым спиртом: коагуляция белка – глобина. 3. Исследовали биохимические свойства гемоглобина, его взаимодействие с кислородом, оксидом углерода (II), углекислым газом, этиловым спиртом, соляной кислотой, солями тяжелых металлов. 4. Качественные реакции, проведенные с гемоглобином, подтвердили, что в состав гемоглобина входит белок, а двухвалентное железо прочно связано с белковой частью. 5. В ходе работы были получены комплексные соединения гемоглобина: оксигемоглобин (HbO2), карбогемоглобин (HbCO2), карбоксигемоглобин (HbCO). Устойчивость комплексов возрастает в ряду: HbO2→HbCO2→HbCO. 6. Необратимыми являются реакции гем?