Комплексообразователь в гемоглобине у
Комплексные соединения Гемоглобин Hb 4 O
 Комплексные соединения
Комплексные соединения
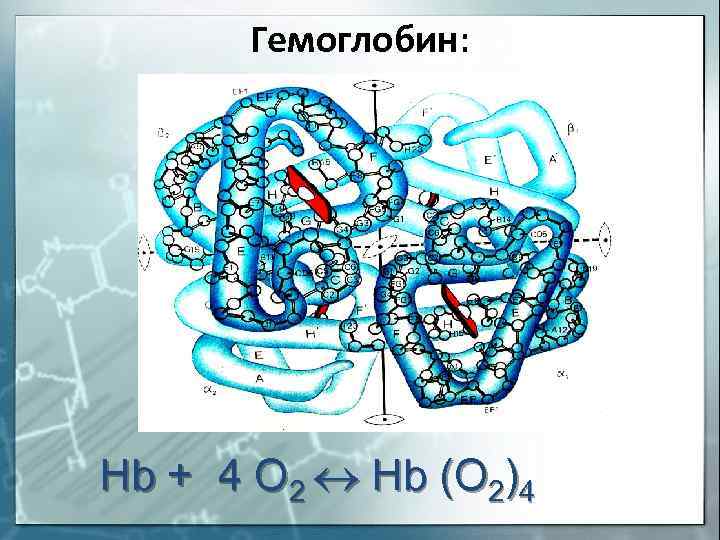 Гемоглобин: Hb + 4 O 2 Hb (O 2)4
Гемоглобин: Hb + 4 O 2 Hb (O 2)4
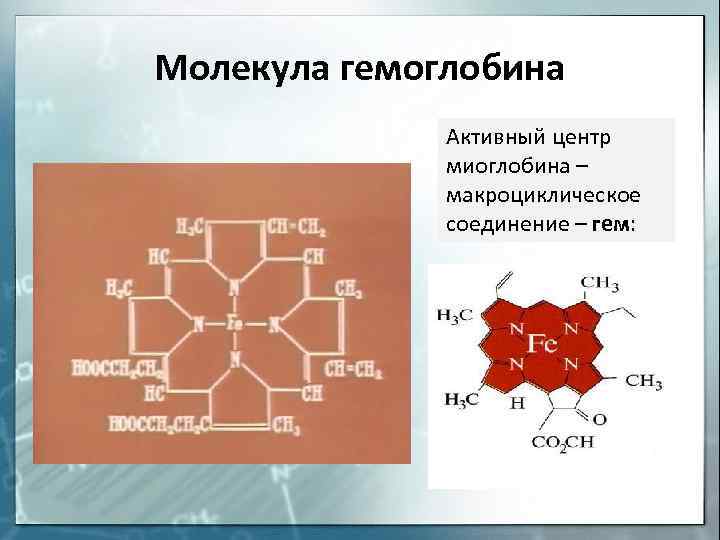 Молекула гемоглобина Активный центр миоглобина — макроциклическое соединение — гем:
Молекула гемоглобина Активный центр миоглобина — макроциклическое соединение — гем:
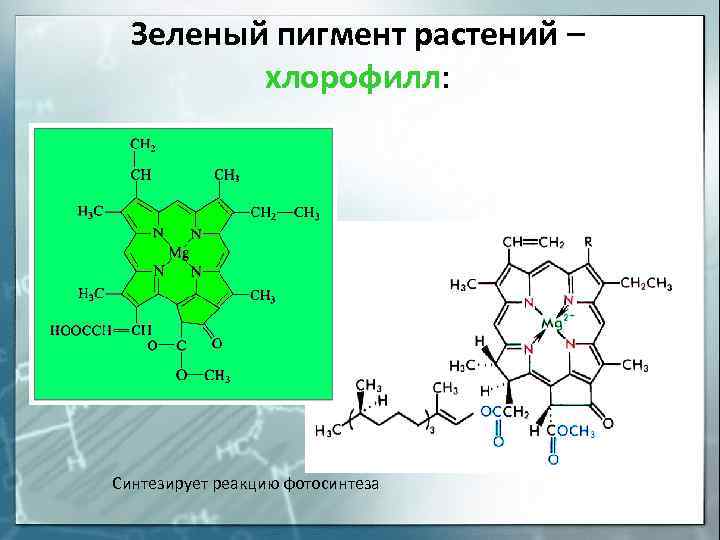 Зеленый пигмент растений — хлорофилл: Синтезирует реакцию фотосинтеза
Зеленый пигмент растений — хлорофилл: Синтезирует реакцию фотосинтеза
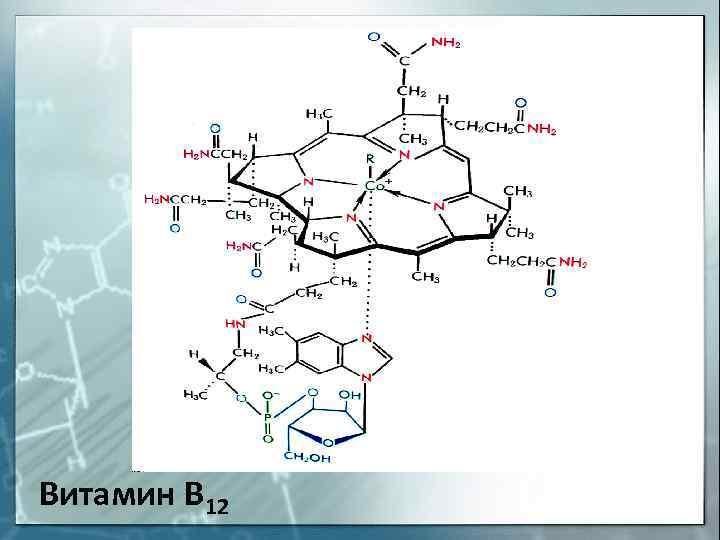 Витамин В 12
Витамин В 12
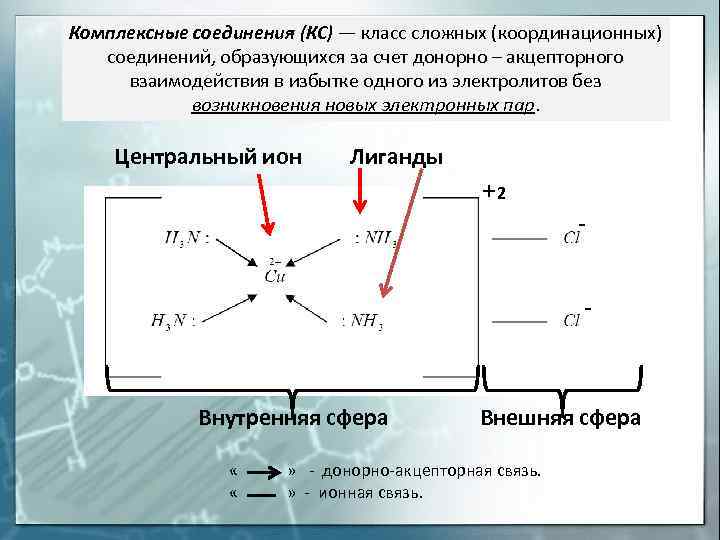 Комплексные соединения (КС) — класс сложных (координационных) соединений, образующихся за счет донорно — акцепторного взаимодействия в избытке одного из электролитов без возникновения новых электронных пар. Центральный ион Лиганды 2 Внутренняя сфера Внешняя сфера « » — донорно-акцепторная связь. « » — ионная связь.
Комплексные соединения (КС) — класс сложных (координационных) соединений, образующихся за счет донорно — акцепторного взаимодействия в избытке одного из электролитов без возникновения новых электронных пар. Центральный ион Лиганды 2 Внутренняя сфера Внешняя сфера « » — донорно-акцепторная связь. « » — ионная связь.
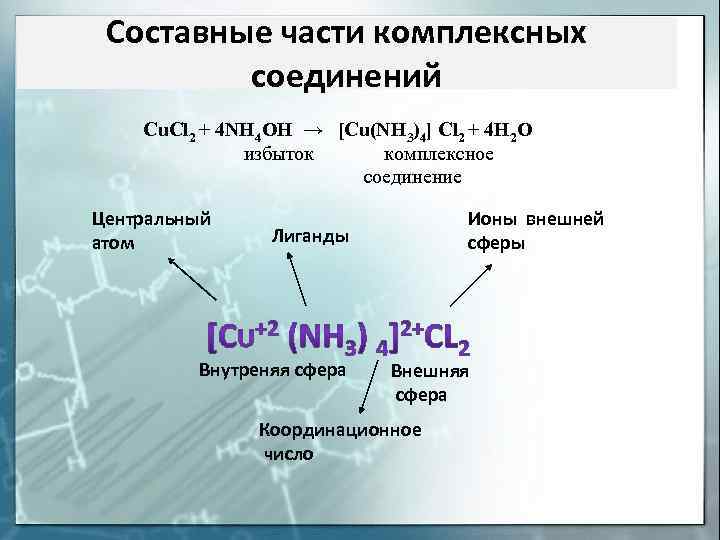 Составные части комплексных соединений Cu. Cl 2 + 4 NH 4 OH → [Cu(NH 3)4] Cl 2 + 4 H 2 O избыток комплексное соединение Центральный атом Ионы внешней сферы Лиганды Внутреняя сфера Внешняя сфера Координационное число
Составные части комплексных соединений Cu. Cl 2 + 4 NH 4 OH → [Cu(NH 3)4] Cl 2 + 4 H 2 O избыток комплексное соединение Центральный атом Ионы внешней сферы Лиганды Внутреняя сфера Внешняя сфера Координационное число
 Характеристики комплексов Заряд комплексного иона равен алгебраической сумме зарядов (или степеней окисления) комплексообразователя и лигандов. Z = Zко +∑Zлиг Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с донорными атомами лигандов, т. е. координационное число (КЧ). Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости (Kн).
Характеристики комплексов Заряд комплексного иона равен алгебраической сумме зарядов (или степеней окисления) комплексообразователя и лигандов. Z = Zко +∑Zлиг Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с донорными атомами лигандов, т. е. координационное число (КЧ). Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости (Kн).
 Ковалентная (диссоциация по типу слабого электролита) Ионная связь (диссоциация по типу сильного электролита) [Cu(NH 3)4] Cl 2 → [Cu(NH 3)4]2+ + 2 Cl-
Ковалентная (диссоциация по типу слабого электролита) Ионная связь (диссоциация по типу сильного электролита) [Cu(NH 3)4] Cl 2 → [Cu(NH 3)4]2+ + 2 Cl-
 Внешняя сфера комплексного соединения — ионы и (или) молекулы, не находящиеся в непосредственной химической связи с комплексообразователем, но нейтрализующие заряд комплексного иона (внутренней сферы) Внутренняя (координационная) сфера комплексного соединения — совокупность комплексообразователя и непосредственно с ним связанных лигандов Лиганды — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно-акцепторной связью. Центральный атом (комплексообразователь) — выполняет роль акцептора электронных пар и поэтому комплексообразователем могут быть любые частицы, имеющие вакантные орбитали.
Внешняя сфера комплексного соединения — ионы и (или) молекулы, не находящиеся в непосредственной химической связи с комплексообразователем, но нейтрализующие заряд комплексного иона (внутренней сферы) Внутренняя (координационная) сфера комплексного соединения — совокупность комплексообразователя и непосредственно с ним связанных лигандов Лиганды — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно-акцепторной связью. Центральный атом (комплексообразователь) — выполняет роль акцептора электронных пар и поэтому комплексообразователем могут быть любые частицы, имеющие вакантные орбитали.
 комплексообразователи Типичными комплексообразователями являются катионы d- и f- элементов, имеющие вакантные орбитали, например Ag+, Au+, Cu 2+, Zn 2+, Cd 2+, Hg 2+, Fe 3+, Co 2+, Ni 2+, Pt 4+, La 3+, Eu 2+, Th 4+, U 4+ и нейтральные атомы металлов того же типа, например Co, Ni, Fe.
комплексообразователи Типичными комплексообразователями являются катионы d- и f- элементов, имеющие вакантные орбитали, например Ag+, Au+, Cu 2+, Zn 2+, Cd 2+, Hg 2+, Fe 3+, Co 2+, Ni 2+, Pt 4+, La 3+, Eu 2+, Th 4+, U 4+ и нейтральные атомы металлов того же типа, например Co, Ni, Fe.
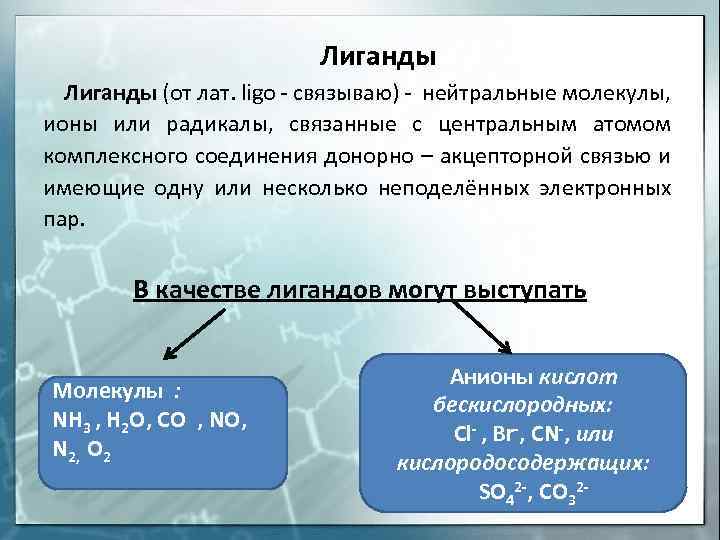 Лиганды (от лат. ligo — связываю) — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно — акцепторной связью и имеющие одну или несколько неподелённых электронных пар. В качестве лигандов могут выступать Молекулы : NH 3 , H 2 O, CO , NO, N 2, O 2 Анионы кислот бескислородных: Cl- , Br-, CN-, или кислородосодержащих: SO 42 -, CO 32 —
Лиганды (от лат. ligo — связываю) — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно — акцепторной связью и имеющие одну или несколько неподелённых электронных пар. В качестве лигандов могут выступать Молекулы : NH 3 , H 2 O, CO , NO, N 2, O 2 Анионы кислот бескислородных: Cl- , Br-, CN-, или кислородосодержащих: SO 42 -, CO 32 —
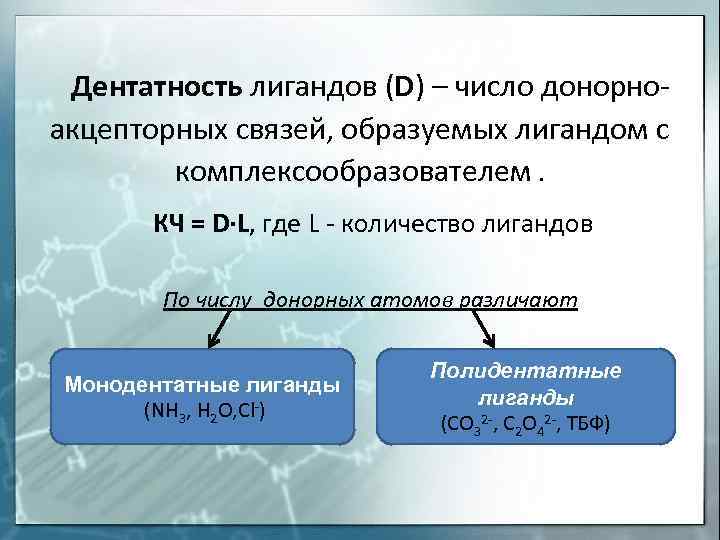 Дентатность лигандов (D) — число донорноакцепторных связей, образуемых лигандом с комплексообразователем. КЧ = D∙L, где L — количество лигандов По числу донорных атомов различают Монодентатные лиганды (NH 3, H 2 O, Cl-) Полидентатные лиганды (CO 32 -, C 2 O 42 -, ТБФ)
Дентатность лигандов (D) — число донорноакцепторных связей, образуемых лигандом с комплексообразователем. КЧ = D∙L, где L — количество лигандов По числу донорных атомов различают Монодентатные лиганды (NH 3, H 2 O, Cl-) Полидентатные лиганды (CO 32 -, C 2 O 42 -, ТБФ)
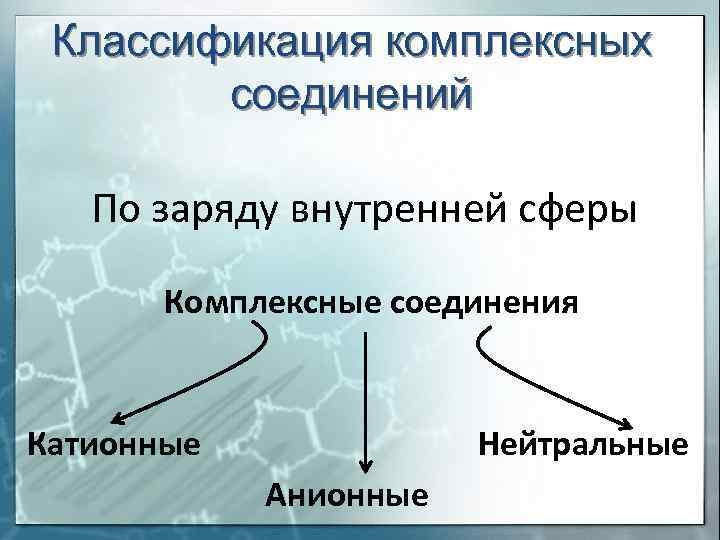 Классификация комплексных соединений По заряду внутренней сферы Комплексные соединения Катионные Нейтральные Анионные
Классификация комплексных соединений По заряду внутренней сферы Комплексные соединения Катионные Нейтральные Анионные
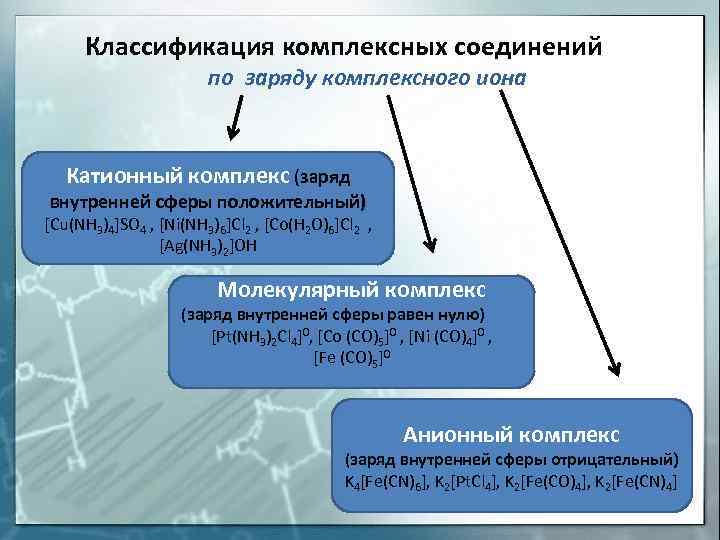 Классификация комплексных соединений по заряду комплексного иона Катионный комплекс (заряд внутренней сферы положительный) [Cu(NH 3)4]SO 4 , [Ni(NH 3)6]Cl 2 , [Co(H 2 O)6]Cl 2 , [Ag(NH 3)2]OH Молекулярный комплекс (заряд внутренней сферы равен нулю) [Pt(NH 3)2 Cl 4]0, [Co (CO)5]0 , [Ni (CO)4]0 , [Fe (CO)5]0 Анионный комплекс (заряд внутренней сферы отрицательный) K 4[Fe(CN)6], K 2[Pt. Cl 4], K 2[Fe(CO)4], K 2[Fe(CN)4]
Классификация комплексных соединений по заряду комплексного иона Катионный комплекс (заряд внутренней сферы положительный) [Cu(NH 3)4]SO 4 , [Ni(NH 3)6]Cl 2 , [Co(H 2 O)6]Cl 2 , [Ag(NH 3)2]OH Молекулярный комплекс (заряд внутренней сферы равен нулю) [Pt(NH 3)2 Cl 4]0, [Co (CO)5]0 , [Ni (CO)4]0 , [Fe (CO)5]0 Анионный комплекс (заряд внутренней сферы отрицательный) K 4[Fe(CN)6], K 2[Pt. Cl 4], K 2[Fe(CO)4], K 2[Fe(CN)4]
![2+ 3 - [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4](https://present5.com/presentation/-42515008_134710477/image-16.jpg) 2+ 3 — [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4 Cl 2] Cl [Pt(NH 3)2 Cl 2] 0 3 — [Fe(CO)5] K 3 [Fe(CN) 6]
2+ 3 — [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4 Cl 2] Cl [Pt(NH 3)2 Cl 2] 0 3 — [Fe(CO)5] K 3 [Fe(CN) 6]
![[Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2](https://present5.com/presentation/-42515008_134710477/image-17.jpg) [Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2 Cl 2] Дихлородиамминплатина [Cr(H 2 O)2(NH 3)3 Cl]Br 2 Бромид хлородиакватриамминхрома (III)
[Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2 Cl 2] Дихлородиамминплатина [Cr(H 2 O)2(NH 3)3 Cl]Br 2 Бромид хлородиакватриамминхрома (III)
 Двойные соли • Двойные соли являются сильными электролитами и в растворах диссоциируют полностью, т. к. связи между катионами металла и анионами кислотного остатка носят ионный характер: • KAl(SO 4)2 → K+ + Al 3+ + 2 SO 42 —
Двойные соли • Двойные соли являются сильными электролитами и в растворах диссоциируют полностью, т. к. связи между катионами металла и анионами кислотного остатка носят ионный характер: • KAl(SO 4)2 → K+ + Al 3+ + 2 SO 42 —
 Образование комплексных соединений Реакции комплексообразования: 1. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 2. Ni. Cl 2 + 4 NH 4 OH → [(Ni(NH 3 )4]Cl 2 + 4 H 2 O 3. UO² 2 — катион, который способен образовывать комплексы анионного типа (КЧ=8) Na 2 U 2 O 7↓ + 6 Na 2 CO 3 + 3 H 2 O → 2 Na 4[UO 2(CO 3)3] 2 UO 2 SO 4 + K 4[Fe(CN)6] → (UO 2)2[Fe(CN)6] ↓ + 2 K 2 SO 4 Cu. SO 4 + K 4[Fe(CN)6] → Cu 2[Fe(CN)6]↓ + 2 H 2 SO 4
Образование комплексных соединений Реакции комплексообразования: 1. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 2. Ni. Cl 2 + 4 NH 4 OH → [(Ni(NH 3 )4]Cl 2 + 4 H 2 O 3. UO² 2 — катион, который способен образовывать комплексы анионного типа (КЧ=8) Na 2 U 2 O 7↓ + 6 Na 2 CO 3 + 3 H 2 O → 2 Na 4[UO 2(CO 3)3] 2 UO 2 SO 4 + K 4[Fe(CN)6] → (UO 2)2[Fe(CN)6] ↓ + 2 K 2 SO 4 Cu. SO 4 + K 4[Fe(CN)6] → Cu 2[Fe(CN)6]↓ + 2 H 2 SO 4
![Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30](https://present5.com/presentation/-42515008_134710477/image-20.jpg) Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30 2 ст. [Cu(NH 3)3]2+ = [Cu(NH 3)2]2+ + NH 30 3 ст. [Cu(NH 3)2]2+ = [Cu(NH 3)]2+ + NH 30 4 ст. [Cu(NH 3)]2+ = Cu 2+ + NH 30 Общий процесс диссоциации комплекса: ∑ [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30
Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30 2 ст. [Cu(NH 3)3]2+ = [Cu(NH 3)2]2+ + NH 30 3 ст. [Cu(NH 3)2]2+ = [Cu(NH 3)]2+ + NH 30 4 ст. [Cu(NH 3)]2+ = Cu 2+ + NH 30 Общий процесс диссоциации комплекса: ∑ [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30
![Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ =](https://present5.com/presentation/-42515008_134710477/image-21.jpg) Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30
Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30
 Свойства константы нестойкости 1. Константы нестойкости характеризуют относительную устойчивость внутренней координационной сферы комплексов 2. Чем меньше КН , тем прочнее комплекс. 3. По КН, можно рассчитать концентрацию свободных ионов комплексообразователя в растворе комплексного соединения. 4. Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть трудно растворимое соединение или более устойчивый комплекс.
Свойства константы нестойкости 1. Константы нестойкости характеризуют относительную устойчивость внутренней координационной сферы комплексов 2. Чем меньше КН , тем прочнее комплекс. 3. По КН, можно рассчитать концентрацию свободных ионов комплексообразователя в растворе комплексного соединения. 4. Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть трудно растворимое соединение или более устойчивый комплекс.
![сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7](https://present5.com/presentation/-42515008_134710477/image-23.jpg) сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7 ∙ 10 -8 K[Ag(CN)2] , Kн = 1, 0 ∙ 10 -21 Допустим, что исходная концентрация этих комплексов равна 1 моль/л. Тогда: C(NH 3) = 2 x, C(CN-) = 2 x, C[Ag(NH 3)2]+ = 1 -x, C[Ag(CN)2]- = 1 -x. Так как x
сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7 ∙ 10 -8 K[Ag(CN)2] , Kн = 1, 0 ∙ 10 -21 Допустим, что исходная концентрация этих комплексов равна 1 моль/л. Тогда: C(NH 3) = 2 x, C(CN-) = 2 x, C[Ag(NH 3)2]+ = 1 -x, C[Ag(CN)2]- = 1 -x. Так как x
 По константе нестойкости и заданной начальной концентрации комплекса можно рассчитать концентрацию комплексообразователя и лигандов. Для корректности расчетов возьмем раствор с избытком лигандов. K 4[Fe(CN)6] → 4 K ++ [Fe(CN)6]4 — ; C = 0, 1 M; Kн = 1, 0 ∙ 10 -37 ; избыток KCN →K+ + CN 0, 1 M 0, 1 M 1 M 1 M Fe [(CN)6]4 — Fe 2+ + 6 CN 0, 1 — x x 6 x+1 исходя из значений константы нестойкости x
По константе нестойкости и заданной начальной концентрации комплекса можно рассчитать концентрацию комплексообразователя и лигандов. Для корректности расчетов возьмем раствор с избытком лигандов. K 4[Fe(CN)6] → 4 K ++ [Fe(CN)6]4 — ; C = 0, 1 M; Kн = 1, 0 ∙ 10 -37 ; избыток KCN →K+ + CN 0, 1 M 0, 1 M 1 M 1 M Fe [(CN)6]4 — Fe 2+ + 6 CN 0, 1 — x x 6 x+1 исходя из значений константы нестойкости x
 Пространственное строение комплексов Геометрическая форма комплексов — это координационный многогранник, образованный в результате определенного расположения лигандов относительно комплексообразователя. Тип гибридизации определяется числом гибридных орбиталей, их формой, направлением в пространстве, взаимным влиянием друг на друга и определенную форму комплекса. Между координационным числом, типом гибридизации и формой есть взаимосвязь:
Пространственное строение комплексов Геометрическая форма комплексов — это координационный многогранник, образованный в результате определенного расположения лигандов относительно комплексообразователя. Тип гибридизации определяется числом гибридных орбиталей, их формой, направлением в пространстве, взаимным влиянием друг на друга и определенную форму комплекса. Между координационным числом, типом гибридизации и формой есть взаимосвязь:
 Пространственное строение комплексов Связь между координационным числом, типом гибридизации и формой:
Пространственное строение комплексов Связь между координационным числом, типом гибридизации и формой:
![Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4](https://present5.com/presentation/-42515008_134710477/image-27.jpg) Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4 d 10 5 s 1 — электронная конфигурация атома серебра Ag+ [ ]4 d 10 5 s 0 — электронная конфигурация иона серебра Вакантные 5 s- и 5 p- орбитали иона серебра являются акцепторами электронных пар атомов азота молекул аммиака (доноров) .
Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4 d 10 5 s 1 — электронная конфигурация атома серебра Ag+ [ ]4 d 10 5 s 0 — электронная конфигурация иона серебра Вакантные 5 s- и 5 p- орбитали иона серебра являются акцепторами электронных пар атомов азота молекул аммиака (доноров) .
![Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) - электронная конфигурация атома бора](https://present5.com/presentation/-42515008_134710477/image-28.jpg) Координационное число = 4 (строение комплекса [BF 4]- тетраэдрическое) — электронная конфигурация атома бора — электронная конфигурация катиона бора
Координационное число = 4 (строение комплекса [BF 4]- тетраэдрическое) — электронная конфигурация атома бора — электронная конфигурация катиона бора
![Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ - плоскоквадратная)](https://present5.com/presentation/-42515008_134710477/image-29.jpg) Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ — плоскоквадратная)
Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ — плоскоквадратная)
![Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– - октаэдрическое)](https://present5.com/presentation/-42515008_134710477/image-30.jpg) Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4- — октаэдрическое)
Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4- — октаэдрическое)
![Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– - октаэдрическое)](https://present5.com/presentation/-42515008_134710477/image-31.jpg) Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4- — октаэдрическое)
Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4- — октаэдрическое)
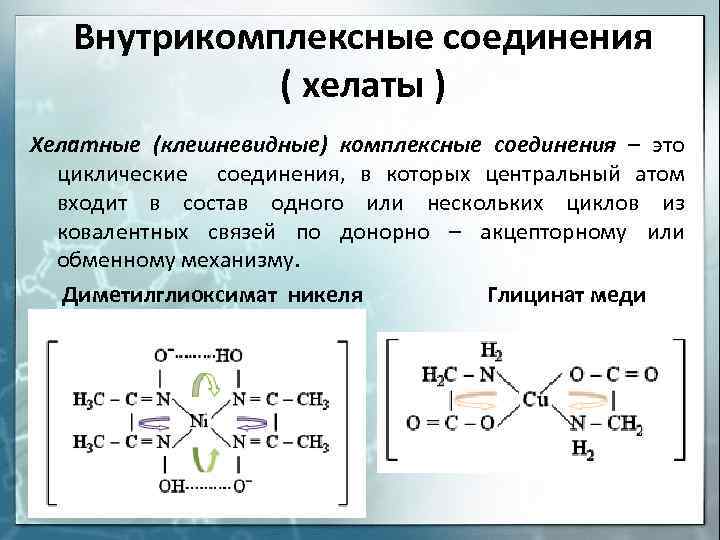 Внутрикомплексные соединения ( хелаты ) Хелатные (клешневидные) комплексные соединения — это циклические соединения, в которых центральный атом входит в состав одного или нескольких циклов из ковалентных связей по донорно — акцепторному или обменному механизму. Диметилглиоксимат никеля Глицинат меди
Внутрикомплексные соединения ( хелаты ) Хелатные (клешневидные) комплексные соединения — это циклические соединения, в которых центральный атом входит в состав одного или нескольких циклов из ковалентных связей по донорно — акцепторному или обменному механизму. Диметилглиоксимат никеля Глицинат меди
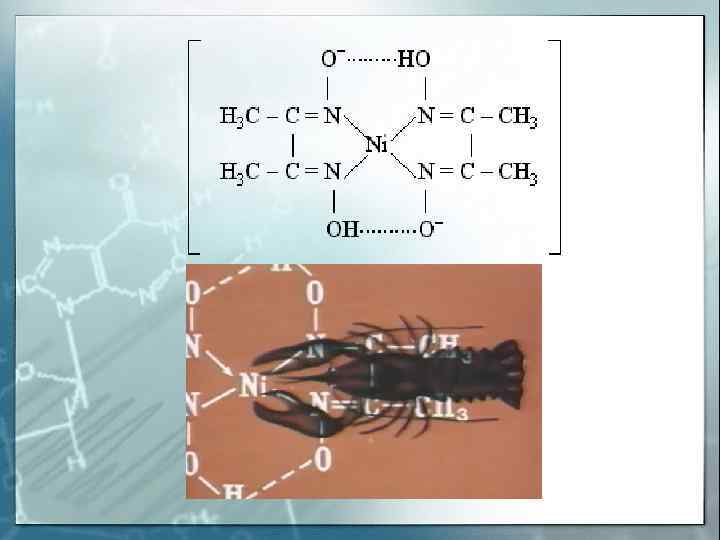
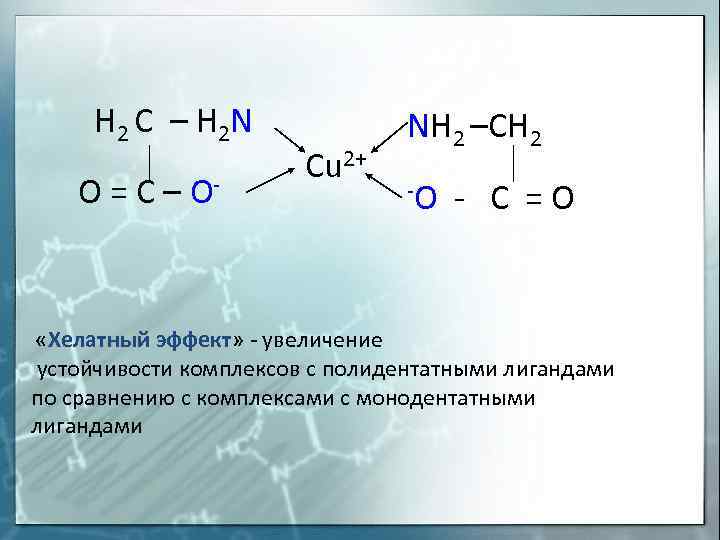 H 2 C — H 2 N O = C — O- «Хелатный Cu 2+ NH 2 -CH 2 -O — C = O эффект» — увеличение устойчивости комплексов с полидентатными лигандами по сравнению с комплексами с монодентатными лигандами
H 2 C — H 2 N O = C — O- «Хелатный Cu 2+ NH 2 -CH 2 -O — C = O эффект» — увеличение устойчивости комплексов с полидентатными лигандами по сравнению с комплексами с монодентатными лигандами
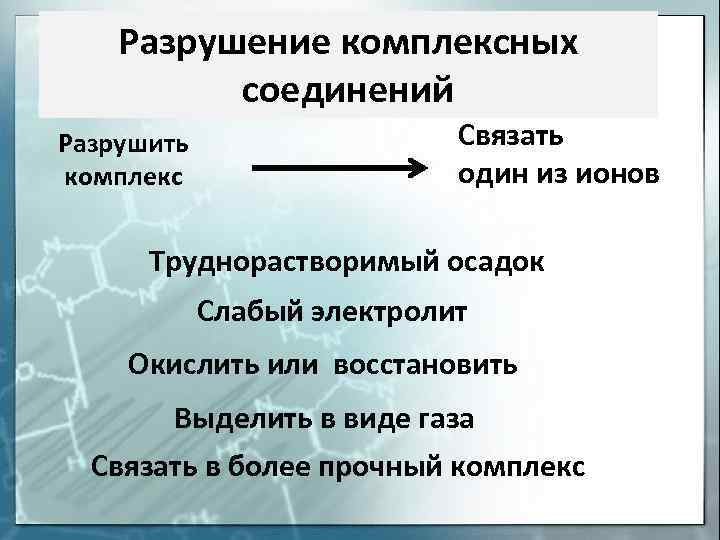 Разрушение комплексных соединений Разрушить комплекс Связать один из ионов Труднорастворимый осадок Слабый электролит Окислить или восстановить Выделить в виде газа Связать в более прочный комплекс
Разрушение комплексных соединений Разрушить комплекс Связать один из ионов Труднорастворимый осадок Слабый электролит Окислить или восстановить Выделить в виде газа Связать в более прочный комплекс
![[Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка +](https://present5.com/presentation/-42515008_134710477/image-37.jpg) [Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка + HNO 3 + KCN NH 4 NO 3 Образование более прочного комплекса Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть: трудно растворимое соединение или более устойчивый комплекс.
[Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка + HNO 3 + KCN NH 4 NO 3 Образование более прочного комплекса Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть: трудно растворимое соединение или более устойчивый комплекс.
![[Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9,](https://present5.com/presentation/-42515008_134710477/image-38.jpg) [Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9, 3 ·10 -8 ПРAg. I = 1, 5·10 -16 [Ag (NH 3)2]++2 CN- = [Ag(CN)2]- +2 NH 3 Кн = 8·10 -22
[Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9, 3 ·10 -8 ПРAg. I = 1, 5·10 -16 [Ag (NH 3)2]++2 CN- = [Ag(CN)2]- +2 NH 3 Кн = 8·10 -22
 Химические свойства комплексных соединений. Реакции комплексообразования: Ni. Cl 2 + 4 NH 4 OH → [Ni(NH 3 )4]Cl 2 + 4 H 2 O Реакции обмена с сохранением внутренней сферы комплекса: 4 Fe. Сl 3 + 3 K 4[Fe(CN)6] → Fe 4[Fe(CN)6]3↓ + 12 K Cl
Химические свойства комплексных соединений. Реакции комплексообразования: Ni. Cl 2 + 4 NH 4 OH → [Ni(NH 3 )4]Cl 2 + 4 H 2 O Реакции обмена с сохранением внутренней сферы комплекса: 4 Fe. Сl 3 + 3 K 4[Fe(CN)6] → Fe 4[Fe(CN)6]3↓ + 12 K Cl
![Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H](https://present5.com/presentation/-42515008_134710477/image-40.jpg) Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H 2 O → Cu. S↓ + Na 2 SO 4 + 4 NH 3 Реакция замещения лигандов во внутренней сфере: K 3[Fe. F 6] + 6 KSCNизб → K 3[Fe(SCN)6] +6 KF
Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H 2 O → Cu. S↓ + Na 2 SO 4 + 4 NH 3 Реакция замещения лигандов во внутренней сфере: K 3[Fe. F 6] + 6 KSCNизб → K 3[Fe(SCN)6] +6 KF
 Окислительно — восстановительные реакции с участием комплексных соединений сопровождаются изменением степени окисления комплексообразователя :
Окислительно — восстановительные реакции с участием комплексных соединений сопровождаются изменением степени окисления комплексообразователя :
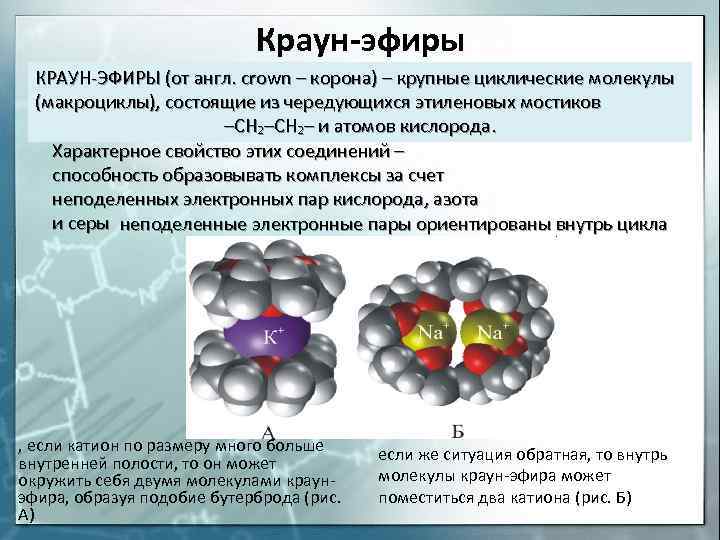 Краун-эфиры КРАУН-ЭФИРЫ (от англ. crown — корона) — крупные циклические молекулы (макроциклы), состоящие из чередующихся этиленовых мостиков -СН 2- и атомов кислорода. Характерное свойство этих соединений — способность образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы неподеленные электронные пары ориентированы внутрь цикла , если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краунэфира, образуя подобие бутерброда (рис. А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. Б)
Краун-эфиры КРАУН-ЭФИРЫ (от англ. crown — корона) — крупные циклические молекулы (макроциклы), состоящие из чередующихся этиленовых мостиков -СН 2- и атомов кислорода. Характерное свойство этих соединений — способность образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы неподеленные электронные пары ориентированы внутрь цикла , если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краунэфира, образуя подобие бутерброда (рис. А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. Б)
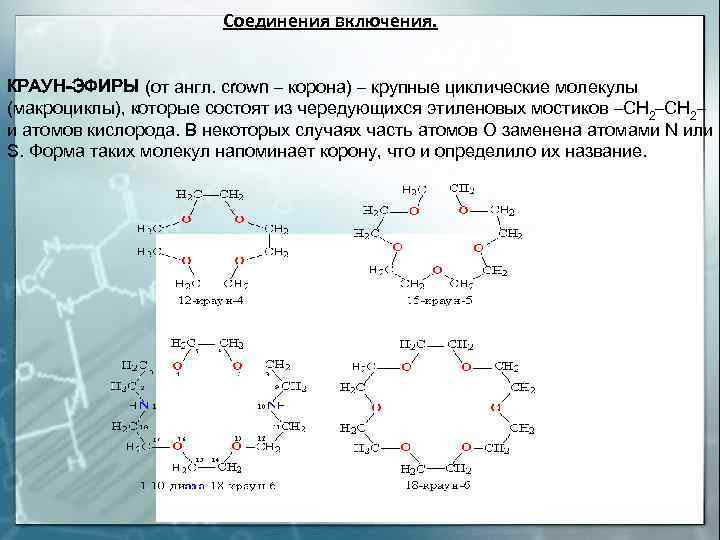 Соединения включения. КРАУН-ЭФИРЫ (от англ. crown — корона) — крупные циклические молекулы (макроциклы), которые состоят из чередующихся этиленовых мостиков -СН 2- и атомов кислорода. В некоторых случаях часть атомов О заменена атомами N или S. Форма таких молекул напоминает корону, что и определило их название.
Соединения включения. КРАУН-ЭФИРЫ (от англ. crown — корона) — крупные циклические молекулы (макроциклы), которые состоят из чередующихся этиленовых мостиков -СН 2- и атомов кислорода. В некоторых случаях часть атомов О заменена атомами N или S. Форма таких молекул напоминает корону, что и определило их название.
 Реакции комплексообразования. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 оранж. Hg. I 2 ↓ + 2 KI (р-р. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый Суммарная реакция: Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый
Реакции комплексообразования. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 оранж. Hg. I 2 ↓ + 2 KI (р-р. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый Суммарная реакция: Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый
Источник
Комплексное соединение гемоглобин. Обратимые и необратимые реакции.
Инфоурок
› Химия ›Презентации›Комплексное соединение гемоглобин. Обратимые и необратимые реакции.
Описание презентации по отдельным слайдам:
1 слайд
Описание слайда:
«Комплексное соединение — гемоглобин. Обратимые и необратимые химические реакции»
2 слайд
Описание слайда:
Цель исследования: изучение строения и биохимических свойств гемоглобина как жизненно важного комплексного соединения с точки зрения обратимых и необратимых реакций.
3 слайд
Описание слайда:
Задачи: • изучить историю возникновения и развития координационной теории; • изучить строение и классификацию комплексного соединения — гемоглобина; • исследовать биохимические свойства комплексного соединения — гемоглобина; • провести качественные реакции; • получить комплексные соединения гемоглобина и сравнить их прочность; • исследовать обратимые и необратимые реакции, лежащие в основе биохимических свойств комплексного соединения гемоглобина крови.
4 слайд
Описание слайда:
Объект исследования: комплексное соединение — гемоглобин крови теленка. Предмет исследования: строение и свойства гемоглобина. Методы исследования: анализ, синтез, аналогия, моделирование, обобщение, вывод, эксперимент, наблюдение.
5 слайд
Описание слайда:
Гипотеза: комплексное соединение — гемоглобин, являясь составной частью крови, может вступать в обратимые и необратимые реакции с различными веществами.
6 слайд
Описание слайда:
Актуальность: Гемоглобин — комплексное соединение, какое химическое строение имеет гемоглобин, какие изменения происходят с гемоглобином под воздействием различных факторов и какое влияние эти изменения оказывают на жизнедеятельность организмов. Решение этой проблемы можно ярко показать на примере комплексного соединения — гемоглобина крови, что и определяет выбор темы исследования.
7 слайд
Описание слайда:
Новизна: до настоящего времени в нашем образовательном учреждении не проводились исследования по данной тематике; гемоглобин, как комплексное соединение, представляет интерес при изучении отдельных тем биологии и химии; в открытом доступе мало или вообще отсутствуют теоретические и практические данные по изучаемой тематике.
8 слайд
Описание слайда:
Практическая значимость: исследовав состав и биохимические свойства гемоглобина, можно дать рекомендации по соблюдению здорового образа жизни, по рациональному отношению к своему здоровью и раннему выявлению заболеваний, употреблению продуктов питания повышающих уровень гемоглобина в организме.
9 слайд
Описание слайда:
Теоретическая часть
10 слайд
Описание слайда:
История развития координационной теории Первый период. С древних времен и до начала 18 века ученые и ремесленники использовали и даже синтезировали комплексные соединения, хотя и неосознанно. С начала 18 века до 1893 года идет целенаправленный синтез комплексных соединений. С 1893 года по 1940 год — создание, обоснование и победа координационной теории А. Вернера. С 1940 года и по настоящее время — современный период укрепления и всестороннего развития координационной теории.
11 слайд
Описание слайда:
Комплексное соединение — гемоглобин. Строение
12 слайд
Описание слайда:
Производные гемоглобина Дезоксигемоглобин; Оксигемоглобин (HbO2); Карбоксигемоглобин (HbCO); Метгемоглобин (мет-Hb; pH 7,0-7,4); Циан-метгемоглобин (CN-мет-Hb).
13 слайд
Описание слайда:
Метаболизм гемоглобина Молодые формы эритроцитов: нормобласты; эритробласты; ретикулоциты. , Функции гемоглобина буферные свойства гемоглобина, поддержание кислотно -щелочного равновесия в организме участие в газообмене между организмом и внешней средой
14 слайд
Описание слайда:
Клинические показания гемоглобина
15 слайд
Описание слайда:
Продукты с высоким содержанием железа
16 слайд
Описание слайда:
Продукты с высоким содержанием железа
17 слайд
Описание слайда:
Специальные рецепты для повышения гемоглобина Стакан грецких орехов и стакан сырой гречневой крупы перемолоть, добавить стакан меда, все перемешать, каждый день есть по столовой ложке. Грецкие орехи, курага, мед, изюм — все в пропорции 1:1 — перемолоть и тщательно перемешать, есть по 1-3 столовые ложки в день(один из лучших рецептов не только для поднятия гемоглобина, но и для обеспечения организма необходимыми витаминами). По 1 стакану чернослива, кураги, грецких орехов, изюма перемолоть, добавить мед, добавить 1-2 лимона со шкуркой (вместо лимона можно добавить сок алоэ), есть по 1-3 столовые ложки в день.
18 слайд
Описание слайда:
Практическая часть
19 слайд
Описание слайда:
Опыт 1. Свертывание белка гемоглобина под действием спирта. Реактивы и оборудование: Спирт 96%-ный, 40%-ный раствор спирта, кровь теленка; пробирки химические или пробирки химические для микрореакций. В две пробирки помещаем 3 мл крови теленка. В первую приливаем 96%-ный спирт, во вторую — 40% спирт. В обеих пробирках наблюдается коагуляция белка. Однако с чистым спиртом коагуляция идет сильнее и красная пигментация почти исчезает, в отличие от второй пробирки, где красная пигментация сохраняется.
20 слайд
21 слайд
Описание слайда:
Опыт 2. Свертывание белка гемоглобина под действием соляной кислоты. Реактивы и оборудование: 10%-ная кислота соляная, 0,5 %-ная кислота соляная, кровь теленка; пробирки химические или пробирки химические для микрореакций. В три пробирки помещаем по 1 мл крови теленка. Первую пробирку оставляем для контроля, во вторую пробирку добавляем 0,5 %-ный раствор соляной кислоты, в третью — 10%-ный раствор соляной кислоты. При добавлении 10%-ного раствора наблюдается полная коагуляция белка гемоглобина с исчезновением кроваво-красного окрашивания. При использовании соляной кислоты, разбавленной в 20 раз, также наблюдается коагуляция белка и изменения окраски, но в значительно меньшей степени.
22 слайд
23 слайд
Описание слайда:
Опыт 3. Свертывание белка гемоглобина под действием растворов солей тяжелых металлов. Реактивы и оборудование: 1%-ный раствор ацетата свинца, 1%-ный раствор сульфата меди (II), 1%-ный раствор хлорида бария, кровь теленка; пробирки химические или пробирки химические для микрореакций. В три пробирки помещаем по 5 мл крови теленка. Первую пробирку добавляем ацетат свинца, во вторую — соль хлорида бария, в третью — соль сульфата меди (II). При добавлении растворов солей меди и свинца, наблюдается полная коагуляция белка гемоглобина. При действии раствора соли бария коагуляция не наблюдается
24 слайд
25 слайд
Описание слайда:
Опыт 4. Качественная реакция на ионы Fe2+ гемоглобина. Реактивы и оборудование: 1%-ные растворы: KSCN, К3[Fe(CN)6], К4[Fe(CN)6], кровь теленка; пробирки химические или пробирки химические для микрореакций. В три пробирки помещаем по 1 мл крови теленка. Первую пробирку добавляем раствор KSCN, во вторую — К4[Fe(CN)6], в третью — К3[Fe(CN)6]. В первых двух пробирках не происходит изменение окраски раствора. В третьей наблюдается появление сине-зеленого окрашивания.
26 слайд
27 слайд
Описание слайда:
Опыт 5. Отделение белковой части крови и проверка наличия свободного от гемоглобина железа. Реактивы и оборудование: Кровь теленка, 1%-ный раствор К3[Fe(CN)6]; пробирки химические или пробирки химические для микрореакций. В две пробирки наливаем одинаковое количество крови. Первую пробирку оставляем как контрольную, а вторую добавляем соляную кислоту. Свернувшийся белок гемоглобина отделяем от жидкости. Проводим качественную реакцию на ионы Fe (II), не связанные с гемоглобином крови. Изменение окраски в типичную темно-синюю для ионов Fe (II) не наблюдается.
28 слайд
29 слайд
Описание слайда:
Опыт 6. Равновесие в системе: венозная кровь ↔ артериальная кровь. Реактивы и оборудование: Кровь теленка; пробирки химические или пробирки химические для микрореакций. В две пробирки наливаем одинаковое количество крови. Первую пробирку оставляем как контрольную, а вторую интенсивно встряхиваем. При встряхивании пробирки с кровью в течение 5 минут, кровь приобретает алую окраску, характерную для артериальной крови. Через 30 минут после встряхивания, кровь вновь приобретает темную окраску, характерную для венозной крови.
30 слайд
31 слайд
Описание слайда:
Опыт 7. Получение равновесного комплекса карбоксигемоглобина. Реактивы и оборудование: Для получения кислорода СО (конц. Н2SO4 и муравьиная кислота), кровь теленка; пробирки химические или пробирки химические для микрореакций. В две пробирки помещаем кровь теленка. Через одну пробирку с кровью пропускаем газ СО в течении 5 минут, а другую оставляем для сравнения. В пробирке образуется комплекс вишневого цвета карбоксигемоглобин HbCO.
32 слайд
33 слайд
Описание слайда:
Опыт 8. Обратимые процессы комплекса карбоксигемоглобина. Реактивы и оборудование: Для получения кислорода O2 (Н2О2 и MnO2), карбоксигемоглобин (получен в опыте 7), кровь теленка; пробирки химические или пробирки химические для микрореакций. Через карбоксигемоглобин, полученный в опыте 7, пропускаем кислород в течении 10 минут. Вторая пробирка с кровью теленка — для контроля. В первой пробирке наблюдается восстановление до цвета контрольного образца крови в течении 3 часов.
34 слайд
35 слайд
Описание слайда:
Опыт 9. Равновесие в системе лекарственного железосодержащего лекарственного препарата мальтофер. Реактивы и оборудование: Мальтофер (активное вещество железо (III) гидроксид полимальтозат), 10%-ный раствор НCl, 1%-ные растворы: KSCN, К3[Fe(CN)6], К4[Fe(CN)6]; пробирки химические или пробирки химические для микрореакций. В три пробирки наливаем одинаковое количество препарата мальтофера. В первую пробирку добавляем KSCN, вторую — К4[Fe(CN)6], в третью — К3[Fe(CN)6]. Никаких видимых изменений окраски не наблюдается
36 слайд
37 слайд
Описание слайда:
Выводы: 1. Изучили историю возникновения и развития координационной теории. 2. Изучили строение и классификацию комплексного соединения — гемоглобина. Строение комплекса гемоглобина соответствует основным положениям теории Вернера. В составе гемоглобина отсутствует ион Fe3+. Наличие белка подтверждено в опытах с соляной кислотой и этиловым спиртом: коагуляция белка — глобина. 3. Исследовали биохимические свойства гемоглобина, его взаимодействие с кислородом, оксидом углерода (II), углекислым газом, этиловым спиртом, соляной кислотой, солями тяжелых металлов. 4. Качественные реакции, проведенные с гемоглобином, подтвердили, что в состав гемоглобина входит белок, а двухвалентное железо прочно связано с белковой частью. 5. В ходе работы были получены комплексные соединения гемоглобина: оксигемоглобин (HbO2), карбогемоглобин (HbCO2), карбоксигемоглобин (HbCO). Устойчивость комплексов возрастает в ряду: HbO2→HbCO2→HbCO. 6. Необратимыми являются реакции гемоглобина с спиртом, кислотами и соединениями меди и свинца. Реакции гемоглобина с кислородом, оксидом углерода (II) и оксидом углерода (IV) являются обратимыми.
38 слайд
Описание слайда:
Заключение. На основе теоретических знаний и проведенных исследований, нами были проведены обратимые и необратимые реакции комплексного соединения — гемоглобина крови. Полученные результаты исследования хорошо коррелируются с теорией комплексных соединений Вернера.
39 слайд
Описание слайда:
Спасибо за внимание!
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Пожаловаться на материал
Курс повышения квалификации
Курс профессиональной переподготовки
Учитель химии
Курс профессиональной переподготовки
Учитель биологии и химии
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Краткое описание документа:
Проверен экспертом
Общая информация
Учебник: «Химия. Углубленный уровень», Габриелян О.С.
Тема: § 1. Предмет органической химии. Органические вещества
Номер материала: ДБ-601999
Вам будут интересны эти курсы:
Оставьте свой комментарий
Источник