Комплексообразователь в молекуле гемоглобина
Содержание статьи
Комплексные соединения Гемоглобин Hb 4 O
 Комплексные соединения
Комплексные соединения
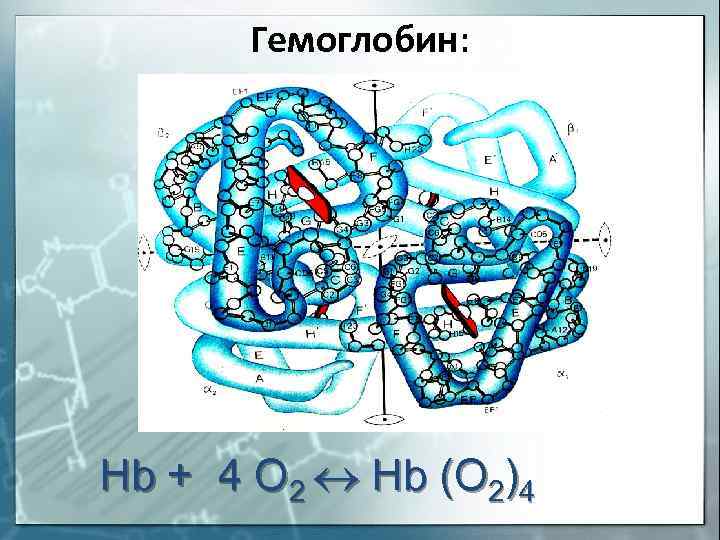 Гемоглобин: Hb + 4 O 2 Hb (O 2)4
Гемоглобин: Hb + 4 O 2 Hb (O 2)4
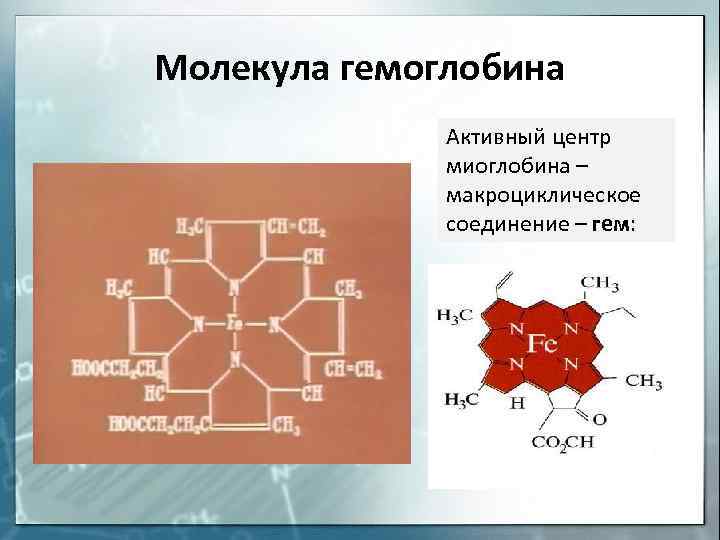 Молекула гемоглобина Активный центр миоглобина — макроциклическое соединение — гем:
Молекула гемоглобина Активный центр миоглобина — макроциклическое соединение — гем:
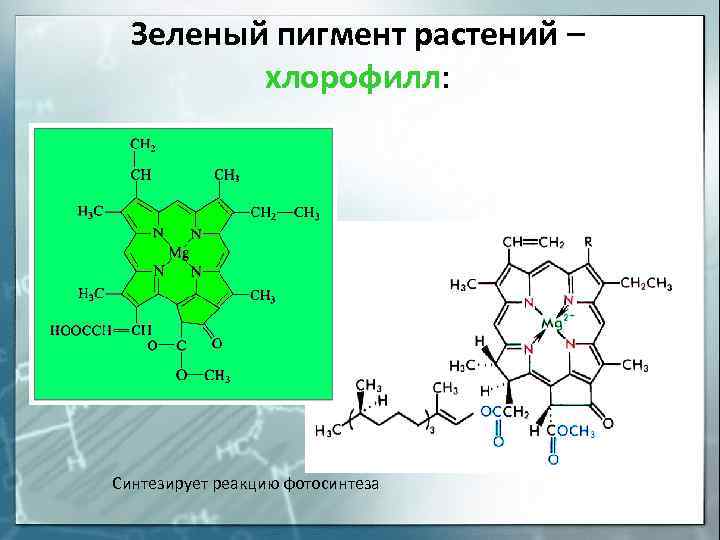 Зеленый пигмент растений — хлорофилл: Синтезирует реакцию фотосинтеза
Зеленый пигмент растений — хлорофилл: Синтезирует реакцию фотосинтеза
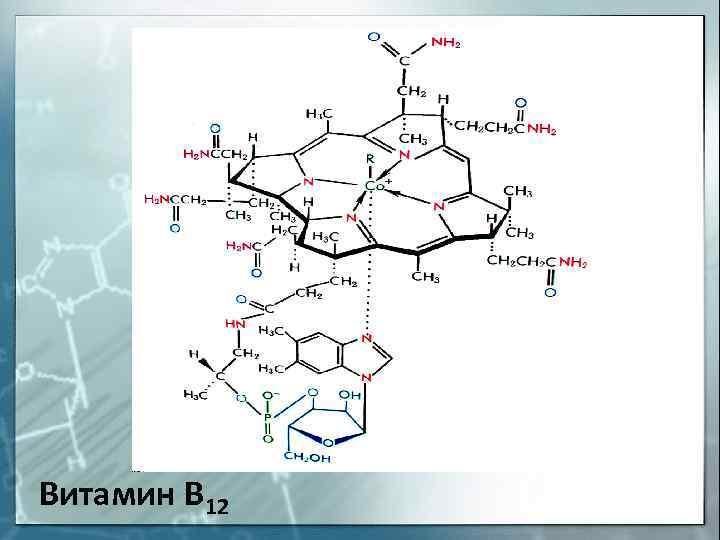 Витамин В 12
Витамин В 12
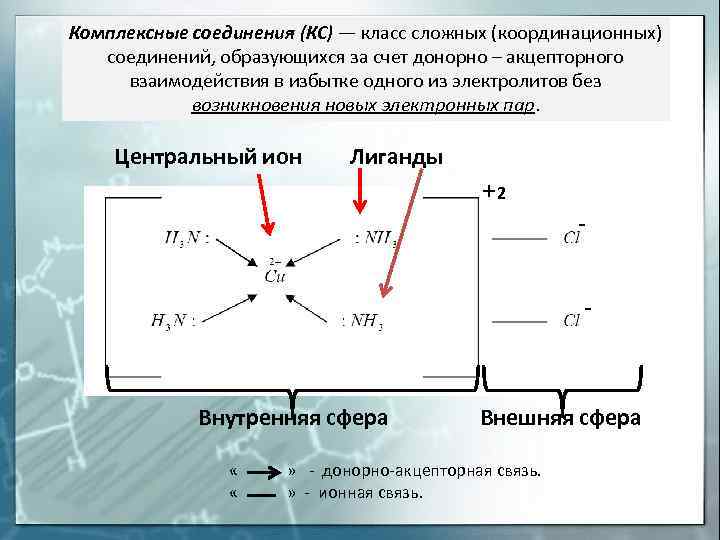 Комплексные соединения (КС) — класс сложных (координационных) соединений, образующихся за счет донорно — акцепторного взаимодействия в избытке одного из электролитов без возникновения новых электронных пар. Центральный ион Лиганды 2 Внутренняя сфера Внешняя сфера « » — донорно-акцепторная связь. « » — ионная связь.
Комплексные соединения (КС) — класс сложных (координационных) соединений, образующихся за счет донорно — акцепторного взаимодействия в избытке одного из электролитов без возникновения новых электронных пар. Центральный ион Лиганды 2 Внутренняя сфера Внешняя сфера « » — донорно-акцепторная связь. « » — ионная связь.
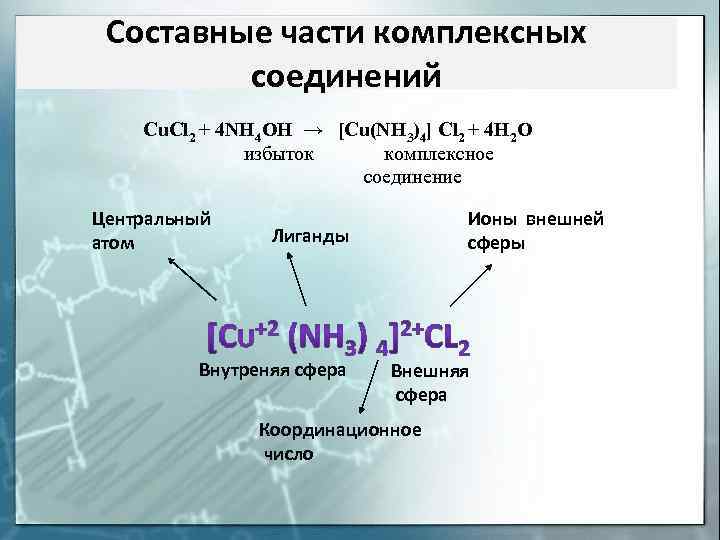 Составные части комплексных соединений Cu. Cl 2 + 4 NH 4 OH → [Cu(NH 3)4] Cl 2 + 4 H 2 O избыток комплексное соединение Центральный атом Ионы внешней сферы Лиганды Внутреняя сфера Внешняя сфера Координационное число
Составные части комплексных соединений Cu. Cl 2 + 4 NH 4 OH → [Cu(NH 3)4] Cl 2 + 4 H 2 O избыток комплексное соединение Центральный атом Ионы внешней сферы Лиганды Внутреняя сфера Внешняя сфера Координационное число
 Характеристики комплексов Заряд комплексного иона равен алгебраической сумме зарядов (или степеней окисления) комплексообразователя и лигандов. Z = Zко +∑Zлиг Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с донорными атомами лигандов, т. е. координационное число (КЧ). Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости (Kн).
Характеристики комплексов Заряд комплексного иона равен алгебраической сумме зарядов (или степеней окисления) комплексообразователя и лигандов. Z = Zко +∑Zлиг Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с донорными атомами лигандов, т. е. координационное число (КЧ). Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости (Kн).
 Ковалентная (диссоциация по типу слабого электролита) Ионная связь (диссоциация по типу сильного электролита) [Cu(NH 3)4] Cl 2 → [Cu(NH 3)4]2+ + 2 Cl-
Ковалентная (диссоциация по типу слабого электролита) Ионная связь (диссоциация по типу сильного электролита) [Cu(NH 3)4] Cl 2 → [Cu(NH 3)4]2+ + 2 Cl-
 Внешняя сфера комплексного соединения — ионы и (или) молекулы, не находящиеся в непосредственной химической связи с комплексообразователем, но нейтрализующие заряд комплексного иона (внутренней сферы) Внутренняя (координационная) сфера комплексного соединения — совокупность комплексообразователя и непосредственно с ним связанных лигандов Лиганды — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно-акцепторной связью. Центральный атом (комплексообразователь) — выполняет роль акцептора электронных пар и поэтому комплексообразователем могут быть любые частицы, имеющие вакантные орбитали.
Внешняя сфера комплексного соединения — ионы и (или) молекулы, не находящиеся в непосредственной химической связи с комплексообразователем, но нейтрализующие заряд комплексного иона (внутренней сферы) Внутренняя (координационная) сфера комплексного соединения — совокупность комплексообразователя и непосредственно с ним связанных лигандов Лиганды — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно-акцепторной связью. Центральный атом (комплексообразователь) — выполняет роль акцептора электронных пар и поэтому комплексообразователем могут быть любые частицы, имеющие вакантные орбитали.
 комплексообразователи Типичными комплексообразователями являются катионы d- и f- элементов, имеющие вакантные орбитали, например Ag+, Au+, Cu 2+, Zn 2+, Cd 2+, Hg 2+, Fe 3+, Co 2+, Ni 2+, Pt 4+, La 3+, Eu 2+, Th 4+, U 4+ и нейтральные атомы металлов того же типа, например Co, Ni, Fe.
комплексообразователи Типичными комплексообразователями являются катионы d- и f- элементов, имеющие вакантные орбитали, например Ag+, Au+, Cu 2+, Zn 2+, Cd 2+, Hg 2+, Fe 3+, Co 2+, Ni 2+, Pt 4+, La 3+, Eu 2+, Th 4+, U 4+ и нейтральные атомы металлов того же типа, например Co, Ni, Fe.
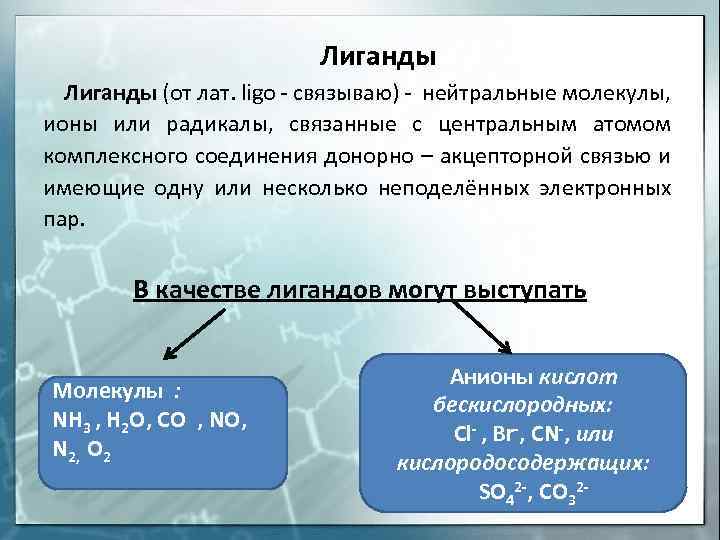 Лиганды (от лат. ligo — связываю) — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно — акцепторной связью и имеющие одну или несколько неподелённых электронных пар. В качестве лигандов могут выступать Молекулы : NH 3 , H 2 O, CO , NO, N 2, O 2 Анионы кислот бескислородных: Cl- , Br-, CN-, или кислородосодержащих: SO 42 -, CO 32 —
Лиганды (от лат. ligo — связываю) — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно — акцепторной связью и имеющие одну или несколько неподелённых электронных пар. В качестве лигандов могут выступать Молекулы : NH 3 , H 2 O, CO , NO, N 2, O 2 Анионы кислот бескислородных: Cl- , Br-, CN-, или кислородосодержащих: SO 42 -, CO 32 —
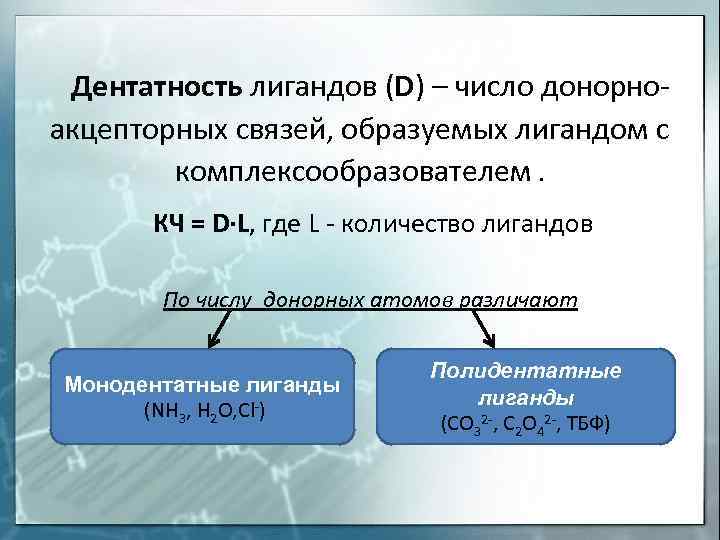 Дентатность лигандов (D) — число донорноакцепторных связей, образуемых лигандом с комплексообразователем. КЧ = D∙L, где L — количество лигандов По числу донорных атомов различают Монодентатные лиганды (NH 3, H 2 O, Cl-) Полидентатные лиганды (CO 32 -, C 2 O 42 -, ТБФ)
Дентатность лигандов (D) — число донорноакцепторных связей, образуемых лигандом с комплексообразователем. КЧ = D∙L, где L — количество лигандов По числу донорных атомов различают Монодентатные лиганды (NH 3, H 2 O, Cl-) Полидентатные лиганды (CO 32 -, C 2 O 42 -, ТБФ)
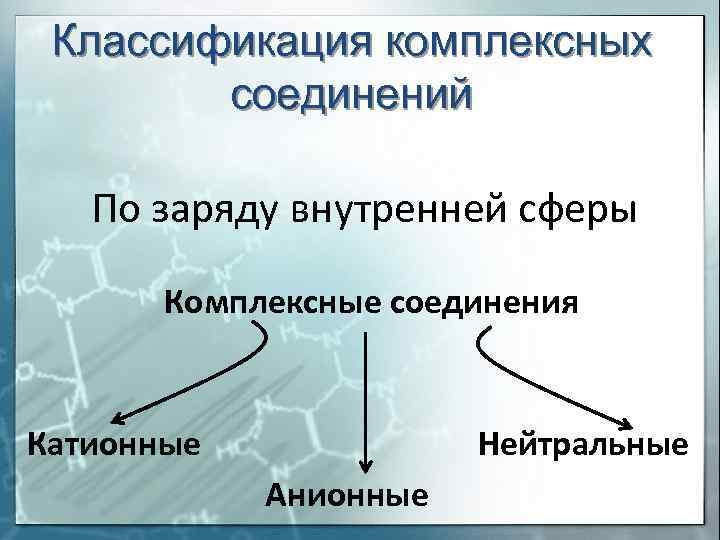 Классификация комплексных соединений По заряду внутренней сферы Комплексные соединения Катионные Нейтральные Анионные
Классификация комплексных соединений По заряду внутренней сферы Комплексные соединения Катионные Нейтральные Анионные
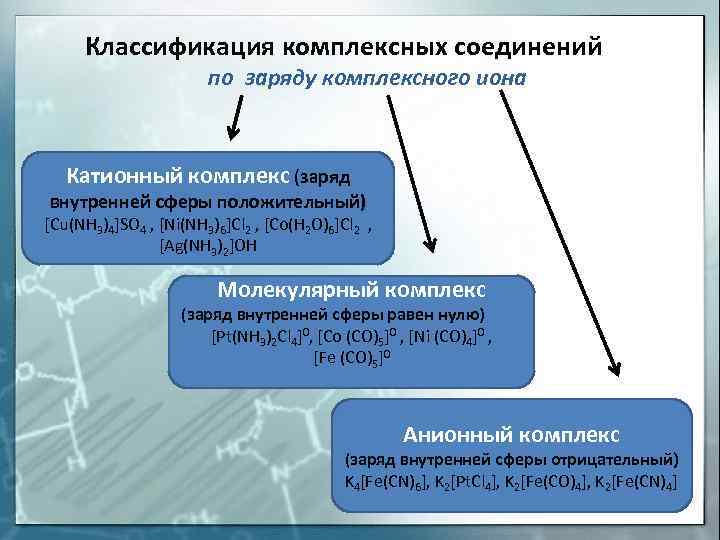 Классификация комплексных соединений по заряду комплексного иона Катионный комплекс (заряд внутренней сферы положительный) [Cu(NH 3)4]SO 4 , [Ni(NH 3)6]Cl 2 , [Co(H 2 O)6]Cl 2 , [Ag(NH 3)2]OH Молекулярный комплекс (заряд внутренней сферы равен нулю) [Pt(NH 3)2 Cl 4]0, [Co (CO)5]0 , [Ni (CO)4]0 , [Fe (CO)5]0 Анионный комплекс (заряд внутренней сферы отрицательный) K 4[Fe(CN)6], K 2[Pt. Cl 4], K 2[Fe(CO)4], K 2[Fe(CN)4]
Классификация комплексных соединений по заряду комплексного иона Катионный комплекс (заряд внутренней сферы положительный) [Cu(NH 3)4]SO 4 , [Ni(NH 3)6]Cl 2 , [Co(H 2 O)6]Cl 2 , [Ag(NH 3)2]OH Молекулярный комплекс (заряд внутренней сферы равен нулю) [Pt(NH 3)2 Cl 4]0, [Co (CO)5]0 , [Ni (CO)4]0 , [Fe (CO)5]0 Анионный комплекс (заряд внутренней сферы отрицательный) K 4[Fe(CN)6], K 2[Pt. Cl 4], K 2[Fe(CO)4], K 2[Fe(CN)4]
![2+ 3 - [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4](https://present5.com/presentation/-42515008_134710477/image-16.jpg) 2+ 3 — [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4 Cl 2] Cl [Pt(NH 3)2 Cl 2] 0 3 — [Fe(CO)5] K 3 [Fe(CN) 6]
2+ 3 — [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4 Cl 2] Cl [Pt(NH 3)2 Cl 2] 0 3 — [Fe(CO)5] K 3 [Fe(CN) 6]
![[Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2](https://present5.com/presentation/-42515008_134710477/image-17.jpg) [Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2 Cl 2] Дихлородиамминплатина [Cr(H 2 O)2(NH 3)3 Cl]Br 2 Бромид хлородиакватриамминхрома (III)
[Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2 Cl 2] Дихлородиамминплатина [Cr(H 2 O)2(NH 3)3 Cl]Br 2 Бромид хлородиакватриамминхрома (III)
 Двойные соли • Двойные соли являются сильными электролитами и в растворах диссоциируют полностью, т. к. связи между катионами металла и анионами кислотного остатка носят ионный характер: • KAl(SO 4)2 → K+ + Al 3+ + 2 SO 42 —
Двойные соли • Двойные соли являются сильными электролитами и в растворах диссоциируют полностью, т. к. связи между катионами металла и анионами кислотного остатка носят ионный характер: • KAl(SO 4)2 → K+ + Al 3+ + 2 SO 42 —
 Образование комплексных соединений Реакции комплексообразования: 1. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 2. Ni. Cl 2 + 4 NH 4 OH → [(Ni(NH 3 )4]Cl 2 + 4 H 2 O 3. UO² 2 — катион, который способен образовывать комплексы анионного типа (КЧ=8) Na 2 U 2 O 7↓ + 6 Na 2 CO 3 + 3 H 2 O → 2 Na 4[UO 2(CO 3)3] 2 UO 2 SO 4 + K 4[Fe(CN)6] → (UO 2)2[Fe(CN)6] ↓ + 2 K 2 SO 4 Cu. SO 4 + K 4[Fe(CN)6] → Cu 2[Fe(CN)6]↓ + 2 H 2 SO 4
Образование комплексных соединений Реакции комплексообразования: 1. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 2. Ni. Cl 2 + 4 NH 4 OH → [(Ni(NH 3 )4]Cl 2 + 4 H 2 O 3. UO² 2 — катион, который способен образовывать комплексы анионного типа (КЧ=8) Na 2 U 2 O 7↓ + 6 Na 2 CO 3 + 3 H 2 O → 2 Na 4[UO 2(CO 3)3] 2 UO 2 SO 4 + K 4[Fe(CN)6] → (UO 2)2[Fe(CN)6] ↓ + 2 K 2 SO 4 Cu. SO 4 + K 4[Fe(CN)6] → Cu 2[Fe(CN)6]↓ + 2 H 2 SO 4
![Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30](https://present5.com/presentation/-42515008_134710477/image-20.jpg) Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30 2 ст. [Cu(NH 3)3]2+ = [Cu(NH 3)2]2+ + NH 30 3 ст. [Cu(NH 3)2]2+ = [Cu(NH 3)]2+ + NH 30 4 ст. [Cu(NH 3)]2+ = Cu 2+ + NH 30 Общий процесс диссоциации комплекса: ∑ [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30
Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30 2 ст. [Cu(NH 3)3]2+ = [Cu(NH 3)2]2+ + NH 30 3 ст. [Cu(NH 3)2]2+ = [Cu(NH 3)]2+ + NH 30 4 ст. [Cu(NH 3)]2+ = Cu 2+ + NH 30 Общий процесс диссоциации комплекса: ∑ [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30
![Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ =](https://present5.com/presentation/-42515008_134710477/image-21.jpg) Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30
Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30
 Свойства константы нестойкости 1. Константы нестойкости характеризуют относительную устойчивость внутренней координационной сферы комплексов 2. Чем меньше КН , тем прочнее комплекс. 3. По КН, можно рассчитать концентрацию свободных ионов комплексообразователя в растворе комплексного соединения. 4. Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть трудно растворимое соединение или более устойчивый комплекс.
Свойства константы нестойкости 1. Константы нестойкости характеризуют относительную устойчивость внутренней координационной сферы комплексов 2. Чем меньше КН , тем прочнее комплекс. 3. По КН, можно рассчитать концентрацию свободных ионов комплексообразователя в растворе комплексного соединения. 4. Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть трудно растворимое соединение или более устойчивый комплекс.
![сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7](https://present5.com/presentation/-42515008_134710477/image-23.jpg) сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7 ∙ 10 -8 K[Ag(CN)2] , Kн = 1, 0 ∙ 10 -21 Допустим, что исходная концентрация этих комплексов равна 1 моль/л. Тогда: C(NH 3) = 2 x, C(CN-) = 2 x, C[Ag(NH 3)2]+ = 1 -x, C[Ag(CN)2]- = 1 -x. Так как x
сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7 ∙ 10 -8 K[Ag(CN)2] , Kн = 1, 0 ∙ 10 -21 Допустим, что исходная концентрация этих комплексов равна 1 моль/л. Тогда: C(NH 3) = 2 x, C(CN-) = 2 x, C[Ag(NH 3)2]+ = 1 -x, C[Ag(CN)2]- = 1 -x. Так как x
 По константе нестойкости и заданной начальной концентрации комплекса можно рассчитать концентрацию комплексообразователя и лигандов. Для корректности расчетов возьмем раствор с избытком лигандов. K 4[Fe(CN)6] → 4 K ++ [Fe(CN)6]4 — ; C = 0, 1 M; Kн = 1, 0 ∙ 10 -37 ; избыток KCN →K+ + CN 0, 1 M 0, 1 M 1 M 1 M Fe [(CN)6]4 — Fe 2+ + 6 CN 0, 1 — x x 6 x+1 исходя из значений константы нестойкости x
По константе нестойкости и заданной начальной концентрации комплекса можно рассчитать концентрацию комплексообразователя и лигандов. Для корректности расчетов возьмем раствор с избытком лигандов. K 4[Fe(CN)6] → 4 K ++ [Fe(CN)6]4 — ; C = 0, 1 M; Kн = 1, 0 ∙ 10 -37 ; избыток KCN →K+ + CN 0, 1 M 0, 1 M 1 M 1 M Fe [(CN)6]4 — Fe 2+ + 6 CN 0, 1 — x x 6 x+1 исходя из значений константы нестойкости x
 Пространственное строение комплексов Геометрическая форма комплексов — это координационный многогранник, образованный в результате определенного расположения лигандов относительно комплексообразователя. Тип гибридизации определяется числом гибридных орбиталей, их формой, направлением в пространстве, взаимным влиянием друг на друга и определенную форму комплекса. Между координационным числом, типом гибридизации и формой есть взаимосвязь:
Пространственное строение комплексов Геометрическая форма комплексов — это координационный многогранник, образованный в результате определенного расположения лигандов относительно комплексообразователя. Тип гибридизации определяется числом гибридных орбиталей, их формой, направлением в пространстве, взаимным влиянием друг на друга и определенную форму комплекса. Между координационным числом, типом гибридизации и формой есть взаимосвязь:
 Пространственное строение комплексов Связь между координационным числом, типом гибридизации и формой:
Пространственное строение комплексов Связь между координационным числом, типом гибридизации и формой:
![Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4](https://present5.com/presentation/-42515008_134710477/image-27.jpg) Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4 d 10 5 s 1 — электронная конфигурация атома серебра Ag+ [ ]4 d 10 5 s 0 — электронная конфигурация иона серебра Вакантные 5 s- и 5 p- орбитали иона серебра являются акцепторами электронных пар атомов азота молекул аммиака (доноров) .
Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4 d 10 5 s 1 — электронная конфигурация атома серебра Ag+ [ ]4 d 10 5 s 0 — электронная конфигурация иона серебра Вакантные 5 s- и 5 p- орбитали иона серебра являются акцепторами электронных пар атомов азота молекул аммиака (доноров) .
![Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) - электронная конфигурация атома бора](https://present5.com/presentation/-42515008_134710477/image-28.jpg) Координационное число = 4 (строение комплекса [BF 4]- тетраэдрическое) — электронная конфигурация атома бора — электронная конфигурация катиона бора
Координационное число = 4 (строение комплекса [BF 4]- тетраэдрическое) — электронная конфигурация атома бора — электронная конфигурация катиона бора
![Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ - плоскоквадратная)](https://present5.com/presentation/-42515008_134710477/image-29.jpg) Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ — плоскоквадратная)
Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ — плоскоквадратная)
![Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– - октаэдрическое)](https://present5.com/presentation/-42515008_134710477/image-30.jpg) Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4- — октаэдрическое)
Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4- — октаэдрическое)
![Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– - октаэдрическое)](https://present5.com/presentation/-42515008_134710477/image-31.jpg) Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4- — октаэдрическое)
Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4- — октаэдрическое)
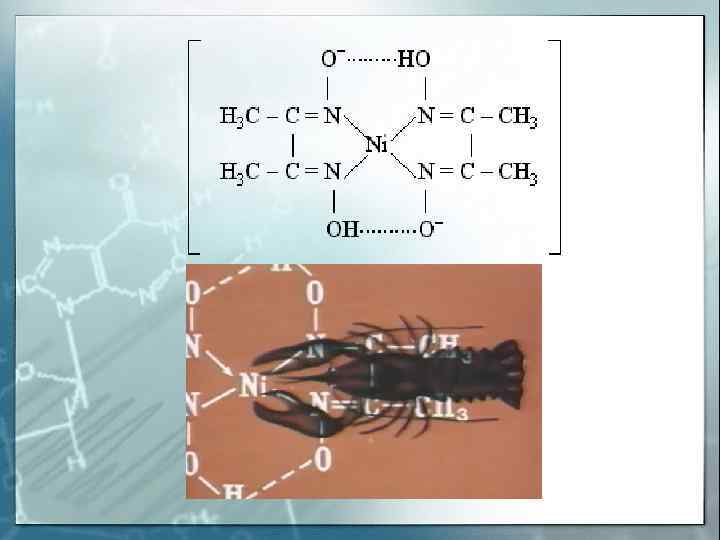
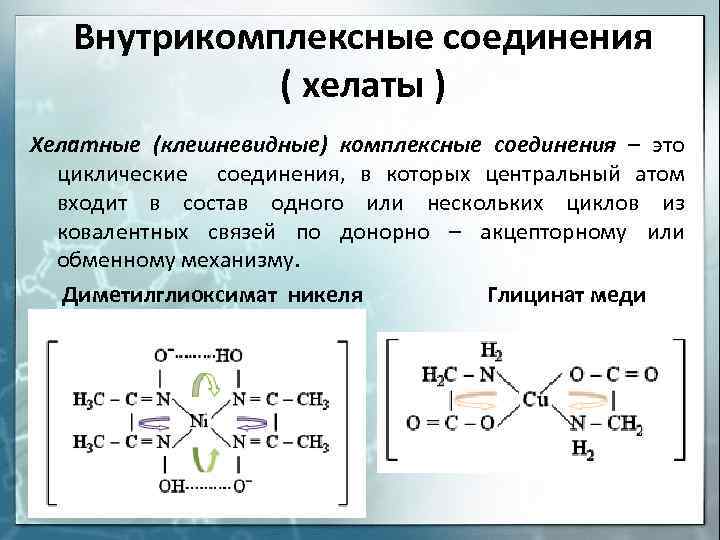 Внутрикомплексные соединения ( хелаты ) Хелатные (клешневидные) комплексные соединения — это циклические соединения, в которых центральный атом входит в состав одного или нескольких циклов из ковалентных связей по донорно — акцепторному или обменному механизму. Диметилглиоксимат никеля Глицинат меди
Внутрикомплексные соединения ( хелаты ) Хелатные (клешневидные) комплексные соединения — это циклические соединения, в которых центральный атом входит в состав одного или нескольких циклов из ковалентных связей по донорно — акцепторному или обменному механизму. Диметилглиоксимат никеля Глицинат меди
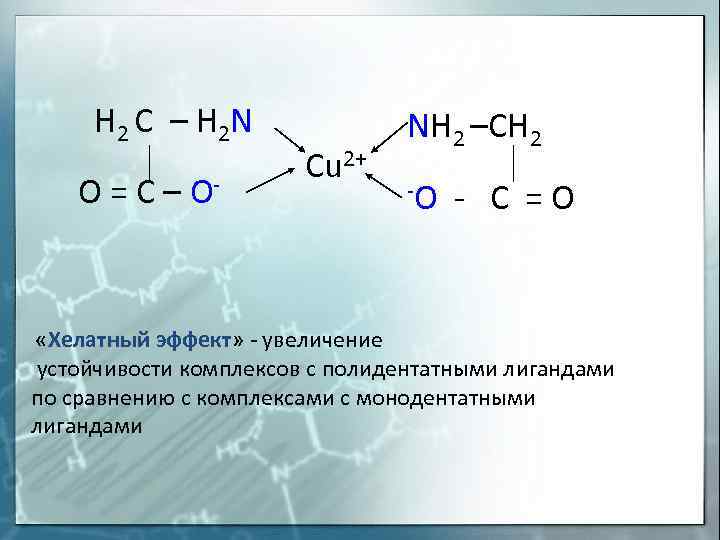 H 2 C — H 2 N O = C — O- «Хелатный Cu 2+ NH 2 -CH 2 -O — C = O эффект» — увеличение устойчивости комплексов с полидентатными лигандами по сравнению с комплексами с монодентатными лигандами
H 2 C — H 2 N O = C — O- «Хелатный Cu 2+ NH 2 -CH 2 -O — C = O эффект» — увеличение устойчивости комплексов с полидентатными лигандами по сравнению с комплексами с монодентатными лигандами
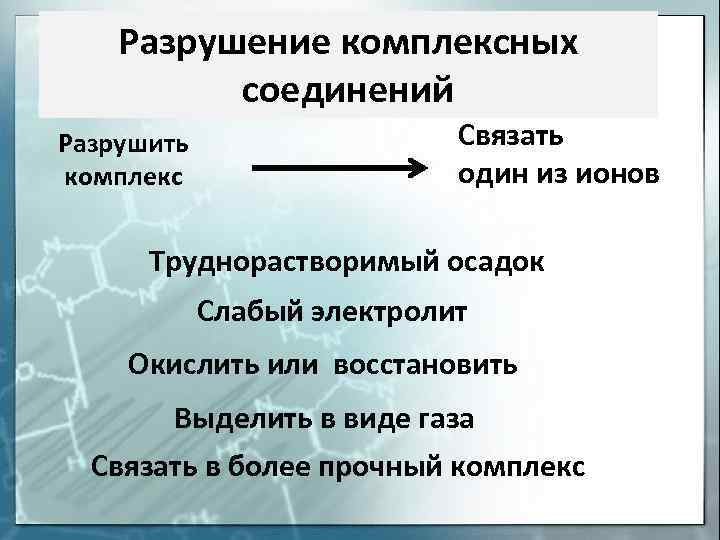 Разрушение комплексных соединений Разрушить комплекс Связать один из ионов Труднорастворимый осадок Слабый электролит Окислить или восстановить Выделить в виде газа Связать в более прочный комплекс
Разрушение комплексных соединений Разрушить комплекс Связать один из ионов Труднорастворимый осадок Слабый электролит Окислить или восстановить Выделить в виде газа Связать в более прочный комплекс
![[Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка +](https://present5.com/presentation/-42515008_134710477/image-37.jpg) [Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка + HNO 3 + KCN NH 4 NO 3 Образование более прочного комплекса Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть: трудно растворимое соединение или более устойчивый комплекс.
[Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка + HNO 3 + KCN NH 4 NO 3 Образование более прочного комплекса Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть: трудно растворимое соединение или более устойчивый комплекс.
![[Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9,](https://present5.com/presentation/-42515008_134710477/image-38.jpg) [Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9, 3 ·10 -8 ПРAg. I = 1, 5·10 -16 [Ag (NH 3)2]++2 CN- = [Ag(CN)2]- +2 NH 3 Кн = 8·10 -22
[Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9, 3 ·10 -8 ПРAg. I = 1, 5·10 -16 [Ag (NH 3)2]++2 CN- = [Ag(CN)2]- +2 NH 3 Кн = 8·10 -22
 Химические свойства комплексных соединений. Реакции комплексообразования: Ni. Cl 2 + 4 NH 4 OH → [Ni(NH 3 )4]Cl 2 + 4 H 2 O Реакции обмена с сохранением внутренней сферы комплекса: 4 Fe. Сl 3 + 3 K 4[Fe(CN)6] → Fe 4[Fe(CN)6]3↓ + 12 K Cl
Химические свойства комплексных соединений. Реакции комплексообразования: Ni. Cl 2 + 4 NH 4 OH → [Ni(NH 3 )4]Cl 2 + 4 H 2 O Реакции обмена с сохранением внутренней сферы комплекса: 4 Fe. Сl 3 + 3 K 4[Fe(CN)6] → Fe 4[Fe(CN)6]3↓ + 12 K Cl
![Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H](https://present5.com/presentation/-42515008_134710477/image-40.jpg) Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H 2 O → Cu. S↓ + Na 2 SO 4 + 4 NH 3 Реакция замещения лигандов во внутренней сфере: K 3[Fe. F 6] + 6 KSCNизб → K 3[Fe(SCN)6] +6 KF
Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H 2 O → Cu. S↓ + Na 2 SO 4 + 4 NH 3 Реакция замещения лигандов во внутренней сфере: K 3[Fe. F 6] + 6 KSCNизб → K 3[Fe(SCN)6] +6 KF
 Окислительно — восстановительные реакции с участием комплексных соединений сопровождаются изменением степени окисления комплексообразователя :
Окислительно — восстановительные реакции с участием комплексных соединений сопровождаются изменением степени окисления комплексообразователя :
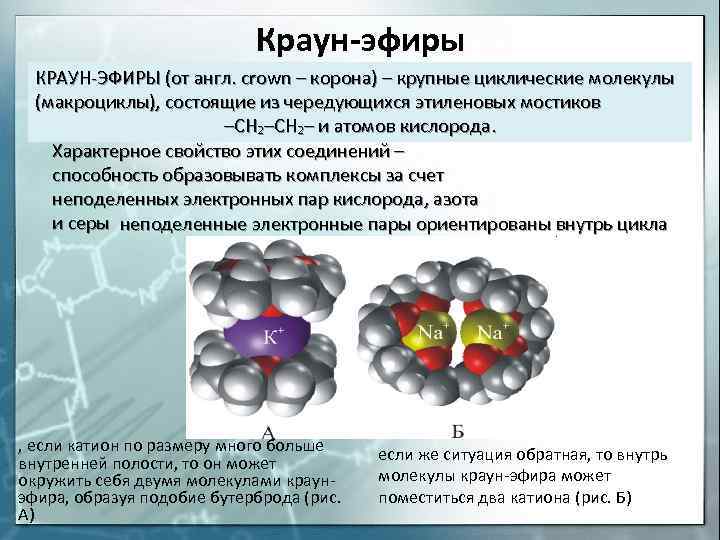 Краун-эфиры КРАУН-ЭФИРЫ (от англ. crown — корона) — крупные циклические молекулы (макроциклы), состоящие из чередующихся этиленовых мостиков -СН 2- и атомов кислорода. Характерное свойство этих соединений — способность образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы неподеленные электронные пары ориентированы внутрь цикла , если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краунэфира, образуя подобие бутерброда (рис. А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. Б)
Краун-эфиры КРАУН-ЭФИРЫ (от англ. crown — корона) — крупные циклические молекулы (макроциклы), состоящие из чередующихся этиленовых мостиков -СН 2- и атомов кислорода. Характерное свойство этих соединений — способность образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы неподеленные электронные пары ориентированы внутрь цикла , если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краунэфира, образуя подобие бутерброда (рис. А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. Б)
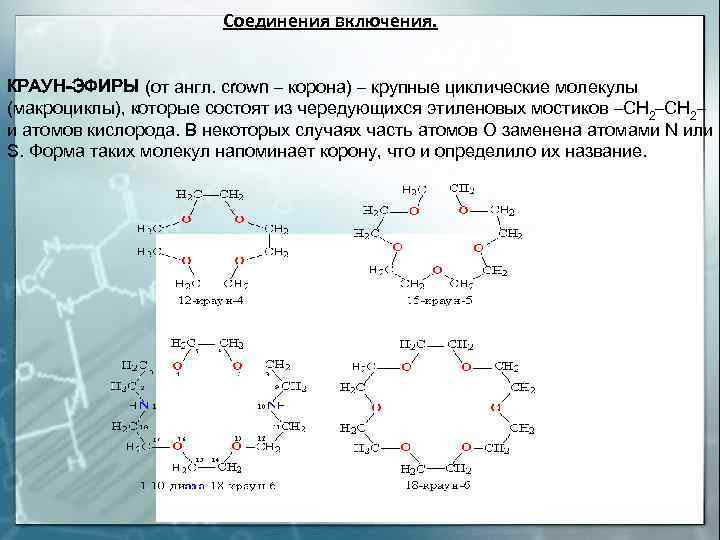 Соединения включения. КРАУН-ЭФИРЫ (от англ. crown — корона) — крупные циклические молекулы (макроциклы), которые состоят из чередующихся этиленовых мостиков -СН 2- и атомов кислорода. В некоторых случаях часть атомов О заменена атомами N или S. Форма таких молекул напоминает корону, что и определило их название.
Соединения включения. КРАУН-ЭФИРЫ (от англ. crown — корона) — крупные циклические молекулы (макроциклы), которые состоят из чередующихся этиленовых мостиков -СН 2- и атомов кислорода. В некоторых случаях часть атомов О заменена атомами N или S. Форма таких молекул напоминает корону, что и определило их название.
 Реакции комплексообразования. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 оранж. Hg. I 2 ↓ + 2 KI (р-р. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый Суммарная реакция: Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый
Реакции комплексообразования. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 оранж. Hg. I 2 ↓ + 2 KI (р-р. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый Суммарная реакция: Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый
Источник
емоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
| Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: 1. Функции клеток крови. Функции эритроцитов. Свойства эритроцитов. Цикл Эмбдена-Мейергофа. Строение эритроцитов. 2. Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина. 3. Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты. 4. Железо. Железо в норме. Роль ионов железа в эритропоэзе. Трансферрин. Потребность организма в железе. Дефицит железа. ОЖСС. 5. Эритропоэз. Эритробластические островки. Анемия. Эритроцитоз. 6. Регуляция эритропоэза. Эритропоэтин. Половые гормоны и эритропоэз. 7. Лейкоциты. Лейкоцитоз. Лейкопения. Гранулоциты. Лейкоцитарная формула. 8. Функции нейтрофильных гранулоцитов ( лейкоцитов ). Дефенсины. Кателицидины. Белки острой фазы. Хемотаксические факторы. 9. Бактерицидный эффект нейтрофилов. Гранулопоэз. Нейтрофильный гранулопоэз. Гранулоцитоз. Нейтропения. 10. Функции базофилов. Функции базофильных гранулоцитов. Нормальное количество. Гистамин. Гепарин. Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140-175) г гемоглобина, у женщин — 138 (123-153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20-30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50-80 % гемоглобина у него представлены гемоглобином F и 15-40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5-33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. — Также рекомендуем «Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.» |
Источник
. .
Комплексные соединения
Комплексные соединения составляют наиболее обширный и разнообразный класс химических соединений. В живых организмах присутствуют комплексные соединения биогенных металлов с белками (хлорофилл, гемоглобин), витаминами (В12 -комплекс кобальта) и другими веществами (инсулин -комплекс цинка, платинол -комплекс платины), играющими роль ферментов или выполняющими специфические функции в обмене веществ.
Часто при получении лекарственных препаратов на основе фармакологически активных комплексных соединений удается понизить токсичность, как металла, так и лигандов, связанных в комплексе, и модифицировать в желаемом направлении как биологическую активность. Так, весьма ядовитый КСN теряет свою токсичность при связывании в ферроцинид (желтая кровяная соль) или феррицианид (красная кровяная соль) калия.
Координационная теория Вернера. Строение комплексных соединений: центральный атом, лиганды, координационное число
Впервые свойства и строение комплексных соединений были объяснены в рамках координационной теории, предложенной швейцарским химиком А. Вернером (1892), хотя широкое признание данной теории получила лишь после создания электронной теории валентности (см задачу № 2, стр. 85 метод пособие Жолнина).
Комплексными соединениями называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома, окруженного лигандами. Комплексные соединения можно рассматривать как сложные соединения высшего порядка, состоящие из простых молекул, способных к самостоятельному существованию в растворе. Но, однако, в настоящее время четкого общепризнанного определения комплексных соединений не существует. Это обусловлено разнообразием комплексных соединений и их характерных свойств.
Координационную теорию Вернера рассмотрим на примере:
K3 [Fe(CN)6]
внешняя и внутренняя сфера
Согласно данной теории, центральный атом или ион, в большинстве случаев в форме катиона (обычно положительно заряженный), координирует (т.е. близко располагает) вокруг себя некоторое число анионов или молекул, которые называются лигандами, (или аддендами — старое название). Простые положительно заряженные катионы в роли лигандов не выступают. Число лигандов, окружающих центральный ион, называется координационным числом (КЧ). Центральный атом вместе с координированными лигандами образуют внутреннюю координационную (т.е. комплексную) сферу,которую при записи формулы заключают в квадратные скобки. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу.
В подавляющем большинстве комплексных соединений в качестве комплексообразователя выступают ионы переходных металлов, хотя известны комплексные соединения практически для всех элементов.
Координационное число может иметь значения 2; 3; 4; 5; 6 и т. д. вплоть до 12 (например, для некоторых соединений редкоземельных металлов). Наиболее часто встречаются координационные числа 2; 4; 6. Координационные числа выше 8 встречаются реже.
Значение кч комплексообразователя зависят от многих факторов:
— от природы лиганда и его электронных свойств;
— агрегатного состояния;
— концентрации компонентов;
— температуры раствора;
— но обычно оно равно удвоенному заряду иона комплексообразователя.
Во внутренней сфере связь комплексообразователя с лигандами имеет донорно — акцепторное происхождение и является ковалентной. Роль акцептора электронов выполняет комплексообразователь, имеющий свободные орбитали и достаточно большой положительный заряд ядра, а роль донора выступают лиганды, способные отдавать комплексообразователью неподеленную электронную пару. Ионы, находящиеся во внешней сфере, связаны с комплексным ионам в основном силами электростатическогого взаимодействия.
Определение заряда (z) основных частиц комплексного соединения на примере: K[AI(OH)4].
Заряд внутренней сферы комплексного соединения равен алгебраической сумме зарядов комплексообразователя и всех лигандов: [AI3+(OH-)4]z-? z=+3+4(-1)=-1, т.е [AI(OH)4]-.
Наоборот, зная заряд комплексного иона и заряды лигандов [AI(OH)4]-), можно определить степени окисления комплексообразователя: х+ (-1)ž4= -1; х= +3. Степень окисления алюминия +3.
Заряд внутренней сферы компенсируется ионами внешней сферы комплексного соединения. В приведенном примере внутренней координационной сферой является [AI(OH)4]-. Заряд аниона в этом случает компенсирует катион К+, находящиеся во внешней координационной сфере.
Классификация лигандов
В качестве лигандов выступают молекулы или ионы, содержащие донорные атомы (наиболее распространенные N, Р, О, галогены), способные отдавать комплексообразователю неподеленную электронную пару.
Число мест, занимаемых каждым лигандом во внутренней сфере комплексного соединения, называется координационной емкостью (дентатностью) лиганда. Она определяется числом электронных пар лиганда, которые участвуют в образовании координационной связи с центральным атомом.
По числу связей, образуемых лигандами с комплексообразователем, лиганды делятся на моно-, ди- и полидентатные::
1) К монодентатным относятся анионы F-, СI-, Вг-, I-, H-, CN-, NO-, SCN- и т.д., нейтральные молекулы (NH3, амины, например, первичные RNH2 (R — органический радикал), молекулы воды и т. д.), имеющие только один донорный атом.
2) К бидентатным лигандам относятся молекулы или ионы, содержащие две функциональные группы, способные быть донором двух электронных пар. Например,
3) Кполидентатным лигандам можно отнести 6-дентатный лиганд тетраанион этилендиаминтриуксусной кислоты (ЭДТА):
Номенклатура комплексных соединений.
Название комплексных солей образуют по общему правилу: сначала называют анион, а затем — катион в родительном падеже
Названия комплексных соединений образуются аналогично названиям обычных солей с той лишь разницей, что указываются лиганды и степень окисления центрального атома. К названиям лигандов-анионов добавляют суффикс -о (сульфато-, хлоро-, бромо-, циано-, и т.д.). Наиболее важные лиганды-молекулы: Н2О — аква, NН3 — аммин, СО — карбонил. Число лигандов каждого рода указывают греческими числительными: ди-, три-, тетра- и т.д. Если комплексная частица является анионом, то ее название заканчивается суффиксом -«ат» (примеры: цинкат, хромат, феррат).
Если присутствуют несколько лигандов, они перечисляются в алфавитном порядке и префиксы не изменяют этот порядок, например [CrCI2(H2O)4]+- тетрааквадихлорохром (III)-ион. (хотя рекомендуют сначала указывать название отрицательно заряженных лигандов, а затем названия нейтральных молекул).
Классификация комплексных соединений
Существует несколько систем классификации комплексных соединений, которые основываются на различных принципах.
1. По знаку заряда комплекса.
Комплексное соединение [Pt(NH3)2CI2] внешней сферы не имеет и заряд комплекса равен 0.
2. По принадлежности комплексного соединения к определенному классу соединений
Есть и вещества, не диссоциирующие на ионы, т.е. неэлектролиты
3. По природе лиганда.
— аквакомплексы (лигандом выступает вода),
— аммиакаты (лигандом выступает аммиак),
— ацидокомплексы (анионы — кислоты),
— гидроксокомплексы (ОН-),
— комплексы с макроциклическими лигандами, внутри которых размещается центральный атом (хлорофилл, гемоглобин, цианокобаламин , см. стр. 316, Попков В.А.).
4. По внутренней структуре комплекса:
— моноядерные — если комплекс содержит только один атом металла — комплексообразователя (пример, PdCI4 — имеет один атом палладия);
— многоядерные или полиядерные — если он содержит два или более атомов металла ( комплекс платины [Pt2(NH3)2CI4] — содержащий два атома платины.
Для комплексных соединений, содержащих во внутренней сфере различные лиганды, характерна геометрическая изомерия, когда при одинаковом составе внутренней сферы лиганды в ней располагаются по- разному относительно друг друга.
.
Геометрические изомеры комплексных соединений отличаются не только по физическим и химическим свойствам, но и биологической активностью. Цис- изомер Pt(NH3)2CI2 имеет ярко выраженную противоопухолевую активность, а транс-изомер — нет.
Устойчивость комплексных соединений в растворах
Внутренняя и внешняя сферы комплексного соединения сильно различаются по устойчивости; частицы, находящиеся во внешней сфере, связаны с комплексным ионом преимущественно электростатическими силами и легко отщепляются в водном растворе. Эта диссоциация называется первичной, она протекает почти нацело, по типу диссоциации сильных электролитов. Поэтому с помощью качественных химических реакций обычно обнаруживаются только ионы внешней сферы.
Лиганды, находящиеся по внутренней сфере, связаны с центральным атомом значительно прочнее и отщепляются лишь в небольшой степени. Обратимый распад внутренней сферы комплексного соединения носит название вторичной диссоциации (протекает по типу слабых электролитов). Например, диссоциацию комплекса [Ag(NH3)2]Cl имеет вид:
Вторичная диссоциация характеризуется наличием равновесия между комплексной частицей, центральным ионом и лигандами
Диссоциация ионов [Ag(NH3)2]+, согласно приведенному выше уравнению, как и диссоциация всякого слабого электролита, подчиняется закону действия масс и может быть охарактеризована соответствующей константой равновесия, называемой константой нестойкости комплексного иона:
С учетом активности ионов уравнение констант нестойкости принимает следующий вид:
Полученная константа Каназывается термодинамической константой нестойкости.
Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса. Чем устойчивее комплексный ион, тем меньше его константа нестойкости. Так, среди однотипных соединений, обладающих различными значениями констант нестойкости
Величина, обратная константе нестойкости, называется общей или суммарной константой устойчивости. Следовательно,
Последняя также характеризует устойчивость комплексных ионов.
Если ионизация комплексных ионов происходит по ступеням, то константы равновесия этих промежуточных реакций называются промежуточными или ступенчатыми константами нестойкости. Например, для комплексов кадмия с цианид-ионами известны следующие промежуточные константы нестойкости, которые нумеруются в порядке возрастания числа лигандов, связанных с центральным атомом комплекса, ионизирующего на одну ступень:
Однако практически пользуются общей суммарной константой нестойкости, равной произведению промежуточных констант нестойкости:
Хелатные комплексы
Особенно эффективное связывание ионов комплексообразователя происходит при реакции с полидентатными ( многозубыми) лигандами. Эти лиганды благодаря наличию в них двух и более электронодонорных центров способны образовывать несколько связей с ионами металлов, формируя устойчивую циклическую структуру (т.е. ион металла захватывается полидентатным лигандом подобно жертве, попавшей в клешни рака). В связи с этим такие комплексные соединения получили названия хелатов.
Хелаты — устойчивые комплексы металлов с полидентатными лигандами, в которых центральный атом является компонентом циклической структуры. Простейшими хелатообразующими лигандами. являются бидентатные лиганды, образующие две связи с центральным атомом, например, глицин:
К нест. =5,6ž10-16
Конкуренция за лиганд или за ион-комплексообразователь.
Процессы образования комплексного соединения иона металла с каждым из лигандов являются конкурирующими: преобладающим будет процесс, который приводит к образованию наиболее прочного (т. е. с наименьшей константой нестойкости) комплексного соединения. Заключение о сравнительной прочности комплексных соединений на основании величин констант нестойкости можно делать только для однотипных соединений.
| Конкуренция за лиганд | Конкуренция за ион-комплексообразователь |
| Допустим, в растворе в равных концентрациях окажутся ионы Zn2+, Ni2+ и CN-ионы. В этом случае преимущественно образуется тетрацианоникколат- ион, а не тетрацианоцинкат- ион, так как Kнест( [Zn(CN)4]2-) > Kнест ([Ni(CN)4]2-). В этом случае объектом конкуренции является цианид-ион, а конкурирующими частицами — ионы цинка и никеля. | Если смешать вещества таким образом, что в растворе в равных концентрациях окажутся ионы Zn2+, NH3, CN-ионы, то преимущественно образуется тетрацианоцинкат-ион, а не тетраамминцинкат-ион, так как Kнест ([Zn(CN)4]2-) < Kнест ([Zn(NH3)4]2-). В этом случае объектом конкуренции является ион цинка, а конкурирующими частицами — цианид-ионы и молекулы аммиака, конкуренцию выигрывают цианид-ионы. |
Тема «Гетерогенные равновесия и процессы»
Гетерогенные процессы — это процессы на границе раздела фаз.
Фазы — отдельные однородные части гетерогенный системы, отграниченные друг от друга поверхностью раздела.
К гетерогенным относят, прежде всего, процессы, связанные с образованием и растворением малорастворимых веществ ионного типа. При контакте таких веществ (сильных электролитов) с водой часть ионов переходит в раствор и устанавливается динамическое равновесие между гидратированньши ионами электролита в водном растворе и кристаллами твердой фазы — гетерогенное равновесие.
Раствор, находящийся в динамическом равновесии с твердой фазой (т.е. с осадком), называют насыщенным.
Процесс растворения — обратимый процесс, он сопровождается процессом осаждения. Например:
При установившемся равновесии и постоянной температуре (t) величину поверхности твердой фазы можно считать постоянной (равной 1) и, используя закон действия масс, можно записать, что v1=k1т. е. скорость растворения осадка при t = const зависит только от природы данного вещества.
Скорость обратного процесса v2, т. е. скорость осаждения ионов на поверхности твердой фазы (учитывая, что поверхность постоянна и равна 1, t = const), будет равна произведению активностей данных ионов. Следовательно,
Так как при установившемся равновесии скорости реакций растворения и осаждения равны v1= v2), то отсюда:
Константы скорости k1, и k2при постоянной температуре — величины постоянные, значит, и отношение их есть величина постоянная. Поскольку данная величина характеризует собой свойство веществ растворяться и равна произведению активности ионов в растворе, она называется произведением растворимости (ПРа или в настоящее время принято обозначить через Кs — константа растворимости).
Итак, произведение растворимости или Кs- это произведение активностей ионов в насыщенном растворе малорастворимого электоолита t= const). Например,
Поскольку активность ионов равна произведению молярной концентрации его на коэффициент активности, то
У малорастворимого электролита при ПРа не более 10-8 в насыщенном растворе концентрации ионов малы, значит силы межионного взаимодействия также малы (fAg+ =fCI- = I) и практически не оказывают влияния на подвижность ионов. Следовательно, приближенное уравнение произведения растворимости
В общем случае для малорастворимого электролита константа растворимости Ksопределяется стехиометрическим произведением концентраций ионов, посылаемых в раствор даннымэлектролитом:
Чем меньше Ks, тем соль меньше растворяется.
Активности ионов нельзя заменять их концентрациями:
а) когда наряду с малорастворимыми электролитами (AgCl, BaSО4 и т. д.) в растворе присутствуют сильные электролиты в достаточно высоких концентрациях, повышающие ионную силу раствора, т. е. резко изменяющие величину коэффициента активности;
б) когда коэффициент активности не равен единице, т. е. для хорошо растворимых электролитов.
Насыщенные, не?
