Конечные продукты обмена холестерина
Содержание статьи
ХОЛЕСТЕРИНОВЫЙ ОБМЕН
ХОЛЕСТЕРИНОВЫЙ ОБМЕН (греческий chole желчь + stereos твердый) — совокупность реакций биосинтеза холестерина (см.) и его распада в организме человека и животных. В организме человека за сутки около 500 мг холестерина окисляется в желчные кислоты, примерно такое же количество стеринов экскретируется с фекалиями, около 100 мг выделяется с кожным салом, небольшое количество холестерина (около 40 мг) используется для образования кортикоидных и половых гормонов, а также витамина D3, 1—2 мг холестерина выводится с мочой. У кормящих женщин с грудным молоком выделяется 100— 200 мг холестерина в сутки. Эти потери восполняются за счет синтеза холестерина в организме (у взрослого человека в сутки около 700—1000 мг) и поступления его с пищей (300— 500 мг). Холестерин, а также часть холестерина, поступившего в просвет кишечника с желчью, всасывается в тонкой кишке в форме жировых мицелл (см. Жировой обмен). Эфиры холестерина предварительно гидролизуются при действии холестеринэстеразы (см.) панкреатического и кишечного соков. В стенке тонкой кишки холестерин используется для образования хиломикронов (см. Липопротеиды), в составе которых он поступает сначала в лимфатическую систему, а затем в кровяное русло.
В капиллярах жировой и некоторых других тканей в результате воздействия на хиломикроны липопротеид-липазы образуются частицы, обогащенные эфирами холестерина и фосфолипидами, получившие название ремнантных (остаточных) частиц. Эти частицы задерживаются в печени, где подвергаются распаду. Освободившийся при этом холестерин наряду с холестерином, синтезированным в печени, образует так называемый общий пул печеночного холестерина, который используется по мере необходимости для образования липопротеидов (см.).
Установлено, что у человека и некоторых животных липопротеиды низкой плотности транспортируют холестерин в органы и ткани, причем захват липоиротеидных частиц клетками этих органов и тканей осуществляется при участии специфических рецепторов. Холестерин, доставленный в клетку в составе липопротеидных частиц, идет на покрытие потребностей клетки (образование мембран при делении клетки, синтез стероидных гормонов и др.). Избыточная часть неэтерифицированного (свободного) холестерина превращается в его эфиры при действии содержащегося в клетке фермента — холестеролацилтрансферазы (КФ 2.3.1.26). Обратный транспорт неэтерифицированного холестерина из различных органов и тканей в печень осуществляется липопротеидами высокой плотности, причем в кровяном русле происходит этерификация захваченного холестерина при участии лецитина и фермента холестерин-лецитин — ацилтрансферазы (КФ 2.3.1.43). Доставленный таким путем в печень холестерин идет на образование желчных кислот (см.).
Синтез холестерина

Общая схема биосинтеза холестерина
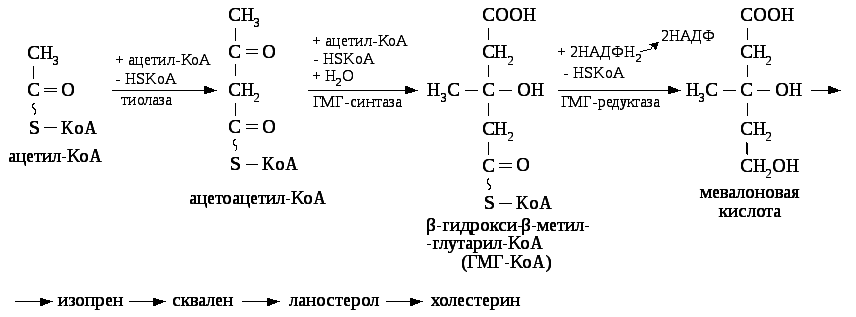
Синтез холестерина осуществляется в клетках почти всех органов и тканей, однако в значительных количествах он образуется в печени (80%), стенке тонкой кишки (10%) и коже (5%). К. Блох, Ф. Линен и др. показали основные реакции биосинтеза холестерина (их не менее 30). Сложный процесс биосинтеза холестерина можно разделить на три стадии: 1) биосинтез мевалоновой кислоты; 2) образование сквалена из мевалоновой кислоты; 3) циклизация сквалена и образование холестерина (см. схему).
Считают, что главным источником образования мевалоновой кислоты в печени является ацетил-КоА, а в мышечной ткани — лейцин. И то и другое соединения в результате ряда энзиматических реакций образуют бета-гидрокси-бета-метилглутарил-КоА (ГМГ-КоА), который затем восстанавливается в мевалоновую кислоту. В последнее время показано, что в синтез мевалоновой кислоты в печени может включаться и малонил-КоА.
Реакцией, определяющей скорость биосинтеза холестерина в целом, является восстановление ГМГ-КоА в мевалоновую кислоту; этот процесс катализирует фермент НАДФ-Н2-зависимая ГМГ-КоА-редуктаза (КФ 1.1.1.34). Именно этот фермент подвержен воздействиям со стороны ряда факторов. Так, активность ГМГ-КоА-редуктазы повышается (или содержание ее в печени возрастает) и скорость синтеза холестерина в целом увеличивается при действии ионизирующего излучения, введении тиреоидных гормонов, поверхностно-активных веществ, холестирамина, а также при гипофизэктомии. Угнетение синтеза холестерина отмечается при голодании, тиреоидэктомии и при поступлении в организм пищевого холестерина. Последний угнетает активность (или синтез) фермента ГМГ-КоА-редуктазы.
Синтез холестерина в стенке тонкой кишки регулируется исключительно концентрацией желчных кислот. Так, отсутствие их в кишечнике при наличии наружного желчного свища ведет к повышению синтеза холестерина в тонкой кишке в 5—10 раз.
На второй стадии синтеза происходит фосфорилирование мевалоновой кислоты при участии АТФ и образование нескольких фосфорилированные промежуточных продуктов (см. Фосфорилирование). При декарбоксилировании одного из них образуется изопентенил-пирофосфат, часть которого превращается в диметилаллил-пирофосфат. Взаимодействие этих двух соединений приводит к образованию димера — геранил-пирофосфата, содержащего 10 атомов углерода. Геранил-пирофосфат конденсируется с новой молекулой изопентенил-пирофосфата и образует тример — фарнезил-пирофосфат, содержащий 15 атомов углерода. Эта реакция идет с отщеплением молекулы пирофосфата. Затем две молекулы фарнезил-пирофосфата конденсируются, теряя каждая свой пирофосфат, и образуют гексамер сквален, содержащий 30 атомов углерода.
Третья стадия синтеза включает окислительную циклизацию сквалена, сопровождающуюся миграцией двойных связей и образованием первого циклического соединения — ланостерина. Ланостерин уже имеет гидроксильную группу в положении 3 и три лишние (по сравнению с холестерином) метильные группы. Дальнейшее превращение ланосте-рина может совершаться двумя путями, причем и в том и в другом случае промежуточными продуктами являются соединения стериновой природы. Более доказанным считается путь через 24, 25-дигидроланостерин и ряд других стеринов, включая 7-дигидрохолестерин, служащий непосредственным предшественником холестерина. Другой возможный путь — превращение ланостерина в зимостерин, а затем в десмостерин, из которого при восстановлении образуется холестерин.
Если суммировать общий итог всех реакций биосинтеза холестерина, то он может быть представлен в следующем виде:
18CH3CO-S-KoA + 10(H+) + 1/2O2 —> C27H46O + 9CO2 + 18KoA-SH. Источником углерода холестерина является ацетил-КоА (им может быть также малонил-КоА и лейцин), источником водорода — вода и никотин-амида дениндинуклеотидфосфат, а источником кислорода — молекулярный кислород.
Начиная со сквалена и кончая холестерином все промежуточные продукты биосинтеза нерастворимы в водной среде, поэтому они участвуют в конечных реакциях биосинтеза холестерина в связанном со сквален или стеринпереносящими белками состоянии. Это позволяет им растворяться в цитоплазме клетки и создает условия для протекания соответствующих реакций. Холестерин-переносящий белок обеспечивает также перемещение стеринов внутри клетки, что имеет важное значение для вхождения его в мембрану клетки, а также для транспорта в клеточные системы, осуществляющие катаболизм холестерина.
Катаболизм холестерина протекает в печени (окисление его в желчные кислоты), в надпочечниках и плаценте (образование из холестерина стероидных гормонов), в тестикулярной ткани и яичниках (образование половых гормонов). При биосинтезе холестерина в коже на завершающей стадии образуется небольшое количество 7-дегидрохолестерина. Под влиянием УФ-лучей он превращается в витамин D3.
Своеобразные превращения претерпевает холестерин в толстой кишке. Речь идет о той части пищевого холестерина или холестерина, поступившего в кишечник с желчью, которая не подверглась всасыванию. Под влиянием микробной флоры толстой кишки происходит восстановление холестерина и образование так наз. нейтральных стеринов. Главным их представителем является копростерин. Экспериментальные исследования, проведенные с использованием радиоизотопных и других методов, показали, что скорость обновления холестерина в различных органах и тканях неодинакова; наиболее высока она в надпочечниках и печени и чрезвычайно низка в мозге взрослых животных.
Патология холестеринового обмена
Нарушения холестеринового обмена обычно связаны с дисбалансом между количеством синтезируемого в организме и поступающего с пищей холестерина, с одной стороны, и количеством холестерина, подвергающегося катаболизму,— с другой. Эти нарушения проявляются в изменении уровня холестерина в плазме крови, которые классифицируются как гиперхолестеринемия или гипохолестеринемия (для взрослого населения высокоразвитых стран величины выше 270 мг/100 мл и ниже 150 мг/100 мл соответственно).
Гиперхолестеринемия может быть первичной (наследственной или алиментарной) и вторичной, обусловленной различными заболеваниями. Наследственная (семейная) гиперхолестеринемия характеризуется высоким уровнем холестерина и липопротеидов низкой плотности (ЛПНГЛ в плазме крови. При гомозиготной гиперхолестеринемии уровень холестеринемии может достигать 700— 800 мг/100 мл, а при гетерозиготной — 300—500 мг/100 мл. В основе наследственной гиперхолестеринемии лежит генетически обусловленное отсутствие (у гомозигот) или недостаток (у гетерозигот) специфических рецепторов к липопротеидам низкой плотности у клеток, вследствие чего резко снижается захват и последующий катаболизм этих богатых холестерином липопротеидов клетками паренхиматозных органов и тканей. В результате пониженного захвата и снижения катаболизма липопротеидов низкой плотности развивается гиперхолестеринемия (см.). Последняя приводит к раннему развитию атеросклероза (см.) и его клинических проявлений — ишемической болезни сердца (см.), преходящей ишемии мозга (см. Инсульт) и др. Особенно тяжело протекает атеросклероз при гомозиготной форме; у таких больных часто наблюдается ксантоматоз (см.), липоидная дуга роговицы (отложение холестерина в роговицу глаз), инфаркт миокарда в юношеском возрасте.
Распространенность гомозиготной формы гиперхолестеринемии невелика (примерно один случай на 1 млн. жителей). Чаще встречается гетерозиготная форма — один случай на 500 жителей.
Алиментарная гиперхолестеринемия характеризуется повышенным уровнем холестерина в плазме крови вследствие длительного потребления больших количеств пищи, богатой холестерином (куриные желтки, икра, печень, животные жиры и др.). Алиментарная гиперхолестеринемия той или иной степени выраженности характерна для жителей высокоразвитых индустриальных стран. Согласно популяционным исследованиям имеется прямая зависимость между уровнем холестерина в крови и распространенностью ишемической болезни сердца.
В эксперименте на различных животных (кролики, морские свинки, обезьяны) показано, что введение массивных доз холестерина с пищей приводит к резко выраженной гиперхолестеринемии и быстрому развитию атеросклероза. Экспериментальные модели гиперхолестеринемии и атеросклероза, впервые предложенные H. Н. Аничковым и С. С. Халатовым (1913), широко используются в научных исследованиях.
Вторичная гиперхолестеринемия встречается при гипотиреозе (см.), сахарном диабете (см. Диабет сахарный), нефротическом синдроме (см.), подагре (см.) и др. и нередко сопровождается развитием атеросклероза (см. Гиперхолестеринемия).
Выделяют первичную и вторичную гипохолестеринемию. Первичная гипохолестеринемия характерна для наследственного заболевания — абеталипопротеинемии (см.). При этой болезни отмечается почти полное отсутствие в плазме крови липопротеидов низкой плотности (у гомозигот) или значительное их снижение (у гетерозигот). Уровень общего холестерина не превышает 75 мг/ 100 мл. Гомозиготная форма болезни протекает исключительно тяжело. В основе абеталипопротеинемии лежит генетически обусловленное нарушение синтеза апопротеина В — главного белка липопротеидов низкой плотности.
Вторичные гипохолестеринемии наблюдаются при кахексии, гипертиреоидизме, аддисоновой болезни и паренхиматозных заболеваниях печени, при ряде инфекционных болезней и интоксикациях (см. Гипохолестеринемия). При недостаточной активности в плазме крови фермента лецитин — холестерин -ацилтрансферазы, или ЛХАТ (наследственная ЛXАТ-недостаточность), ответственного за этерификацию холестерина плазмы, наблюдается накопление неэтерифицированного холестерина в мембранах эритроцитов и клетках почек, печени, селезенки, костного мозга, роговицы глаза. Резко снижается доля этерифицированного холестерина в плазме крови и одновременно повышается уровень неэтерифицированного холестерина и лецитина. У больных с наследственной ЛXAT-недостаточностыо стенки артерий и капилляров подвержены деструктивным изменениям, что связано с отложением в них липидов. Наиболее тяжелые изменения происходят в сосудах почечных клубочков, что приводит к развитию почечной недостаточности (см.).
Одним из распространенных нарушений холестериновый обмен. является образование желчных камней, основной составной частью которых является холестерин (см. Желчнокаменная болезнь). Образование желчных камней происходит вследствие выкристаллизовывания холестерина при относительно высокой его концентрации в желчи и относительно низкой концентрации в ней желчных кислот и фосфолипидов, обладающих способностью растворять холестерин. Исследования показали, что имеется прямая связь между уровнем холестерина в плазме крови и распространенностью холестероза (см.) и желчнокаменной болезни.
Библиогр.: Климов А. Н, и Н икульчева Н. Г. Липопротеиды, дислипопротеидемии и атеросклероз, Л., 1984; Полякова Э. Д. Пути биосинтеза холестерина в печени и их регуляция, в кн.: Липиды, структура,биосинтез, превращения и функции, под ред. С. Е. Северина, с. 131, М., 1977;она же, Регуляция содержания холестерина в клетке, в кн.: Биохимия липидов и их роль в обмене веществ, под ред.С. Е. Северина, с. 120, М., 1981; Финагин Л. К. Обмен холестерина и его регуляция, Киев, 1980; Lipids and lipidoses, ed. by G. Schettler, B.— Heidelberg, 1967; Sodhi H. S., Kudchod-k a r B. J. a. Mason D. T. Clinical methods in study of cholesterol metabolism, Basel a. o., 1979.
A. H. Климов
Источник
7.14. Обмен холестерина
Ежесуточно в
организме взрослого человека обменивается
до 1,5 г холестерина. Примерно половина
этого количества синтезируется в
организме (эндогенный холестерин), а
половина поступает с пищей (экзогенный
холестерин). Холестерин пищевых продуктов
всасывается в тонком кишечнике при
участии жёлчных кислот.
7.14.1. Биосинтез холестерина
Синтез холестерина
происходит в печени из ацетил-КоА. Синтез
холестерина представляет собой сложный
многоэтапный процесс, протекающий в 20
стадий. Начальная стадия – образование
мевалоновой кислоты является ключевой
ГМГ — редуктаза –
ключевой фермент синтеза холестерина,
она угнетается высокими концентрациями
холестерина. Синтезированный в печени
холестерин включается в состав
липопротеидов ЛПОНП. Под действием
липопротеидной липазы ЛПОНП переходят
в ЛПНП, которые транспортируют холестерин
от печени к органам и тканям. В тканях
имеются рецепторы к липопротеидам, при
участии которых происходит захват
холестерина и проникновение его в
клетки.
В клетках часть
холестерина превращается в эфиры при
участии фермента АХАТ
(ацилхолестеролацилтрансфераза). Эфиры
холестерина депонируются в тканях.
7.14.2. Использование холестерина в тканях
Холестерин необходим
для всех клеток и тканей.
1. В печени примерно
половина синтезирующегося холестерина
превращается в жёлчные кислоты при
участии ключевого фермента 7-α-гидроксилазы.
Применение веществ, адсорбирующих
жёлчные кислоты в кишечнике, повышает
переход холестерина в жёлчные кислоты
и снижает его уровень в крови.
2. Холестерин
используется для построения клеточных
мембран, где он составляет примерно
треть всех липидов мембран и определяет
физико-химические свойства липидной
фазы мембран.
3. В надпочечниках,
половых железах холестерин используется
на синтез стероидных гормонов
4. В коже из
производного холестерина происходит
образование витамина Д3(холекальциферола).
7.14.3. Выведение холестерина из организма
Избыток холестерина
удаляется из тканей при участии ЛПВП,
которые адсорбируют холестерин из
клеток и переносят его в печень. Основная
часть холестерина выводится из организма
через кишечник в виде жёлчных кислот,
продуктов их обмена и образующихся из
холестерина под действием микрофлоры
холестанола и копростанола. Выведение
холестерина из организма в небольших
количествах происходит со слущивающимся
эпителием, с мочой в виде соединений
стероидных гормонов с глюкуроновой
кислотой.
7.14.4. Нарушение обмена холестерина
В норме концентрация
холестерина в крови взрослых людей
составляет 3,5 – 5,2 ммоль/л. У детейконцентрация холестерина в крови ниже,
чем у взрослых. У новорожденных уровень
холестерина равен 2,67 ммоль/л, у детей в
возрасте одного года — 4,03 ммоль/л.
Симптом повышения
уровня холестерина в крови называется
гиперхолестеринемией. Врождённые
гиперхолестеринемии встречаются редко,
чаще развиваются приобретённые
(вторичные) гиперхолестеринемии. На
фоне гиперхолестеринемии возможно
развитие таких заболеваний как
атеросклероз и жёлчекаменная болезнь.
При атеросклерозеизбыток холестерина откладывается в
эндотелии сосудов, что ведёт к развитию
асептического воспаления, отложению
кальция, вследствие чего нарушается
кровоснабжение тканей. Для диагностики
атеросклероза рекомендуется определение
коэффициента атерогенности, который
показывают соотношение между ЛПНП и
ЛПВП.
К атерогенности
= (Хобщ. — ХЛПВП)/ХЛПВП≤ 3.
Для лечения
атеросклероза применяют ингибиторы
ГМГ-редуктазы, которые блокируют синтез
холестерина.
Жёлчекаменная
болезнь связана с нарушением соотношения
между водонерастворимым холестерином
и гидрофильными фосфолипидами и жёлчными
кислотами в составе жёлчи. Холестерин
является основой формирования камней
в жёлчных путях.
При циррозах
печени, гепатитах возможно развитие
гипохолестеринемии.
Источник
Какие продукты выводят холестерин?
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Какие продукты помогают снизить уровень холестерина в организме?
Для борьбы с высоким уровнем холестерина существуют разные методы. Однако противохолестериновая диета признана самым эффективным. Какие продукты нужно ввести в свой рацион человеку, который борется с холестерином?
Как нужно питаться при повышенном холестерине?
При данной проблеме важно соблюдать следующие меры:
- Ограничить количество соли до минимума. Соль способствует задержке жидкости в тканях организма. Это провоцирует отеки и заболевания выделительной системы.
- Питаться низкокалорийной пищей, но 5–7 раз в сутки. Частое питание поможет создать постоянное ощущение сытости при потреблении легкой пищи.
- Отдавать предпочтение растительным жирам. Нужно полностью отказаться от сливочного масла и маргарина, заправляя блюда растительными жирами.
- Полностью отказаться от вредных привычек. Максимум, что может позволить себе человек с высоким уровнем холестерина – это выпивать раз в неделю 2-3 глотка сухого красного вина.
- Сделать растительную пищу основой своего повседневного меню. Так холестерин начнет выводиться из организма быстрее, сосуды будут становиться более крепкими и эластичными.
- Находить в своем расписании время для физических нагрузок и просто прогулок пешком на свежем воздухе.
Какие продукты помогут больному снизить уровень холестерина?
В список продуктов для снижения уровня холестерина можно включить следующие:
- Жирная рыба. Наличие жира в рыбе не должно пугать пациента. Жир там не такой, как в колбасе или чипсах. Рыба богата жирными кислотами, которые эффективнее всего уничтожают холестерин. Много жирных кислот в скумбрии, селедке, щуке, форели, тунце, семге, камбале.
- Орехи любого сорта. В день достаточно съедать около 30 г орешков, чтобы через месяц анализы на холестерин значительно улучшились. При этом важно следить за самочувствием, так как орехи часто провоцируют аллергические реакции.
- Растительные масла. Особо выделить среди растительных масел можно кунжутное, льняное, соевое. В них больше полезных компонентов, чем в привычном подсолнечном. Они могут придать блюдам дополнительный, оригинальный вкус.
- Бобовые культуры. Бобовые богаты клетчаткой, которая быстро активируется в крови. Они дарят длительное ощущение сытости и способны выводить из организма даже тот холестерин, который уже успел отложиться на стенках сосудов.
- Продукты с добавлением отрубей. Раньше отруби считались мусором, который просто выкидывали. Сегодня их ценят как источник ценной для организма клетчатки. Их добавляют в хлебобулочные изделия, используют в качестве приправы в салаты, а кто-то ест их просто так, запивая водой.
- Фрукты и овощи. Практически все свежие фрукты и овощи содержат пектин. Пектин – это разновидность клетчатки, которая помогает удалять холестериновые отложения из организма. Их полезно употреблять в качестве перекуса, можно полностью заменять овощами или фруктами какой-либо прием пищи.
- Листовой зеленый чай. В чайном листе содержится вещество под названием танин. Оно связывает между собой вредные соединения и выводит их из организма.
Какие продукты нельзя есть при повышенном холестерине?
От следующих продуктов при повышенном холестерине стоит полностью отказаться, чтобы его уровень пришел в норму:
- Колбасные изделия, сосиски.
- Мясные копчености.
- Свежая, сдобная выпечка.
- Сладости (торты, пирожные, конфеты, мороженое).
Внимание! Любителям сладкого можно есть фрукты, натуральный мед, ягоды, сухофрукты, восточные сладости).
- Сухие снэки (сухарики, крекер, чипсы, соленая рыба).
- Фастфуд и полуфабрикаты.
При повышенном холестерине важно соблюдать диету. Есть продукты, которые помогают бороться с повышенным содержанием в крови этого вещества.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Эксперт: Евгения Булах Эксперт в области материнства, здоровья и правильного питания
Оцените статью
(22 голосов, в среднем 4)
Источник