Кооперативное связывание кислорода гемоглобином
Содержание статьи
Кооперативное связывание гемоглобина с кислородом
Гемоглобин связывает и передает тканям за сутки около 600 л О2, в тканях образуется примерно 500 л СО2, который выводится из организма при участии гемоглобина.
Скорость оксигенирования и транспорт кислорода из лёгких в ткани зависит от изменений сродства гемоглобина к О2.
Присоединением О2 к одному из протомеров гемоглобина в лёгких при высоком рО2, (100 мм рт. ст.) вызывает конформационные изменения во всей олигомерной структуре гемоглобина и облегчает присоединение последующих молекул О2. Это явление носит название кооперативных изменений гемоглобина или кооперативного связывания О2, благодаря которому гемоглобин максимально связывает О2 в легких и легко отдает О2 в периферических тканях при более низких значениях рО2 (рис кривая насыщения миоглобина и гемоглобина).
Давление в капиллярах Давление в лёгочных
работающей мышцы а л ь в е о л а х
Рис.Кривые насыщения (диссоциации) миоглобина и гемоглобина кислородом.
Кривая насыщения для гемоглобина имеет сигмоидную форму (S-образную). Это указывает на кооперативное связывание О2 (в легких при высоком рО2) и освобождении О2 (в тканевых капиллярах при более низком рО2).
Эффект Бора
Гемоглобин не только переносит О2 от легких к периферическим тканям, но и ускоряет транспорт СО2 и протонов от тканей к легким.
Эффект Бора – это влияние концентрации СО2 и Н+ на сродство гемоглобина к О2.
Увеличение концентрации протонов и СО2 снижает сродство О2 к гемоглобину и усиливает транспорт О2 в ткани. Разные органы потребляют неодинаковые количества кислорода. Наиболее активно извлекают кислород из крови работающие мышцы (до 85%).
Если гемоглобин насыщен кислородом почти на 100%, то все молекулы гемоглобина находятся в R-форме, Нb(О2)4. Такое состояние гемоглобина возникает при высоком парциальном О2в капиллярах легких (100 мм рт. ст.) и при высоком сродстве Нb к О2. В капиллярах мышц и других тканей более низкое парциальное давление О2 , в этих условиях от гемоглобина могут отщепляться молекулы О2 и поступать в ткани. Например, при парциальном давлении кислорода в капиллярах 40 мм рт. ст. гемоглобин имеет насыщение ≈ 65%.
Далее действуют другие факторы, приводящие к снижению сродства гемоглобина к О2, тем самым увеличивая доставку кислорода в ткани:
а) гемоглобин протонируется, связывая три пары Н+ в пептидных цепях гемоглобина, вновь формируется Т-структура;
б) гемоглобин обратимо присоединяет часть СО2 (до 15%) к концевым аминогруппам пептидных цепей, образуется карбогемоглобин: R-NH-COO- +Н+, где R-белковая цепь гемоглобина. Это также снижает сродство гемоглобина к О2. Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3 -.
Таким образом, диоксид углерода, образовавшийся в тканях реагирует с водой, образуя угольную кислоту, которая диссоциирует на бикарбонат- ион и Н+. Синтез углекислоты, как и её разложение на СО2 и Н2О происходит при участии фермента карбоангидразы. В периферических тканях гемоглобин отдает О2, сам протонируется и связывает часть СО2, его R-форма переходит в Т-форму, сродство к О2 резко снижается. В легких происходят обратные процессы.
Влияние 2,3-БФГ на сродство гемоглобина к кислороду
2,3-биcфосфоглицерат (2,3-дифосфоглицерат) – образуется в эритроцитах в ходе анаэробного гликолиза из промежуточного соединения 1,3-биcфосфоглицерата. 2,3-БФГ является аллостерическим регулятором гемоглобина (от греч. «аллос» – другой), он соединяется ионными связями с дезоксигемоглобином не в области гема, а в другом участке, т. е. аллостерическом центре, содержащим положительно заряженные радикалы аминокислот Лиз 82 и Гис 143 β-цепей.
Структура 2,3-бифосфоглицерата
Образовавшиеся дополнительные солевые мостики (или ионные связи) делают структуру дезоксигемоглобина ещё более жесткой и поэтому сродство Нb к О2 снижается. Концентрация 2,3-БФГ в крови близка к концентрации гемоглобина и одинакова в артериальной и венозной крови. 2,3-БФГ реагирует только с дезоксигемоглобином, т. е. Т-формой, т. к. он имеет доступную центральную полость с центром связывания 2,3-БФГ. В оксигемоглобине (R-форма) эта полость закрыта.
Источник
Эффективность связывания кислорода с гемоглобином регулируется
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Источник
родство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.
Оглавление темы «Вентиляция легких. Перфузия легких кровью.»: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. — Также рекомендуем «Углекислый газ. Транспорт углекислого газа.» |
Источник
вязывание гемоглобина с кислородом. Обмен железа
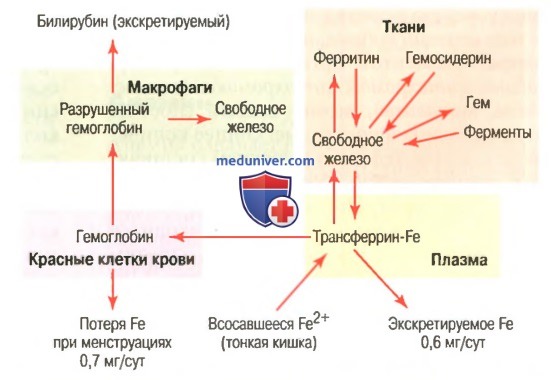
Связывание гемоглобина с кислородом. Обмен железаНаиболее важным свойством гемоглобиновой молекулы является ее способность свободно и обратимо связываться с кислородом. Эта способность детально изложена в отдельной статье на сайте в связи с дыханием (просим вас пользоваться формой поиска выше), поскольку главной функцией гемоглобина в организме является соединение его с кислородом в легких и затем освобождение этого кислорода в тканевых капиллярах, где парциальное давление кислорода гораздо ниже, чем в легких. Кислород не соединяется с двумя положительными связями железа гемоглобиновой молекулы. Вместо этого он связывается с так называемыми координационными связями атома железа. Это чрезвычайно свободная связь, поэтому соединение легко обратимо. Более того, кислород не переходит в ионную форму и переносится в виде молекулярного кислорода (составленного из двух атомов кислорода) к тканям, где легко освобождается в тканевые жидкости в форме молекулярного кислорода, а не иона кислорода. Обмен железа (метаболизм железа)Поскольку железо необходимо для формирования не только гемоглобина, но и других жизненно важных элементов организма (например, миоглобина, цитохромов, цитохромоксидазы, пероксидазы, катализы), важно понять способы утилизации железа в организме. Общее количество железа в теле человека в среднем составляет 4-5 г, причем около 65% этого количества входит в состав гемоглобина. Примерно 4% железа входит в состав миоглобина, 1% находится в составе различных гем-соединений, способствующих внутриклеточному окислению, 0,1% связан с белком трансферрином в плазме крови и 15-30% накапливаются для последующего использования в основном в ретикулоэндотелиальной системе и клетках паренхимы печени главным образом в форме ферритина.
а) Транспорт и накопление железа. Транспорт, накопление и метаболизм железа в организме схематически представлены на рисунке выше. После всасывания из тонкого кишечника железо немедленно связывается в плазме крови с бета-глобулином (апотрансферрином), формируя трансферрин, который затем транспортируется в плазме. Железо в трансферрине связано свободно и, следовательно, может высвобождаться в любую тканевую клетку в любой точке тела. Избыток железа в крови откладывается в основном в гепатоцитах и в меньшей степени — в ретикулоэндотелиальных клетках костного мозга. В цитоплазме клеток железо связывается главным образом с белком апоферритином, формируя ферритин. Молекулярная масса апоферритина — около 460000, и с этой большой молекулой может соединяться в кластеры радикалов железа разное количество железа; следовательно, ферритин может содержать как большое, так и небольшое количество железа. Железо, которое накапливается в виде ферритина, называют резервным железом. Меньшая часть этого резерва хранится в совершенно нерастворимой форме, называемой гемосидерином. Он в основном формируется, когда общее количество железа в теле больше, чем может связать апоферритин. Гемосидерин собирается в клетках в виде больших кластеров, которые видны под микроскопом, как большие частицы. Наоборот, частицы ферритина так малы и рассеяны, что их можно обычно увидеть в цитоплазме клеток только с помощью электронного микроскопа. Когда уровень железа в плазме падает до низких значений, некоторое его количество из запаса в форме ферритина легко выделяется в плазму и транспортируется в виде трансферрина к нуждающимся в железе областям. Уникальной особенностью молекулы трансферрина является то, что она прочно связывается с рецепторами клеточной мембраны эритробластов в костном мозге. Затем вместе со связанным железом молекула поглощается эритробластом путем эндоцитоза. Внутри клетки трансферрин освобождает железо прямо в митохондрии, где синтезируется гем. При отсутствии адекватного количества трансферрина в крови людей недостаточность транспорта железа к эритробластам может вызвать тяжелую гипохромную анемию, которая характеризуется наличием красных клеток крови, содержащих гораздо меньше гемоглобина, чем в норме. Когда эритроциты завершают свой жизненный путь и разрушаются, гемоглобин, выделившийся из клеток, поглощается моноцитарно-макрофагальными клетками. Железо при этом освобождается и накапливается преимущественно в виде ферритина, чтобы использовать ся, когда необходимо, для формирования нового гемоглобина. б) Ежедневная потеря железа. Мужчина выделяет примерно 0,6 мг железа ежедневно, главным образом с фекалиями. Дополнительное количество железа теряется при кровотечении. У женщин дополнительная менструальная потеря крови дает долговременную потерю железа в среднем примерно до 1,3 мг/сут. — Также рекомендуем «Всасывание железа в кишечнике. Длительность жизни эритроцитов» Оглавление темы «Эритропоэз. Белые клетки крови»: |
Источник