Координационная связь в гемоглобине
Содержание статьи
Вопрос 6. Строение гема, производные гемоглобина
В
состав молекулы гемоглобина входят 4
одинаковые гемовые группы. Гем представляет
собой порфирин, содержащий центрально
расположенный ион Fe2+.
Является производным порфина, который
представляет собой конденсированную
систему из 4 пирролов, соединенных между
собой метиновыми мостиками (-СН=). В
зависимости от строения заместителей
в порфине различают несколько
разновидностей гемов.
гем
IX
– наиболее распространенная разновидность
гема. Производным порфина в нем является
протопорфирин IX
(1,3,5,8 – тетраметил-2,4 – дивинил – 6, 7 –
дипропионовокислый порфин);гем
а (формилпорфирин). Гем а вместо метильной
группы содержит формильный остаток в
восьмом положении (-СНО) и вместо одной
винильной группы (во втором положении)
изопреноидную цепь. Гем а входит в
состав цитохромоксидазы;гем
с, в котором с винильными (-СН=СН2)
группами в положениях 2 и 4 связаны
остатки цистеина. Входит в состав
цитохрома С;гем
представляет собой железодигидропорфирин
4.
Гем
является простетической группой не
только гемоглобина и его производных,
но и миоглобина, каталазы, пероксидазы,
цитохромов, фермента триптофанпироллазы,
катализируещего окисление троптофана
в формилкинуренин.
Координационное
число для атомов железа равно 6. В геме
железо связано двумя ковалентными
связями с атомами азота двух пиррольных
колец и двумя координационными связями
с атомами азота остальных пиррольных
колец. Пятая и шестая координационные
связи железа распределяются по-разному,
в зависимости от того в состав какой
белковой молекулы входит гем, в зависимости
от её функций. Так, например, в цитохромах
5 и 6 координационные связи железа
соединены с остатками гистидина и
метионина. Такое расположение гема в
цитохромах, необходимо для выполнения
их специфической функции – переноса
электронов в дыхательной цепи. Переходы
Fe3++
е= Fe2+;
Fe2+-е=
Fe3+
создают возможность перебрасывать
электроны от одного цитохрома к другому.
Рассмотрим
подробнее расположение гема в составе
гемоглобина (миоглобина). Гем расположен
в щели между спиралями Е и F;
его полярные пропионатные группы
ориентированы к поверхности глобулы,
а остальная часть находится внутри
структуры и окружена не полярными
остатками, за исключением His
F8
и His
F7.
Пятое координационное положение атома
железа занято атомом азота гетероциклического
кольца проксимального гистидина His
F8.
Дистальный гистидин (His
F7)
расположен по другую сторону гемого
кольца, почти напротив His
F8,
но шестое координационное положение
атома железа остаётся свободным. Из
двух не использованных координационных
связей одна идет на соединение с белком,
а вторая – на соединение с различными
лигандами (физиологическими – кислород,
вода и чужеродными – диоксид углерода,
цианид и т.д.).
Производные гемоглобина
Гемоглобин
взаимодействует с различными лигандами,
для этого предназначена шестая
координационная связь железа в геме. К
производными гемоглобина относят:
оксигемоглобин
HbО2
– соединение молекулярного кислорода
с гемоглобином. Чтобы подчеркнуть тот
факт, что валентность железа при этом
связывании не меняется, реакцию называют
не окислением, а оксигенацией; обратный
процесс называется дезоксигенацией.
Когда хотят специально отметить, что
гемоглобин не связан с кислородом, его
называют дезоксигемоглобином;карбоксигемоглобин
HbСО.
Валентность железа в результате
присоединения угарного газа (моноксида
углерода – СО) также остается II.
СО связывается с гемом примерно в двести
раз прочнее, чем связь гем- О2.
Не большая часть молекул гемоглобина
(1%) в нормальных условиях связывает СО.
У курильщиков же к вечеру эта величина
достигает 20%. При отравлении монооксидом
углерода наступает смерть от удушья,
недостаточного снабжения тканей
кислородом.метгемоглобин
(HbОН).
Он не связывает молекулярный кислород.
Атом железа в его молекуле находится
в степени окисления 3+. Метгемоглобин
образуется при воздействии на гемоглобин
окислителей (оксидов азота, метиленового
синего, хлоратов). В крови человека
метгемоглобин находится в незначительных
количествах, но при некоторых заболеваниях
(например, нарушение синтеза ГЛ-6-фосфатДГ),
либо при отравлении окислителями его
содержание возрастает, что может быть
причиной летального исхода, так как
метгемоглобин не способен к переносу
кислорода от легких к тканям;цианметгемоглобин
(HbСN)
– метгемоглобин оказывает и положительное
действие. Он связывает СN-
с образованием цианметгемоглобина и
спасает организм от смертельного
действия цианидов. Поэтому для лечения
отравлений цианидами применяют
метгемоглобинообразователи (тот же
нитрит Na);карбгемоглобин
образуется, когда гемоглобин связывается
с СО2.
Однако СО2
присоединяется не к гему, а к NН2
– группам глобина:
HbNH2
+ CO2=
HbNHCOO-
+ H+
Причем
дезоксигемоглобин связывает больше
СО2,
чем оксигемоглобин. Образование
карбгемоглобина используется для
выведения СО2
из тканей к легким. Этим путем выводится
10-15% СО2.
Вопрос 7. Механизм
насыщения гемоглобина кислородом
За
счет шестой координационной связи к
атому железа присоединяется молекула
кислорода с образованием оксигемоглобина.
Пиррольные кольца гема расположены в
одной плоскости в то время как атом
железа несколько выступает из этой
плоскости. Присоединение кислорода
«выпрямляет» молекулу гема: железо
перемещается в плоскость пиррольных
колец на 0,06 нм, так как диаметр
координационной сферы атома железа
уменьшается. Гемоглобин связывает 4
молекулы кислорода (по одной молекуле
на гем в каждой субъединице).
Оксигенерирование сопровождается
значительными конформационными
изменениями в гемоглобине. Перемещаясь
в плоскость пиррольных колец, Fe,
соединенное в 5 координационном положении
с остатком HisF8
«тянет» пептидную цепь на себя. Происходит
изменение конформации этой цепи и
связанных с ней других полипептидных
цепей, поскольку один протомер соединен
многими связями с другими протомерами.
Это явление называют коопреативностью
изменения конформации протомеров.
Изменения конформации таковы, что
первоначальное связывание О2
с одной субъединицей ускоряет связывание
молекул кислорода с отстальными
субъединицами. Это явление известно
как гомотропный положительный
кооперативный эффект (гомотропный,
потому что участвует только кислород).
Именно это обуславливает сигмовидный
характер кривой насыщения гемоглобина
кислородом. Четвертая молекула кислорода
присоединяется к гемоглобину в 300 раз
легче, чем первая молекула. Чтобы
составить себе более ясное представление
об этом механизме, целесообразно
рассматривать структуру гемоглобина
в виде двух гетеродимеров, образованных
и
— субъединицами: 1
1
и 2
2.
Незначительный сдвиг атома железа
приводит к тому, что одна /
пара субъединиц, поворачивается
относительно другой /
— пары. При этом между субъединицами
разрушаются нековалентные связи,
обусловленные электростатическими
взаимодействиями. Один набор связей
между димерами замещается на другой,
происходит их относительная ротация.
Четвертичная
структура частично оксигенерированного
гемоглобина описывается как Т-состояние
(от англ. Taut
–напряжение), полностью оксигенерированному
гемоглобину (HbО2)
отвечает R
– состояние (relaxed-
релаксирование). Состояние характеризуется
меньшим сродством к кислороду, вероятности
перехода из Т- формы в R-форму
повышается по мере последовательного
оксигенерирования каждой из 4 гемогрупп.
Солевые мостики (нековалентные связи)
по мере присоединения кислорода
разрушаются, увеличивая вероятность
перехода из Т – формы в R-
форму (состояние высокого сродства).
Источник
емоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. — Также рекомендуем «Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.» |
Источник
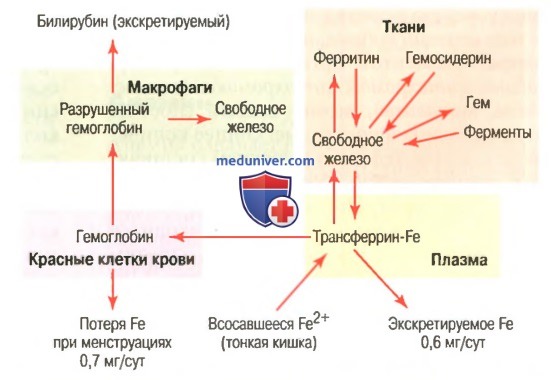
вязывание гемоглобина с кислородом. Обмен железа
Связывание гемоглобина с кислородом. Обмен железаНаиболее важным свойством гемоглобиновой молекулы является ее способность свободно и обратимо связываться с кислородом. Эта способность детально изложена в отдельной статье на сайте в связи с дыханием (просим вас пользоваться формой поиска выше), поскольку главной функцией гемоглобина в организме является соединение его с кислородом в легких и затем освобождение этого кислорода в тканевых капиллярах, где парциальное давление кислорода гораздо ниже, чем в легких. Кислород не соединяется с двумя положительными связями железа гемоглобиновой молекулы. Вместо этого он связывается с так называемыми координационными связями атома железа. Это чрезвычайно свободная связь, поэтому соединение легко обратимо. Более того, кислород не переходит в ионную форму и переносится в виде молекулярного кислорода (составленного из двух атомов кислорода) к тканям, где легко освобождается в тканевые жидкости в форме молекулярного кислорода, а не иона кислорода. Обмен железа (метаболизм железа)Поскольку железо необходимо для формирования не только гемоглобина, но и других жизненно важных элементов организма (например, миоглобина, цитохромов, цитохромоксидазы, пероксидазы, катализы), важно понять способы утилизации железа в организме. Общее количество железа в теле человека в среднем составляет 4-5 г, причем около 65% этого количества входит в состав гемоглобина. Примерно 4% железа входит в состав миоглобина, 1% находится в составе различных гем-соединений, способствующих внутриклеточному окислению, 0,1% связан с белком трансферрином в плазме крови и 15-30% накапливаются для последующего использования в основном в ретикулоэндотелиальной системе и клетках паренхимы печени главным образом в форме ферритина.
а) Транспорт и накопление железа. Транспорт, накопление и метаболизм железа в организме схематически представлены на рисунке выше. После всасывания из тонкого кишечника железо немедленно связывается в плазме крови с бета-глобулином (апотрансферрином), формируя трансферрин, который затем транспортируется в плазме. Железо в трансферрине связано свободно и, следовательно, может высвобождаться в любую тканевую клетку в любой точке тела. Избыток железа в крови откладывается в основном в гепатоцитах и в меньшей степени — в ретикулоэндотелиальных клетках костного мозга. В цитоплазме клеток железо связывается главным образом с белком апоферритином, формируя ферритин. Молекулярная масса апоферритина — около 460000, и с этой большой молекулой может соединяться в кластеры радикалов железа разное количество железа; следовательно, ферритин может содержать как большое, так и небольшое количество железа. Железо, которое накапливается в виде ферритина, называют резервным железом. Меньшая часть этого резерва хранится в совершенно нерастворимой форме, называемой гемосидерином. Он в основном формируется, когда общее количество железа в теле больше, чем может связать апоферритин. Гемосидерин собирается в клетках в виде больших кластеров, которые видны под микроскопом, как большие частицы. Наоборот, частицы ферритина так малы и рассеяны, что их можно обычно увидеть в цитоплазме клеток только с помощью электронного микроскопа. Когда уровень железа в плазме падает до низких значений, некоторое его количество из запаса в форме ферритина легко выделяется в плазму и транспортируется в виде трансферрина к нуждающимся в железе областям. Уникальной особенностью молекулы трансферрина является то, что она прочно связывается с рецепторами клеточной мембраны эритробластов в костном мозге. Затем вместе со связанным железом молекула поглощается эритробластом путем эндоцитоза. Внутри клетки трансферрин освобождает железо прямо в митохондрии, где синтезируется гем. При отсутствии адекватного количества трансферрина в крови людей недостаточность транспорта железа к эритробластам может вызвать тяжелую гипохромную анемию, которая характеризуется наличием красных клеток крови, содержащих гораздо меньше гемоглобина, чем в норме. Когда эритроциты завершают свой жизненный путь и разрушаются, гемоглобин, выделившийся из клеток, поглощается моноцитарно-макрофагальными клетками. Железо при этом освобождается и накапливается преимущественно в виде ферритина, чтобы использовать ся, когда необходимо, для формирования нового гемоглобина. б) Ежедневная потеря железа. Мужчина выделяет примерно 0,6 мг железа ежедневно, главным образом с фекалиями. Дополнительное количество железа теряется при кровотечении. У женщин дополнительная менструальная потеря крови дает долговременную потерю железа в среднем примерно до 1,3 мг/сут. — Также рекомендуем «Всасывание железа в кишечнике. Длительность жизни эритроцитов» Оглавление темы «Эритропоэз. Белые клетки крови»: |
Источник
Обмен гемоглобина — Студопедия
Из различных хромопротеинов наибольшее значение имеет гемоглобин. Поступающий с пищей гемоглобин в желудочно-кишечном тракте распадается на составные части – глобин и гем. Глобин как белок, гидролизуется на аминокислоты. Гем окисляется в гематин и выводится с калом. Таким образом, гемоглобин пищи не участвует в интенсивном метаболизме эндогенного гемоглобина. Уровень метаболизма эндогенного гемоглобина определяется тем, что период жизни эритроцита равен 126 дней, т.е. ежечасно обновляется примерно 6*109эритроцитов, а, следовательно, и гемоглобина.
Строение гемоглобина. Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Видовые различия гемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина.
Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Последний состоит из четырех замещенных пирролов, соединенных между собой метиновыми мостиками (—СН=).
Незамещенный порфирин называется порфином. В молекуле гема порфин представлен в виде протопорфирина IX, содержащего четыре метильные группы (—СН3), две винильные группы (—СН=СН2) и два остатка пропионовой кислоты. Протопорфирин, присоединяя железо, превращается в гем.
Из формулы видно, что железо связано с двумя атомами азота молекулы протопорфирина ковалентно и с двумя другими – координационными связями, обозначенными пунктирными линиями.
Гем в виде гемпорфирина является простетической группой не только гемоглобина и его производных, но и миоглобина, каталазы, пероксидазы и цитохромов b, с и c1.
Структурная организация гемоглобина (и миоглобина) была расшифрована Дж. Кендрью и М. Перутц (Нобелевская премия 1962 г.). Дыхательная функция гемоглобина крови подробно рассматривается в курсе физиологии. Здесь следует указать на уникальную роль гемоглобина в траспорте кислорода от легких к тканям и диоксида углерода от тканей к легким. Это элементарное проявление жизни – дыхание, хотя и выглядит простым, основано на взаимодействии многих типов атомов в гигантской молекуле гемоглобина. Подсчитано, что в одном эритроците содержится около 340000000 молекул гемоглобина, каждая из которых состоит примерно из 103 атомов С, Н, О, N, S и 4 атомов железа.
Атом железа расположен в центре гема-пигмента, придающего крови характерный красный цвет. Каждая из 4 молекул гема «обернута» одной полипептидной цепью. В молекуле гемоглобина взрослого человека HbА (от англ. adult – взрослый) содержатся четыре полипептидные цепи, которые вместе составляют белковую часть молекулы – глобин. Две из них, называемые α-цепями, имеют одинаковую первичную структуру и по 141 аминокислотному остатку. Две другие, обозначаемые β-цепями, также идентично построены и содержат по 146 аминокислотных остатков. Таким образом, вся молекула белковой части гемоглобина состоит из 574 аминокислот. Во многих положениях α- и β-цепи содержат разные аминокислотные последовательности, хотя и имеют почти одинаковые пространственные структуры. Получены доказательства, что в структуре гемоглобинов более 20 видов животных 9 аминокислот в последовательности оказались одинаковыми, консервативными (инвариантными), определяющими функции гемоглобинов; некоторые из них находятся вблизи гема, в составе участка связывания с кислородом, другие – в составе неполярной внутренней структуры глобулы.
Рисунок 31 Координационные связи атома железа в молекуле гема. Все 4 связи с атомами азота пиррольных колец расположены в одной плоскости, 5-я и 6-я координационные связи (с атомом азота имидазольного кольца гистидина и с кислородом соответственно) – по разные стороны перпендикулярно к этой плоскости
В дополнение к основному гемоглобину HbA1в крови взрослого человека доказано существование мигрирующего с меньшей скоростью при электрофорезе гемоглобина НbА2, также состоящего из 4 субъединиц: двух α-цепей и двух δ-цепей. На долю НbА2 приходится около 2,5% от всего гемоглобина. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый HbF и состоящий из двух α-цепей и двух γ-цепей. Фетальный гемоглобин отличается от HbA1не только составом аминокислот, но и физико-химическими свойствами: спектральным показателем, электрофоретической подвижностью, устойчивостью к щелочной денатурации и др. Кровь новорожденного содержит до 80% HbF, но к концу 1-го года жизни он почти целиком заменяется на НbА (все же в крови взрослого человека открывается до 1,5% HbF от общего количества гемоглобина). Последовательность аминокислот в γ- и δ-цепях гемоглобинов окончательно не расшифрована.
Обмен гемоглобина. Как синтез, так и распад гемоглобина происходит в селезенке, печени, косном мозге.
Распад гемоглобина начинается с окисления гема, когда железо Fе2+ превращается в Fе3+. Образующееся соединение называется вердоглобином (вещество зеленого цвета), который спонтанно распадается на составные части – глобин, железо и оставшаяся часть гема – биливердин (пигмент зеленого цвета). Биливердин восстанавливается в желто-красный билирубин, который поступает в печень. Для организма билирубин является токсичным и водонерастворимым. Поэтому в местах его образования происходит его обезвреживание и превращение в водорастворимую форму. Этот процесс происходит двумя путями:
1 С помощью глюкуроновой кислоты с которой билирубин образует моно- или диглюкурониды, комплекс билирубина с одной или двумя молекулами глюкуроновой кислоты. Такой билирубин является связанным (в лабораторной практике – прямой билирубин).
2 Образование комплекса с альбумином. В этом случае билирубин называют свободным (непрямым).
В крови содержится около 75% свободного билирубина и 25% связанного.
В печени комплекс билирубина с белками распадается, и освободившийся билирубин превращается в глюкуронид. В печени весь билирубин присутствует в форме связанной с глюкуроновой кислотой, т.е. в нетоксичной и водорастворимой форме. Из печени билирубин поступает в желчный пузырь, откуда под влиянием желчного пигмента поступает в кишечник. Там билирубин освобождается от глюкуроновой кислоты и подвергается различным превращениям с образованием в конце уробилиногена и стеркобилиногена. Первый всасывается в кровь, затем в печень, откуда поступает в мочу. На воздухе уробилиноген окисляется в уробилин. Второй выводится с калом (специфическая окраска) и кислородом окисляется до стрекобилина.
Синтез гемоглобина состоит из двух процессов:
1 синтез гема из глицина, янтарной кислоты и железа.
2 конденсация с глобином
Н2О
N N N N
— Н2О
Fе2+ Fе2+ + О2
N N N N
Гем Миоглобин
О2
N N
Fе2+
N N оксимиооглобин
Гемоглобин состоит из четырех полипептидных цепей, аналогичных по строению миоглобину.
В лекгих
ННb(Fе2+) + О2 ННbО2 (Fе2+)
В тканях
Оксигемоглобин выполняет функцию транспорта кислорода. Благодаря ему, литр крови переносит 250 мл кислорода в различные органы. Здесь оксигемоглобин отдает кислород, который диффундируют через плазму и стенки капилляров в ткани.
СО О2
ННbСО ННb ННb О2
карбокигемоглобин Н2О оксигемоглобин
СО2
(ННb СО2)- Нb- НbО2
Анион анион анион
карбаминогемоглобина гемоглобина оксигемоглобина
Из многообразия производных гемоглобина, следует, прежде всего, указать на оксигемоглобин НbО2 – соединение молекулярного кислорода с гемоглобином. Кислород присоединяется к каждому гему молекулы гемоглобина при помощи координационных связей железа, причем присоединение одной молекулы кислорода к тетрамеру облегчает присоединение второй молекулы, затем третьей и т.д. Помимо кислорода, гемоглобин легко соединяется с другими газами, в частности с СО, NO и др. Так, при отравлении оксидом углерода гемоглобин прочно связывается с ним с образованием карбоксигемоглобина (НbСО). При этом вследствие высокого сродства к СО гемоглобин теряет способность связывать кислород и наступает смерть от удушья, недостаточного снабжения тканей кислородом При этом содержание его в крови в 210 раз больше, чем оксигемоглобина, поэтому наступает отравление угарным газом.. Однако при быстром повышении парциального давления кислорода во вдыхаемом воздухе можно добиться частичного вытеснения СО из связи с гемоглобином и предотвратить летальный исход. Норма содержания карбоксигемоглобина – 0,3 – 05%, у курильщиков – 4,7%. При легкой тяжести отравления – 10-15% — головная боль, слабость, тошнота. При средней – 25-30% — нарушение координации, синюшность лица и помутнение сознания. При тяжелых – 60% и более – потеря сознания и смерть.
При отравлении оксидами азота, парами нитробензола и другими соединениями часть гемоглобина окисляется в метгемоглобин (НbОН), содержащий трехвалентное железо. Метгемоглобин также теряет способность к переносу кислорода от легких к тканям, поэтому при метгемоглобинемии (вследствие отравления окислителями) в зависимости от степени отравления может наступить смерть от недостатка кислорода. Если вовремя оказать помощь, т.е. повысить парциальное давление кислорода (вдыхание чистого кислорода), то и в этом случае можно вывести больного из опасного состояния.
Установление первичной структуры субъединиц молекулы гемоглобина стимулировало исследования по расшифровке структуры так называемых аномальных гемоглобинов. В крови человека в общей сложности открыто около 150 различных типов мутантных гемоглобинов. Появляются мутантные формы гемоглобинов в крови вследствие мутации генов. Обычно мутации делят на 3 класса в соответствии с топографией измененного участка молекулы. Если замена аминокислоты происходит на поверхности молекулы гемоглобина, то это мутация первого класса; подобные мутации обычно не сопровождаются развитием тяжелой патологии, и болезнь протекает бессимптомно; исключение составляет серповидно-клеточная анемия. При замене аминокислоты вблизи гема нарушается связывание кислорода – это мутация второго класса, сопровождающаяся развитием болезни. И наконец, если замена происходит во внутреннем участке молекулы гемоглобина, говорят о третьем классе мутации; подобные мутации приводят к нарушению пространственной структуры и соответственно функции гемоглобина.
Аномальные гемоглобины, различающиеся по форме, химическому составу и величине заряда, были выделены при помощи электрофореза и хроматографии. Передающиеся по наследству изменения чаще всего являются результатом мутации единственного триплета, приводящей к замене одной какой-либо аминокислоты в полипептидных цепях молекулы гемоглобина на другую. В большинстве случаев происходит замена кислой аминокислоты на основную или нейтральную. Поскольку это замещение осуществляется в обеих полипептидных цепях одной из пар (α или β), образовавшийся аномальный гемоглобин будет отличаться от нормального величиной заряда и соответственно электрофоретической подвижностью.
Следует указать, что некоторые мутации, вызывающие существенное изменение структуры и соответственно функции гемоглобина, оказываются летальными, и индивидуумы с подобным гемоглобином умирают в раннем возрасте. Однако при ряде мутаций замена аминокислот не вызывает заметного изменения функции гемоглобина, в этих случаях болезнь протекает бессимптомно.
Болезни гемоглобинов (их насчитывают более 200) называют гемоглобинозами. Принято делить их на гемоглобинопатии, в основе развития которых, лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина (часто их относят также к «молекулярным болезням»), и талассемии, обусловленные наследственным нарушением синтеза какой-либо нормальной цепи гемоглобина. Различают также железодефицитные анемии.
Рисунок 32 —Нормальные и серповидные эритроциты
Классическим примером наследственной гемоглобинопатии является серповидно-клеточная анемия, широко распространенная в странах Южной Америки, Африки и Юго-Восточной Азии. При этой патологии эритроциты в условиях низкого парциального давления кислорода принимают форму серпа (рис. 32). Гемоглобин S, как показали Л. Полинг и др., отличается рядом свойств от нормального гемоглобина: в частности, после отдачи кислорода в тканях он превращается в плохо растворимую дезоксиформу и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами. Болезнь протекает остро, и дети, гомозиготные по мутантному гену, часто умирают в раннем возрасте.
Химический дефект при серповидно-клеточной анемии был раскрыт и сводится к замене единственной аминокислоты, а именно глутаминовой, в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина HbS. Это результат мутации в молекуле ДНК, кодирующей синтез β-цепи гемоглобина. Все остальные аминокислоты располагаются в той же последовательности и в таком же количестве, как и в нормальном гемоглобине НЬА:
Одной этой замены оказалось достаточно не только для нарушения формы эритроцита, но и для развития тяжелой наследственной болезни – серповидно-клеточной анемии.
У беспозвоночных роль переносчика кислорода часто выполняют пигменты негеминовой природы – гемэритрин и гемоцианин. Они не относятся к гемсодержащим хромопротеинам, хотя в их названиях содержится корень «гем». Эти белки, как и гемоглобин, несмотря на то, что выполняют одну и ту же функцию, сильно различаются между собой по молекулярной массе и четвертичной структуре, химической природе активного центра, характеру связывания железа (гемэритрин) и меди (гемоцианин) с кислородом и др.
Источник