Механизм буферного действия системы гемоглобин оксигемоглобин
. : b bO2. ( ) Hb ‾ HbO2‾. :
H+ + Hb‾ ↔ HHb pKa (HHb) = 8,20
H + + HbO2‾ ↔ HHbO2 ↔ HHb + O2 pKa (HHbO2) = 6,95
+ , .
, :
OH ‾ + HHbO2↔ HbO2‾ + H2O OH ‾ + HHb ↔ Hb ‾ + H2O
: , , . .
(, , ).
(Prot-H) H2N CHR COOH, . , NH2 ─ . , , .
:
CO2 + H2O ↔ H2CO3 ↔ HCO3‾ + H + ()
Prot-H ↔ Prot ‾ + H + ()
() () . 2 (, ) () , () .
, — Prot ‾. HCO3‾ Prot ‾ .
( , ..), , Prot-H CO2, 2 .
( ). :
H2N CH2 COO ↔ H3N CH2 COO ‾
R ↔ R
R 224 000 R.
, — COO ‾ R +. H3N + — , R‾:
+ H + + H +
H3N CH2 COOH ↔ H3N CH2 COO ‾↔ H3N CH2 COO ‾
R + ( ) R ‾( )
, R + , 1 2 ( 1 = 2,6 2 = 9,8). , .
(R +, R , R‾ ) . R+. R+ R , .
N +H3 CH2 COO ‾ + H+(.) ↔ NH3+ CH2 COOH
, . :
= 1 + lg[R] / [R+]
R‾ . R R‾. .
NH3+ — CH2 — COO‾ + OH ‾ (.) ↔ NH2 CH2 COO ‾
R, R‾. :
= 2 + lg[R] / [R+]
—
— , .
— .
, , , . . , 2 . , — , . -, .
-. , , , 2 .
. ( ) , , . / 1 : 4 1 : 50 .
, 800 : 1.
. , , . ( ) . ( ) .
— .
, .
:
) ( , , , , .);
) ;
) — , , . — .
, .
:
) ( , .);
) ( , — , , , , .).
( 2), — .
-:
) (, , ..); ) () ; ) , ..
— . , — .
— 4% , . — . 5% .
3.
, . , colligatus, .
: , , , .
.
, , . , : , . , . , , , , , . .
, , (, ) (, ). , , , , , ..
1, , , — 1 2, 2, , . 1, 1 > 2. 1 2. , . .
() .
, — . .
, , . 1, . . 1 . ( 1) ( !). 1 2, , 1, , 2.
( ), ( , ), .
1 ,
. : 1 ; 2 .
1 , , . h 1 , . , . 1, 1 2. 1 , , ; .
,
, , .
, h, , π .
1887 , .
1.
π = 1
2. (/)
π= 2
— — -. , , :
π = RT,
, R , .
— . , -:
, , , .
, , .
(, , , .) , . ( ). -.
, .. , , 1 , , .
c =ic(x). . . , , , , , , . , , , . .
. () (, , ..) — . 8 , ≈ 15, 100, 400 . . NaCl.
, . , , 0,03 0,04 . .
.
π= gRT/M + A∙g2
π/g = RT/M + A∙g
g , .
, , — i, . :
i = /
i = 1, i > 1:
NaCl CaCl2 Na3PO4
I(.) = 2 3 4
, i < 1.
— : π= iCRT.
, .
π , π , π — . .
, . .
.
: . > .; π(.) > π(.).
, , . .
, , . (, , , ).
() . ( 125 ) . , , .
:
.
: .> .; π(.) > π(.).
, . , . , , , , , . .
(, , ).
. , , , , . . , , ( ). , , . . , , , . ( , ) . , . , , , .
. , , . . . , , , , .
.
, — (). S. . .
, , .. , . . , , , . . , , , S.
, , . , , .
, , .
0, , 0 = Δ . , :
0 /0
I- ,
:
p / = 2, 1 + 2 = 1, 1 = 01
1 2 . (, ).
, .
. , . , .
— , . . , .
, , , . , . , .
.
:
.
:
Δ = b Δ = b
, , , =1,86, =0,516, b . (, , 1 .).
. .
1. 1 2 :
0 /0 = 2 = 2/1 + 2
g1 1 g2 2,
x1 = g1/M1 2 = g2/M2
,
0 /0 = g2/M2/ (g1/M1) + (g2/M2).
, 2 1. :
0 /0 = 2/x1 = g2M2 / g1M1.
0 1 ( ), g1 g2 . 2 — , ( 0 ).
2. , , , , 1 1000 , .
, , Δ= 0 ( , 0 ), 2 , :
Δ= ∙ 1000∙g2 / M2∙ g1 M2 = E ∙ 1000∙g2 / Δ ∙g1
, , , .
3. , , , , 1 , 1000 , . :
Δ = ∙ 1000∙g2 / M2∙g1 M2 = K ∙ 1000∙g2 / Δ ∙g1
( , ).
, .
Источник
YOBA-3000 / Khimia_1_7_Bufernye_sistemy (1)
Буферные системы
Буферные растворы
Организм человека располагает тонкими механизмами координации происходящих в нем процессов и поддержания постоянства внутренней среды.
Эта координация называется гомеостазом. Она осуществляется с помощью гуморальной регуляции, т.е. через кровь, тканевую жидкость, лимфу с помощью биологически активных веществ (ферментов, гормонов и других веществ).
Сохранение постоянства pH жидких сред организма имеет очень важное значение для жизнедеятельности человеческого организма, т.к.
Ионы H+ катализируют многие биохимические превращения (расщепление белков в жкт),
Кроме того, многие ферменты и гормоны проявляют свою биологическую активность только в строго определенном интервале pH
Даже незначительные сдвиги pH могут оказать существенное влияние на величину осмотического давления биологических жидкостей.
Буферные растворы
Поддержание на постоянном уровне концентрации ионов водорода способствуют буферные растворы — растворы, рН которых не меняется при добавлении к ним небольших количеств сильных кислот, щелочей, а также при разведении.
Простейший буферный раствор — это смесь слабой кислоты и соли, имеющей с этой кислотой общий анион — буферная система I типа.
Смесь слабого основания и соли с общим катионом.
Классификация буферных растворов
1 тип буферных растворов:
Ацетатный — CH3COOH и СН3СООNa
Фосфатный — NaH2PO4 и Na2HPO4
Бикарбонатный — H2CO3 и NaHCO3
Белковый — PtCOOH и PtCOONa
Гемоглобиновый — HHb и KHb
Оксигемоглобиновый — HhbO2 и KHbO2
* Все ацетатные буферные системы входят в состав организменных сред
2 тип буферных растворов:
Аммиачный — NH4OH и NH4Cl
По более современной классификации БР делят на следующие группы:
БР, состоящие из слабой кислоты и ее аниона — HA/A- (CH3COOH / CH2COO-)
БР, состоящие из слабого основания и его катиона — B/BH+ (NH4OH / NH4+)
БР, состоящие из аниона кислой и средней соли, или из анионов двух кислых солей, например, фосфатная буферная система — H2PO4-/HPO42-
БР, состоящие из ионов и молекул амфолитов. К ним относятся белковые БС, гемоглобиновая и оксигемоглобиновая БС.
pH буферных растворов

Так как концентрация ионов CH3COO- велика из-за диссоциации соли, процесс диссоциации CH3COOH по принципу Ле-Шателье сдвинут влево, поэтому концентрация недиссоциированных молекул CH3COOH практически равна общей концентрации кислоты в БР.
А концентрация ионов CH3COO- равна концентрации соли в БР, поэтому:

Механизм буферного действия
Если к буферному раствору добавить сильную кислоты, то ионы водорода будут соединяться с анионами с образованием слабого электролита и реакция среды при этом не меняется:
CH3COONa + HCl = CH3COOH + NaCl
CH3COO- + H+ = CH3COOH
pH практически не изменится, т.к. добавленный сильный электролит замещается эквивалентным количеством слабого электролита
Механизм буферного действия
Если к буферному раствору прибавить сильное основание, то ионы ОН- будут взаимодействовать с ионами Н+, которые содержатся в небольшом количестве, вследствие небольшой диссоциации кислоты. В результате образуется Н2О.
Кроме этого, увеличение концентрации ионов СН3СОО- приводит к смещению равновесия процесса диссоциации СН3СООН влево, поэтому рН не изменяется:
CH3COOH + NaOH = CH3COONa + H2O
CH3COOH + OH- = CH3COO- + H2O
Уравнение Гендерсона-Гассельбаха показывает, что рН буферного раствора данного состава определяется соотношением кислоты и соли не зависит от разбавления, т.к. при изменении объема раствора концентрация каждого компонента изменяется в одинаковое число раз, а их соотношение остается постоянным.
Буферная емкость.
Способность буферного раствора сохранять рН при добавлении сильных кислот или щелочей не беспредельна и ограничена величиной, называемой буферной емкостью.
За единицу буферной емкости принята емкость такого БР, для изменения рН которого на единицу требуется введение сильной кислоты или щелочи в количестве 1 моль эквивалента на 1 литр буферного раствора.

Буферная емкость
От природы и общих концентраций компонентов буферного раствора, а также от соотношения их концентраций:
Чем больше концентрация компонентов и
Чем ближе отношение кислота/соль к 1, тем больше буферная емкость.
Буферные системы крови
Для каждой биологической жидкости характерно определенное значение рН и сохранение этого значения имеет очень важную роль для нормальной жизнедеятельности организма.
Значение рН крови в норме 7.36, которое поддерживается за счет буферных систем, содержащихся в крови.
Буферные системы плазмы крови
Водородкарбонатная (гидрокарбонатная) — состоит из слабой H2CO3 и сопряженного основания HCO3-
Углекислота образуется при взаимодействии растворенного в плазме СО2 с водой:
СО2 + Н2О = Н2СО3

при поступлении в кровь кислот (например, молочной кислоты) гидрокарбонат их нейтрализует, а избыток СО2 выводится через легкие, вызывая увеличение легочной вентиляции.
Таким образом, соотношение НСО3-/Н2СО3, а следовательно, и рН крови не меняется.

у гидрокарбонатной буферной системы наибольшая взаимосвязь со всеми буферными системами и вне-, и внутриклеточных жидкостей
нарушение в любой буферной системе сказывается на концентрациях составляющих гидрокарбонатной БС, поэтому изменение ее параметров может достаточно точно характеризовать состояние дыхательных или метаболических нарушений, т.е. кислотно-основного состояния.
Фосфатная буферная система состоит из слабой кислоты Н2РО4- и сопряженного основания НРО42-. В основе ее действия лежит равновесие:
Н2РО4- ↔ НРО42- + Н+
Фосфатная буферная система способна сопротивляться изменению рН в интервале 6,2-8,2, т.е. обеспечивает значительную долю буферной емкости крови.
Отношению НРО42-/Н2РО4- в плазме крови равно 4:1, поэтому данная буферная система имеет более высокую емкость по кислоте, чем по щелочи (Вк = 1-2 ммоль/л; Вщ = 0,5 ммоль/л)
В связи с малым содержанием фосфатов в плазме крови она менее мощная, чем гидрокарбонатная, однако, эта система играет решающую роль в других биологических средах — в клетке, моче и соках пищеварительных желез.
Белковые буферные системы — состоят из остатков аминокислот, которые содержат -NH2 группы, имеющие слабый основный характер, и -СООН группы, со слабыми кислотными свойствами, поэтому белки способны противодействовать как подкислению, так и подщелачиванию среды.

при увеличении количества ионов Н+ (при избыточном образовании молочной кислоты при гипоксии или 3 гидроксимасляной кислоты при диабетическом кетозе) обе эти реакции сдвигаются влево, образуя PtCOOH и СО2, избыток которого выводится через легкие.
Буферная емкость, определяемая белками плазмы, зависит от:
концентрации белков в плазме,
их вторичной и третичной структуры,
а также числа свободных протон-акцепторных групп.
Эта система способна нейтрализовать как кислые, так и основные продукты, однако, вследствие преобладания формы белок-основание, ее буферная емкость значительно выше по кислоте и составляет для альбуминов 10ммоль/л, а для глобулинов — 3 ммоль/л
Буферные системы эритроцитов
-гемоглобиновая/оксигемоглобиновая
БС, на долю которой приходится 75% буферной емкости крови.
-Гемоглобиновый буфер является разновидностью белковой БС и состоит из 2х форм гемоглобина:
Восстановленного (ННb)
Окисленного (ННbO2)
В эритроцитах система гемоглобин/оксигемоглобин играет важную роль в процессах дыхания (транспортная функция по переносу О2 к тканям и органам и удаление из них метаболического СО2), а также в поддержании постоянства рН внутри эритроцитов, а в результате и в крови в целом).
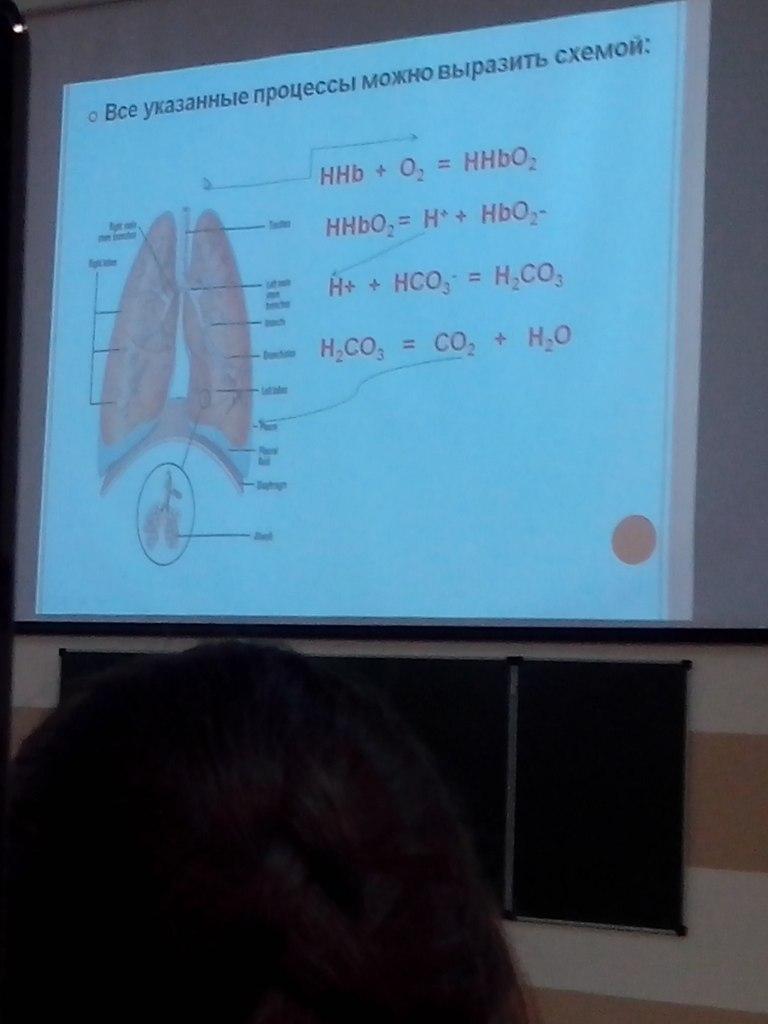
В основе действия системы гемоглобин/оксигемоглобин лежит следующее уравнение:
ННb + O2 = HHbO2
HHb является более слабой кислотой, чем ННbO2:
К(HHb) = 6.3*10-9
K(HHbO2) = 1.12*10-7
Поэтому ион Hb- способен активнее связывать протон Н+, чем ион HbO2
В организме гемоглобиновые БС взаимодействуют с гидрокарбонатной БС.
Совместное действие гемоглобиновой и гидрокарбонатной БС.
В капиллярах большого круга кровообращения оксигемоглобин диссоциирует и отдает О2 тканям:
HHbO2 = HHb + O2
Вследствие образования восстановленного гемоглобина, являющегося более слабой кислотой, снижается степень диссоциации кислотных групп гемоглобина и уменьшается отдача ионов Н+ в среду, но активная реакция среды (рН) не меняется, т.к. из тканей в кровь поступает СО2
Под действием угольной ангидразы СО2 превращается в Н2СО3, при этом происходит одновременный процесс ее диссоциации:
Н2СО3 ↔ Н+ + НСО3-
Образующиеся в ходе этой реакции ионы Н+ связываются в эритроцитах с восстановленным гемоглобином, который освобождает часть связанных ионов К+:
КHb + H+ = HHb + K+
Часть ионов НСО3- образуют с ионами К+ соединение КНСО3, другая часть ионов НСО3- переходит в плазму, где образуется NaHCO3
Из плазмы в обмен на ионы НСО3- в эритроциты переходят ионы Cl-, которые с ионами К+ образуют KCl
В капиллярах большого круга кровообращения:

В легочных капиллярах
Через тончайшую легочную мембрану по градиенту парциального давления О2 переходит в плазму и эритроциты, при этом происходит оксигенация гемоглобина
HHb + O2 = HHbO2 = H+ + HbO2-
Ионы Н+ связываются с гидрокарбонат-ионами, а ионы К+ с гемоглобином:
Н+ + НСО3 = Н2СО3
К+ + Нb- = KHb
Угольная кислота под действием карбоангидразы разлагается на СО2 и Н2О.
Образовавшийся СО2 переходит из эритроцитов в плазму, диффундирует в легкие и удаляется с выдыхаемым воздухом.
Вследствие уменьшения концентрации НСО3- в плазме крови, из эритроцитов в плазму переходят ионы Cl-, где связываются с ионами Na+.
В результате этих преобразований соотношение в артериальной крови HCO3-/H2CO3 остается оптимальным (20:1).
Кислотно-основное состояние
Таким образом, благодаря буферному действию буферных систем происходит лишь небольшое снижение рН крови, т.е. сохраняется кислотно-основное состояние, несмотря на поступление в кровь значительных количеств кислот,
Т.к. в процессе усвоения пищи в организме генерируется значительное количество диоксида углерода (550-775 г/сут), при взаимодействии которого с влагой образуется угольная кислота в количестве, эквивалентном поступлению в кровь от 25 до 35 ммоль/сут ионов Н+.
Кислотно-основное состояние организма — неотъемлемая часть гомеостаза внутренней среды организма.
Физиологические системы регуляции кислотно-основного состояния связаны с функциональной активностью легких и почек.
Смещение кислотно-основного равновесия крови в сторону повышения концентрации ионов Н+ (снижения рН) и уменьшения резервной щелочности называется ацидозом.
Смещение его в сторону снижения концентрации ионов водорода (повышение рН) и увеличение резервной щелочности — алкалозом.
Ацидоз и алкалоз
В зависимости от механизма развития расстройств кислотно-основного состояния выделяют
-дыхательный
-метаболический ацидоз и алкалоз.
Метаболический ацидоз характеризуется нарушением метаболизма и может наступить в результате следующих причин:
-избыточное введение или образование в организме стойких кислот (поступление кетокислот при голодании и диабете,
-повышенное образование молочной кислоты при шоке; поступление кислот с пищей, питьем, медикаментами, в результате вдыхания загрязненного воздуха и т.д.);
-неполное удаление кислот (при почечной недостаточности);
-избыточные потери HCO3- иона (в результате поноса, колита, язвы кишечника
Метаболический алкалоз наступает вследствие:
-потери ионов Н+ (рвоте, кишечной непроходимости и др.);
-увеличения концентрации НСО3- иона (при потере воды, введение солей органических кислот — молочной, уксусной, лимонной, катаболизирующихся с поглощением ионов Н+).
Соседние файлы в папке YOBA-3000
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Буферные системы крови
Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови — от 7,37 до 7,44 со средней величиной 7,40 . Кровь представляет собой взвесь клеток в жидкой среде, поэтому ее кислотно-основное равновесие поддерживается совместным участием буферных систем плазмы и клеток крови. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемогло-биновая.
Бикарбонатная буферная система — мощная и, пожалуй, самая управляемая система внеклеточной жидкости и крови. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Бикарбонатная система представляет собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты Н2СО3, выполняющую роль донора протона, и бикарбонат-иона НСО3-, выполняющего роль акцептора протона:
Для данной буферной системы величину рН в растворе можно выразить через константу диссоциации угольной кислоты (рКН2СО3) и логарифм концентрации недиссоциированных молекул Н2СО3 и ионов HCO3-:
Истинная концентрация недиссоциированных молекул Н2СО3 в крови незначительна и находится в прямой зависимости от концентрации растворенного углекислого газа (СО2 + Н2О <=> Н2СО3). Поэтому удобнее пользоваться тем вариантом уравнения, в котором рКH2СО3 заменена «кажущейся» константой диссоциации Н2СО3, учитывающей общую концентрацию растворенного СО2 в крови:
где K1- «кажущаяся» константа диссоциации Н2 С О3 ; [СО2(р)] — концентрация растворенного СО2.
При нормальном значении рН крови (7,4) концентрация ионов бикарбоната НСО3 в плазме крови превышает концентрацию СО2 примерно в 20 раз. Бикарбонатная буферная система функционирует как эффективный регулятор в области рН 7,4.
Механизм действия данной системы заключается в том, что при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н+ взаимодействуют с ионами бикарбоната НСО3-, что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Последующее снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 через легкие в результате их гипервентиляции (напомним, что концентрация Н2СО3 в плазме крови определяется давлением СО2 в альвеолярной газовой смеси).
Если в крови увеличивается количество оснований, то они, взаимодействуя со слабой угольной кислотой, образуют ионы бикарбоната и воду. При этом не происходит сколько-нибудь заметных сдвигов в величине рН. Кроме того, для сохранения нормального соотношения между компонентами буферной системы в этом случае подключаются физиологические механизмы регуляции кислотно-основного равновесия: происходит задержка в плазме крови некоторого количества СО2 в результате гиповентиляции легких . Как будет показано далее, данная буферная система тесно связана с гемоглобиновой системой.
Фосфатная буферная система представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4- (донор протонов) и иона НРО42- (акцептор протонов):
Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли двузамещенный фосфат — Na2HPO4.
Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. В других тканях эта система является одной из основных. Для фосфатной буферной системы справедливо следующее уравнение:
Во внеклеточной жидкости, в том числе в крови, соотношение [НРО42-]: [Н2РО4-] составляет 4:1. Величина рКН2РО4- равна 6,86.
Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО42- с образованием Н2РО4- (Н+ + + НРО42- -> Н2РО4-), а также ионов ОН- с ионами Н2РО4- (ОН- + + Н2 Р О4- -> HPO42-+ H2O). Буферная пара (Н2РО4—НРО42-) способна оказывать влияние при изменениях рН в интервале от 6,1 до 7,7 и может обеспечивать определенную буферную емкость внутриклеточной жидкости, величина рН которой в пределах 6,9-7,4. В крови максимальная емкость фосфатного буфера проявляется вблизи значения рН 7,2. Фосфатный буфер в крови находится в тесном взаимодействии с бикарбонатной буферной системой. Органические фосфаты также обладают буферными свойствами, но мощность их слабее, чем неорганического фосфатного буфера.
Белковая буферная система имеет меньшее значение для поддержания КОР в плазме крови, чем другие буферные системы.
Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок-Н+ (кислота, донор протонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2-7,4.
Гемоглобиновая буферная система — самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови.
Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Константа диссоциации кислотных групп гемоглобина меняется в зависимости от его насыщения кислородом. При насыщении кислородом гемоглобин становится более сильной кислотой (ННbО2). Гемоглобин, отдавая кислород, превращается в очень слабую органическую кислоту (ННb).
Итак, гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Точно так же может быть рассмотрена оксигемоглобиновая буферная система. Система гемоглобина и система оксигемоглобина являются вза-имопревращающимися системами и существуют как единое целое. Буферные свойства гемоглобина прежде всего обусловлены возможностью взаимодействия кисло реагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина:
КНb + Н2СO3-> КНСO3 + ННb.
Именно таким образом превращение калийной соли гемоглобина эритроцитов в свободный ННb с образованием эквивалентного количества бикарбоната обеспечивает поддержание рН крови в пределах физиологически допустимых величин, несмотря на поступление в венозную кровь огромного количества углекислого газа и других кисло реагирующих продуктов обмена.
Гемоглобин (ННb), попадая в капилляры легких, превращается в окси-гемоглобин (ННbО2), что приводит к некоторому подкислению крови, вытеснению части Н2СО3 из бикарбонатов и понижению щелочного резерва крови . Перечисленные буферные системы крови играют важную роль в регуляции кислотно-основного равновесия. Как отмечалось, в этом процессе, помимо буферных систем крови, активное участие принимают также система дыхания и мочевыделительная система.
Источник