Молекула гемоглобина состоящая из нескольких полипептидных цепей
Содержание статьи
Видеоурок по биологии «Белки»
Белки — это строительные материалы и живые нано-машины нашего тела. По сравнению с липидами и углеводами белки являются наиболее важными для организма.
Каждый из сотен тысяч разных белков обладает неповторимой пространственной структурой. И у каждого белка своя задача и функция. Есть белки костной и мышечной ткани, белки тканей кожи и мозга. Белки ферменты и рецепторы.
Если в организме отсутствует хотя бы один белок (например, белковый гормон инсулин), жизнь человека в опасности, так как инсулин оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови.
Белки — это самые сложные молекулярные системы, имеющиеся в природе.
Кроме углерода, кислорода, водорода и азота в состав белков могут входить сера, фосфор, железо.
Белки построены из мономеров, которыми являются аминокислоты.
Среди двухсот известных аминокислот только 20 из них участвуют во внутриклеточном синтезе белков. Их называют протеиногенными или стандартными аминокислотами. Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих.
Из 20 аминокислот, входящих в состав белков, может быть образовано вот такое число комбинаций различных белков, которые будут обладать совершенно одинаковым составом, но различным строением.
Все аминокислоты подразделяют на заменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека, к ним относят: аланин, аргинин, аспарагин, аспарагиновую кислоту, глицин, глутамин, глутаминовую кислоту, пролин, серин, тирозин и цистеин.
Незаменимые аминокислоты в организме не синтезируются и должны в обязательном порядке поступать с пищей. Это валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Содержатся они в основном в продуктах животного происхождения.
Для удобства названия аминокислот имеют общепринятые сокращения.
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (─ ) с основными свойствами, другая —карбоксильной группой (─COOH) с кислотными свойствами. Часть молекулы, которая называется радикалом (в формулах она обычно обозначается большой латинской буквой R), у разных аминокислот имеет различное строение.
Аминокислоты соединяются между собой. Так образуется молекула, которая представляет собой пептид. Эта реакция называется (полимеризацией). В процессе полимеризации выделяется молекула воды, а освободившиеся электроны образуют ковалентную связь, которая получила название пептидной. Это связь между атомами углерода и азота.
Поскольку на одном конце дипептида находится свободная аминогруппа, а на другом — свободная карбоксильная группа, дипептид может присоединять к себе другие аминокислоты.
Также белки могут состоять и из большого числа аминокислотных остатков. И, кроме того, каждая аминокислота может встречаться в белке несколько раз.
В состав белка может входить одна, две и более полипептидные цепи. Например, в молекуле инсулина — две цепи, а иммуноглобулины состоят из четырёх цепей.
Среди белков различают протеины, состоящие только из белков, и протеиды, содержащие не белковую часть. Например, гемоглобин.
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве небелкового компонента здесь выступает особая пигментная группа, содержащая железо, — гем.
Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1и β2.
Четвертичная структура гемоглобина придаёт ему способность регулировать присоединение и отщепление кислорода.
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии. В эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина.
Эритроцит при этом приобретает форму серпа. Из-за этого малярийный плазмодий не проникает в эритроцит и не питается белком-гемоглобином. Изменение в форме эритроцита приводит к заболеванию ─ серповидноклеточной анемии.
Если белки состоят только из аминокислот, то их называют простыми.
Если в состав белков входят компоненты неаминокислотной природы, то такие белки относят к сложным.
Если в состав сложных белков входят углеводы, то их называют «гликопротеиды». Если входят липиды — то «липопротеиды», а если нуклеиновые кислоты — «нуклеопротеиды».
Именно строение белковых молекул определяет многообразие функций белков и их особую роль в жизненных процессах. Поэтому исследование структуры белков ─ самая важная стадия познания явлений, происходящих в живой клетке.
Белок можно выявить при помощи его денатурации. Денатурация — это утрата белковой молекулой своей первоначальной структуры.
Денатурация может возникать под воздействием нагревания (температуры), химических веществ (например, кислот, оснований, органических растворителей), обезвоживания, облучения и других факторов, в результате которых свойство белковых молекул резко изменяется.
Зажигаем спиртовку, наливаем в демонстрационную пробирку каллоидный раствор белка в дистиллированной воде. Закрепляем пробирку в держалке и осторожно нагреваем содержимое пробирки. Уже при небольшом нагревании хорошо видны изменения, происходящие в растворе. Он перестаёт быть прозрачным, появляется белый осадок. Это и есть свернувшийся белок. Температура (нагревание) вызывает свёртывание коллоидного раствора белка.
Следующий опыт
В пробирку с коллоидным раствором белка в дистиллированной воде добавляем разбавленный раствор азотной кислоты. Признак реакции — образование осадка. Белок денатурирован.
Третий опыт
Денатурация белка происходит и под действием растворов солей тяжёлых металлов. К раствору белка добавляем раствор сульфата меди. Признаком реакции является образование белого непрозрачного осадка. Это и есть денатурированный белок.
Обнаружив белок, мы ничего не можем сказать о его составе, структуре, свойствах. Что бы ответить на все эти вопросы, необходимо, прежде всего, выделить белок — получить его в чистом виде. Существует множество методов получения белков в чистом виде.
Процесс, обратный денатурации, при котором белки возвращают свою природную структуру, называется ренатурацией.
Уровни организации белковой молекулы
Молекулы белков могут принимать различные пространственные формы —конформации, которые представляют собой четыре уровня их организации.
Последовательное чередование различных аминокислотных звеньев в полипептидной цепи называется — первичной структурой белковой молекулы. Она уникальна для любого белка и определяет его форму, свойства и функции.
Молекула белка обладает определённой пространственной формой — это вторичная структура. Такая структура поддерживается водородными связями. Водородные связи возникают межу амино- и карбоксильными группами амикислотных остатков полипептидной цепи.
Водородные связи фиксируют различные пространственные структуры. Хотя они и малопрочные, но из-за того, что их большое количество, — вторичная структура белка достаточно прочна. Части белковой молекулы могут организовываться в спираль или в другие виды вторичной структуры.
Третичная структура белка имеет вид клубка (глобулы). Третичная структура — это трёхмерная организация белковой молекулы. Она поддерживается водородными и дисульфидными (-S-S-) связями между остатками цисцеина (аминокислоты), а также гидрофобными взаимодействиями.
Существует и четвертичная структура белка. Однако она характерна не для всех молекул белка. Четвертичная структура возникает в результате соединения нескольких глобул в сложный комплекс. Например, гемоглобин крови состоит из четырёх таких субъединиц.
Как вы уже поняли, белки многочисленны и многообразны. И у каждого белка своя задача и функция.
Структурная функция белков
Так как белки являются основой всех биологических мембран, они выполняют строительную функцию.
Белок коллаген — важный составной компонент соединительных тканей.
Эластин — эластичный компонент связок, стенок кровеносных сосудов.
Кератин — фибриллярный белок, обладающий механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и роговой чехол, который покрывает клюв птиц.
Ферментативная функция белков
Ферменты — вещества белковой природы. Их молекулы состоят в основном из аминокислотных звеньев. Ферменты специфичны для каждого вещества. Основная функция их — это ускорение биохимических реакций организма, реакций распада и синтеза.
Они действуют в строго определённой последовательности. Почему так? Дело в том, что избирательность действия ферментов на разные химические вещества связана с их строением. Ферменты имеют специфические активные участки (центры), с которыми связываются субстраты.
Форма и химическое строение активного центра таково, что с ним могут связаться только определённые молекулы в силу их пространственного соответствия, они подходят друг к другу, как ключ к замку.
Связывание субстрата осуществляется именно в активном центре фермента. Одни ферментные системы направляют процессы биосинтеза. Этот процесс требует затрат энергии.
Другие ферментные системы регулируют распад и окисление веществ. При этих реакциях энергия выделяется.
На заключительном этапе химической реакции комплекс распадается с образованием конечных продуктов и свободного фермента.
Освободившийся при этом активный центр фермента может снова принимать новые молекулы вещества — субстрата.
Многие ферменты, как мы уже сказали, представлены белковыми молекулами. Другие состоят не только из белка, но и из небелкового соединения (кофермента). В качестве кофермента могут выступать различные вещества, но, как правило, это витамины и ионы металлов.
Отсутствие витамина в пище сначала приводит к недостаточному образованию кофермента, а без него не может работать (активироваться) соответствующий фермент. Поэтому скорость биохимической реакции, за которую отвечает этот фермент, значительно падает. Итогом этого становится нарушение обмена веществ.
Транспортная функция белков имеет важное значение. Так, гемоглобин переносит кислород из лёгких к клеткам других тканей.
В мышцах эту функцию выполняет белок миоглобин. Сывороточный альбумин крови способствует переносу липидов и жирных кислот, различных биологически активных веществ.
Белки-переносчики осуществляют перенос веществ через клеточные мембраны.
Специфические белки выполняют защитную функцию. Они предохраняют организм от вторжения чужеродных организмов и от повреждения.
Например, на проникновение в организм чужеродных белков реагирует иммунная система организма. Она бросает против них целую армию своих белков, так называемых антител. Антитела являются особым классом гликопротеинов, имеющихся на поверхности B-лимфоцитов в виде мембраносвязанных рецепторов.
При помощи антиген-связывающих участков антитела присоединяются к вирусам и бактериям, чужеродным белкам, препятствуя их размножению.
Ещё один важный белок нашего организма — интерферон — универсальный противовирусный белок.
Фибриноген и тромбин предохраняют организм от кровопотери, образуя тромб.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами.
Регуляторная функция белков присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является упомянутый выше инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии.
Но в качестве источника энергии белки используются в последнюю очередь, после углеводов и жиров. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Таким образом, роль белков огромна. Современная биология показала, что сходство и различие организмов определяются в конечном счёте набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Скачать этот видеоурок вы можете на странице:
https://videouroki.net/blog/vidieourok-po-biologhii-bielki.html
#videouroki_net #полезное_для_учителей #бесплатные_материалы_учителю #видеоурок #Белки
Источник
·°ÇæøQÉoÏ
D9.«ôV
t^ÎïA§°e¡!¬
uuïaß?E®ñJι°C.D*ÍGݽXêvÌÛ³nu#þÃ-·Èpäë),õByÅ4r㹧AD»E% ÞnM¬àÀ`¨Cº
Í!´æp*Þ¢hÕìïB·C¡Åî3~
ÂJð+.â3
ÀR«ZëÙµ:
ÃBÍ9Üààîwp×ìp¯¿û»>ãî²ëä®aÓ/4P$n5°-³¹?Üj¶w@ϨW-ô(EõôT_¡géñLÍ]ì-~í½S´öM±âÿéKKGÑ£®,øÌÉè lò¢j4ÚÀLAØôWhªÇ4uÄTßl¨ª·®ýôz´12 ¥4±WK^x¦Né.¥På;¯Â©û¹ðc[zÎ1%$õ9¢¡²~ó(ëyØ6Ú|
+sÛ¤íÛucã+Q®ÌÙ(ëLêxq)-éeÖÒ¨®Sµ»É¹îì3â7®«dÕÖÉÛMV³ó3% KXöAýùÐ*QÖ’>`vgÞa¡Û/¸`%È..¸ *ñ9¿ª/|x?*³u´âëV §µõ4yDò¿ÍNï ºí@U-¥üË;³UF¨§véqr¦ö>Ô,O9ç?qçÅ-/}ÖvÍýeà2Û4|ìMICÈ}[nµ6¤±_Õ~mOUnâ´6÷ö’SÅ`.Í6Mk?Ñ£ÁF`?±NÄR®oZºÃSwú´¥caÚ
SyHUWBÔƦh«¶À%.±#O1«dkî3õMù¥>ë>ºæt~ÁJ(TÍE¬òKØÊ/J@hDið ]´°-Ý÷´T7ÒEN¶¶÷¾x£ÞKÛsØòÈ©ÑÉ3ª¥jG;Zº]ankbj黸ñ AýáT§³1jÍé¢R¡-u
el¬²A»ð7¸ÇFo,EÔ:Bgg¢cþT»NfTè¼µ}£>Õ3µ¥úõ%ï!I_Ö¨6uÐÎBÓ8²ûs£ÀN-;Ù-éª;÷¬]}5»ZÎ`M®ËW[a $¥çj½ssU¾ÒÀuÝë9[®ÜºùígçDhNToæ
y]¢ØÃ)ð}Hɬ,AØÊívô»¬ÄØvoçíoív¾í&²%Á}öõ¾-*
ËItVϾÅeÝp6}i´»SeðGe¢ýñÖ^BðµoÝîÀÛ
;Û[Ì´Òù
·ÌeìÒ&]04@Éܸ¼gm¾údÁ¢>6G=ogKZÜÑ¢ùË-;ýædºÁÑNiÙIà
µ3Zv2~üõ¾µd 4i§´ì3%aøEµaég´ì®7BëM-ÿ@æUÌ
endstream
endobj
5 0 obj
>
endobj
6 0 obj
>
endobj
7 0 obj
>
endobj
8 0 obj
[ 9 0 R]
endobj
9 0 obj
>
endobj
10 0 obj
>
endobj
11 0 obj
>
endobj
12 0 obj
>
endobj
13 0 obj
>
endobj
14 0 obj
>
endobj
15 0 obj
[ 16 0 R]
endobj
16 0 obj
>
endobj
17 0 obj
>
endobj
18 0 obj
>
endobj
19 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 20 0 R/Group>/Tabs/S/StructParents 1>>
endobj
20 0 obj
>
stream
x=Ûnd7rïÌ?ôK i±}÷0h@Ý à`ã}xmÇ×Þu&û÷añZÅÃÃsZN6¥Y,«uå|xúíëO?|ùîëéãÇO_¿~ùî¿¿ÿëéóë¯_¿þú·¿|øôÏ¿ÿáÏ_~üé/_úõËåt}¾®Þ¿ûðªO>ýðþ?±ð?~²lñJ¤[Q§O{ÿ~ozÿîóÃéñ/§OÿöþÝKü÷ï4·ó’©ÏüÉ,V¸Üé·ïß¿ûÏ?~©ò5åóà¶úçÖü7@j1
~sû×ç#d’®°ØRÖEàH@ö@´Ydr:³
ÉÓ§ï4ø?OtnÝD&u>¼ªò/Né?2¡0 ýz91y9s¡Ã_ÃÃ__Â×Søº
ßíþ~Í
üv½åÇÆÁ}ߺ·»Xîq1.1àa°¾áÎÂÏVçÏnùs}A(ãÉðó
+ò©å³/ ¯i52ªÒÔH§Y¡IÆ©`¬Ó¶Ó¯x%±ðÆ[V÷ÂØkÜK¿b ¡
â.í*/ØZ’pÑ1@ùFý[
ÑÈßÎìîqYá
ÞÅ-¾¥¿J&Rúcù â-CÓá
ýZÝÎ0C
Ãã²e§ÁÆR¨îó)ÃYÔq&
E,Ì_ó2ö«|êÒ´R9ÙëÁ¯|÷éQè`eÞEf)}KÈàLå*°.§dYÐmÜD¦¡ù+]aÛÀÆñ¿,#he»vå?HuñßãÓD¯ç%§(¥ªzÁoµx$¯¶¼aIZD㯠Í,Í0q¸¡b²ME©Õ¢dGEvå^Ô¿4|ÑL>¨{¥Ñö«Ã»f²&ºÝ¾öûÅÏ3ª3Th+uࢯ·6q=ÀÌ-¼mÇ$¶»ªÙræÊÁ}_D ü®²Im¨´³ÂÓ
ÍnY« ÊÎWø¤rì’Ì^*Ë[b÷+qºÑª%ãZ·¨ËWUÒAö5ê ¼Í·A3
¨5ï¿`(/Eé&Mâ`ËÏu@Ó/&65Mã§1ï%ÖP8ÅVw ÒÀÚEk$pB9r±¶/¢é!¦Û¡j¿×CÒ^&:(ýaW´+R¬¯Å]%IS:ß]W°Sòn5¹±y2QÖ.j ²°¢-d¬7hFð]S JyX÷
$TZã·G¼ÝÜiûñ¼£G½æ©MjÉDm_
lð99´x.ÞVÓ»Û¼n «HÄ`9ÒðÃúL3öU%~Jû¼±büÛ©UYÄÿù¬ã§Ù,¯vA;¢µÍ¢ù1TiWl/N{Ê7’Ëv«·c±?
ãÕY}rMRQ8ìõKi¿XÄ,ªê°»ÁÓ
N¹QùRõíI¯¤ç¬>w^ÅQØ(×z¸õK»0³ä³ÍªªGé seggY{±öR}Ôê&}¬oÞÙØ÷Q übØ×vþxîQ=ÈôCø¶9]ªEË£äÛzÅåçK
û¦æÞÉâS:l dùbeBѱ)ÖtÖçºY²¶C2ëyQaãùØ1JèMèg?¦g°Wìç¨Äl îWÎï¸Ù7ËJ ߢ5Æ8Y$kþCàg½n»|.þ)Ç_x½B
°Ò|¤µ2®H?nw¹¡Jî÷·¡®gz
*³q#*̺K¸»^Ì5’*ÝÛGöE·ïOnk’9WµV%ýöa¶¢èÎ:(Ñ . qeÄm ôͽ¯Ø³ðÿ5â@83wlÇÓçÝp6Tw÷@%87ÀÊ7ÿ÷ðÏðí¯ðíûߦ`ŬvrHÿqæùyð99»æXq5Wµ+Ô¢àÁB±8eøÝÈbÖmóäpú á¬Ýµ³¿ÿF 8öRÍ9øbS#¹)ëÙ®oçnÂHJÊ_¬Ý`ÄÓß? -£ñÖ|òÏ¢Åxbüâe#ÌH£ÍáÏ3¬ö½!ÉzÑw¯w÷@Iþümô×»ô2ܨvHDìxwû)QÍ>Q¡+ù=äÝARÛÅú{ DâÿâLí÷
¾ÌS}Xk+f?-Y¤~ÓNä¾xJ/»3k;éÂäE9 /&K»´r$*øþHÄSYcǡ쥲né/ãIá¢$F^¡Òt_:µÔ¸Ç#é,&6çÞô6Ä(þíí:ñT,
¸¯e÷pø(þ$Vp6¼ÆÅÀmè˳öPF+C?Úwo3]4ºh{ÞX4Tò-k« bbtÍÛ±5¥èð=º¨äíÖëçpM¥£Äß¿¦òѦ]Fñ=ºfðÑݸöØAì[[G)× g¶æ:ѱÈD$!·’B8*é-Ayî)Ë¡1Lj£ ¿ø·_÷¯Ñzt?ÁðÉÿLá-c-¢»Aص;ÏØ®&ÆBñ9ïøïû{ô=}D]Dh
¶hM>ÓD5-!8’«ÛM0¶RàqNçíú5n]%U)-[
?Tݶ
p-o9ÓRÑ©l!&wl.5 i/{ì¢Ù8ÏñWyäÚO×Á°UfÌã¬Ë§Ckâ`çÉ!ܪª u
*9³e3
ݦÁÓ¦Ú}ÀªÇ`wÄa?( ¹4Jwµn)TjþÄ×ê¬#õÊ-§»ÊñÕ´b:wRykYÁýîeårZ²äïÜÄfÓÖC wUÁY¤û¹Õ0ÐÊdÞ’üÊjqO§¬üdÕD)Õ´º-§aRúG~þ$×àUíÂËPò·ftqûjÙСJãqjßcNÃí¡W?+Ñè;CÆæ·T]ú»Ç¯V«ñQäò-Â(³Øô(:i¯{æÁ¥¤ÜX¤jdªÓUä0û0ÎTyèQ0Vùè6ô¼¼.õÊ{‘5z;£GaÚ»5tT¤,8¤¾5)Ç)SæÖøÈ]¦åF@c7×zÅÈ{T6òû(T¯B³x_ËãYÀ÷±ÛÍ>d6ÐÍfz¾ß8é«w¨Õ$MÙØÈ)Ù[JJEºjJ>¸¸jÛRÝCõÐq¢X+)!¤Hö5*aä»ý RâÒøbR{ÄÑzíÁ6¤f16Tû@öm?ðYA9yÞAÈVÃ
|HçÝÍÍýhzvãTRç¨=r®±
²ÕÓ]×Ébr¡r+CMÔ[Ï+´|Ð$¬i}RÇCí6¢·Ùt.lDºhÐTöë
UûóKíHÕlMë+^Ô-|SMC6D®h½¦®>Ø· ¬*ÆÑ1-+]
ù¼l;z»à«kS%7ªwËçÙÆ£ÕÔÉÎñëj®+a»Tò8Ñ¥È9õ.
C¨2¥ã@`²ü Ô÷PÙ _0]w~äÓÑôÐ(ÔĹ(ô¸@ I}§ Ìs©¾Òy2Ë:º°³ç¥ñà$ÿO>ñ®©nY»¹ÍH;à¶ìúâmÙ¯*ÝEÚÐHg©IáÁ{¤Áh$6FÉ]çfFIÿåëú···llîÖæÀÓ²ÿT6|ýË£øöñ[3oàÝö*ÿ·ûv*t¼=6CômU¸v÷ÌQoe4Áà2ÖnS¶(¿±ÌcC´ªCQ púAZ23#8,ðm£
NÒÀE¸]¸Yi 3ê5l_yÁ}3%IÈ Ú/íÒ6©{O0}fK°òÝ=
R« eO¡ùâ%¼ÅÕc8k!Ü:gN¨æt1IE0êX¿3pÚízK
cÅSëOÖøõ¥k¹ÆÏUihL¥2éRwt?$cᾪÞ4
° sצðe;@¬¬õÞäg>$ÊtÒd*bÖàdi}èùD¦Û2=é×VÁ-bcÛ*´±UÏ’D_4°c=IdAºx3ß,u¸´;ûhxÁ*Vjo;+¢àpÔø̹£ÎQúévÑB£+`Îi×íðX%?Aj2öf.SMÝ´Ã:ÕÃL}½r¤>IW£eP éêJà9%ðÛÅi«·âj@¸ÌhÁUGÎNÊV*km{÷/fW¦Vaèà8äò¡üD*¯Ú¼ÎJ§j}i6}ûäuødmfW!÷ZiÎwÛ¦Uf.}M(åÁñȲC¤DYUùÁ 7DömimµÃÕÌ»ëÓÒë_ [Ì}öI®(ê;?ofçvyÞM>(Ë
¬1ºõT˱Eæ-Ú¼Ô®*vLQúXcÖnråïÐ@«5ÓÚYs âË×¹FíáߧpUbtzÔ¸Cù´HÕì;ñTq4¤¦Å¿M_ÔÔa-c6¬ék4kxv×`{ Ñq]·å6~1ë>~Ä{hâé!.ñkÝCAvÑ sí¦Ð»¡Í©á°ò@$¡ÓòoYãç7âáä·ry@é¹ÌW&Jù`,B[µç/Tµ_ñG
ßOÑh_×Ç; tIlòKP«Þýöl¢6KÀØzY’íK¨SóX5²
Ìеpp¢è÷QgÚU/£Õ¦Ê5õºÚýüÙz#¯RË9ªÿpmæ
æßüøÈÙáÏèa59Z5ò®{]FÍÂBCE}¥-~Ø’SxbLmUW´NoAαUc+¹®É5ÝS(ß;âèú×-öY,«kk$¶TdÇZIc]ÎØv’ѺÎw²÷9ÁAìCϦøNÒá¾f Ág~Â
Í8]¹é/2÷cåI}ºS9Ϩæm
À³(ßäÿÓv
aÐnñýUGNJûçë¯AVçd|%§æLPÑNÑéOÉeªD»
T}£ ̹ßR@V³ÆÅ[H»´k}LRÙmR¥,p&g, :bá~’ l’i{È»gèHØî×dÀ)º8~ͽC’ÄÙ׬Vb6Vb¡ÅSô|£/ó©d6S%5rиø)¯ÒXÁÚZ/å]#!¹±öR[ÕxÝq½cJhº!Ú0ÕübVÚ£wÜ.à½ÓõV5v0u6ÍRü®ØÇ4ÔêÆÁõ(¢E&ÓÍk²É¹ºöZyé¯ô-%ìºÊÓ¾çÌõÔz×|ÊUͬB/X½cª¨{«toø¤,[ª·òC»4″óÒï¬Ê/-½û´£f¿Ëí4£’·ý¤pØTÊ^TºBsî6*rlÝÕSåU[~絬+wÍñäzn|Ũì(S³Y
FOp)s}cþÍdvÐæ
&X¹�JÀÚFy®Á)F¥é¸,α¨Ú×râQ$¡b$)NJß
Q}kCJg챤¸t[Q¥#²ôÁÌÆôûª’L:Ñ¢uRWóªU1dëP¢]30ü¾twÚlw½çÂ
I²¡åýj Þ¤öÛFe CÇå7[A H;Ýû|/+
!ó½#8½ïeùì°CGûX°}DKïWçKÿæßõSÍXT¡ªÐuëJ&??MiôyÚ’µÐ_ós)MssòÌçö^&Oý/ÍLÂ/$JýÕ3NMEÇv±4B×mb
Nox2~)oÀ2_Ô
ÓÌ8P>%
ÍJPDOI}êÁ]P¶³%ÖæÉXU*¡!·¶_2ÈoOáT)×*²$¶ÎÙqÅÓhYç>]´Ç;áá¾È _Uö|ôh|í9ñw¬¦IÎü°ÉÁe|
u¼ág£
Источник
Гемоглобин состоит из четырех полипептидных цепей — ПЕРЕНОСЧИКИ КИСЛОРОДА МИОГЛОБИН И ГЕМОГЛОБИН — КОНФОРМАЦИЯ И ДИНАМИКА — БИОХИМИЯ ТОМ 1- Л. Страйер
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 3. ПЕРЕНОСЧИКИ КИСЛОРОДА—МИОГЛОБИН И ГЕМОГЛОБИН
3.11. Гемоглобин состоит из четырех полипептидных цепей
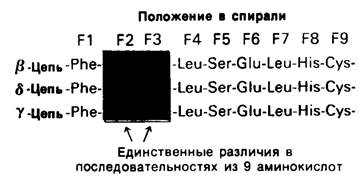
Обратимся теперь к гемоглобину-белку, родственному миоглобину. Если миоглобин состоит из одной полипептидной цепи, то гемоглобин-из четырех. Эти четыре цепи удерживаются вместе нековалентными связями. Каждая цепь содержит один гем, и, таким образом, в молекуле гемоглобина имеются четыре участка связывания кислорода. Гемоглобин А-основной гемоглобин взрослого организма-состоит из двух цепей одного типа, называемых а-цепи, и двух цепей другого типа, называемых β-цепи. В целом субъединичная структура гемоглобина А описывается формулой α2β2. У взрослых есть, кроме того, минорный гемоглобин А2, на долю которого приходится примерно 2% общего количества гемоглобина; субъединичная структура этого гемоглобина α2δ2. Эмбрионы содержат другие гемоглобины. На ранних этапах эмбрионального развития выявляется гемоглобин плода α2ε2. На смену ему приходит гемоглобин F с субъединичной структурой а2у2. Биологическое значение этих разных гемоглобинов представляет собой очень интересную проблему, которую мы обсудим в следующей главе. Общая для всех перечисленных гемоглобинов α-цепь содержит 141 аминокислотный остаток, β, δ и γ-Цепи содержат по 146 остатков с очень схожей последовательностью аминокислот (рис. 3.23).
Рис. 3.23. β-, γ- и δ-Цепи гемоглобинов человека обладают сходными аминокислотными последовательностями. Для примера показаны участки трех цепей с остатками от F1 до F9
3.12. Рентгеноструктурный анализ гемоглобина
Как упоминалось ранее, пространственную структуру гемоглобина А определили Макс Перутц и сотрудники. Этот монументальный труд был начат в 1936 г., когда для выполнения дипломной работы Перутц уехал из Австрии в Англию в Кембридж и начал работать в лаборатории Джона Бернала (J. Bemal), где двумя годами ранее были получены первые рентгеновские отпечатки кристаллов белка. Бернал и студентка- дипломница Дороти Кродфут Ходжкин (D. С. Hodgkin) получили отличные отпечатки дифракции пепсина и таким образом показали, что белкам свойственна точно определенная структура. Еще в 1934 г. они предсказали перспективность применения рентгеноструктурного анализа как метода, «позволяющего получить гораздо более подробные сведения о белковой структуре по сравнению с тем, что могли дать предшествовавшие физические и химические подходы». Прошло, однако, более 20 лет, прежде чем этот прогноз оправдался. В тот период, когда Перутц избрал объектом своей работы гемоглобин, самым высокомолекулярным соединением с расшифрованной структурой был краситель фталоцианин, состоящий из 58 атомов. Перутц же взялся за молекулу в сотни раз большую. Не удивительно, что «мои товарищи смотрели на меня с жалостливой улыбкой… По счастью, экзаменаторы, принимавшие мою дипломную работу, не настаивали на окончательном установлении структуры, иначе бы я оставался студентом-дипломником в течение 23 лет». Однако Лоуренс Брэгг (L. Bragg), который вместе со своим отцом впервые в 1912 г. применил рентгеноструктурный анализ, стал в это время во главе Кавендишской лаборатории и поддержал работу Перутца. Он писал: «Я не обманывал себя в отношении перспективы. Дело выглядело так, как если бы нулевую вероятность успеха помножили на бесконечную важность искомого результата; результат этой математической операции был никому не известен». Успех пришел в 1959 г., когда Перутц получил карту электронной плотности низкого разрешения для оксигемоглобина лошади. Впоследствии были получены карты высокого разрешения как для окси-, так и дезоксигемоглобина лошади и человека. Гемоглобины этих двух видов очень близки по своей структуре.
3.13. Четвертичная структура гемоглобина
Молекула гемоглобина имеет почти правильную форму шара диаметром 55 А. Четыре цепи, образующие молекулу гемоглобина, расположены в виде тетраэдра (рис. 3.24). Четыре гема, по одному у каждой субъединицы, находятся в углублениях на внешней стороне молекулы. Эти четыре кислородсвязывающих участка расположены далеко друг от друга: расстояние между двумя ближайшими атомами железа составляет 25 А. Каждая α-цепь контактирует с обеими β-цепями. В то же время взаимодействия между двумя а- или между двумя β-цепями незначительны.
Рис. 3.24. Модель гемоглобина при низком разрешении. α-Цепь показана желтым, β-цепь-синим, гем-красным

3.14. α- и β-Цепи гемоглобина очень сходны с миоглобнном
Пространственные структуры миоглобина и α- и β-цепей гемоглобина обладают поразительным сходством (рис. 3.25). Близкое подобие в конфигурации основных цепей этих белков оказалось неожиданным, поскольку в последовательности аминокислотных остатков в этих трех полипептидных цепях существует много различий. Собственно, только 24 положения из 141 идентичны во всех трех полипептидных цепях; это показывает, что очень сходные пространственные структуры могут быть обусловлены совершенно разной последовательностью аминокислот (рис. 3.26).
Рис. 3.25. Сравнение конформаций главной цепи миоглобина и (3-цепи гемоглобина. Сходство конформаций совершенно очевидно

Рис. 3.26. Сравнение аминокислотных последовательностей миоглобина кашалота и α- и β-цепей гемоглобина человека на примере участка от остатка F1 от остатка F9. Последовательности аминокислот имеют гораздо меньше сходства, чем пространственные структуры этих трех полипептидных цепей

Совершенно очевидно, что пространственная конфигурация миоглобина кашалота и α- и β-цепей гемоглобина человека имеет общебиологическое значение. В сущности, эта структура свойственна всем миоглобинам и гемоглобинам позвоночных. Сложная конфигурация полипептидной цепи, впервые выявленная на примере миоглобина, это та основная форма, которую природа предназначила для переносчика кислорода: смысл ее в том, что вокруг гема создается такое микроокружение, которое обеспечивает обратимость связывания кислорода.
Источник