Мономеры связаны пептидной связью гемоглобин
Содержание статьи
емоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
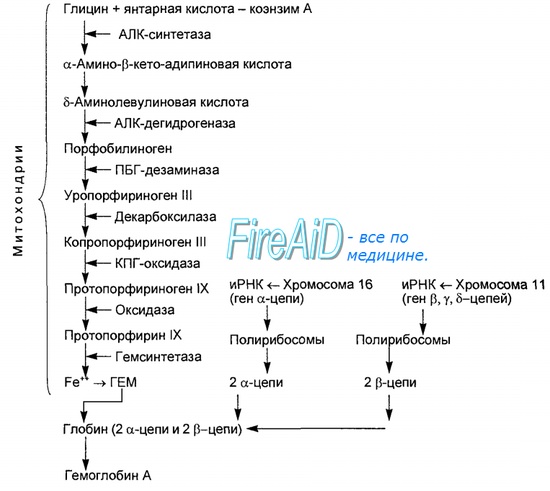
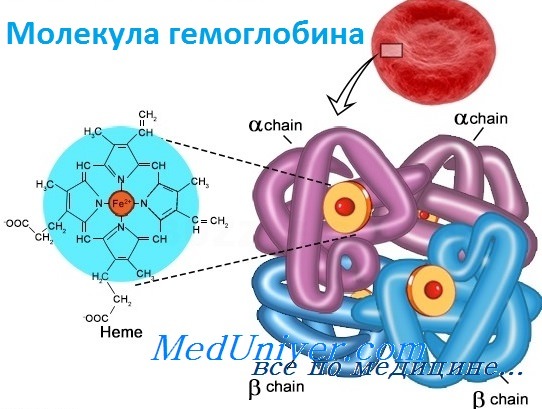
| Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: 1. Функции клеток крови. Функции эритроцитов. Свойства эритроцитов. Цикл Эмбдена-Мейергофа. Строение эритроцитов. 2. Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина. 3. Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты. 4. Железо. Железо в норме. Роль ионов железа в эритропоэзе. Трансферрин. Потребность организма в железе. Дефицит железа. ОЖСС. 5. Эритропоэз. Эритробластические островки. Анемия. Эритроцитоз. 6. Регуляция эритропоэза. Эритропоэтин. Половые гормоны и эритропоэз. 7. Лейкоциты. Лейкоцитоз. Лейкопения. Гранулоциты. Лейкоцитарная формула. 8. Функции нейтрофильных гранулоцитов ( лейкоцитов ). Дефенсины. Кателицидины. Белки острой фазы. Хемотаксические факторы. 9. Бактерицидный эффект нейтрофилов. Гранулопоэз. Нейтрофильный гранулопоэз. Гранулоцитоз. Нейтропения. 10. Функции базофилов. Функции базофильных гранулоцитов. Нормальное количество. Гистамин. Гепарин. Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140-175) г гемоглобина, у женщин — 138 (123-153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20-30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50-80 % гемоглобина у него представлены гемоглобином F и 15-40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5-33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. — Также рекомендуем «Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.» |
Источник
труктура и функция гемоглобина
Структура и функция гемоглобинаБолезни гемоглобинов человека, названные гемоглобинопатиями, занимают уникальную позицию в медицинской генетике. Это наиболее частые моногенные болезни у людей, к тому же вызывающие высокую смертность. По оценке Всемирной организации здравоохранения более 5% человеческой популяции — носители мутаций клинически значимых нарушений гемоглобина. Кроме того, поскольку гемоглобин был одной из первых исследованных белковых структур, а гены глобина у человека стали первыми клонированными генами, связанными с болезнями, их молекулярная и биохимическая патология изучена лучше, чем в любой другой группе генетических болезней. Глобины также проливают свет на процесс как молекулярной, так и популяционной эволюции и служат моделью действия генов в развитии. Прежде чем подробно обсуждать гемоглобинопатии, опишем вкратце нормальное состояние гена глобина и биологию гемоглобина. Гемоглобин — переносчик кислорода в эритроцитах позвоночных. Его молекула содержит четыре субъединицы: две а-цепи и две b-цепи. Каждая субъединица формируется цепью полипептида глобина и простетической группой, гемом, железосодержащим пигментом, соединяющимся с кислородом, придавая молекуле способность транспортировать кислород.
Каждая молекула гемоглобина состоит из двух пар полипептидных цепей разного типа. Цепи глобина в нормальном гемоглобине взрослых, гемоглобине А (НЬА), названы а и b соответственно. Четыре цепи складываются и объединяются, формируя шарообразный тетрамер с молекулярным весом приблизительно 64 500, структуру, обозначаемую для НbА — а2b2. Оба типа цепей почти равны по длине; а-цепь имеет 141 аминокислоту, b-цепь — 146. Цепи имеют заметное сходство друг с другом в аминокислотной последовательности (первичной структуре) и в трехмерной конфигурации (третичной структуре). Основные характеристики структуры глобина весьма консервативно сохранялись в ходе эволюции, что стало основой для понимания гемоглобинопатии. Более того, третичная структура полипептида глобина также оказалась в высшей степени консервативной: фактически все изученные глобины имеют семь или восемь извитых участков (в зависимости от цепи). В то же время только две аминокислоты сохраняются во всех глобинах в природе, и неудивительно, что мутации в любом из этих остатков связаны с болезнью. Исследование структуры гемоглобина позволило предсказать, какие типы мутаций, вероятно, окажутся патогенными. Таким образом, мутации, изменяющие строение глобина, замена высококонсервативной аминокислоты или одного из неполярных остатков, формирующих гидрофобную оболочку, исключающую попадание воды внутрь молекулы, вероятно, вызовут гемоглобинопатию. Как и все белки, глобин имеет «чувствительные области», мутации в которых не могут не влиять на функцию, и «нечувствительные области», мутации в которых переносятся более свободно. Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021 — Также рекомендуем «Гены гемоглобина человека» Оглавление темы «Выявление генов болезни»:
|
Источник

Белки (протеины) составляют 50% от сухой массы живых организмов.
Белки состоят из аминокислот. У каждой аминокислоты есть аминогруппа и кислотная (карбоксильная) группа, при взаимодействии которых получается пептидная связь, поэтому белки еще называют полипептидами.
Структуры белка
Первичная — цепочка из аминокислот, связанных пептидной связью (сильной, ковалентной). Чередуя 20 аминокислот в разном порядке, можно получать миллионы разных белков. Если поменять в цепочке хотя бы одну аминокислоту, строение и функции белка изменятся, поэтому первичная структура считается самой главной в белке.
Вторичная — спираль. Удерживается водородными связями (слабыми).
Третичная — глобула (шарик). Четыре типа связей: дисульфидная (серный мостик) сильная, остальные три (ионные, гидрофобные, водородные) — слабые. Форма глобулы у каждого белка своя, от нее зависят функции. При денатурации форма глобулы меняется, и это сказывается на работе белка.
Четвертичная — имеется не у всех белков. Состоит из нескольких глобул, соединенных между собой теми же связями, что и в третичной структуре. (Например, гемоглобин.)
Денатурация
Это изменение формы глобулы белка, вызванное внешними воздействиями (температура, кислотность, соленость, присоединение других веществ и т.п.)
- Если воздействия на белок слабые (изменение температуры на 1°), то происходит обратимая денатурация.
- Если воздействие сильное (100°), то денатурация необратимая. При этом разрушаются все структуры белка.
Функции белков
Их очень много, например:
- Ферментативная (каталитическая) — белки-ферменты ускоряют химические реакции за счет того, что активный центр фермента подходит к веществу по форме, как ключ к замку (комплементарность, специфичность).
- Строительная (структурная) — клетка, если не считать воду, состоит в основном из белков.
- Защитная — антитела борются с возбудителями болезней (иммунитет).
Еще можно почитать
ПОДРОБНЫЕ КОНСПЕКТЫ: Строение белков, Свойства белков + работа адренорецептора, Ферментативная (каталитическая) функция белков, Функции белков с примерами
ЗАДАНИЯ ЧАСТИ 2 ЕГЭ ПО ЭТОЙ ТЕМЕ
Задания части 1
Выберите один, наиболее правильный вариант. Вторичная структура молекулы белка имеет форму
1) спирали
2) двойной спирали
3) клубка
4) нити
Выберите один, наиболее правильный вариант. Водородные связи между СО- и NН-группами в молекуле белка придают ей форму спирали, характерную для структуры
1) первичной
2) вторичной
3) третичной
4) четвертичной
Выберите один, наиболее правильный вариант. Процесс денатурации белковой молекулы обратим, если не разрушены связи
1) водородные
2) пептидные
3) гидрофобные
4) дисульфидные
Выберите один, наиболее правильный вариант. Четвертичная структура молекулы белка образуется в результате взаимодействия
1) участков одной белковой молекулы по типу связей S-S
2) нескольких полипептидных нитей, образующих клубок
3) участков одной белковой молекулы за счет водородных связей
4) белковой глобулы с мембраной клетки
Выберите один, наиболее правильный вариант. Последовательность и число аминокислот в полипептидной цепи — это
1) первичная структура ДНК
2) первичная структура белка
3) вторичная структура ДНК
4) вторичная структура белка
Выберите один, наиболее правильный вариант. Вторичная структура белка, имеющая форму спирали, удерживается связями
1) пептидными
2) ионными
3) водородными
4) ковалентными
Выберите один, наиболее правильный вариант. Первичная структура белка образована связью
1) водородной
2) макроэргической
3) пептидной
4) ионной
Выберите один, наиболее правильный вариант. В основе образования пептидных связей между аминокислотами в молекуле белка лежит
1) принцип комплементарности
2) нерастворимость аминокислот в воде
3) растворимость аминокислот в воде
4) наличие в них карбоксильной и аминной групп
БЕЛКИ
1. Выберите три варианта. Белки в организме человека и животных
1) служат основным строительным материалом
2) расщепляются в кишечнике до глицерина и жирных кислот
3) образуются из аминокислот
4) в печени превращаются в гликоген
5) откладываются в запас
6) в качестве ферментов ускоряют химические реакции
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Выберите только особенности строения белковой молекулы.
1) содержит атомы фосфора
2) состоит из аминокислот
3) мономеры удерживаются пептидными связями
4) состоит из одинаковых по строению мономеров
5) изменяет форму под действием температуры
6) четвертичная структура состоит из нескольких молекул
БЕЛКИ КРОМЕ
1. Все перечисленные признаки, кроме двух, можно использовать при описании яичного белка альбумина. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) состоит из аминокислот
2) пищеварительный фермент
3) денатурирует обратимо при варке яйца вкрутую
4) мономеры связаны пептидными связями
5) молекула образует первичную, вторичную и третичную структуры
2. Все перечисленные ниже признаки, кроме двух, можно использовать для описания молекулы белка. Определите два признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) состоит из нуклеотидов
2) может иметь форму глобулы
3) имеет третичную и четвертичную структуры
4) образуется в ядре
5) бывают глобулярные и фибриллярные

БЕЛКИ КРОМЕ РИС
1. Перечисленные ниже признаки, кроме двух, используются для описания строения, функций изображенного органического вещества. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) имеет структурные уровни организации молекулы
2) входит в состав клеточных стенок
3) является биополимером
4) служит матрицей при трансляции
5) состоит из аминокислот

2. Все перечисленные ниже признаки, кроме двух, используются для описания изображённой на рисунке структуры. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) вторичная структура молекулы белка
2) удерживается только пептидными связями
3) определяется методом рентгеноструктурного анализа
4) представляет собой глобулу
5) может выполнять ферментативные функции
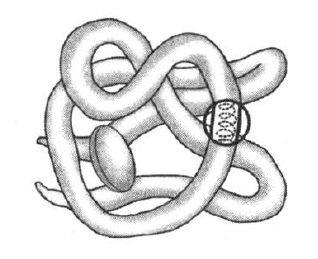
3. Все перечисленные ниже характеристики, кроме двух, используют для описания изображенной на рисунке молекулы органического вещества клетки. Определите две характеристики, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) денатурация
2) репликация
3) транскрипция
4) аминокислоты
5) водородные связи
СТРУКТУРЫ БЕЛКА
Установите соответствие между характеристикой и структурой белка: 1) первичная, 2) третичная. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) молекула в форме глобулы или фибриллы
Б) строгая последовательность аминокислотных остатков
В) аминокислотные остатки соединены только пептидными связями
Г) имеет дисульфидные мостики между радикалами аминокислот
Д) при ее разрушении наступает необратимая денатурация
Е) пространственная конфигурация полипептидной цепи
РЕГУЛЯТОРНАЯ — СТРУКТУРНАЯ
Установите соответствие между характеристикой и функцией белка, которую он выполняет: 1) регуляторная, 2) структурная
А) входит в состав центриолей
Б) образует рибосомы
В) представляет собой гормон
Г) формирует мембраны клеток
Д) изменяет активность генов
ФЕРМЕНТАТИВНАЯ
1. Все приведенные ниже признаки, кроме двух, можно использовать для описания ферментов. Определите два признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) входят в состав клеточных мембран и органоидов клетки
2) играют роль биологических катализаторов
3) имеют активный центр
4) оказывают влияние на обмен веществ, регулируя различные процессы
5) специфические белки
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Ферменты — это вещества, которые
1) вырабатываются в железах внутренней секреции
2) являются белками
3) поступают в организм, как правило, вместе с пищей
4) являются в организме источником энергии
5) ускоряют протекание химических реакций
6) у человека выполняют свои функции при температуре около 36 градусов
ФУНКЦИИ БЕЛКОВ
Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Функциями белков в организме человека являются
1) строительная
2) передача наследственных признаков
3) защитная
4) запасающая
5) ферментативно-каталитическая
6) хранение генетической информации
ФУНКЦИИ БЕЛКОВ КРОМЕ
Все перечисленные характеристики используют для описания функций белков. Определите две характеристики, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) регуляторная
2) двигательная
3) рецепторная
4) образуют клеточные стенки
5) служат коферментами

Рассмотрите рисунок с изображением полипептида и укажите (А) уровень его организации, (Б) форму молекулы и (В) вид взаимодействия, поддерживающий эту структуру. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) вторичная структура
3) третичная структура
4) взаимодействия между нуклеотидами
5) металлическая связь
6) гидрофобные взаимодействия
7) фибриллярная
8) глобулярная
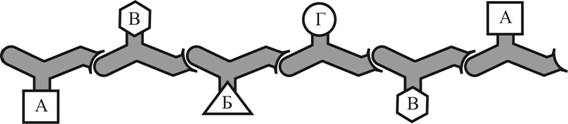
Рассмотрите рисунок с изображением полипептида. Укажите (А) уровень его организации, (Б) мономеры, которые его образуют, и (В) вид химических связей между ними. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) водородные связи
3) двойная спираль
4) вторичная структура
5) аминокислота
6) альфа-спираль
7) нуклеотид
8) пептидные связи

Проанализируйте таблицу «Уровни организации белка». Для каждой ячейки, обозначенной буквой, выберите соответствующий термин из предложенного списка.
1) глобула
2) двойная спираль
3) эфирные
4) гидрофильные
5) пептидные
6) нитчатая
7) вторичная
8) четвертичная
Известно, что белки — нерегулярные полимеры, имеющие высокую молекулярную массу, строго специфичны для каждого вида организма. Выберите из приведенного ниже текста три утверждения, по смыслу относящиеся к описанию этих признаков, и запишите цифры, под которыми они указаны. (1) В состав белков входит 20 различных аминокислот, соединенных пептидными связями. (2) Белки имеют различное количество аминокислот и порядок их чередования в молекуле. (3) Низкомолекулярные органические вещества имеют молекулярную массу от 100 до 1000. (4) Они являются промежуточными соединениями или структурными звеньями — мономерами. (5) Многие белки характеризуются молекулярной массой от нескольких тысяч до миллиона и выше, в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. (6) Каждый вид живых организмов имеет особый, только ему присущий набор белков, отличающий его от других организмов.
© Д.В.Поздняков, 2009-2020
Источник