Назовите комплексообразователь в гемоглобине
Содержание статьи
Комплексные соединения Гемоглобин Hb 4 O

Комплексные соединения
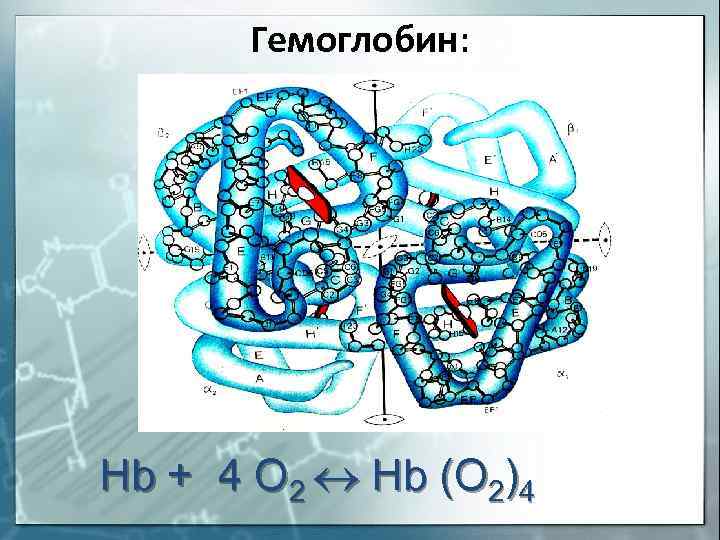
Гемоглобин: Hb + 4 O 2 Hb (O 2)4
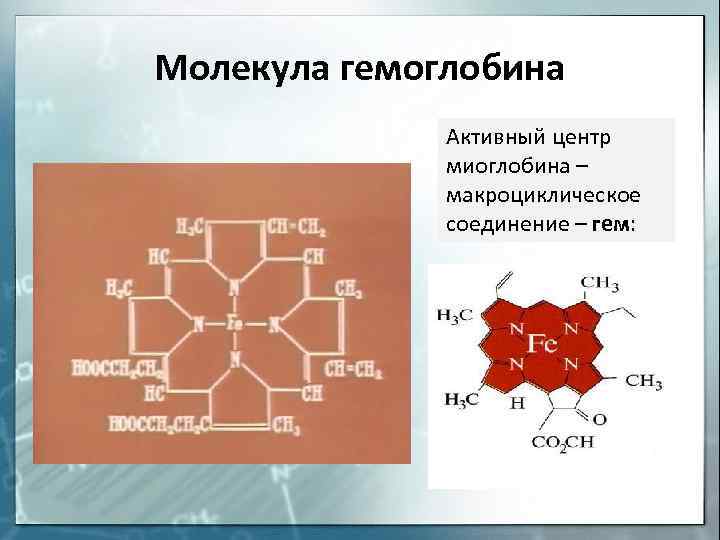
Молекула гемоглобина Активный центр миоглобина – макроциклическое соединение – гем:
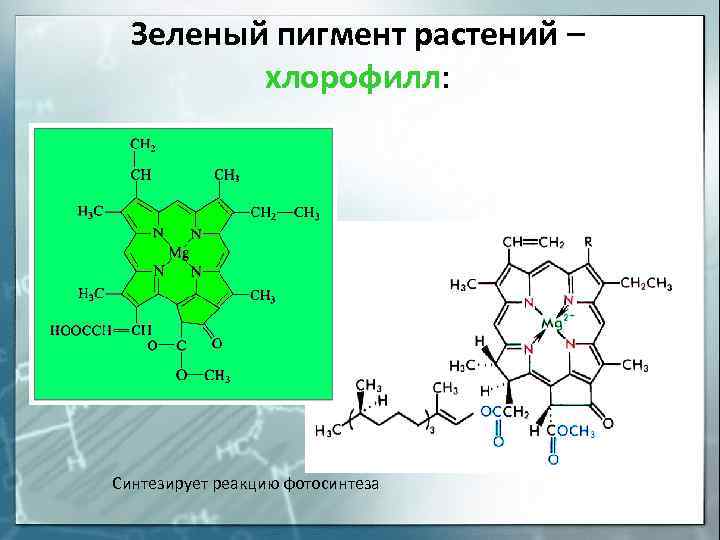
Зеленый пигмент растений – хлорофилл: Синтезирует реакцию фотосинтеза
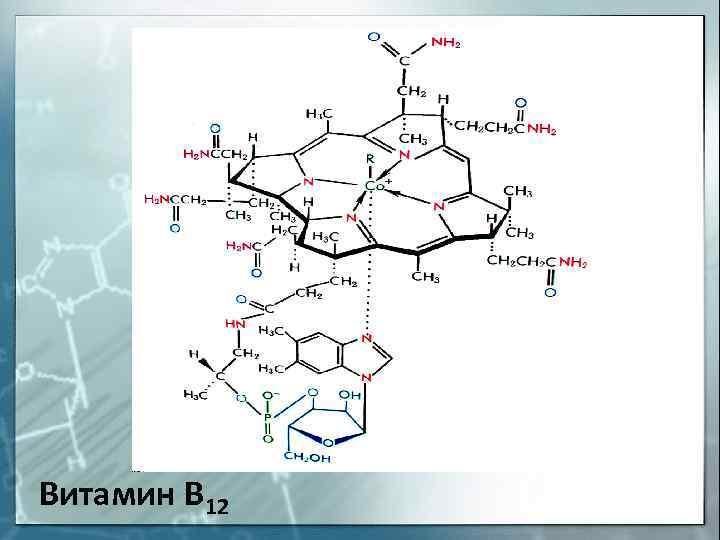
Витамин В 12
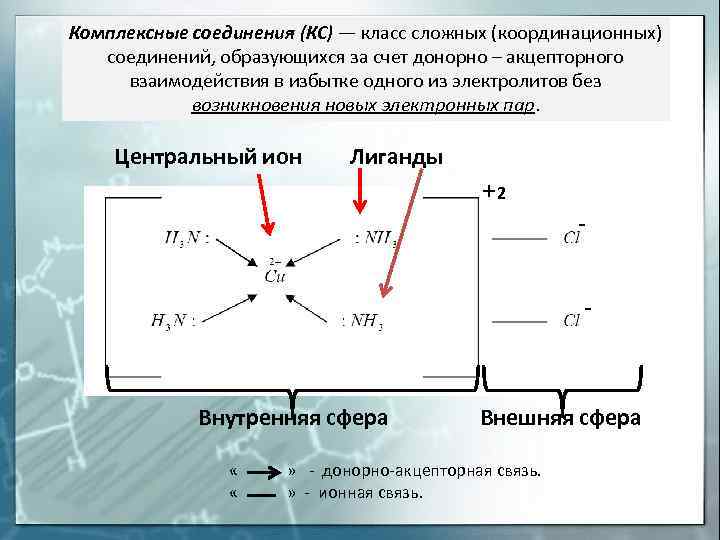
Комплексные соединения (КС) — класс сложных (координационных) соединений, образующихся за счет донорно – акцепторного взаимодействия в избытке одного из электролитов без возникновения новых электронных пар. Центральный ион Лиганды 2 Внутренняя сфера Внешняя сфера « » — донорно-акцепторная связь. « » — ионная связь.
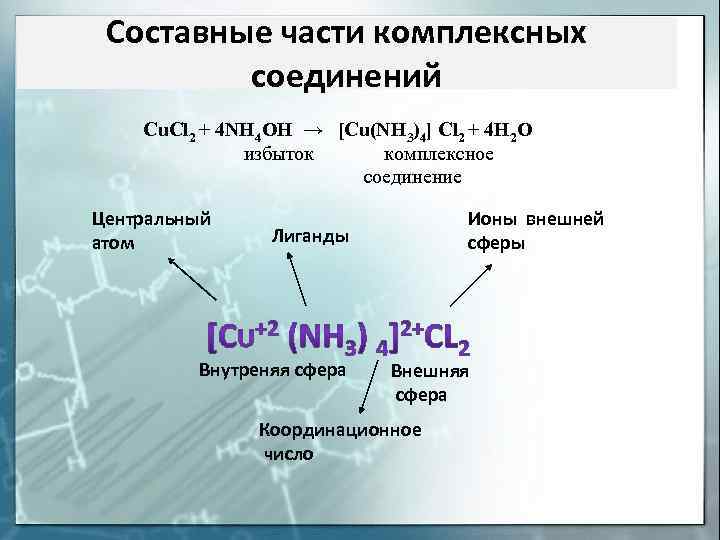
Составные части комплексных соединений Cu. Cl 2 + 4 NH 4 OH → [Cu(NH 3)4] Cl 2 + 4 H 2 O избыток комплексное соединение Центральный атом Ионы внешней сферы Лиганды Внутреняя сфера Внешняя сфера Координационное число

Характеристики комплексов Заряд комплексного иона равен алгебраической сумме зарядов (или степеней окисления) комплексообразователя и лигандов. Z = Zко +∑Zлиг Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с донорными атомами лигандов, т. е. координационное число (КЧ). Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости (Kн).

Ковалентная (диссоциация по типу слабого электролита) Ионная связь (диссоциация по типу сильного электролита) [Cu(NH 3)4] Cl 2 → [Cu(NH 3)4]2+ + 2 Cl–

Внешняя сфера комплексного соединения – ионы и (или) молекулы, не находящиеся в непосредственной химической связи с комплексообразователем, но нейтрализующие заряд комплексного иона (внутренней сферы) Внутренняя (координационная) сфера комплексного соединения – совокупность комплексообразователя и непосредственно с ним связанных лигандов Лиганды — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно–акцепторной связью. Центральный атом (комплексообразователь) – выполняет роль акцептора электронных пар и поэтому комплексообразователем могут быть любые частицы, имеющие вакантные орбитали.

комплексообразователи Типичными комплексообразователями являются катионы d- и f- элементов, имеющие вакантные орбитали, например Ag+, Au+, Cu 2+, Zn 2+, Cd 2+, Hg 2+, Fe 3+, Co 2+, Ni 2+, Pt 4+, La 3+, Eu 2+, Th 4+, U 4+ и нейтральные атомы металлов того же типа, например Co, Ni, Fe.
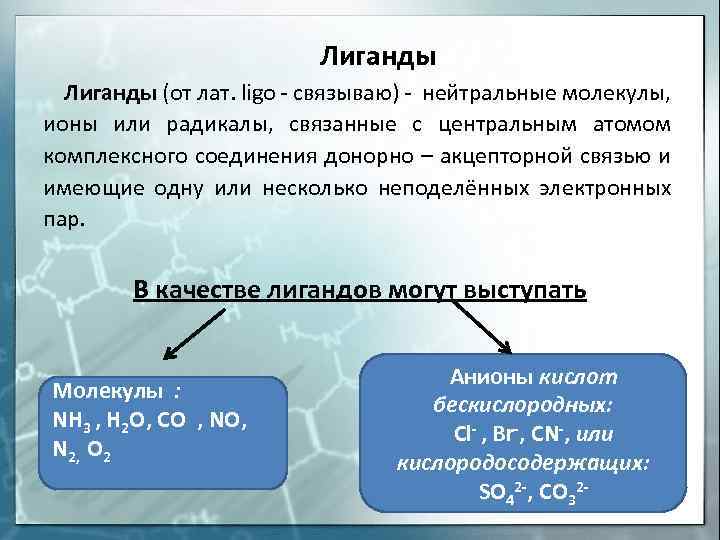
Лиганды (от лат. ligo — связываю) — нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно – акцепторной связью и имеющие одну или несколько неподелённых электронных пар. В качестве лигандов могут выступать Молекулы : NH 3 , H 2 O, CO , NO, N 2, O 2 Анионы кислот бескислородных: Cl- , Br-, CN-, или кислородосодержащих: SO 42 -, CO 32 —
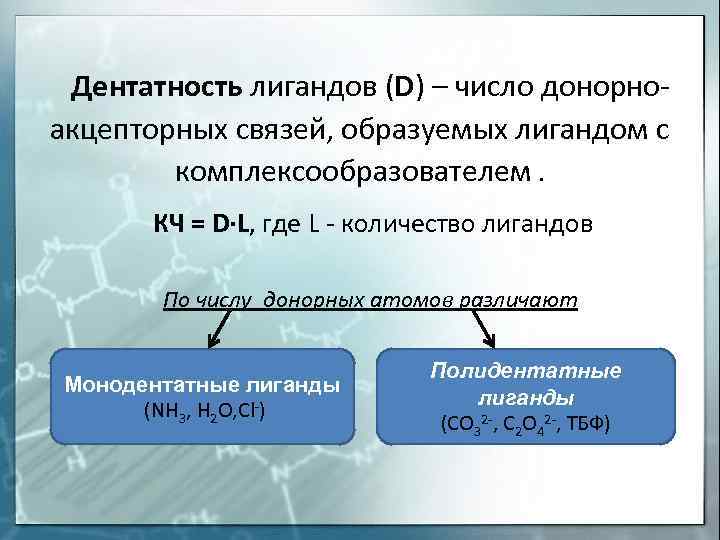
Дентатность лигандов (D) – число донорноакцепторных связей, образуемых лигандом с комплексообразователем. КЧ = D∙L, где L — количество лигандов По числу донорных атомов различают Монодентатные лиганды (NH 3, H 2 O, Cl-) Полидентатные лиганды (CO 32 -, C 2 O 42 -, ТБФ)
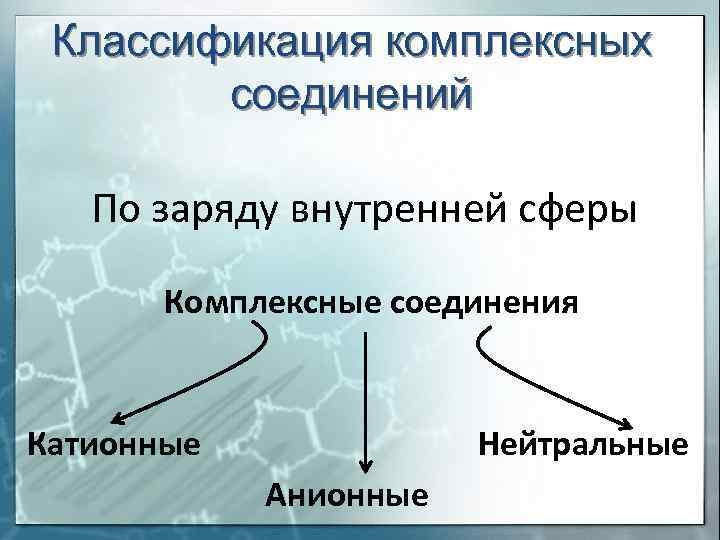
Классификация комплексных соединений По заряду внутренней сферы Комплексные соединения Катионные Нейтральные Анионные
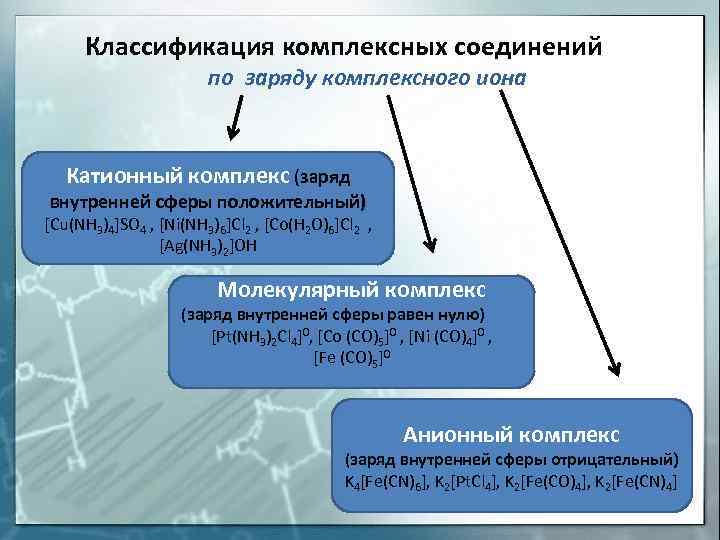
Классификация комплексных соединений по заряду комплексного иона Катионный комплекс (заряд внутренней сферы положительный) [Cu(NH 3)4]SO 4 , [Ni(NH 3)6]Cl 2 , [Co(H 2 O)6]Cl 2 , [Ag(NH 3)2]OH Молекулярный комплекс (заряд внутренней сферы равен нулю) [Pt(NH 3)2 Cl 4]0, [Co (CO)5]0 , [Ni (CO)4]0 , [Fe (CO)5]0 Анионный комплекс (заряд внутренней сферы отрицательный) K 4[Fe(CN)6], K 2[Pt. Cl 4], K 2[Fe(CO)4], K 2[Fe(CN)4]
![2+ 3 - [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4 2+ 3 - [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4](https://present5.com/presentation/-42515008_134710477/image-16.jpg)
2+ 3 — [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4 Cl 2] Cl [Pt(NH 3)2 Cl 2] 0 3 — [Fe(CO)5] K 3 [Fe(CN) 6]
![[Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2 [Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2](https://present5.com/presentation/-42515008_134710477/image-17.jpg)
[Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2 Cl 2] Дихлородиамминплатина [Cr(H 2 O)2(NH 3)3 Cl]Br 2 Бромид хлородиакватриамминхрома (III)

Двойные соли • Двойные соли являются сильными электролитами и в растворах диссоциируют полностью, т. к. связи между катионами металла и анионами кислотного остатка носят ионный характер: • KAl(SO 4)2 → K+ + Al 3+ + 2 SO 42 —

Образование комплексных соединений Реакции комплексообразования: 1. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 2. Ni. Cl 2 + 4 NH 4 OH → [(Ni(NH 3 )4]Cl 2 + 4 H 2 O 3. UO² 2 – катион, который способен образовывать комплексы анионного типа (КЧ=8) Na 2 U 2 O 7↓ + 6 Na 2 CO 3 + 3 H 2 O → 2 Na 4[UO 2(CO 3)3] 2 UO 2 SO 4 + K 4[Fe(CN)6] → (UO 2)2[Fe(CN)6] ↓ + 2 K 2 SO 4 Cu. SO 4 + K 4[Fe(CN)6] → Cu 2[Fe(CN)6]↓ + 2 H 2 SO 4
![Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30 Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30](https://present5.com/presentation/-42515008_134710477/image-20.jpg)
Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30 2 ст. [Cu(NH 3)3]2+ = [Cu(NH 3)2]2+ + NH 30 3 ст. [Cu(NH 3)2]2+ = [Cu(NH 3)]2+ + NH 30 4 ст. [Cu(NH 3)]2+ = Cu 2+ + NH 30 Общий процесс диссоциации комплекса: ∑ [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30
![Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ = Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ =](https://present5.com/presentation/-42515008_134710477/image-21.jpg)
Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30

Свойства константы нестойкости 1. Константы нестойкости характеризуют относительную устойчивость внутренней координационной сферы комплексов 2. Чем меньше КН , тем прочнее комплекс. 3. По КН, можно рассчитать концентрацию свободных ионов комплексообразователя в растворе комплексного соединения. 4. Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть трудно растворимое соединение или более устойчивый комплекс.
![сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7 сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7](https://present5.com/presentation/-42515008_134710477/image-23.jpg)
сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7 ∙ 10 -8 K[Ag(CN)2] , Kн = 1, 0 ∙ 10 -21 Допустим, что исходная концентрация этих комплексов равна 1 моль/л. Тогда: C(NH 3) = 2 x, C(CN-) = 2 x, C[Ag(NH 3)2]+ = 1 -x, C[Ag(CN)2]- = 1 -x. Так как x

По константе нестойкости и заданной начальной концентрации комплекса можно рассчитать концентрацию комплексообразователя и лигандов. Для корректности расчетов возьмем раствор с избытком лигандов. K 4[Fe(CN)6] → 4 K ++ [Fe(CN)6]4 — ; C = 0, 1 M; Kн = 1, 0 ∙ 10 -37 ; избыток KCN →K+ + CN 0, 1 M 0, 1 M 1 M 1 M Fe [(CN)6]4 — Fe 2+ + 6 CN 0, 1 — x x 6 x+1 исходя из значений константы нестойкости x

Пространственное строение комплексов Геометрическая форма комплексов – это координационный многогранник, образованный в результате определенного расположения лигандов относительно комплексообразователя. Тип гибридизации определяется числом гибридных орбиталей, их формой, направлением в пространстве, взаимным влиянием друг на друга и определенную форму комплекса. Между координационным числом, типом гибридизации и формой есть взаимосвязь:

Пространственное строение комплексов Связь между координационным числом, типом гибридизации и формой:
![Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4 Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4](https://present5.com/presentation/-42515008_134710477/image-27.jpg)
Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4 d 10 5 s 1 — электронная конфигурация атома серебра Ag+ [ ]4 d 10 5 s 0 — электронная конфигурация иона серебра Вакантные 5 s- и 5 p- орбитали иона серебра являются акцепторами электронных пар атомов азота молекул аммиака (доноров) .
![Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) - электронная конфигурация атома бора Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) - электронная конфигурация атома бора](https://present5.com/presentation/-42515008_134710477/image-28.jpg)
Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) — электронная конфигурация атома бора — электронная конфигурация катиона бора
![Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ - плоскоквадратная) Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ - плоскоквадратная)](https://present5.com/presentation/-42515008_134710477/image-29.jpg)
Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ — плоскоквадратная)
![Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– - октаэдрическое) Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– - октаэдрическое)](https://present5.com/presentation/-42515008_134710477/image-30.jpg)
Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– — октаэдрическое)
![Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– - октаэдрическое) Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– - октаэдрическое)](https://present5.com/presentation/-42515008_134710477/image-31.jpg)
Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– — октаэдрическое)
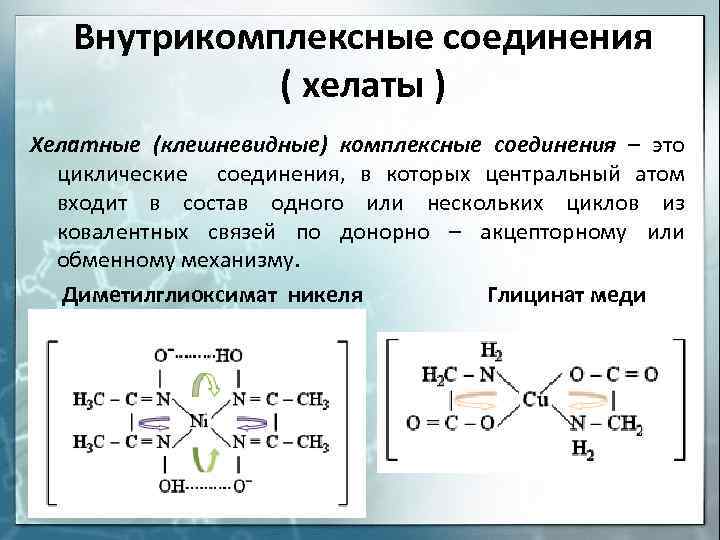
Внутрикомплексные соединения ( хелаты ) Хелатные (клешневидные) комплексные соединения – это циклические соединения, в которых центральный атом входит в состав одного или нескольких циклов из ковалентных связей по донорно – акцепторному или обменному механизму. Диметилглиоксимат никеля Глицинат меди
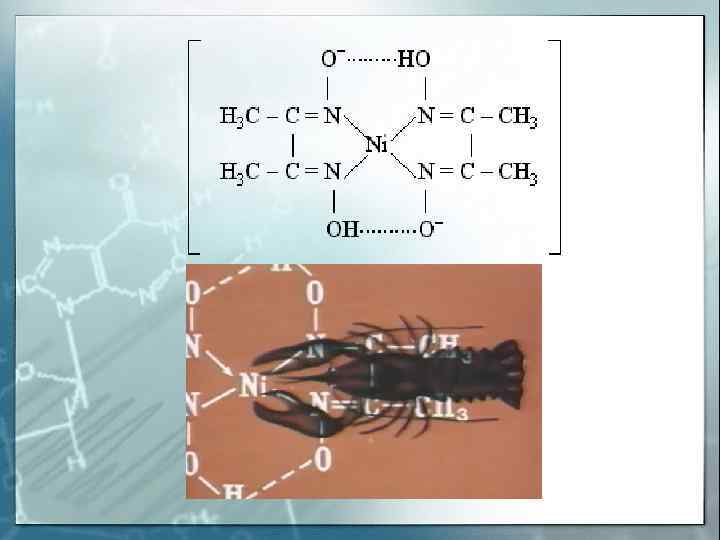
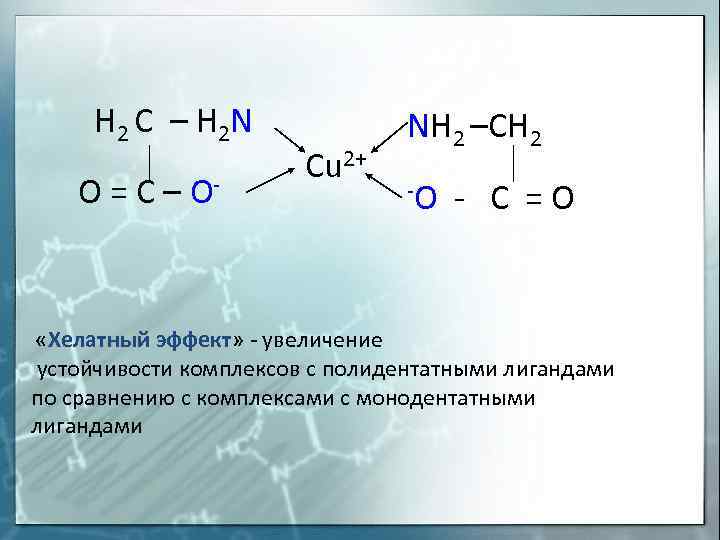
H 2 C – H 2 N O = C – O- «Хелатный Cu 2+ NH 2 –CH 2 -O — C = O эффект» — увеличение устойчивости комплексов с полидентатными лигандами по сравнению с комплексами с монодентатными лигандами
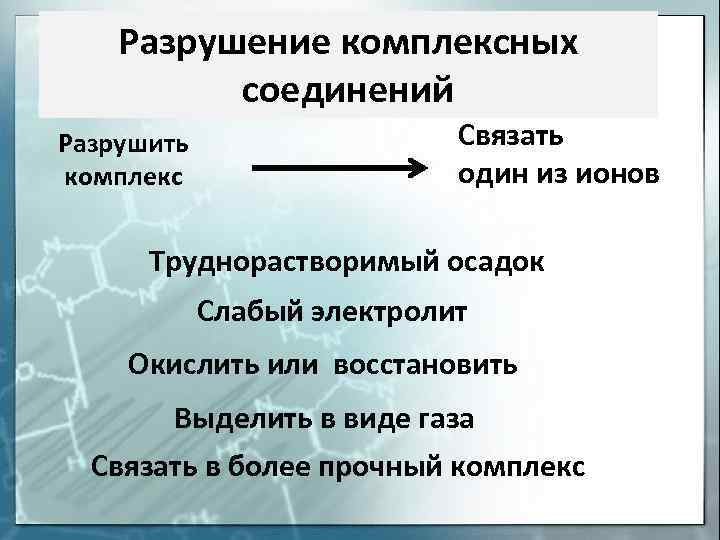
Разрушение комплексных соединений Разрушить комплекс Связать один из ионов Труднорастворимый осадок Слабый электролит Окислить или восстановить Выделить в виде газа Связать в более прочный комплекс
![[Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка + [Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка +](https://present5.com/presentation/-42515008_134710477/image-37.jpg)
[Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка + HNO 3 + KCN NH 4 NO 3 Образование более прочного комплекса Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть: трудно растворимое соединение или более устойчивый комплекс.
![[Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9, [Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9,](https://present5.com/presentation/-42515008_134710477/image-38.jpg)
[Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9, 3 ·10 -8 ПРAg. I = 1, 5·10 -16 [Ag (NH 3)2]++2 CN- = [Ag(CN)2]- +2 NH 3 Кн = 8·10 -22

Химические свойства комплексных соединений. Реакции комплексообразования: Ni. Cl 2 + 4 NH 4 OH → [Ni(NH 3 )4]Cl 2 + 4 H 2 O Реакции обмена с сохранением внутренней сферы комплекса: 4 Fe. Сl 3 + 3 K 4[Fe(CN)6] → Fe 4[Fe(CN)6]3↓ + 12 K Cl
![Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H](https://present5.com/presentation/-42515008_134710477/image-40.jpg)
Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H 2 O → Cu. S↓ + Na 2 SO 4 + 4 NH 3 Реакция замещения лигандов во внутренней сфере: K 3[Fe. F 6] + 6 KSCNизб → K 3[Fe(SCN)6] +6 KF

Окислительно – восстановительные реакции с участием комплексных соединений сопровождаются изменением степени окисления комплексообразователя :
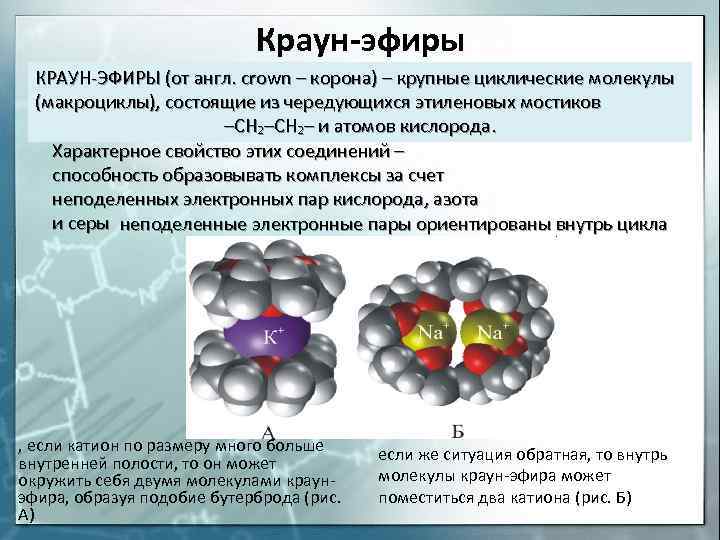
Краун-эфиры КРАУН-ЭФИРЫ (от англ. crown – корона) – крупные циклические молекулы (макроциклы), состоящие из чередующихся этиленовых мостиков –СН 2– и атомов кислорода. Характерное свойство этих соединений – способность образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы неподеленные электронные пары ориентированы внутрь цикла , если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краунэфира, образуя подобие бутерброда (рис. А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. Б)
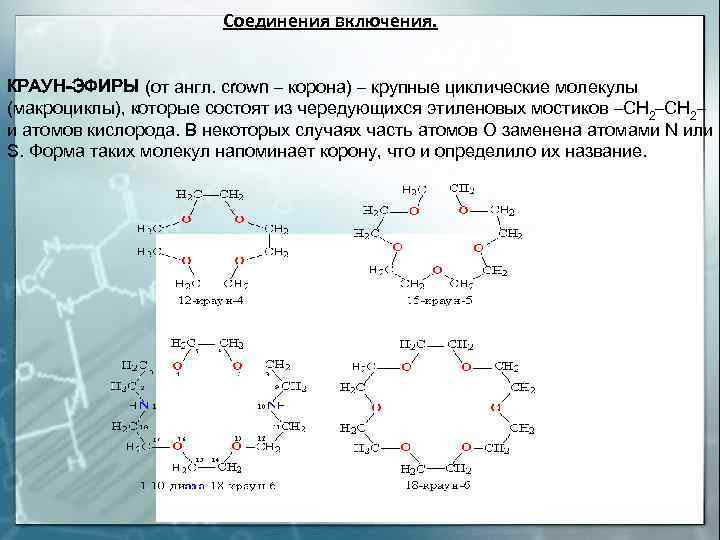
Соединения включения. КРАУН-ЭФИРЫ (от англ. crown – корона) – крупные циклические молекулы (макроциклы), которые состоят из чередующихся этиленовых мостиков –СН 2– и атомов кислорода. В некоторых случаях часть атомов О заменена атомами N или S. Форма таких молекул напоминает корону, что и определило их название.

Реакции комплексообразования. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 оранж. Hg. I 2 ↓ + 2 KI (р-р. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый Суммарная реакция: Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый
Источник
назовите комплексообразователь в гемоглобине
Комплексные соединения — это
1)сложные устойчивые химические образования;
2)вещества, состоящие из комплексообразователя и лигандов;
3)соединения, состоящие из внутренней и внешней сферы;
4)сложные устойчивые химические соединения, в которых обязательно присутствует связь, образованная по донорно-акцепторному механизму.
Комплексообразователи — это
1)только атомы, доноры электронных пар;
2)только ионы, акцепторы электронных пар;
3)только d-элементы, доноры электронных пар;
4)атомы или ионы, акцепторы электронных пар.
Назовите комплексообразователь в гемоглобине
1)Сu 0 ; 2)Fe 3+ ; 3)Fe 2+ 4)Fe 0 .
Лиганды — это
1)молекулы, доноры электронных пар;
2)ионы, акцепторы электронных пар;
3)молекулы и ионы — акцепторы электронных пар;
4)молекулы и ионы — доноры электронных пар.
5.При образовании комплекса лиганды являются
1)донором электронной пары;
2)акцептором электронной пары;
3)и донором, и акцептором электронной пары;
4)ковалентная связь в комплексе образуется по обменному механизму.
Между комплексообразователем и лигандами связь
1)ковалентная по донорно-акцепторному механизму;
2)ковалентная по обменному механизму;
Дентатность — это
1)число связей между комплексообразователем и лигандами;
2)число электронодонорных атомов в лиганде;
3)число электронодонорных атомов в комплексообразователе;
4)число электроноакцепторных атомов в комплексообразователе.
В хелатные соединения входят
1)монодентатные лиганды; 2)полидентатные лиганды;
3)бидентатные лиганды; 4)би- и полидентатные лиганды.
9.По дентатности этилендиаминтетраацетат является лигандом:
10. Дентатность лиганда ОН —
Бидентатным является лиганд
Ряд монодентатных лигандов
Комплексоны — это
1)любые лиганды; 2)би- и полидентатные лиганды;
3)любые комплексообразователи; 4)только полидентатные лиганды.
Комплексонами являются
1)хелатообразующие би- и полидентатные лиганды — доноры электронных пар;
2)органические соединения, способные к образованию комплексных соединений;
3)полидентатные лиганды-акцепторы электронных пар;
4)моно- и бидентатные лиганды.
Координация лигандов с металлами в биокомплексах, как правило, идет через атомы элементов
1)O, N; 2)O, S, N; 3)Н, О, Р; 4)H, P, S.
Координационное число это
1)число связей комплексообразователя; 2)число центральных атомов;
3)число лигандов; 4)заряд внутренней сферы.
17.Координационное число центрального атома и его заряд в соединении [Сr(NH3)4Cl2] равны соответственно
18. Координационное число центрального атома и его заряд в соединении [Со(NH3)3Cl3] равны соответственно
19.Чем меньше Кн, тем комплекс более
2)устойчивость не определяется величиной Кн;
20.Степень окисления центра атома в молекуле K3[Fe(CN)6] равна
21. Заряд внутренней сферы в соединении K4[Fe(CN)6] равен
Не имеет первичной диссоциации комплексное соединение
23. Степень окисления центрального атома в соединении [Pt(NH3)2Cl2] равна
24. Степень окисления центрального атома в соединении [Со(NH3)6]Cl3 равна
25. Заряд внутренней сферы в комплексном соединении К3[Al(ОН)6] равен
26. Заряд внутренней сферы и комплексообразователя в соединении K4[FeF6] равен
27. В соединении [Ag(NH3)2]Cl степень окисления и тип гибридизации центрального атома соответственно
1)+1, sp; 2)+1, sp 2 ; 3)+2, sp; 4)0, sp.
Комплексообразователем в хлорофилле является элемент
29. Элемент — комплексообразователь в молекуле витамина В12
30.В состав полости биокластера металлоферментов цитохромов входит катион металла:
31. Механизм образования связи между внутренней и внешней сферой в комплексном соединении
3)донорно-акцепторный; 4)металлическая связь;
Последнее изменение этой страницы: 2017-02-08; Нарушение авторского права страницы
источник
Исаева,Хадашева Общая химия 1 курс экз
+: катиона и аниона с водой одновременно
S: Реакция среды при гидролизе анионом
S: рН среду при гидролизе катионом будет
S: Повышение температуры при гидролизе согласно принципу Ле Шателье-Брауна будет способствовать из-за увеличения скорости прямой реакции
-: сохранению постоянства степени гидролиза
-: уменьшению константы гидролиза
S: Понижение температуры при гидролизе приводит
-: уменьшению константы гидролиза
-: увеличению константы гидролиза
S: Разбавление при гидролизе
S: Константа гидролиза катионом выражается формулой
+:
-:
-:
-:
S: Формула константы гидролиза анионом выглядит
-:
-:
-:
+:
S: Константа гидролиза катионом и анионом одновременно имеет следующую формулу
-:
-:
+:
-:
S: Физиологический раствор по отношению к сыворотке крови является
S: Осмотическое давление пропорционально
+: молярной концентрации растворенного вещества
-: моляльной концентрации растворенного вещества
-: молярной концентрации эквивалента растворенного вещества
-: молярной доле растворенного вещества
S: Относительное понижение давления пара над раствором пропорционально
+: молярной доле растворенного вещества
-: молярной концентрации растворенного вещества
-: моляльной концентрации растворенного вещества
-: молярной доле растворителя
S: Давление пара над раствором при увеличении концентрации растворенного в нем нелетучего вещества по сравнению с чистым растворителем
+: уменьшается, т. к. уменьшается молярная доля растворителя
-: увеличивается, т. к. увеличивается молярная доля растворенного вещества
-: не изменяется, т. к. растворенное вещество нелетучее
-: не изменяется, т. к. растворенное вещество летучее
S: Какова окраска раствора, содержащего иона MnO — 4
S: Какое яркое химическое свойство проявляют перманганаты
S: Соединения Cr(VI) являются
S: Высшую степень окисления +7 марганец имеет в
S: В какой степени окисления получается марганец при восстановлении перманганата калия в щелочной среде
S: В какой среде проводилось восстановление марганцовокислого калия, если раствор приобрел зеленую окраску
S: В какой среде проводилось восстановление перманганата калия, если раствор обесцветился
S: В какой степени окисления получается марганец при восстановлении перманганата калия в нейтральной среде
S:Значения рН буферных растворов при добавлении небольших количеств кислот и оснований
-: сохраняются постоянными, тк добавляемые катионы водорода и анионы гидроксила связываются соответственно акцепторами и донорами протонов буферной системы
+: сохраняются примерно постоянными до тех пор, пока концентрации компонентов буферных систем будут превышать концентрации добавляемых ионов
-: изменяются, тк изменяются концентрации кислот и оснований в системе
-: сохраняются постоянными, тк добавляемые катионы водорода и анионы гидроксила связываются соответственно акцепторами и донорами протонов буферной системы
S:Значения рН буферных растворов при разбавлении…
-: сохраняются постоянными, тк соотношение концентрации компонентов буферных систем не изменяется
+: сохраняются примерно постоянными до определенных значений концентраций
-: изменяются, тк концентрация компонентов системы уменьшается
-: сохраняются постоянными, тк соотношение концентрации компонентов буферных систем не изменяется
S:Какие из перечисленных сопряженных кислотно-основных пар обладают буферными свойствами: а) НСОО — /НСООН; б) СН3СОО — /СН3СООН; в) Сl — /HCl; г) НСО — 3/СО2
S:Из перечисленных сопряженных кислотно-основных пар выберите системы, обладающие буферными свойствами: а) Н3РО4/Н2РО4 — ; б) Н2РО4 — /НРО4 2- ; в) НРО4 2- /РО4 3-
S:Какие из кислотно-основных пар обладают буферными свойствами; а) Нb — /ННb
S:Какие из кислотно-основных пар обладают буферными свойствами; а)Cl — /HCl
S:Какие из сопряженных кислотно-основных пар обладают буферными свойствами
S:Какие из буферных систем содержат в своем составе только соли: а) СО3 2- /НСО3 —
S:При добавлении HCl к буферной системе НРО4 2- /Н2РО4 —
-: активная концентрация (НРО4 2- ) увеличивается, (Н2РО4 — ) – уменьшается
+: активная концентрация (НРО4 2- ) уменьшается, (Н2РО4 — )- увеличивается
-: активности компонентов не изменяются
S:При добавлении NaOH к буферной системе НРО4 2- /Н2РО4 —
+: активная концентрация (НРО4 2- ) увеличивается, (Н2РО4 — ) – уменьшается
-: активная концентрация (Н2РО4 — ) увеличивается, (НРО4 2- )- уменьшается
-: активные концентрации (НРО4 2- ) и , (Н2РО4 — ) не изменяются
-: активная концентрация (Н2РО4 — ) увеличивается, (НРО4 2- )- уменьшается
S:При добавлении NaOH к буферной системе NH4 + /NH3·H2O
+: активная концентрация (NH4 + ) уменьшается, (NH3·H2O) — увеличивается
-: активная концентрация (NH4 + ) увеличивается, (NH3·H2O) — уменьшается
-: активные концентрации (NH4 + ) и (NH3·H2O) не изменяются
-: активные концентрации (NH4 + ) и (NH3·H2O) не изменяются
S:При добавлении HCl к буферной системе NH4 + /NH3·H2O
-: активная концентрация (NH4 + ) уменьшается, (NH3·H2O) — увеличивается
+: активная концентрация (NH4 + ) увеличивается, (NH3·H2O) — уменьшается
-: активные концентрации (NH4 + ) и (NH3·H2O) не изменяются
-: активные концентрации (NH4 + ) и (NH3·H2O) не изменяются
S:При добавлении NaOH к буферной системе СН3СОО — /СН3СООН
+: активная концентрация (СН3СООН) уменьшается, СН3СОО — — увеличивается
-: активная концентрация (СН3СООН) увеличивается, СН3СОО — -уменьшается
-: активные концентрации (СН3СООН) и (СН3СОО — ) не изменяются
-: активная концентрация (СН3СООН) увеличивается, СН3СОО — -уменьшается
S:При добавлении HCl к буферной системе СН3СОО — /СН3СООН
-: активная концентрация (СН3СООН) уменьшается, СН3СОО — — увеличивается
+: активная концентрация (СН3СООН) увеличивается, СН3СОО — -уменьшается
-: активные концентрации (СН3СООН) и (СН3СОО — ) не изменяются
-: активная концентрация (СН3СООН) уменьшается, СН3СОО — — увеличивается
S:Буферные системы поддерживают в организме равновесия
S:Фосфатная буферная система содержит в организме кислотно-основные сопряженные пары
+: Н2РО4 — — кислота, НРО4 2- — сопряженное основание
-: НРО4 2- — кислота, РО4 3- — сопряженное основание
-: Н3РО4 – кислота, РО4 3- — сопряженное основание
S: Под буферными системами следует подразумевать такие растворы, которые способны при добавлении небольших порций кислоты или щелочи
-: уменьшать значение рН раствора
S: При добавлении к ацетатному буферу соляной кислоты в реакцию вступает
S: При действии щелочи на ацетатный буфер реагирует
S: В случае аммиачного буфера при действии щелочи реагирует
S: При действии соляной кислоты на аммиачный буфер с ней взаимодействует
S: Формула вычисления концентрации ионов водорода для буферных систем, образованных слабой кислотой и ее солью выглядит
-:
-:
-:
+:
S: Формула нахождения концентрации гидроксид-ионов для буферов, образованных слабым основанием и его солью выглядит
-:
-:
+:
-:
S: Формула для вычисления рН буферных систем называется уравнением
S: Численное совпадение рН и рК кислоты есть
+: силовой показатель кислоты
-: силовой регулятор напряжения
S: Совпадающее, при равенстве концентраций основания и соли (составляющих буферную систему), с рН раствора значение отрицательного десятичного логарифма константы ионизации основания называют
+: силовой показатель основания
S: Формула для вычисления рН буфера, образованного слабой кислотой и ее солью, будет
-:
+:
-:
-:
S: рОН буфера, образованного слабым основанием и его солью находится по формуле
-:
-:
-:
+:
S: рН аммиачного буфера находится по формуле
+:
-:
-:
-:
S: Буферные системы поддерживают в организме равновесия
S: Фосфатная буферная система содержит в организме кислотно-основные сопряженные пары
+: Н2РО4 — — кислота, НРО4 2- — сопряженное основание
-: НРО4 2- — кислота, РО4 3- — сопряженное основание
-: Н3РО4 – кислота, РО4 3- — сопряженное основание
S: Комплексные соединения – это
-: сложные устойчивые химические образования
-: вещества, состоящие из комплексообразователя и лигандов
-: соединения, состоящие из внутренней и внешней среды
+: сложные устойчивые химические соединения, в которых обязательно присутствует связь, образованная по донорно-акцепторному механизму
S: Комплексообразователи – это
-: только атомы, доноры электронных пар
-: только ионы, акцепторы электронных пар
-: только d-элементы, доноры электронных пар
+: атомы или ионы, акцепторы электронных пар
S: Наименьшей комплексообразующей способностью обладают
S: Лучшим комплексообразователем из: Na, Mg, Co, Al является
S: Назовите комплексообразователь в гемоглобине
-: молекулы, доноры электронных пар
-: ионы, акцепторы электронных пар
-: молекулы и ионы — акцепторы электронных пар
+: молекулы и ионы — доноры электронных пар
S: При образовании комплекса лиганды являются
-: акцептором электронной пары
-: и донором, и акцептором электронной пары
-: ковалентная связь в комплексе образуется по обменному механизму
S: Какая связь между комплексообразователем и лигандами
+: ковалентная по донорно-акцепторному механизму
-: ковалентная по обменному механизму
-: число связей между комплексообразователем и лигандами
+: число электродонорных атомов в лиганде
-: число электродонорных атомов в комплексообразователе
-: число электроакцепторных атомов в комплексообразователе
S: В хелатные соединения входят
+: би- и полидентатные лиганды
S: Из перечисленных лигандов выберите бидентатные
S: По дентатности этиленаминтетраацетат является лигандом
S: Какова дентатность лиганда OH —
S: Из перечисленных лигандов выберите монодентатные
S: Какой лиганд является бидентатным
S: Выберите ряд монодентатных лигандов
S: Для ионов щелочных металлов комплексообразование мало характерно вследствие: а) устойчивой электронной структуры; б) больших размеров; в) малого заряда ядра; г) слабого поляризующего действия
S: В каком качестве галогены входят в состав комплексных соединений: а) лигандов; б) комплексообразователей; в) лигандов и комплексообразователей; г) внешней среды
S: Унитиол – это: а) антидот, образующий комплексное соединение с тяжелыми металлами; б) лекарственный препарат, применяемый для улучшения кроветворения; в) противоядие при отравлении селеном; г) хорошо растворимая соль, содержащая SN-группы
S: Что собой представляет гемоглобин (Hb)по химической природе
+: Hb — сложный белок, содержащий хелатный микроцикл гем с железом в степени окисления +2
-: Hb — кислый белок, содержащий небелковую часть — гем с железом в степени окисления +3
-: Hb — транспортная форма кислорода, содержащая атом железа в нейтральном состоянии
-: Hb — резервная форма кислорода, содержащая атом железа в степени окисления +2
S: Через атомы каких элементов, как правило, идет координация лигандов с металлами в биокомплексах
S: Что такое координационное число
+: число связей комплексообразователя
-: число полидентатных лигандов
S: Укажите координационное число центрального атома и его заряд в соединении [Cr(NH3)2Cl2]
S: Укажите координационное число центрального атома и его заряд в соединении [Co(NH3)3Cl3]
S: Для платины в степени окисления +4 характерно координационное число
S: Для цинка в бионеорганических комплексах характерно координационное число
S: Чем меньше Кн, тем комплекс более
-: устойчивость не определяется величиной Кн
S: Устойчивость комплекса с увеличением числа донорных атомов в полидентатном лиган