Нормальный гемоглобин состоит из цепи аминокислот
Содержание статьи
Гемоглобин
Гемоглобин – белок, содержащийся в эритроцитах и осуществляющий обмен кислорода между легкими и тканями организма. Имеет в своем составе железо. Также он обуславливает цвет крови.
Синонимы русские
Содержание гемоглобина.
Синонимы английские
Hemoglobin, Haemoglobin, Haemoglobin concentration, Hb, Hgb.
Единицы измерения
Г/л (грамм на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Общая информация об исследовании
Измеряется количество гемоглобина, содержащегося в эритроцитах белка, который доставляет кислород к тканям и органам, а углекислый газ – от тканей и органов к легким, где он выдыхается.
Это происходит за счет того, что кислород способен связываться железом, атомы которого «встроены» в гемоглобин. «Подходя» к тканям, эритроциты освобождаются от кислорода и забирают «отработанный» диоксид углерода (углекислый газ).
Гемоглобин состоит из аминокислот, образующих белковый комплекс глобин, и гема, содержащего железа. Образование глобина и гема у некоторых людей может нарушаться, что грозит анемией.
Сниженный уровень гемоглобина, скорее всего, свидетельствует об анемии – состоянии, при котором организм не получает достаточно кислорода, что вызывает слабость и быструю утомляемость.
Гемоглобин повышается при увеличении количества эритроцитов и снижается, соответственно, если их становится меньше.
Снижение количества эритроцитов может происходить из-за уменьшения их образования в костном мозге, их потери в результате кровотечения или разрушения внутри организма.
Для чего используется исследование?
- Чтобы оценить тяжесть анемии или полицитемии.
- Чтобы отслеживать в динамике эффективность терапии этих состояний.
Когда назначается исследование?
- Входит в рутинный клинический анализ крови, который может назначаться по различным показаниям.
Что означают результаты?
Референсные значения
Возраст | Пол | Гемоглобин, г/л |
134-198 | ||
14 дней – 1 мес. | 107-171 | |
1-2 мес. | 94-130 | |
2-4 мес. | 103-141 | |
4-6 мес. | 111-141 | |
6-9 мес. | 110-140 | |
9-12 мес. | 113-141 | |
1-5 лет | 110-140 | |
5-10 лет | 115-145 | |
10-12 лет | 120-150 | |
12-15 лет | мужской | 120-160 |
женский | 115-150 | |
15-18 лет | мужской | 117-166 |
женский | 117-153 | |
18-45 лет | мужской | 132-173 |
женский | 117-155 | |
45-65 лет | мужской | 131-172 |
женский | 117-160 | |
> 65 лет | мужской | 126-174 |
женский | 117-161 |
Причины изменения уровня гемоглобина
Уровень гемоглобина выше у мужчин, так как андрогены стимулируют образование эритроцитов.
Причины повышения уровня гемоглобина:
- дегидратация (обезвоживание) из-за сгущения крови – гемоконцентрации;
- истинная полицитемия в результате избыточной продукции эритроцитов в костном мозге;
- хроническая обструктивная болезнь легких; хроническая сердечная недостаточность.
Причины понижения уровня гемоглобина:
- железо-, B12- или фолиево-дефицитная анемия;
- острое или хроническое кровотечение (хотя во время кровотечения или сразу после него уровень гемоглобина будет повышен),
- нарушения синтеза гемоглобина (серповидно-клеточная анемия, талассемия);
- хронические болезни почек (как правило, из-за уменьшения синтеза гормона эритропоэтина, который стимулирует образование эритроцитов в костном мозге);
- цирроз печени;
- микседема (снижение функции щитовидной железы);
- гемолиз (разрушение эритроцитов), который может происходить по разным причинам – из-за наследственного дефекта эритроцитов, в результате появления антител к собственным эритроцитам или токсического действия при малярии;
- онкологические заболевания костного мозга или метастазы других опухолей в костный мозг;
- апластическая анемия;
- системные заболевания соединительной ткани;
- хронические инфекции.
Что может влиять на результат?
Повышенный уровень гемоглобина наблюдается:
- у людей, поднимающихся на большую высоту, так как их организм адаптируется к пониженной концентрации кислорода;
- у курильщиков (вследствие кислородного голодания тканей);
- при влиянии гентамицина и пентоксифиллина.
Уровень гемоглобина понижен:
- в норме у беременных,
- у соблюдающих вегетарианскую диету,
- после сдачи крови,
- при выраженной липемии и повышении количества лейкоцитов,
- при сдаче крови в положении лежа (снижение до 5 %).
Важные замечания
- Следует понимать: нормальный уровень эритроцитов не всегда означает, что содержание в них гемоглобина будет тоже в норме.
Также рекомендуется
- Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с микроскопией мазка крови при выявлении патологических изменений)
- Гематокрит
- Эритропоэтин
Кто назначает исследование?
Врач общей практики, терапевт, гематолог, нефролог, хирург.
Источник
емоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.
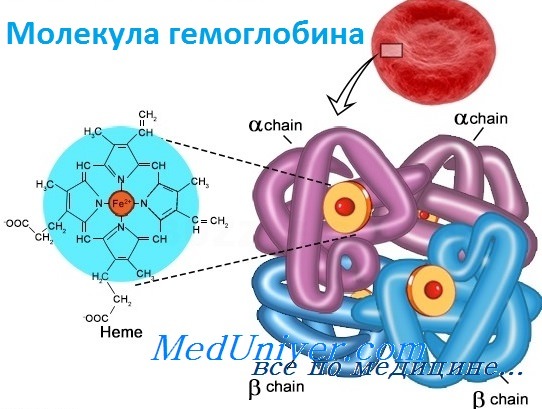
Оглавление темы «Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.»: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. — Также рекомендуем «Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.» |
Источник
труктура и функция гемоглобина
Структура и функция гемоглобинаБолезни гемоглобинов человека, названные гемоглобинопатиями, занимают уникальную позицию в медицинской генетике. Это наиболее частые моногенные болезни у людей, к тому же вызывающие высокую смертность. По оценке Всемирной организации здравоохранения более 5% человеческой популяции — носители мутаций клинически значимых нарушений гемоглобина. Кроме того, поскольку гемоглобин был одной из первых исследованных белковых структур, а гены глобина у человека стали первыми клонированными генами, связанными с болезнями, их молекулярная и биохимическая патология изучена лучше, чем в любой другой группе генетических болезней. Глобины также проливают свет на процесс как молекулярной, так и популяционной эволюции и служат моделью действия генов в развитии. Прежде чем подробно обсуждать гемоглобинопатии, опишем вкратце нормальное состояние гена глобина и биологию гемоглобина. Гемоглобин — переносчик кислорода в эритроцитах позвоночных. Его молекула содержит четыре субъединицы: две а-цепи и две b-цепи. Каждая субъединица формируется цепью полипептида глобина и простетической группой, гемом, железосодержащим пигментом, соединяющимся с кислородом, придавая молекуле способность транспортировать кислород.
Каждая молекула гемоглобина состоит из двух пар полипептидных цепей разного типа. Цепи глобина в нормальном гемоглобине взрослых, гемоглобине А (НЬА), названы а и b соответственно. Четыре цепи складываются и объединяются, формируя шарообразный тетрамер с молекулярным весом приблизительно 64 500, структуру, обозначаемую для НbА — а2b2. Оба типа цепей почти равны по длине; а-цепь имеет 141 аминокислоту, b-цепь — 146. Основные характеристики структуры глобина весьма консервативно сохранялись в ходе эволюции, что стало основой для понимания гемоглобинопатии. Более того, третичная структура полипептида глобина также оказалась в высшей степени консервативной: фактически все изученные глобины имеют семь или восемь извитых участков (в зависимости от цепи). В то же время только две аминокислоты сохраняются во всех глобинах в природе, и неудивительно, что мутации в любом из этих остатков связаны с болезнью. Исследование структуры гемоглобина позволило предсказать, какие типы мутаций, вероятно, окажутся патогенными. Таким образом, мутации, изменяющие строение глобина, замена высококонсервативной аминокислоты или одного из неполярных остатков, формирующих гидрофобную оболочку, исключающую попадание воды внутрь молекулы, вероятно, вызовут гемоглобинопатию. Как и все белки, глобин имеет «чувствительные области», мутации в которых не могут не влиять на функцию, и «нечувствительные области», мутации в которых переносятся более свободно. — Также рекомендуем «Гены гемоглобина человека» Оглавление темы «Выявление генов болезни»:
|
Источник
ернициозная анемия. Образование гемоглобина
Пернициозная анемия. Образование гемоглобинаНарушение созревания, связанное с недостаточным всасыванием витамина В12 из желудочно-кишечного тракта: а) Пернициозная анемия. Распространенной причиной нарушения созревания красных клеток крови является недостаточное всасывание витамина В12 из желудочно-кишечного тракта. Это часто происходит при заболевании пернициозной анемией, при которой основной патологией является атрофический гастрит, нарушающий нормальную секреторную функцию желудка. Париетальные клетки желудочных желез секретируют гликопротеин, называемый внутренним фактором, который соединяется с витамином В12 пищи и делает этот витамин доступным для всасывания в кишечнике. Это происходит следующим образом: (1) внутренний фактор прочно связывается с витамином B12. В таком связанном состоянии витамин В12 защищается от переваривания желудочно-кишечными секретами; (2) находясь в связанном состоянии, внутренний фактор связывается со специфическими рецепторами на мембранах клеток щеточной каемки слизистой подвздошной кишки; (3) затем в течение следующих нескольких часов витамин В12 транспортируется в кровь путем пиноцитоза; в результате внутренний фактор и витамин вместе переносятся через мембрану. Следовательно, недостаток внутреннего фактора ведет к уменьшению доступности витамина В12 из-за нарушения всасывания витамина. Сразу после всасывания из желудочно-кишечного тракта витамин B12 сначала накапливается в печени в большом количестве, затем медленно выделяется по мере потребности в нем костного мозга. Минимальное количество витамина B12, необходимое ежедневно для поддержания нормального созревания красных клеток крови, составляет всего 1-3 мкг, а нормальное накопление в печени и других тканях тела примерно в 1000 раз больше этого количества. Следовательно, обычно для развития анемии в связи с нарушением созревания эритроцитов недостаточность всасывания В12 должна продолжаться 3-4 года. б) Недостаточность созревания, связанная с дефицитом фолиевой кислоты (птероилглутаминовой кислоты). Фолиевая кислота является нормальным компонентом овощей, некоторых фруктов и мяса (особенно, печени). Однако она легко разрушается во время приготовления пищи. Кроме того, люди с нарушением всасывания в желудочно-кишечном тракте, например при часто встречающемся заболевании тонкого кишечника, которое называют спру, обычно имеют серьезные затруднения всасывания и фолиевой кислоты, и витамина B12. Следовательно, во многих случаях причиной нарушений созревания является недостаточность всасывания в кишечнике и фолиевой кислоты, и витамина B12. Формирование гемоглобинаСинтез гемоглобина начинается в проэритробластах и продолжается даже на стадии ретикулоцита красных клеток крови. Следовательно, когда ретикулоциты оставляют костный мозг и проходят в кровоток, они продолжают формировать минимальные количества гемоглобина в течение примерно следующего дня до тех пор, пока не станут зрелыми эритроцитами.
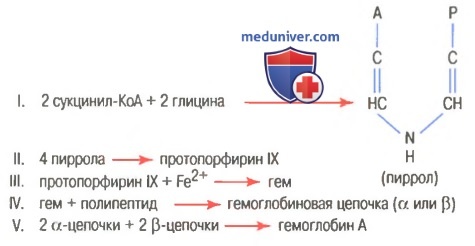
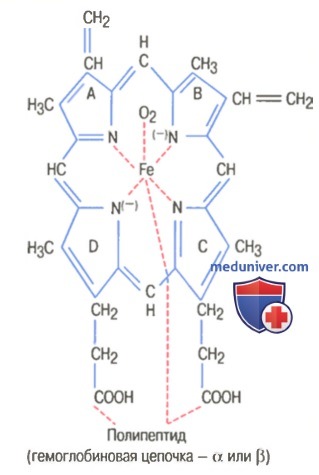
На рисунке выше показаны основные химические этапы формирования гемоглобина. Сначала сукцинил-КоА, формируемый в метаболическом цикле Кребса, связывается с глицином, образуя молекулу пиррола. В свою очередь, четыре молекулы пиррола объединяются, образуя протопорфирин IX, который затем соединяется с железом, формируя молекулу гема. Наконец, каждая молекула гема присоединяется к синтезируемому рибосомами длинному полипептиду глобину, формируя субъединицу гемоглобина, называемую гемоглобиновой цепочкой (для облегчения понимания просим вас изучить рисунок ниже). Каждая цепочка имеет молекулярную массу около 16000; в свою очередь, четыре такие цепочки свободно связываются вместе, формируя целую гемоглобиновую молекулу.
Существуют несколько легких вариаций гемоглобиновых цепочек в зависимости от аминокислотного состава полипептидной части субъединицы. Разные типы цепочек обозначают как альфа, бета, гамма и дельта. Наиболее распространенная форма гемоглобина взрослого человека — гемоглобин А. Он представляет собой комбинацию двух альфа-цепочек и двух бета-цепочек. Гемоглобин А имеет молекулярную массу 64458. Поскольку каждая гемоглобиновая цепочка имеет простетическую группу в виде гема, содержащего атом железа, ясно, что каждая молекула гемоглобина, состоящая из четырех таких цепочек, содержит четыре атома железа. Каждый из них может свободно связываться с одной молекулой кислорода, обеспечивая возможность транспортировки каждой молекулой гемоглобина четырех молекул (или восьми атомов) кислорода. Типы гемоглобиновых цепочек в молекуле гемоглобина определяют сродство гемоглобина к кислороду. Патологические изменения цепочек могут менять физические характеристики гемоглобиновой молекулы. Например, при серповидно-клеточной анемии в одном участке каждой из двух бета-цепочек аминокислота валин заменяется глутаминовой кислотой. При низком парциальном давлении кислорода этот тип гемоглобина формирует внутри эритроцитов вытянутые кристаллы, длина которых иногда достигает 15 мкм. Они делают практически невозможным прохождение эритроцитов через многие мелкие капилляры, и острые концы кристаллов, вероятно, разрывают клеточные мембраны, способствуя развитию серповидно-клеточной анемии. — Также рекомендуем «Связывание гемоглобина с кислородом. Обмен железа» Оглавление темы «Эритропоэз. Белые клетки крови»: |
Источник