Обратимо как гемоглобин связывается с кислородом
Гемоглобин: роль в газообмене и процессе дыхания
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии… Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1-2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
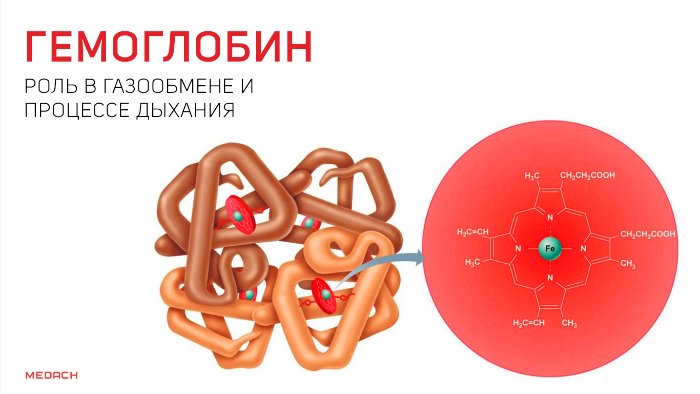
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
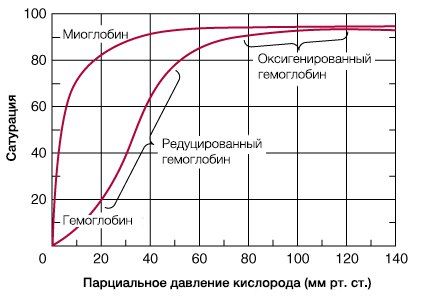
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.
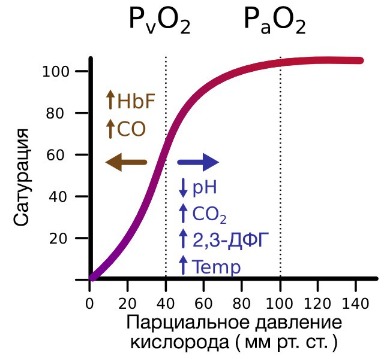
В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
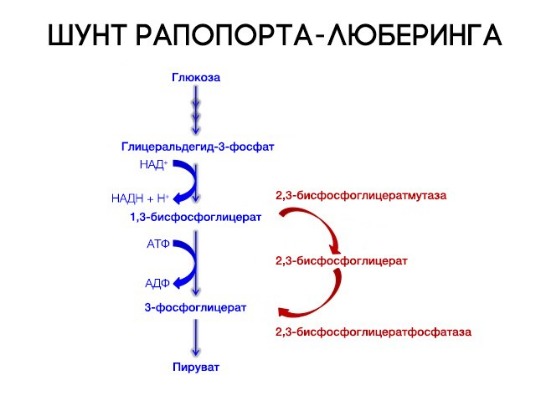
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
- Harrison’s hematology and oncology Longo, Dan L (Dan Louis), Third edition. New York : McGraw-Hill Education Medical, 2017.
- Наглядная физиология, С. Зильбернагль, А. Деспопулос, 2013.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. /Д. Нельсон, М. Кокс ; Пер. с англ.-М.: БИНОМ: Лаборатория знаний, 2011.- 694 с.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Комплексное соединение гемоглобин. Обратимые и необратимые реакции.
Инфоурок
› Химия ›Презентации›Комплексное соединение гемоглобин. Обратимые и необратимые реакции.
Описание презентации по отдельным слайдам:
1 слайд
Описание слайда:
«Комплексное соединение — гемоглобин. Обратимые и необратимые химические реакции»
2 слайд
Описание слайда:
Цель исследования: изучение строения и биохимических свойств гемоглобина как жизненно важного комплексного соединения с точки зрения обратимых и необратимых реакций.
3 слайд
Описание слайда:
Задачи: • изучить историю возникновения и развития координационной теории; • изучить строение и классификацию комплексного соединения — гемоглобина; • исследовать биохимические свойства комплексного соединения — гемоглобина; • провести качественные реакции; • получить комплексные соединения гемоглобина и сравнить их прочность; • исследовать обратимые и необратимые реакции, лежащие в основе биохимических свойств комплексного соединения гемоглобина крови.
4 слайд
Описание слайда:
Объект исследования: комплексное соединение — гемоглобин крови теленка. Предмет исследования: строение и свойства гемоглобина. Методы исследования: анализ, синтез, аналогия, моделирование, обобщение, вывод, эксперимент, наблюдение.
5 слайд
Описание слайда:
Гипотеза: комплексное соединение — гемоглобин, являясь составной частью крови, может вступать в обратимые и необратимые реакции с различными веществами.
6 слайд
Описание слайда:
Актуальность: Гемоглобин — комплексное соединение, какое химическое строение имеет гемоглобин, какие изменения происходят с гемоглобином под воздействием различных факторов и какое влияние эти изменения оказывают на жизнедеятельность организмов. Решение этой проблемы можно ярко показать на примере комплексного соединения — гемоглобина крови, что и определяет выбор темы исследования.
7 слайд
Описание слайда:
Новизна: до настоящего времени в нашем образовательном учреждении не проводились исследования по данной тематике; гемоглобин, как комплексное соединение, представляет интерес при изучении отдельных тем биологии и химии; в открытом доступе мало или вообще отсутствуют теоретические и практические данные по изучаемой тематике.
8 слайд
Описание слайда:
Практическая значимость: исследовав состав и биохимические свойства гемоглобина, можно дать рекомендации по соблюдению здорового образа жизни, по рациональному отношению к своему здоровью и раннему выявлению заболеваний, употреблению продуктов питания повышающих уровень гемоглобина в организме.
9 слайд
Описание слайда:
Теоретическая часть
10 слайд
Описание слайда:
История развития координационной теории Первый период. С древних времен и до начала 18 века ученые и ремесленники использовали и даже синтезировали комплексные соединения, хотя и неосознанно. С начала 18 века до 1893 года идет целенаправленный синтез комплексных соединений. С 1893 года по 1940 год — создание, обоснование и победа координационной теории А. Вернера. С 1940 года и по настоящее время — современный период укрепления и всестороннего развития координационной теории.
11 слайд
Описание слайда:
Комплексное соединение — гемоглобин. Строение
12 слайд
Описание слайда:
Производные гемоглобина Дезоксигемоглобин; Оксигемоглобин (HbO2); Карбоксигемоглобин (HbCO); Метгемоглобин (мет-Hb; pH 7,0-7,4); Циан-метгемоглобин (CN-мет-Hb).
13 слайд
Описание слайда:
Метаболизм гемоглобина Молодые формы эритроцитов: нормобласты; эритробласты; ретикулоциты. , Функции гемоглобина буферные свойства гемоглобина, поддержание кислотно -щелочного равновесия в организме участие в газообмене между организмом и внешней средой
14 слайд
Описание слайда:
Клинические показания гемоглобина
15 слайд
Описание слайда:
Продукты с высоким содержанием железа
16 слайд
Описание слайда:
Продукты с высоким содержанием железа
17 слайд
Описание слайда:
Специальные рецепты для повышения гемоглобина Стакан грецких орехов и стакан сырой гречневой крупы перемолоть, добавить стакан меда, все перемешать, каждый день есть по столовой ложке. Грецкие орехи, курага, мед, изюм — все в пропорции 1:1 — перемолоть и тщательно перемешать, есть по 1-3 столовые ложки в день(один из лучших рецептов не только для поднятия гемоглобина, но и для обеспечения организма необходимыми витаминами). По 1 стакану чернослива, кураги, грецких орехов, изюма перемолоть, добавить мед, добавить 1-2 лимона со шкуркой (вместо лимона можно добавить сок алоэ), есть по 1-3 столовые ложки в день.
18 слайд
Описание слайда:
Практическая часть
19 слайд
Описание слайда:
Опыт 1. Свертывание белка гемоглобина под действием спирта. Реактивы и оборудование: Спирт 96%-ный, 40%-ный раствор спирта, кровь теленка; пробирки химические или пробирки химические для микрореакций. В две пробирки помещаем 3 мл крови теленка. В первую приливаем 96%-ный спирт, во вторую — 40% спирт. В обеих пробирках наблюдается коагуляция белка. Однако с чистым спиртом коагуляция идет сильнее и красная пигментация почти исчезает, в отличие от второй пробирки, где красная пигментация сохраняется.
20 слайд
21 слайд
Описание слайда:
Опыт 2. Свертывание белка гемоглобина под действием соляной кислоты. Реактивы и оборудование: 10%-ная кислота соляная, 0,5 %-ная кислота соляная, кровь теленка; пробирки химические или пробирки химические для микрореакций. В три пробирки помещаем по 1 мл крови теленка. Первую пробирку оставляем для контроля, во вторую пробирку добавляем 0,5 %-ный раствор соляной кислоты, в третью — 10%-ный раствор соляной кислоты. При добавлении 10%-ного раствора наблюдается полная коагуляция белка гемоглобина с исчезновением кроваво-красного окрашивания. При использовании соляной кислоты, разбавленной в 20 раз, также наблюдается коагуляция белка и изменения окраски, но в значительно меньшей степени.
22 слайд
23 слайд
Описание слайда:
Опыт 3. Свертывание белка гемоглобина под действием растворов солей тяжелых металлов. Реактивы и оборудование: 1%-ный раствор ацетата свинца, 1%-ный раствор сульфата меди (II), 1%-ный раствор хлорида бария, кровь теленка; пробирки химические или пробирки химические для микрореакций. В три пробирки помещаем по 5 мл крови теленка. Первую пробирку добавляем ацетат свинца, во вторую — соль хлорида бария, в третью — соль сульфата меди (II). При добавлении растворов солей меди и свинца, наблюдается полная коагуляция белка гемоглобина. При действии раствора соли бария коагуляция не наблюдается
24 слайд
25 слайд
Описание слайда:
Опыт 4. Качественная реакция на ионы Fe2+ гемоглобина. Реактивы и оборудование: 1%-ные растворы: KSCN, К3[Fe(CN)6], К4[Fe(CN)6], кровь теленка; пробирки химические или пробирки химические для микрореакций. В три пробирки помещаем по 1 мл крови теленка. Первую пробирку добавляем раствор KSCN, во вторую — К4[Fe(CN)6], в третью — К3[Fe(CN)6]. В первых двух пробирках не происходит изменение окраски раствора. В третьей наблюдается появление сине-зеленого окрашивания.
26 слайд
27 слайд
Описание слайда:
Опыт 5. Отделение белковой части крови и проверка наличия свободного от гемоглобина железа. Реактивы и оборудование: Кровь теленка, 1%-ный раствор К3[Fe(CN)6]; пробирки химические или пробирки химические для микрореакций. В две пробирки наливаем одинаковое количество крови. Первую пробирку оставляем как контрольную, а вторую добавляем соляную кислоту. Свернувшийся белок гемоглобина отделяем от жидкости. Проводим качественную реакцию на ионы Fe (II), не связанные с гемоглобином крови. Изменение окраски в типичную темно-синюю для ионов Fe (II) не наблюдается.
28 слайд
29 слайд
Описание слайда:
Опыт 6. Равновесие в системе: венозная кровь ↔ артериальная кровь. Реактивы и оборудование: Кровь теленка; пробирки химические или пробирки химические для микрореакций. В две пробирки наливаем одинаковое количество крови. Первую пробирку оставляем как контрольную, а вторую интенсивно встряхиваем. При встряхивании пробирки с кровью в течение 5 минут, кровь приобретает алую окраску, характерную для артериальной крови. Через 30 минут после встряхивания, кровь вновь приобретает темную окраску, характерную для венозной крови.
30 слайд
31 слайд
Описание слайда:
Опыт 7. Получение равновесного комплекса карбоксигемоглобина. Реактивы и оборудование: Для получения кислорода СО (конц. Н2SO4 и муравьиная кислота), кровь теленка; пробирки химические или пробирки химические для микрореакций. В две пробирки помещаем кровь теленка. Через одну пробирку с кровью пропускаем газ СО в течении 5 минут, а другую оставляем для сравнения. В пробирке образуется комплекс вишневого цвета карбоксигемоглобин HbCO.
32 слайд
33 слайд
Описание слайда:
Опыт 8. Обратимые процессы комплекса карбоксигемоглобина. Реактивы и оборудование: Для получения кислорода O2 (Н2О2 и MnO2), карбоксигемоглобин (получен в опыте 7), кровь теленка; пробирки химические или пробирки химические для микрореакций. Через карбоксигемоглобин, полученный в опыте 7, пропускаем кислород в течении 10 минут. Вторая пробирка с кровью теленка — для контроля. В первой пробирке наблюдается восстановление до цвета контрольного образца крови в течении 3 часов.
34 слайд
35 слайд
Описание слайда:
Опыт 9. Равновесие в системе лекарственного железосодержащего лекарственного препарата мальтофер. Реактивы и оборудование: Мальтофер (активное вещество железо (III) гидроксид полимальтозат), 10%-ный раствор НCl, 1%-ные растворы: KSCN, К3[Fe(CN)6], К4[Fe(CN)6]; пробирки химические или пробирки химические для микрореакций. В три пробирки наливаем одинаковое количество препарата мальтофера. В первую пробирку добавляем KSCN, вторую — К4[Fe(CN)6], в третью — К3[Fe(CN)6]. Никаких видимых изменений окраски не наблюдается
36 слайд
37 слайд
Описание слайда:
Выводы: 1. Изучили историю возникновения и развития координационной теории. 2. Изучили строение и классификацию комплексного соединения — гемоглобина. Строение комплекса гемоглобина соответствует основным положениям теории Вернера. В составе гемоглобина отсутствует ион Fe3+. Наличие белка подтверждено в опытах с соляной кислотой и этиловым спиртом: коагуляция белка — глобина. 3. Исследовали биохимические свойства гемоглобина, его взаимодействие с кислородом, оксидом углерода (II), углекислым газом, этиловым спиртом, соляной кислотой, солями тяжелых металлов. 4. Качественные реакции, проведенные с гемоглобином, подтвердили, что в состав гемоглобина входит белок, а двухвалентное железо прочно связано с белковой частью. 5. В ходе работы были получены комплексные соединения гемоглобина: оксигемоглобин (HbO2), карбогемоглобин (HbCO2), карбоксигемоглобин (HbCO). Устойчивость комплексов возрастает в ряду: HbO2→HbCO2→HbCO. 6. Необратимыми являются реакции гемоглобина с спиртом, кислотами и соединениями меди и свинца. Реакции гемоглобина с кислородом, оксидом углерода (II) и оксидом углерода (IV) являются обратимыми.
38 слайд
Описание слайда:
Заключение. На основе теоретических знаний и проведенных исследований, нами были проведены обратимые и необратимые реакции комплексного соединения — гемоглобина крови. Полученные результаты исследования хорошо коррелируются с теорией комплексных соединений Вернера.
39 слайд
Описание слайда:
Спасибо за внимание!
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Пожаловаться на материал
Курс повышения квалификации
Курс профессиональной переподготовки
Учитель химии
Курс профессиональной переподготовки
Учитель биологии и химии
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Краткое описание документа:
Проверен экспертом
Общая информация
Учебник: «Химия. Углубленный уровень», Габриелян О.С.
Тема: § 1. Предмет органической химии. Органические вещества
Номер материала: ДБ-601999
Вам будут интересны эти курсы:
Оставьте свой комментарий
Источник