Оксигенация гемоглобина и миоглобина
Содержание статьи
Кинетика оксигенирования миоглобина и гемоглобина
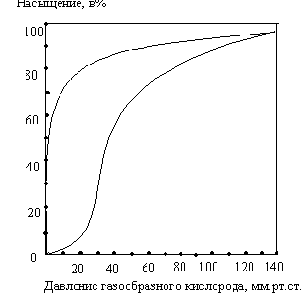
Почему
миоглобин не способен транспортировать
кислород, но зато активно его запасает?
Для миоглобина изотерма адсорбции
кислорода имеет форму гиперболы. Давление
О2
в ткани, окружающей легочные капилляры,
составляет 100 мм рт.ст., поэтому миоглобин
в легких мог бы весьма эффективно
насыщаться кислородом. В венозной крови
Р О2
равно 40 мм рт. ст., а в активно работающей
мышце — 20 мм рт.ст. Но даже при парциальном
давлении 20 мм рт. ст. степень насыщения
миоглобина кислородом будет весьма
значительна, и поэтому миоглобин не
может служить транспортной молекулой
для доставки О2
от легких к периферическим тканям.
Однако при кислородном голодании,
которым сопровождается тяжелая физическая
работа, парциальное давление О2
в тканях может понизиться и до 5 мм
рт.ст.; при столь низком давлении миоглобин
легко отдает кислород, обеспечивая тем
самым окислительный синтез АТФ в
митохондриях мышечных клеток.
Кинетика
оксигенирования гемоглобина коренным
образом отличается от кинетики
оксигенирования миоглобина. Кривая
насыщения гемоглобина О2
имеет сигмоидальную форму. Т.о., способность
гемоглобина связывать О2
зависит от того, содержатся ли в данном
тетрамере другие молекулы О2.
Если да, то последующие молекулы О2
присоединяются легче. Для гемоглобина
характерна кинетика кооперативного
связывания, благодаря которой он
связывает максимальное количество О2
в легких и отдает максимальное количество
О2
при тех значениях Р О2
, которые имеют место в периферических
тканях.
Сродство
гемоглобинов к О2
характеризуется величиной Р50-
значением парциального давления О2,
при котором наблюдается полунасыщение
гемоглобина кислородом. Например, для
HbA
Р50
= 26 мм рт.ст., а для HbF
— 20 мм рт. ст. Благодаря этой разнице
гемоглобин F
отбирает кислород у HbA,
находящегося в плацентарной крови.
2)
У олигомерных белков имеется специальный
центр, отличный от активного, к которому
присоединяется аллостерический лиганд.
Этот центр получил название аллостерического.
Рассмотрим
аллостерическую регуляцию на примере
HbА.
В центре молекулы HbА
находится полость, которая является
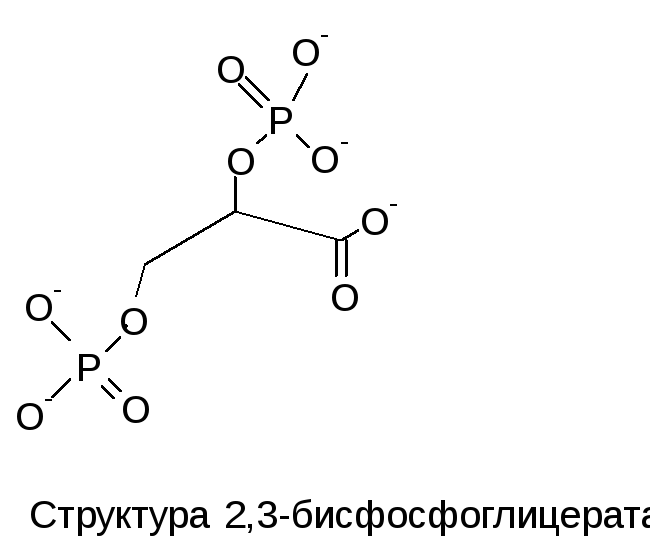
местом присоединения 2,3-ДФГ. Это соединение
накапливается в эритроцитах при
недостатке О2.
Непосредственным предшественником
служит 1,3-дифосфоглицерат — промежуточный
продукт гликолиза. 2,3-ДФГ имеет сильный
отрицательный заряд и взаимодействует
с 5 положительно заряженными группами
аллостерического центра. В результате
взаимодействия образуется 5 дополнительных
ионных связей, что снижает сродство Hb
к кислороду и облегчает его отдачу в
ткани.
Кооперативные
изменения конформации олигомерных
белков составляют основу механизма
регуляции функциональной активности
не только Hb,
но и большого числа других белков, в том
числе аллостерических
ферментов.
5. Изофункциональные белки
Белок,
выполняющий определенную функцию в
клетке, может быть представлен несколькими
формами — изофункциональными белками
или изобелками.
Такие белки хоть и выполняют одинаковую
функцию, но отличаются константой
связывания, что приводит к некоторым
различиям в функциональном отношении.
Например, в эритроцитах человека
обнаружено несколько форм гемоглобина:
HbA
(96%), HbF
(2%), HbA2
(2%).
Все гемоглобины представляют собой
тетрамеры, построенные из протомеров
,
,
,
(HbA
-22,
HbF
— 22,
HbA2
— 22).
Все протомеры сходны между собой по
первичной, вторичной и третичной
структурам. Все формы гемоглобинов
предназначены для переноса кислорода
в клетки тканей, но HbF,
например, имеет большее сродство к
кислороду, чем HbA.
HbF
характерен для эмбриональной стадии
развития человека. Он способен отнимать
кислород у HbA,
что обеспечивает нормальное снабжение
кислородом плода.
Изобелки
— это результат наличия более чем одного
структурного гена в генофонде вида.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Эффективность связывания кислорода с гемоглобином регулируется
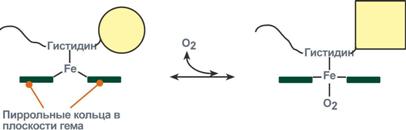
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
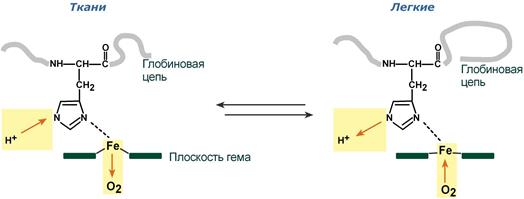
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
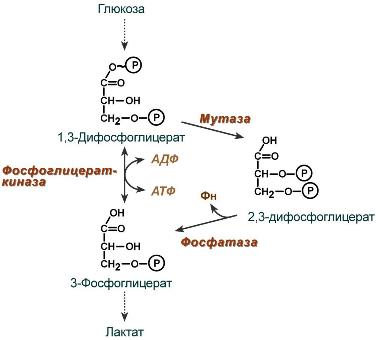
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
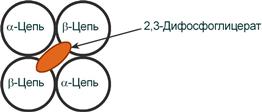
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Источник
МИОГЛОБИН
МИОГЛОБИН (myoglobinum; греч, mys, my [os] мышца + лат. globus шарик; Mgb; син.: миогемоглобин, мышечный гемоглобин) — сложный белок красного цвета, относящийся к хромопротеидам; содержится в красных мышцах животных различных классов и видов. Основной функцией М. является накопление кислорода, поступающего в процессе дыхания в мышцы из крови и отдача кислорода по мере необходимости в нем (см. Газообмен).
Факторами, определяющими различия в содержании М., являются видовая принадлежность животных (см. табл.), особенности условий их существования, образ жизни, тип мышцы, степень ее активности, а также трофические влияния нервной системы. Очень высокое содержание М. (до 16—40 г на 100 г высушенной ткани) характерно для водных животных. Значительные количества М. содержатся в красных мышцах нек-рых беспозвоночных (моллюски), в гладких мышцах мускульного желудка птиц, в гладкой мускулатуре бронхов, сосудов, стенок кишечника, а также в паренхиматозных органах, причем последние участвуют в процессах синтеза (печень), распада (селезенка) и выделения пигмента. Однако еще не доказано, что пигмент, выделенный из паренхиматозных органов, идентичен М.
Таблица. Содержание миоглобина в сердечных и скелетных мышцах человека и некоторых классов позвоночных животных (в г на 100 г высушенной ткани)
Класс животных; человек | Мышцы сердца | Скелетные мышцы |
Рыбы | 0,2—0,5 | 0, 1—0,4 |
Амфибии | 0, 1—0, 6 | 0 —0,1 |
Рептилии | 0, 8—2, 6 | 0,2—2,4 |
Птицы: | ||
домашние | 1, 0-2,0 | 0,9—1,8 |
дикие | 2,1—6, 5 | 0, 7—5, 3 |
Млекопитающие: | ||
домашние | 0, 9—4, 4 | 0,2-8, 5 |
дикие | 1,1-6,2 | 0,02—5,13 |
Человек | 1,5 | 1,4-3,9 |
В крови и моче М. в норме отсутствует. Поэтому его появление в этих биол, жидкостях является признаком заболеваний, сопряженных с деструкцией тканей (инфаркт миокарда, травматические повреждения мышц, генетически обусловленная прогрессивная мышечная дистрофия и т. д.). Определение уровня М. в плазме крови может служить критерием обширности деструкции, динамики процесса и эффективности лечебных мероприятий.
Мол. вес (масса) М. составляет в среднем 17 500, содержание железа 0,34%, Изоэлектрическая точка находится при pH 6,99. М. характеризуется большой растворимостью и высокой устойчивостью к действию щелочей.

Схематическое изображение молекулы миоглобина: цифрами отмечен каждый десятый аминокислотный остаток; светлые кружки — остатки пролина (Про), часто совпадающие с поворотом полипептидной цепи. В виде диска изображена группа гема; буквами С и N обозначены концевые участки цепи, содержащие соответственно свободные карбокси- и аминогруппы.
Изучена третичная структура М. и построена пространственная модель его молекулы (рис.). М. состоит из простого белка— глобина, представляющего собой одну полипептидную цепь, в состав к-рой входит 153 аминокислотных остатка, и простетической (небелковой) группы — гема (железопротопорфириновый комплекс, или протогем). Полипептидная цепь глобина М. на 77% представлена альфа-спиральными участками (всего 8 спиралей), к-рые перемежаются с участками неупорядоченной структуры, расположенными в области четырех изгибов полипептидной цепи. Все полярные группы, образованные лизином, аргинином, глутамином, аспарагином, гистидином, треонином, тирозином и триптофаном, находятся на поверхности и соединены с молекулами воды, а неполярные остатки сконцентрированы в центре. Поэтому молекула М. компактна и устойчива к изменениям pH и ионной силы р-ра.
По своим свойствам глобин М. близок к альбуминам. Гем М. расположен в углублении, находящемся на определенном изгибе полипептидной цепи вблизи поверхности молекулы. Это делает гем более доступным различным воздействиям. Одной координационной связью (пятой) гем соединен с гистидиновым остатком альфа-спирали, а шестая координационная связь железа гема может быть занята водой, кислородом, окисью углерода или другими соединениями. При взаимодействии с кислородом (оксигенации) в глобине молекулы М. не происходит структурных изменений. Пигмент мышц не способен соединяться с двуокисью углерода (CO2).
Доказано существование двух конформеров (А и В) нативного состояния М., к-рые отличаются по своим свойствам и структуре. Переход конформера А в конформер В протекает при повышении температуры от 20 до 40° и отражается на активности гема. Высокотемпературный конформер В является менее реакционноспособным.
М. человека и животных имеет неодинаковую форму кристаллов: тонкие, игловидные, собранные в пучки (человек), ромбические таблички (рогатый скот) и др. М. подобно гемоглобину (см.) образует различные производные, отличающиеся друг от друга по спектрам поглощения. При соединении с кислородом М. превращается в оксимиоглобин (MgbO2), в к-ром железо гема является двухвалентным. С помощью метода дифракции рентгеновских лучей показано, что оксигенация М. сопровождается пространственным смещением железа от середины порфиринового кольца по направлению к проксимальному гистидину (F-8) полипептидной цепи на 0,033 нм. В гемоглобине же оксигенация вызывает гораздо большее смещение атома железа (0,04— 0,05 нм) и изменения в четвертичной структуре всей молекулы пигмента крови.
Вдыхание животными воздуха, содержащего окись углерода в повышающихся концентрациях (0,01—0,2%), приводит не только к увеличению содержания карбоксигемоглобина в крови, но и к связыванию окиси углерода миоглобином с образованием карбоксимиоглобина (MgbCO), железо гема к-рого также находится в двухвалентном состоянии. Когда количество карбоксигемоглобина в крови достигает 60%, содержание карбоксимиоглобина в скелетных мышцах составляет 10—50%, а в мышце сердца — от 6 до 44%. MgbCO обнаружен и в мышцах людей, погибших от отравления: угарным газом. Воздействие на М. окислителей обусловливает возникновение метмиоглобина (метMgb). Превращение М. в метMgb при окислении происходит очень легко и при одинаковых условиях в 12—14 раз превышает скорость образовании метгемоглобина. В то же время в мышцах животных эта реакция после внутривенного вливания окисляющих ядов протекает более медленно, чем окисление гемоглобина.
Максимумы полос поглощения М. и его производных расположены при следующих значениях длин волн: для MgbO2 — 582, 542, 415 нм; для Mgb — 602, 560, 436 нм; для MgbCO — 585, 542, 423 нм; для метMgb — 630, 500, 409 нм. Известный другие производные пигмента: сульфмиоглобин, нитроксимиоглобин, цианмиоглобин и т. д. В реакциях сопряженного окисления М. переходит в зеленый пигмент — вердомиоглобин, а при более глубоком распаде — в желчные пигменты (см.).
Биосинтез М. происходит в мышцах со значительно меньшей скоростью по сравнению с гемоглобином. После введения животным меченого железа оно обнаруживается в гемоглобине уже спустя 6—8 дней, а в М. только через месяц. Продолжительность существования М. составляет 80 дней. В процессе эмбриогенеза М. раньше всего появляется в мышце сердца.
В мышцах позвоночных М. локализуется в саркоплазме на уровне диска А и связан электростатически с наружной мембраной митохондрий или саркоплазматического ретикулума (см. Мышечная ткань).
Создаваемый с помощью М. резерв кислорода в мышцах прежде всего определяется концентрацией в них пигмента и его способностью подвергаться оксигенации и деоксигенации. М. поддерживает постоянный уровень оксигенации во время мышечного сокращения, создавая определенный градиент напряжения кислорода между капиллярами и мышечными клетками, обеспечивая, т. о., возможность его утилизации при усилении окислительных процессов в работающих мышцах. Благодаря высокому сродству к кислороду полунасыщение им М. происходит менее чем за 0,1 сек. (при pO2 = 3,3 мм рт. ст.). При pO2, равном 5 мм рт. ст. (минимальное для деятельности цитохромоксидазы), диссоциирует до 40% оксимиоглобина, повышая, т. о., количество кислорода, растворенного в саркоплазме. М. участвует в молекулярном механизме его транспорта в клетку путем создания градиента и ускорения диффузии. Не исключена возможность непосредственного переноса кислорода М. при поступательном движении молекулы пигмента. Благодаря наличию пероксидазных свойств М. обладает ферментативной активностью. Доказана возможность включения М. в работу фосфорилирующей дыхательной цепи в качестве акцептора электронов от восстановленных коферментов пиридинового типа (НАД-H и в меньшей степени НАДФ-Н).
Существующие методы количественной оценки содержания М. включают электрофорез (см.) и ионообменную хроматографию (см.). Разделение М. и гемоглобина достигается благодаря их различной растворимости в 3 М фосфатном буфере при pH 6,6 (гемоглобин при этом значении pH нерастворим). Спектрофотометрическая регистрация количества М. основана на разнице в светопоглощении карбокси- и цианметсоединений М. и гемоглобина в видимой части спектра (см. Спектрофотометрия). Предложены также гистохимические методы определения М., основанные на бензидин-пероксидазной активности пигмента. Они позволяют с достаточной достоверностью выявлять М. в мышечной ткани и устанавливать закономерности в локализации и распределении М. в норме и их изменения при различных патол, состояниях.
Миоглобин в судебно-медицинском отношении
Миоглобин в судебно-медицинском отношении имеет значение в случаях прижизненного поражения скелетных мышц, сопровождающегося высвобождением М. При этом М. накапливается в плазме крови. При концентрации, превышающей 30 мг%, развивается миоглобинурия (см.), к-рая наряду с шоковым и коматозным состоянием, интоксикацией и пр. служит патогенетическим фактором развития миоглобинурийного нефроза (см. Нефротический синдром). Повреждение мышц, сочетающееся с обширными гематомами или внутрисосудистым гемолизом, кроме того, ведет к возникновению гемоглобинемии (см.), приводящей в последующем к миоглобинурии и миоглобинурийному нефрозу. Т. о., миоглобинемия и обусловленные ею процессы служат экспертным критерием поражения скелетной мускулатуры и доказательством его прижизненности.
Миоглобинемия может иметь место при механической травме (одномоментная травма обширных мышечных массивов, так наз. краш-синдром, или синдром раздавливания), отравлении миолитическими ядами, в т. ч. пищевыми (токсический миозит), при нарушении артериального или венозного кровообращения в конечностях (тромбоз или тромбоэмболия крупных артерий, тромбоз вен, синдром жгута, состояние после реплантации конечностей), при длительном пребывании человека в одной и той же позе (позиционное сдавление), при ожогах, обморожениях, при судорожных состояниях (эпилепсия, столбняк и т. д.).
Наличие и содержание М. в крови и моче устанавливают спектрофотометрическим способом или при помощи электрофореза. Для дифференциации пигментов в моче применяют пробу с сульфатом аммония, при к-рой в осадке мочи, содержащем миоглобиновые шлаки, на фильтре наблюдается характерное окрашивание .
Библиография: Атанасов Б. П. Модели конформеров нативного состояния миоглобина, Молек. биол., т. 4, в. 3, с. 348, 1970, библиогр. ; Верболович П. А. и Верболович В. П. Миоглобин и использование кислорода в животном организме, в кн.: Полярографическое определение кислорода в биол, объектах, под ред. В.А. Березовского, с. 123, Киев, 1974, библиогр.; Свадковский Б. С. Острый пигментный нефроз и его судебно-медицинская оценка, М., 1974, библиогр.; Троицкая О. В. Миоглобин, его химическое строение и функции в организме, Вопр, мед. хим., т. 17, в. 5, с. 451, 1971, библиогр.; Murray J. D. On the role of myoglobin in muscle respiration, J. theor. Biol., v. 47, p. 115, 1974, bibliogr.; Wittenberg J. B. Myoglobin — facilitated oxygen diffusion, role of myoglobin in oxygen entry into muscle, Physiol. Rev., v. 50, p. 559, 1970, bibliogr.
П. А. Верболович, В. П. Верболович; М. В. Кисин (суд.-мед.).
Источник