Оксигенация гемоглобина в артериальной крови
Содержание статьи
одержание кислорода в артериальной крови. Причины низкой концентрации кислорода
Содержание кислорода в артериальной крови. Причины низкой концентрации кислородаСодержание кислорода в артериальной крови ct02(a) отражает общее содержание кислорода в единице объема крови, которое зависит от следующих факторов: • концентрации гемоглобина крови; • концентрации дисгемоглобинов; • парциального давления кислорода в артериальной крови; • насыщения кислородом артериальной крови, которое, в свою очередь, зависит от р02а и сродства гемоглобина к кислороду. Рассматривая роль концентрации гемоглобина в крови, необходимо отметить, что до сих пор в большинстве клиник оценивают общую концентрацию гемоглобина (ctHb). Этот показатель включает в себя все виды гемоглобина: деоксигемоглобин, оксигемоглобин, карбоксигемоглобин, метгемоглобин и сульфгемоглобин. Гемоксиметры, позволяющие определять все вышеперечисленные фракции гемоглобина, пока еще не получили широкого распространения. В этой связи необходимо учитывать, что в определенных клинических ситуациях при повышенной концентрации дисгемоглобинов ориентироваться на ctHb необходимо с большой осторожностью. Известно, что наиболее частыми причинами высокого ctHb являются истинная полицитемия, дегидратация, хронические заболевания легких, проживание в условиях высокогорья, занятия спортом. Высокие значения ctHb приводят к увеличению вязкости крови и нарушению микроциркуляции. Вместе с тем при переливании крови и определении оптимального уровня гематокрита иногда приходится ориентироваться на исходные (до кровопотери) значения ctHb, поскольку полицитемия может носить компенсаторный характер. Причинами низкой ctHb являются кровотечение, гипергидратация, намеренная гемодилюция, гемолиз, нарушение продукции эритроцитов, множественные заборы крови для анализов (особенно у новорожденных). Снижение этого параметра сигнализирует о риске тканевой гипоксии. Поскольку основным фактором компенсации кислородного дефицита при анемии является возрастание сердечного выброса, этот риск повышен у пациентов с ишемической болезнью сердца, нарушениями сократительной способности миокарда, а также при пороках сердца, приводящих к препятствию изгнанию крови из него. Нормальные значения ctHb еще не гарантируют адекватного кислородного снабжения тканей, поэтому в условиях отделений реанимации и интенсивной терапии очень важно определять все фракции гемоглобина. Фракция оксигемоглобина артериальной крови F02Hb(a) представляет собой соотношение между концентрациями оксигемоглобина и общего гемоглобина и определяется как: F02Hb = c02Hb / (с02НЬ + cHHb + cCOHb + cMetHb).
Нормальные значения этого параметра составляют 94-99 %. На практике чаще пользуются показателем насыщения гемоглобина крови кислородом (s02), который представляет собой отношение оксигенированной фракции гемоглобина к общей фракции гемоглобина, переносящего кислород: s02 = c02Hb / (с02НЬ + сННЬ). Вместе с тем между s02 и F02Hb существует следующая зависимость: F02Hb = s02 (1 — cCOHb + cMetHb + cSHb). Это означает, что при отсутствии в крови дисгемоглобинов фракция оксигемоглобина соответствует насыщению гемоглобина крови кислородом. В случае повышения концентрации в крови какой-либо из аномальных форм гемоглобина между этими показателями могут быть существенные различия. Последнее иллюстрирует пример с повышением фракции карбоксигемоглобина: ctHb = 10; сННb = 0,2; сСОНb = 3; с02Нb = 6,8; F02Hb = 6,8 / (6,8 + 0,2 + 3) х 100 = 68 %; s02 = 6,8 / (6,8 + 0,2) х 100 = 97 %. Таким образом, присутствие повышенной фракции карбоксигемоглобина в данном случае дает разницу между сравниваемыми параметрами в 31 %. Поскольку данное патологическое состояние, т. е. карбоксигемоглобинемия, не является редкостью, особенно при лечении пациентов с травмой и кровопотерей, поступающих из районов стихийных бедствий, пожаров, взрывов и т. д., определение F02Hb имеет для них чрезвычайно важное значение. Сказанное выше верно и при использовании пульсоксиметрии, поскольку насыщение крови кислородом, определяемое с помощью пульсоксиметра, соответствует s02. Строго говоря, данные пульсоксиметра могут быть ниже F02Hb при спазме периферических сосудов и нарушениях микроциркуляции и выше этого показателя при высоких фракциях аномальных форм гемоглобина. Это также означает, что проведение мониторинга функции дыхания на основе одной пульсоксиметрии может давать ложные результаты, и в этих случаях необходимо делать поправку на ctHb. Фракция карбоксигемоглобина определяется как отношение концентраций карбоксигемоглобина и общего гемоглобина: FCOHb = cCOHb / ctHb. Нормальные значения этого показателя у взрослых составляют от 0 до 2 %. У злостных курильщиков FCOHb может достигать 10-12 %. Окись углерода обратимо связывается с ионами железа тема, однако сродство гемоглобина к СО в 200-250 раз выше, чем к кислороду. Кроме того, карбоксигемоглобин приводит к смещению кривой диссоциации оксигемоглобина влево. Это означает, что при отравлениях СО наряду с уменьшением кислородной емкости крови затруднена отдача кислорода в тканях. При острых отравлениях окисью углерода, когда FCOHb превышает 30 %, отмечаются сильные головные боли, общая слабость, рвота, одышка и тахикардия, а при уровне более 50 % — судороги, кома, летальный исход. Лечение заключается в использовании вентиляции 100 %-ным кислородом, гипербарической оксигенации, заменном переливании крови или синтетических кислородлереносящих кровезаменителей (перфторуглеродов). Фракция метгемоглобина определяется как отношение концентраций метгемоглобина и общего гемоглобина: FMetHb = cMetHb / ctHb. Нормальные значения этого показателя у взрослых составляют от 0,2 до 0,6 %. Метгемоглобин образуется в результате окисления в геме двухвалентного железа в трехвалентное. Метгемоглобин неспособен переносить кислород. Кроме того, он затрудняет освобождение кислорода вследствие смещения КДО влево. Большинство случаев метгемоглобинемии обусловлены отравлением веществами, содержащими нитро- и аминогруппы. При уровне FMetHb выше 10-15 % развивается псевдоцианоз, при значениях, превышающих 30 %, появляются головная боль и одышка, а метгемоглобинемия более 70 % может привести к летальному исходу. Лечение метгемоглобинемии заключается во внутривенном введении метиленового синего и переливании эритроцитарной массы. — Вернуться в оглавление раздела «Неотложная хирургия.» Оглавление темы «Нарушения гомеостаза во время операции и в послеоперационном периоде»: 1. Сочетания нарушений кислотно-основного состояния. Кислородный статус организма 2. Лактат как показатель. Нарушения транспорта кислорода 3. Транспорт кислорода при централизации кровообращения. Метаболический ацидоз во время операции 4. Метаболический алкалоз во время операции. Респираторные нарушения после операции 5. Калий и кислотно-основное равновесие крови. Гиперкалиемия 6. Гиперкалиемия. Примеры послеоперационных нарушений гомеостаза 7. Нарушения гомеостаза в абдоминальной хирургии. Ошибки интерпретации данных и корригирующей терапии 8. Приборы для определения кислотно-основного равновесия крови. Приборы для оценки гомеостаза у пациента 9. Кислородный статус организма. Поступление кислорода 10. Содержание кислорода в артериальной крови. Причины низкой концентрации кислорода |
Источник
ранспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
Оглавление темы «Вентиляция легких. Перфузия легких кровью.»:
1. Вентиляция легких. Вентиляция кровью легких. Физиологическое мертвое пространство. Альвеолярная вентиляция.
2. Перфузия легких кровью. Влияние гравитации на вентиляцию легких. Влияние гравитации на перфузию легких кровью.
3. Коэффициент вентиляционно-перфузионных отношений в легких. Газообмен в легких.
4. Состав альвеолярного воздуха. Газовый состав альвеолярного воздуха.
5. Напряжение газов в крови капилляров легких. Скорость диффузии кислорода и углекислого газа в легких. Уравнение Фика.
6. Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
7. Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.
8. Углекислый газ. Транспорт углекислого газа.
9. Роль эритроцитов в транспорте углекислого газа. Эффект Холдена..
10. Регуляция дыхания. Регуляция вентиляции легких.
Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
Кровообращение выполняет одну из важнейших функций переноса кислорода от легких к тканям, а углекислого газа — от тканей к легким. Потребление кислорода клетками тканей может изменяться в значительных пределах, например при переходе от состояния покоя к физической нагрузке и наоборот. В связи с этим кровь должна обладать большими резервами, необходимыми для увеличения ее способности переносить кислород от легких к тканям, а углекислый газ в обратном направлении.
Транспорт кислорода.
При 37 С растворимость 02 в жидкости составляет 0,225 мл • л-1 • кПа-1 (0,03 мл/л/мм рт. ст.). В условиях нормального парциального давления кислорода в альвеолярном воздухе, т. е. 13,3 кПа или 100 мм рт.ст., 1 л плазмы крови может переносить только 3 мл 02, что недостаточно для жизнедеятельности организма в целом. В покое в организме человека за минуту потребляется примерно 250 мл кислорода. Чтобы тканям получить такое количество кислорода в физически растворенном состоянии, сердце должно перекачивать за минуту огромное количество крови. В эволюции живых существ проблема транспорта кислорода была более эффективно решена за счет обратимой химической реакции с гемоглобином эритроцитов. Кислород переносится кровью от легких к тканям организма молекулами гемоглобина, которые содержатся в эритроцитах.
Гемоглобин способен захватывать кислород из альвеолярного воздуха (соединение называется ок-сигемоглобином) и освобождать необходимое количество кислорода в тканях. Особенностью химической реакции кислорода с гемоглобином является то, что количество связанного кислорода ограничено количеством молекул гемоглобина в эритроцитах крови. Молекула гемоглобина имеет 4 места связывания с кислородом, которые взаимодействуют таким образом, что зависимость между парциальным давлением кислорода и количеством переносимого кислорода с кровью имеет S-образную форму, которая носит название кривой насыщения или диссоциации оксигемоглобина (рис. 10.18). При парциальном давлении кислорода 10 мм рт. ст. насыщение гемоглобина кислородом составляет примерно 10 %, а при Р02 30 мм рт. ст. — 50-60 %. При дальнейшем увеличении парциального давления кислорода от 40 мм рт. ст. до 60 мм рт. ст. происходит уменьшение крутизны кривой диссоциации оксигемоглобина и процент его насыщения кислородом возрастает в диапазоне от 70-75 до 90 % соответственно. Затем кривая диссоциации оксигемоглобина начинает занимать практически горизонтальное положение, поскольку увеличение парциального давления кислорода с 60 до 80 мм рт. ст. вызывает прирост насыщения гемоглобина кислородом на 6 %. В диапазоне от 80 до 100 мм рт. ст. процент образования оксигемоглобина составляет порядка 2. В результате кривая диссоциации оксигемоглобина переходит в горизонтальную линию и процент насыщения гемоглобина кислородом достигает предела, т. е. 100. Насыщение гемоглобина кислородом под влиянием Р02 характеризует своеобразный молекулярный «аппетит» этого соединения к кислороду.
Значительная крутизна кривой насыщения гемоглобина кислородом в диапазоне парциального давления от 20 до 40 мм рт. ст. способствует тому, что в ткани организма значительное количество кислорода может диффундировать из крови в условиях фадиента его парциального давления между кровью и клетками тканей (не менее 20 мм рт. ст.). Незначительный процент насыщения гемоглобина кислородом в диапазоне его парциального давления от 80 до 100 мм рт. ст. способствует тому, что человек без риска снижения насыщения артериальной крови кислородом может перемещаться в диапазоне высот над уровнем моря до 2000 м.
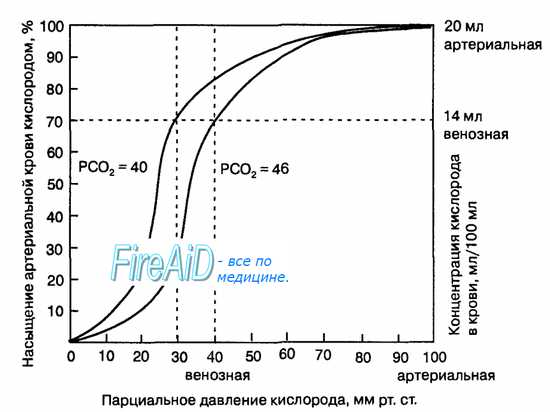 Рис. 10.18. Кривая диссоциации оксигемоглобина. Пределы колебания кривой при РС02 = 40 мм рт. ст. (артериальная кровь) и РС02 = 46 мм рт. ст. (венозная кровь) показывают изменение сродства гемоглобина к кислороду (эффект Ходена).
Рис. 10.18. Кривая диссоциации оксигемоглобина. Пределы колебания кривой при РС02 = 40 мм рт. ст. (артериальная кровь) и РС02 = 46 мм рт. ст. (венозная кровь) показывают изменение сродства гемоглобина к кислороду (эффект Ходена).
Общие запасы кислорода в организме обусловлены его количеством, находящимся в связанном состоянии с ионами Fe2+ в составе органических молекул гемоглобина эритроцитов и миоглобина мышечных клеток.
Один грамм гемоглобина связывает 1,34 мл 02. Поэтому в норме при концентрации гемоглобина 150 г/л каждые 100 мл крови могут переносить 20,0 мл 02.
Количество 02, которое может связаться с гемоглобином эритроцитов крови при насыщении 100 % его количества, называется кислородной емкостью гемоглобина. Другим показателем дыхательной функции крови является содержание 02 в крови (кислородная емкость крови), которое отражает его истинное количество, как связанного с гемоглобином, так и физически растворенного в плазме. Поскольку в норме артериальная кровь насыщена кислородом на 97 %, то в 100 мл артериальной крови содержится примерно 19,4 мл 02.
Видео физиология газообмена в легких и транспорта газов кровью — профессор, д.м.н. П.Е. Умрюхин
— Также рекомендуем «Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.»
Источник
родство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.
| Оглавление темы «Вентиляция легких. Перфузия легких кровью.»: 1. Вентиляция легких. Вентиляция кровью легких. Физиологическое мертвое пространство. Альвеолярная вентиляция. 2. Перфузия легких кровью. Влияние гравитации на вентиляцию легких. Влияние гравитации на перфузию легких кровью. 3. Коэффициент вентиляционно-перфузионных отношений в легких. Газообмен в легких. 4. Состав альвеолярного воздуха. Газовый состав альвеолярного воздуха. 5. Напряжение газов в крови капилляров легких. Скорость диффузии кислорода и углекислого газа в легких. Уравнение Фика. 6. Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина. 7. Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора. 8. Углекислый газ. Транспорт углекислого газа. 9. Роль эритроцитов в транспорте углекислого газа. Эффект Холдена.. 10. Регуляция дыхания. Регуляция вентиляции легких. Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. Видео физиология газообмена в легких и транспорта газов кровью — профессор, д.м.н. П.Е. Умрюхин— Также рекомендуем «Углекислый газ. Транспорт углекислого газа.» |
Источник


