Особенности строения гемоглобина и миоглобина
Содержание статьи
Структура и функции сложных белков. Строение и функции миоглобина и гемоглобина.
Тема: «СТРОЕНИЕ И ФУНКЦИИ СЛОЖНЫХ БЕЛКОВ. СТРУКТУРА И ФУНКЦИИ МИОГЛОБИНА И ГЕМОГЛОБИНА»
1. Определение понятия и основные принципы классификации сложных белков. Примеры.
2. Гликопротеины: особенности строения, примеры, функции. Иммуноглобулины: особенности строения, классы иммуноглобулинов, их роль в организме.
3. Фосфопротеины: представители, связывание простетической группы с апопротеином, роль в организме.
4. Металлопротеины: представители, характер простетической группы, ее связывание с апопротеином, роль металлопротеинов в организме.
5. Строение и функции хромопротеинов (на примере миоглобина и гемоглобина). Аллостерические свойства гемоглобина. Кооперативный эффект. Роль СО2, водородных ионов и 2,3-дифосфоглицерата в регуляции сродства гемоглобина к кислороду.
6. Производные гемоглобина (дезоксигемоглобин, оксигемоглобин, карбгемоглобин, карбоксигемоглобин, метгемоглобин, цианметгемоглобин), их характеристика. Причины и последствия накопления метгемоглобина в крови.
7. Молекулярные формы гемоглобина. Фетальный гемоглобин, особенности структуры, свойства, биологическая роль. Серповидно-клеточный гемоглобин (HbS), особенности структуры, свойства, проявления гемоглобиноза S.
| Раздел 3.1 | Понятие о простых и сложных белках. Классификация сложных белков. | |||||||||||||||||||||
3.1.1. Запомните, что белки можно разделить на простые и сложные. Простые белки — белки, которые состоят только из аминокислотных остатков. Сложные белки (холопротеины) — белки, которые состоят из аминокислотных остатков и компонентов небелковой природы. Белковая часть сложного белка получила название апопротеин, небелковая часть сложного белка — простетическая группа. 3.1.2. Сложные белки классифицируют в зависимости от химического строения их простетических групп. Выучите названия классов сложных белков, их простетических групп и примеры представителей различных классов сложных белков (таблица 3.1) . Таблица 3.1 Классификация сложных белков
В этом разделе мы более подробно коснёмся строения и свойств хромопротеинов и нуклеопротеинов. Характеристика белков — представителей других классов будет рассмотрена позднее. | ||||||||||||||||||||||
| Раздел 3.2 | Особенности строения и биологическая роль липопротеинов, нуклеопротеинов, фосфопротеинов, металлопротеинов. |
3.2.1. Липопротеины — сложные белки, содержащие в качестве простетической группы липиды и их производные. Представителями служат хиломикроны и другие фракции липопротеинов крови. Липопротеины являются транспортными формами липидов в крови. Более подробно этот класс сложных белков рассматривается в разделе «Обмен липидов». 3.2.2. Нуклеопротеины — сложные белки, содержащие в качестве простетической группы нуклеиновые кислоты. Нуклеопротеинами являются вирусы, рибосомы, хроматин клеточного ядра. Существуют две разновидности нуклеопротеинов: 1) рибонуклеопротеины, в состав которых входит рибонуклеиновая кислота (РНК); 2) дезоксирибонуклеопротеины, в состав которых входит дезоксирибонуклеиновая кислота (ДНК). Строение и свойства нуклеиновых кислот будут рассматриваться позднее. Особенность белковой части нуклеопротеинов заключается в том, что в её состав входит много положительно заряженных аминокислотных остатков. Так, в состав дезоксирибонуклеопротеинов входят белки гистоны, богатые лизином и аргинином. Между белковыми и небелковыми компонентами нуклеопротеинов образуются ионные связи (так как нуклеиновые кислоты заряжены отрицательно). 3.2.3. Фосфопротеины содержат в своём составе остатки фосфорной кислоты, соединённые с остатками гидроксиаминокислот (серин, треонин) при помощи сложноэфирных связей. К этой группе сложных белков относятся казеиноген молока, яичные белки овальбумин и вителлин. Многие внутриклеточные белки являются фосфопротеинами. Присоединение фосфатной группы к белку часто вызывает изменение его функции. Фосфорилирование и обратный процесс — дефосфорилирование — распространенный механизм регуляции биологической активности белков. Например, фосфорилирование гистонов снижает их способность связываться с ДНК и участвовать в регуляции матричных синтезов с участием ДНК. 3.2.4. Металлопротеины. Если в белке содержатся ионы одного или нескольких металлов, то такие белки называются металлопротеинами. Ионы металлов соединены координационными связями с функциональными группами белка и участвуют в поддержании его пространственной структуры. Металлопротеины часто являются ферментами. Трансферрин — водорастворимый железопротеин, содержащийся в сыворотке крови в составе β-глобулинов. Молекула трансферрина содержит 2 иона Fe3+; этот белок служит переносчиком железа в организме. Ферритин — внутриклеточный глобулярный белок, содержится главным образом в селезенке, печени, костном мозге, выполняя роль депо железа в организме. Благодаря ферритину цитозольные запасы железа поддерживаются в растворимой и нетоксичной форме. Гемосидерин, в отличие от ферритина и трансферрина, является водонерастворимым железосодержащим белковым комплексом. Он содержится главным образом в клетках печени и селезенки, накапливается при избытке железа в организме, например, при частых переливаниях крови. Церулоплазмин — белок α2-глобулиновой фракции сыворотки крови, его молекула содержит 6 — 8 ионов меди. Обладает каталитической активностью, катализирует реакцию окисления Fe2+ в Fe3+. Это делает возможным связывание железа с трансферрином и его последующий транспорт в крови. | |
| Раздел 3.3 | Строение и функции гликопротеинов. Иммуноглобулины. |
3.3.1. Гликопротеины — содержат в качестве простетической группы углеводы и их производные. Они присоединяются либо N-гликозидной связью к амидогруппе остатка аспарагина, либо О-гликозидной связью к гидроксигруппе остатка серина или треонина. Углеводная часть имеет нерегулярное строение. Гликопротеины выполняют в организме следующие функции: структурную (коллаген, эластин), защитную (антитела, интерфероны), рецепторную, гормональную (гормоны гипофиза), ферментативную, транспортную. 3.3.2. Иммуноглобулины (антитела) — группа белков, вырабатываемых организмом в ответ на попадание в организм чужеродных структур (антигенов). Они синтезируются В-лимфоцитами или плазматическими клетками. В организме может вырабатываться порядка 107 разновидностей иммуноглобулинов, каждый из которых может распознавать определённый антиген. Все иммуноглобулины подразделяют на пять классов: IgA, IgG, IgM, IgD, IgE. Основную структурную единицу иммуноглобулинов, или мономер, образуют четыре полипептидные цепи, соединённые между собой дисульфидными связями, из них: а) две идентичные тяжёлые цепи (молекулярная масса 53000 — 75000 Да), обозначаемые буквами Н; б) две идентичные лёгкие цепи (молекулярная масса около 23000 Да), обозначаемые буквами L. Иммуноглобулины G, D и Е по своей структуре, как правило, являются мономерами, молекулы IgM построены из пяти мономеров, IgA могут быть как мономерами, так и состоять из двух и более структурных единиц. Белковые цепи, входящие в состав иммуноглобулинов, можно условно разделить на специфические домены, или области, имеющие определённые структурные и функциональные особенности. N-концевые участки как L-, так и Н-цепей называются вариабельной областью (V), так как их структура характеризуется существенными различиями у разных классов антител. Внутри вариабельного домена имеются 3 гипервариабельных участка, отличающихся наибольшим разнообразием аминокислотной последовательности. Именно вариабельная область антител ответственна за связывание антигенов по принципу комплементарности; первичная структура белковых цепей в этой области определяет специфичность антител. | |
С-концевые домены Н- и L-цепей обладают относительно постоянной первичной структурой в пределах каждого класса антител и называются константной областью (С). Константная область определяет свойства различных классов иммуноглобулинов, их распределение в организме, может принимать участие в запуске механизмов, вызывающих уничтожение антигенов.
3.3.3. Функции иммуноглобулинов. IgG составляют около 75% общего количества иммуноглобулинов плазмы крови. IgG эффективно связывают и инактивируют чужеродные молекулы и клетки, попавшие в организм, а также облегчают их дальнейшее уничтожение, способны преодолевать плацентарный барьер, что обеспечивает иммунитет новорождённых в течение первых недель жизни.
IgA содержатся главным образом в секретах слизистых оболочек дыхательных и выделительных путей, желудочно-кишечного тракта, т.е. обеспечивают защиту поверхностей, сообщающихся с внешней средой.
IgM синтезируются на ранних стадиях иммунного ответа, вступают в реакцию агглютинации с антигенами, активируют систему комплемента.
IgD связаны с мембраной лимфоцитов, функционируют в качестве рецепторов для антигенов.
IgE участвуют в развитии аллергических реакций, в защите от паразитарных инвазий.
| Раздел 3.4 | Миоглобин и гемоглобин: сходство и различия структуры и функции. |
| 3.4.1. Среди хромопротеинов различают гемопротеины (содержат в качестве простетической группы порфириновые производные) и флавопротеины (содержат производные рибофлавина — витамина B2). Хромопротеины участвуют в осуществлении многих жизненно важных функций, таких как тканевое дыхание, перенос кислорода, окислительно-восстановительные реакции, светоощущение, фотосинтез в растительных клетках и другие процессы. 3.4.2. К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем.
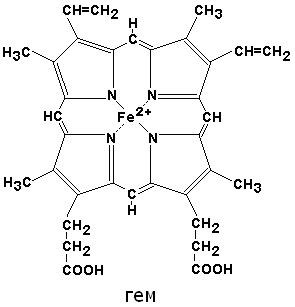
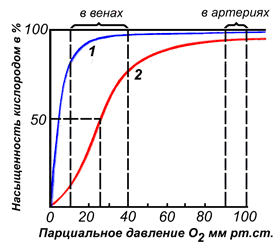
По своему химическому строению гем представляет собой протопорфирин IX, связанный с двухвалентным железом. Протопорфирин IX — органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН-. Заместителями в пиррольных кольцах являются: четыре метильные группы СН3-, две винильные группы СН2=СН- и два остатка пропионовой кислоты — СН2-СН2-СООН. Гем соединяется с белковой частью следующим образом. Неполярные группы . протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов. Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет). 3.4.3. Сравните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков. Миоглобин — хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами (см. 2.4.), кривая насыщения его кислородом имеет вид гиперболы (рисунок 4). Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода. Гемоглобин (Hb) — хромопротеин, присутствующий в эритроцитах и участвующий в транспорте кислорода к тканям. Гемоглобин взрослых людей называется гемоглобином А (Hb A). Молекулярная масса его составляет около 65000 Да. Молекула Hb А имеет четвертичную структуру и включает четыре субъединицы — полипептидные цепи (обозначаемые α1, α2, β1 и β2, каждая из которых связана с гемом. Запомните, что гемоглобин относится к аллостерическим белкам, его молекулы могут обратимо переходить из одной конформации в другую. При этом изменяется сродство белка к лигандам. Конформация, обладающая наименьшим сродством к лиганду, называется напряжённой, или Т-конформацией. Конформация, обладающая наибольшим сродством к лиганду, называется релаксированной, или R-конформацией. R- и Т-конформации молекулы гемоглобина находятся в состоянии динамического равновесия: Различные факторы среды могут сдвигать это равновесие в ту или иную сторону. Аллостерическими регуляторами, влияющими на сродство Hb к O2, являются: 1) кислород; 2) концентрация Н+ (рН среды); 3) углекислота (СO2) ; 4) 2,3-дифосфоглицерат (ДФГ) . Присоединение молекулы кислорода к одной из субъединиц гемоглобина способствует переходу напряжённой конформации в релаксированную и повышает сродство к кислороду других субъединиц той же молекулы гемоглобина. Это явление получило название кооперативного эффекта. Сложный характер связывания гемоглобина с кислородом отражает кривая насыщения гемоглобина O2, имеющая S-образную форму (рисунок 3.1). Повышение содержания СO2, Н+, ДФГ на фоне низкого парциального давления O2 в тканях способствует взаимодействию этих факторов с гемоглобином и переходу R-конформации в Т-конформацию. Это приводит к смещению равновесия в уравнении (1) вправо. Выделившийся O2 поступает в ткани.
Рисунок 3.1. Кривые насыщения миоглобина (1) и гемоглобина (2) кислородом. | |
| Раздел 3.5 | Производные гемоглобина. Молекулярные формы гемоглобина: отличия HbF и HbS от HbA. |
3.5.1. Следует различать производные гемоглобина и его молекулярные формы. К производным гемоглобина относятся продукты взаимодействия гемоглобина (дезоксигемоглобина) с различными лигандами. Это взаимодействие, как правило, носит обратимый характер. Производные гемоглобина, представляющие наибольший интерес для медицины, перечислены в таблице 3.2. Запомните, что метгемоглобин (MetHb), в отличие от гемоглобина, теряет способность связывать и транспортировать кислород. Следовательно, попадание в организм больших количеств веществ, вызывающих образование метгемоглобина (нитриты, нитраты, анилин, нитробензол, некоторые лекарства), может привести к гипоксии (кислородному голоданию) тканей и смерти. В то же время метгемоглобин может легко связывать ионы CN-, нейтрализуя их токсическое действие. В результате образуется цианметгемоглобин. 3.5.2. Молекулярные формы гемоглобина отличаются друг от друга строением полипептидных цепей. Примером такой разновидности гемоглобина, существующей в физиологических условиях, является фетальный гемоглобин (HbF), присутствующий в крови в эмбриональной стадии развития человека. В отличие от HbA, его молекула содержит 2 α- и 2 γ-цепи (то есть β-цепи заменены на γ-цепи). Такой гемоглобин обладает более высоким сродством к кислороду. Именно это позволяет эмбриону получать кислород из крови матери через плаценту. Вскоре после рождения HbF в крови ребёнка замещается на HbA. В качестве примера аномального или патологического гемоглобина можно привести уже упоминавшийся (см. 2.4.) гемоглобин S, обнаруженный у больных серповидно-клеточной анемией. Как вам уже известно, он отличается от гемоглобина А заменой в β-цепях глутамата на валин. Эта аминокислотная замена вызывает снижение растворимости HbS в воде и уменьшение его сродства к O2. | |
Таблица 3.2
Производные гемоглобина
| Критерий | Дезоксигемоглобин | Оксигемоглобин | Карбгемоглобин | Карбоксигемоглобин | Метгемоглобин | Цианметгемоглобин |
|---|---|---|---|---|---|---|
| Лиганд | — | O2 | СО2 | СО | ОН- | CN- |
| Валентность железа | II | II | II | II | III | III |
| Место присоединения лиганда | — | Fe2+ | NH2- группы глобина | Fe2+ | Fe3+ | Fe3+ |
| Механизм образования | — | Hb + O2 « HbO2 | Hb-NH2 + CO2 « Hb-NH-COOH | HbО2 + CO « HbCO + O2 | Hb + O2 + OН- « MetHb(OH) + O2- | MetHb(OH) + CN- « MetHb(CN) + OH- |
| Сродство к O2 | низкое | высокое | низкое | очень низкое | отсутствует | отсутствует |
| Присутствие в крови в норме | присутствует | присутствует | присутствует | отсутствует | отсутствует | отсутствует |
| Примеры | Обучающие задачи и эталоны их решения |
3.5.1. Задачи.1. В гидролизате сложного белка обнаружена фосфорная кислота. Можно ли с достаточной уверенностью сказать, к какому классу относится изучаемый белок? 2. Сравните растворимость простетической группы гемоглобина в воде и органических растворителях. 3. У альпиниста через 2 дня после подъёма на высоту 4000 м над уровнем моря содержание 2,3-дифосфоглицерата в эритроцитах составляет 6,5 ммоль/л (в норме — 4,5 ммоль/л) . Как это отразится на сродстве гемоглобина к кислороду? Какое значение для организма имеет такое изменение? 3.5.2. Эталоны решения.1. Как видно из таблицы 3.1, фосфорная кислота является простетической группой белков класса фосфопротеинов. Известно также, что фосфат входит в состав нуклеиновых кислот, которые могут выступать в качестве простетической группы нуклеопротеинов. Поэтому фосфорная кислота может быть обнаружена в гидролизате как фосфопротеина, так и нуклеопротеина. Для уточнения класса гидролизованного белка нужно провести с гидролизатом качественные реакции на азотистые основания и пентозы (см. 3.1.). 2. Растворимость вещества в воде или органических растворителях зависит от того, какие функциональные группы преобладают в молекуле. Простетическая группа гемоглобина — гем — содержит только две полярные группировки (две карбоксильные группы), остальная часть молекулы неполярна (равномерное распределение электронной плотности). Поэтому гем хорошо растворяется в органических растворителях и не растворяется в воде (см. 3.2.). 3. 2, 3-Дифосфоглицерат (ДФГ) является аллостерическим регулятором, понижающим сродство гемоглобина к кислороду. Поэтому при увеличении содержания ДФГ в эритроцитах равновесие в уравнении диссоциации HbO2 смещается вправо. Увеличение отдачи кислорода оксигемоглобином имеет компенсаторное значение для организма, так как восполняет недостаточное поступление кислорода из атмосферы (см. 3.2.). | |
Источник
Строение и функции гемоглобина и миоглобина человека
Краткосрочный план
Раздел долгосрочного плана:
Раздел 4 Транспорт веществ.
Дата:
ФИО преподавателя Снегирева Марина Васильевна
Группа: Ис-11
Количество присутствующих:
отсутствующих:
Тема урока
Строение и функции гемоглобина и миоглобина человека.
Цели обучения
1)Систематизировать разные типы транспорта веществ.
2) Объяснять механизм разных типов транспорта веществ.
Цели урока
Все учащиеся к концу урока смогут: Выделять отличия в строении гемоглобина и миоглобина.
Большинство учащихся к концу урока смогут: Объяснять функции миоглобина и миоглобина при транспорте веществ. Характеризовать формы гемоглобина по их структуре и функциям.
Некоторые учащиеся к концу урока смогут: Представлять аргументы о возникновении «неполадок» в функционировании гемоглобина и объяснять возникновение заболеваний человека.
Критерии
оценивания
Характеризует молекулы гемоглобина и миоглобина по их строению и функциям.
Межпредметные связи
Химия (окислительно-восстановительные реакции), физика (диффузия)
Медицина.
Навыки ИКТ
Использовать ресурс https://www.youtube.com/watch?v=iJG6x618L3M https://www.youtube.com/watch?v=fhEVifdSMBk
при изучении новой темы, конструктор тестов Online Test Pad при закреплении нового материала
Ход урока
Запланированные этапы урока
Запланированная деятельность на уроке
Ресурсы
Начало урока
3 минута
3 минуты
4 минуты
Организационный момент:
Приветствие
Проверка отсутствующих
Объединение в группы, используя онлайн деление (по ссылке)
Вызов: Мозговая атака
Каким образом кислород может попасть из легких в клетки мышечной ткани?
Подвести учащихся к теме урока.
Предположительный ответ учащихся:
Кислород разносит кровь. Для этого кислород должен удерживаться в крови в форменных элементах, чтобы транспортироваться в мышцы, а не уходить диффузно.
При этом должны использоваться какие-то молекулы. Озвучить тему урока.
Целеполагание: Какие цели урока должны быть достигнуты? (Обратная связь с учителем).
Совместная формулировка целей урока
https://castlots.org/razdelit-na-gruppy/
Середина урока
7 минут
3 минут
5 минут
5 минут
10 минут
10 минут
5 минут
5 минут
10 минут
Изучение нового материла
Объединение в группы, используя онлайн деление (по ссылке). Для работы над каждым заданием будет меняться состав участников группы.
Изучить материал видеоролика о строение и функции гемоглобина и миоглобина человека.
(временной отрезок с 0.00 до 5 минут).
Задание №1
Используя материал видеофрагмента, запишите термины «гемоглобин» и «миоглобин» в рабочих тетрадях.
Опишите строение молекулы гемоглобина и миоглобина.
Корзина идей». В тетради можно нарисовать корзинку, где условно собирается все, что студенты знают по данной проблеме; спикер группы в виде тезисов записывает в «корзинке» все высказывания и идеи, включая ошибочные; по мере освоения новой информации исправляются ошибки, вносятся необходимые дополнения.
Изучить структуру гемоглобина
Задание №2
Составить ментальную (интеллект) карту «Структура гемоглобина» в онлайн сервисе для создания ментальных карт MindMeister
Изучить структуру миоглобина
Задание №3
Составить ментальную (интеллект) карту «Структура миоглобина» в онлайн сервисе для создания ментальных карт MindMeister
Сравнить структуру молекул гемоглобина и миглобина.
Задание №4
Заполнить таблицу «Сходства и различия молекул гемоглобина и миоглобина». Сравнить структуру молекул гемоглобина и миоглобина.
(пример заполнения)
пп
Показатель
Гемоглобин
Миоглобин
1
Высшая структура
третичная
четвертичная
2
Число полипептидных цепей
1
4
3
белок
Сложный
сложный
4
Простетическая группа
1 ГЕМ
4 ГЕМа
5
Общая структура
1 Мb +1
2 α — глобин
2 β — глобин
4 ГЕМа
Итог:
Сложный неолигомерный белок
Сложный олигомерный доменный белок
Рассмотреть формы гемоглобина.
Задание №5
Характеризовать формы гемоглобина по их строению и функциям.
Обьяснить реакцию оксигенации, используя понятия: гемоглобин, оксигемоглобин, карбоксигемоглобин.
Реакцию оксигенации можно разделить на четыре стадии:
Нb + О2Û HbO2
НbО2 + О2Û Hb(O2)2
Hb(O2)2 + О2Û Hb(O2)3
Hb(O2)3 + О2Û Hb(O2)4
Рассмотреть функцию миоглобина..
Задание №6
Характеризовать молекулу миоглобина по ее структуре и функциям. Объяснить газообмен в мышечной ткани.
Рассмотреть кривую оксигенации миоглобина (а) и гемоглобина (б)
Задание №7
Обьяснить почему без кислорода молекулы гемоглобина обладают низким сродством к кислороду, затем кривая становится круче и при высоких значениях рО2 практически сливается с кривой диссоциации миоглобина.
Вывод:
Метод «SWOT» анализ
SWOT» анализ
Сильные стороны
1. Четвертичная структура гемоглобина.
2.Присоединение молекул кислорода происходит по кооперативному эффекту и отсоединение кислорода происходит по кооперативному эффекту.
Слабые стороны
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода
Возможности
2,3 -дифосфоглицериновая кислота облегчает присоединение кислорода у организмов, обитающих в высокогорных районах
Угрозы
Гемоглобин- высокотоксичное вещество.
Гемоглобин -один из основных белков, которым питается малярийный плазмодий.
Анемия.
Какое строение имеют молекулы гемоглобина и миоглобина?
Чем отличаются молекулы гемоглобина и миоглобина?
Какую функцию выполняет гемоглобин и миоглобин ?
В чем заключается возможность переноса кислорода из легких в ткани?
Критерии оценивания: Характеризует молекулы гемоглобина и миоглобина по их строению и функциям.
Дескрипторы:
Определил в тексте строение гемоглобина и миоглобина.
Сравнил строение молекул гемоглобина и миоглобина.
Объяснил «метод переноса кислорода» от гемоглобина миоглобину
Характеризует молекулы гемоглобина и миоглобина по их строению и функциям.
Демонстрация итогов работы в группе:
Каждая группа представляет и резюмирует итоги работы группы
https://castlots.org/razdelit-na-gruppy/
https://www.youtube.com/watch?v=fhEVifdSMBk
Конец урока
5 минут
3 минуты
2 минуты
Закрепление нового материала
(И) Пройти тестирование по изученной теме на образовательной платформе Google Сlassroom
Рефлексия «Cветофор»
У каждого ученика имеются карточки трех цветов светофора. Учитель просит учащихся показывать карточками сигналы, обозначающие их понимание или непонимание материала, затем он просит учащихся ответить на вопросы:
К учащимся, которые подняли зеленые карточки (все поняли):
— Что вы поняли?
К учащимся, поднявшим желтые или красные карточки:
— Что вам не понятно?
По итогам полученных ответов учитель принимает решение о повторном изучении, закреплении темы или продолжении изучения материала по программе.
Домашнее задание:
* Проанализируйте, почему в результате длительного вдыхания угарного газа наступает смерть?
* Подготовить материал о заболеваниях человека, связанных с гемоглобином.
** Какое отношение к теме урока имеет возникновение симптома — одышка у короновирусного больного?
*** Правильно ли утверждение? Малокровие возникает только тогда, когда человек потерял много крови.
https://onlinetestpad.com/hpgizm52llkoy
Подсчитать количество зеленых, желтых и красных карточек. На следующих уроках стремиться к увеличению зеленых карточек.
(для домашнего чтения)
Источник