Полипептидные цепи молекуле гемоглобина уложены
Содержание статьи
Гемоглобин состоит из четырех полипептидных цепей — ПЕРЕНОСЧИКИ КИСЛОРОДА МИОГЛОБИН И ГЕМОГЛОБИН — КОНФОРМАЦИЯ И ДИНАМИКА — БИОХИМИЯ ТОМ 1- Л. Страйер
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 3. ПЕРЕНОСЧИКИ КИСЛОРОДА—МИОГЛОБИН И ГЕМОГЛОБИН
3.11. Гемоглобин состоит из четырех полипептидных цепей
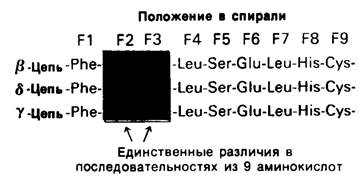
Обратимся теперь к гемоглобину-белку, родственному миоглобину. Если миоглобин состоит из одной полипептидной цепи, то гемоглобин-из четырех. Эти четыре цепи удерживаются вместе нековалентными связями. Каждая цепь содержит один гем, и, таким образом, в молекуле гемоглобина имеются четыре участка связывания кислорода. Гемоглобин А-основной гемоглобин взрослого организма-состоит из двух цепей одного типа, называемых а-цепи, и двух цепей другого типа, называемых β-цепи. В целом субъединичная структура гемоглобина А описывается формулой α2β2. У взрослых есть, кроме того, минорный гемоглобин А2, на долю которого приходится примерно 2% общего количества гемоглобина; субъединичная структура этого гемоглобина α2δ2. Эмбрионы содержат другие гемоглобины. На ранних этапах эмбрионального развития выявляется гемоглобин плода α2ε2. На смену ему приходит гемоглобин F с субъединичной структурой а2у2. Биологическое значение этих разных гемоглобинов представляет собой очень интересную проблему, которую мы обсудим в следующей главе. Общая для всех перечисленных гемоглобинов α-цепь содержит 141 аминокислотный остаток, β, δ и γ-Цепи содержат по 146 остатков с очень схожей последовательностью аминокислот (рис. 3.23).
Рис. 3.23. β-, γ- и δ-Цепи гемоглобинов человека обладают сходными аминокислотными последовательностями. Для примера показаны участки трех цепей с остатками от F1 до F9
3.12. Рентгеноструктурный анализ гемоглобина
Как упоминалось ранее, пространственную структуру гемоглобина А определили Макс Перутц и сотрудники. Этот монументальный труд был начат в 1936 г., когда для выполнения дипломной работы Перутц уехал из Австрии в Англию в Кембридж и начал работать в лаборатории Джона Бернала (J. Bemal), где двумя годами ранее были получены первые рентгеновские отпечатки кристаллов белка. Бернал и студентка- дипломница Дороти Кродфут Ходжкин (D. С. Hodgkin) получили отличные отпечатки дифракции пепсина и таким образом показали, что белкам свойственна точно определенная структура. Еще в 1934 г. они предсказали перспективность применения рентгеноструктурного анализа как метода, «позволяющего получить гораздо более подробные сведения о белковой структуре по сравнению с тем, что могли дать предшествовавшие физические и химические подходы». Прошло, однако, более 20 лет, прежде чем этот прогноз оправдался. В тот период, когда Перутц избрал объектом своей работы гемоглобин, самым высокомолекулярным соединением с расшифрованной структурой был краситель фталоцианин, состоящий из 58 атомов. Перутц же взялся за молекулу в сотни раз большую. Не удивительно, что «мои товарищи смотрели на меня с жалостливой улыбкой… По счастью, экзаменаторы, принимавшие мою дипломную работу, не настаивали на окончательном установлении структуры, иначе бы я оставался студентом-дипломником в течение 23 лет». Однако Лоуренс Брэгг (L. Bragg), который вместе со своим отцом впервые в 1912 г. применил рентгеноструктурный анализ, стал в это время во главе Кавендишской лаборатории и поддержал работу Перутца. Он писал: «Я не обманывал себя в отношении перспективы. Дело выглядело так, как если бы нулевую вероятность успеха помножили на бесконечную важность искомого результата; результат этой математической операции был никому не известен». Успех пришел в 1959 г., когда Перутц получил карту электронной плотности низкого разрешения для оксигемоглобина лошади. Впоследствии были получены карты высокого разрешения как для окси-, так и дезоксигемоглобина лошади и человека. Гемоглобины этих двух видов очень близки по своей структуре.
3.13. Четвертичная структура гемоглобина
Молекула гемоглобина имеет почти правильную форму шара диаметром 55 А. Четыре цепи, образующие молекулу гемоглобина, расположены в виде тетраэдра (рис. 3.24). Четыре гема, по одному у каждой субъединицы, находятся в углублениях на внешней стороне молекулы. Эти четыре кислородсвязывающих участка расположены далеко друг от друга: расстояние между двумя ближайшими атомами железа составляет 25 А. Каждая α-цепь контактирует с обеими β-цепями. В то же время взаимодействия между двумя а- или между двумя β-цепями незначительны.
Рис. 3.24. Модель гемоглобина при низком разрешении. α-Цепь показана желтым, β-цепь-синим, гем-красным

3.14. α- и β-Цепи гемоглобина очень сходны с миоглобнном
Пространственные структуры миоглобина и α- и β-цепей гемоглобина обладают поразительным сходством (рис. 3.25). Близкое подобие в конфигурации основных цепей этих белков оказалось неожиданным, поскольку в последовательности аминокислотных остатков в этих трех полипептидных цепях существует много различий. Собственно, только 24 положения из 141 идентичны во всех трех полипептидных цепях; это показывает, что очень сходные пространственные структуры могут быть обусловлены совершенно разной последовательностью аминокислот (рис. 3.26).
Рис. 3.25. Сравнение конформаций главной цепи миоглобина и (3-цепи гемоглобина. Сходство конформаций совершенно очевидно

Рис. 3.26. Сравнение аминокислотных последовательностей миоглобина кашалота и α- и β-цепей гемоглобина человека на примере участка от остатка F1 от остатка F9. Последовательности аминокислот имеют гораздо меньше сходства, чем пространственные структуры этих трех полипептидных цепей

Совершенно очевидно, что пространственная конфигурация миоглобина кашалота и α- и β-цепей гемоглобина человека имеет общебиологическое значение. В сущности, эта структура свойственна всем миоглобинам и гемоглобинам позвоночных. Сложная конфигурация полипептидной цепи, впервые выявленная на примере миоглобина, это та основная форма, которую природа предназначила для переносчика кислорода: смысл ее в том, что вокруг гема создается такое микроокружение, которое обеспечивает обратимость связывания кислорода.
Источник
МИОГЛОБИН И ГЕМОГЛОБИН. ТРАНСПОРТ КИСЛОРОДА — Студопедия
МИОГЛОБИН – сложный глобулярный белок, третьего уровня структурной организации, молекула которого состоит из 1 полипептидной цепи и содержит 153 аминокислоты. В миоглобине содержится железопорфириновая группа (гем), и он способен обратимо присоединять кислород.
Миоглобин содержится в клетках скелетных мышц. Пептидная цепь миоглобина напоминает длинную колбасу, причудливо скрученную. Было показано, что остов молекулы миоглобина состоит из 8 относительно прямолинейных отрезков, разделенных между собой местами сгибов. Каждый отрезок закручен в виде a-спирали. Все спирали являются правыми. 70 % аминокислотных остатков входят в состав спирализованных участков.
Свойства миоглобина:
1. молекула миоглобина компактна (внутри нее может уместиться 4Н2О);
2. все полярные R- группы аминокислотных остатков расположены на внешней поверхности молекулы и находятся в гидратированном состоянии, т.е. связаны с Н2О;
3. неполярные, или гидрофобные R- группы располагаются в глубине молекулы и защищены от соприкосновения с Н2О;
4. остатки пролина встречаются только в метах сгибов пептидной цепи (пролин нарушает a-спираль). В местах сгибов находятся и другие аминокислоты, которые неспособны легко образовывать a-спираль (изолейцин, серин), и аминокислоты, боковые цепи которых несут одинаковые заряды при рН7;
5. у миоглобинов, выделенных из разных млекопитающих, конформация пептидных цепей сходна (но они несколько отличаются по аминокислотному составу).
ГЕМ — комплекс порфирина и иона железа в степени окисления +2.
Ион железа встроен в кольцо порфирина таким образом, что четыре координационные связи из шести (в состоянии гибридизации sp3d2 связи у шестикоординационного железа направлены к вершинам октаэдра) затрачены на образование связей с атомами азота, еще одна связана с азотом имидазольного остатка ГИС полипептидной цепи (проксимальный Гистидин F8), а другая- также с имидазольным остатком другого ГИС (дистальный ГИС Е7). Молекула кислорода присоединяется между остатком дистального ГИС и железом. Изменения степени окисления железа при этом не происходит. Порфириновое кольцо (ГЕМ) не находится на плоскости молекулы белка, а частично погружено в него. Молекула кислорода присоединяется к гему, входя как бы через открывающуюся дверцу. Пока остается несным, дожидается молекула кислорода случайного открывания двери, или существует какой-то механизм, пускающий кислород к гему.
Миоглобин сосредоточен, главным образом, в мышцах и его главной функцией является хранение кислорода. Скорость насыщения миоглобина кислородом намного превышает таковую для гемоглобина. Миоглобин мало приспособлен для транспортировки кислорода из легких в ткани, поскольку скорость отдачи кислорода в тканях невелика (при давлении 1 мм рт. ст. примерно половина миоглобина все еще не отдает кислород).
Вопросы транспортировки кислорода решаются при участии белка четвертичной структуры — гемоглобина.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА ГЕМОГЛОБИНА. При помощи рентгеноструктурного анализа Перутцем и его сотрудниками в Кембридже установлены третичная и четвертичная структуры гемоглобина. Гемоглобин содержится в эритроцитах и служит для переноса кислорода. Молекулярная масса гемоглобина 64500. Молекула состоит из 4 отдельных полипептидных цепей: 2 a-цепей (141 остаток аминокислот) и 2 b- цепей (146 остатков аминокислот в каждой), каждая из которых связана нековалентной связью с остатками гема. Каждая из 4 отдельных цепей гемоглобина свернута нерегулярным образом и состоит из ряда a- спиральных участков, разделенных местами сгибов.
a- и b- цепи гемоглобина примерно на 70 % состоят из a-спиральных участков. По своей третичной структуре a- и b-цепи очень сходны, они образованы из a- спиральных участков одинаковой длины, согнутых под одинаковыми углами и в одних и тех же направлениях. Третичная структура a- и b-цепей гемоглобина очень сходна с третичной структурой единственной цепи миоглобина. Сходная функция гемоглобина и миоглобина, обусловленная способностью обратимо связывать О2, объясняется сходством третичной структуры.
Согласно данным рентгеноструктурного анализа молекула гемоглобина по своей форме приближается к сфере диаметром ~ 5,5 нм. 4 полипептидные цепи уложены относительно друг друга приблизительно в виде тетраэдра, в результате чего возникает характерная четвертичная структура гемоглобина.
Это очень компактная структура. Большинство гидрофобных R- групп аминокислот находится внутри глобулы, а большинство гидрофильных R- групп – снаружи. В молекуле гемоглобина возникает небольшое число контактов между одинаковыми цепями (2 a- и 2 b- цепями) и множество контактов между a- и b- цепями. В образовании таких контактов принимают участие в основном гидрофобные R- группы аминокислотных остатков.
При присоединении к гемоглобину кислорода расстояние между 2 b- цепями гемоглобина уменьшается и изменяется четвертичная структура. Таким образом, гемоглобин и оксигемоглобин (насыщенный кислородом) различаются по своей четвертичной структуре.
Четвертичная структура олигомерных белков также определяется первичной аминокислотной последовательностью входящих в их состав отдельных полипептидных цепей. Олигомерные белки (гемоглобин) обнаруживают способность к самосборке.
Главное отличие гемоглобина от миоглобина заключается в проявлении особого рода эффектов — кооперативных, влияющих на скорости присоединения- отсоединения молекул кислорода. Каждая молекула гемоглобина способна присоединять и переносить четыре молекулы кислорода, при этом кооперативность проявляется в том, что как присоединение, так и отсоединение каждой последующей молекулы кислорода облегчается в результате структурных изменений в конформации молекулы, которых у гемоглобина имеется две основных- оксигенированная и дезоксигенированная. Промежуточные состояния нестабильны. Предполагается следующий механизм кооперативного эффекта. Присоединение первой молекулы кислорода приводит к тому, что атом железа смещается от своего места примерно на 0,4-0,6 ангстрем, вызывая изменения конформации субъединицы. Изменившаяся конформация по аллостерическому эффекту облегчает присоединение кислорода к другой субъединице и т.д. Это позволяет максимально ускорить процесс присоединения кислорода в легких (рО2 = 100 мм рт. ст.). При переносе оксигенированного гемоглобина в капилляры тканей (рО2 = 5 мм рт. ст.) отсоединение молекул кислорода протекает также быстро, по кооперативному эффекту. Известны, впрочем, и химические регуляторы скорости и полноты присоединения кислорода. К ним, в частности, относится 2,3- дифосфоглицериновая кислота. Она облегчает присоединение кислорода у организмов, обитающих в высокогорных районах.
Источник
Строение и функции белковой части гемоглобина – глобина

Видовые различия гемоглобина обусловлены химическим составом и строением глобина. Гемоглобины представляют собой тетрамерные белки, молекулы которых образованы различными типами полипептидных цепей, Глобин состоит из 4 полипептидных цепей. На сегодняшний день известно 5 полипептидных цепей, формирующих молекулу гемоглобина (альфа, бетта, гамма, дельта, эпсилон) при скрещении цепей образуются различные физиологические гемоглобины.
Общая формула глобина X2Y2, где Х – альфа цепь,Y одна из оставшихся 4 — х.
В состав молекулы входят по 2 полипептидные цепи двух разных типов, каждая из которых оборачивает 1 гем гемоглобина. Гемоглобины различных видов различаются вторичной, третичной и четвертичной структурами, и индивидуальные свойства гемоглобинов неразрывно связаны с их структурами. Известно, что гемоглобин человека состоит из двух равных половин, каждая из которых образована двумя одинаковыми полипептидными цепями. У человека обнаружены гемоглобины различных типов, которые отличаются по химическому строению. отличающийся от HbA вторичной, третичной и четвертичной структурами, что обусловливает их различия: по спектральным характеристикам, электрофоретической подвижности, устойчивости к тепловой денатурации и др. В крови новорожденного ребенка содержится ~ 80% HbF, который к концу первого года жизни почти целиком заменяется на HbA (в крови взрослого человека содержится до ~ 1,5% HbF от общего количества гемоглобина).
Физиологические гемоглобины:
Первый гемоглобин – зародышевый в 3 месяца сменяется на плодный или фетальный гемоглобин НвF (он состоит из альфа2 + гамма2 цепей — a2g2), который присутствует в период эмбриогенеза, и полностью замещается гемоглобином взрослого к концу 1 – го года жизни. Гемоглобин взрослого – А1 и А2, начинают синтезироваться в плодный период и после 1- го года жизни процент HbА1 составляет 97 – 98% — основной компонент эритроцитов взрослого, он состоит из альфа2 + бетта2 цепей (a2b2 ).
2-3% — гемоглобин А2, процент НвF к концу 1-го года – не более 1%.
Фетальный гемоглобин по сравнению с гемоглобином взрослого обладает более высоким сродством к кислороду, т.к. фетальный гемоглобин связывает 2,3-дифосфоглицерат труднее, чем НвА.
Растворы гемоглобина окрашены в темно-красный цвет и имеют характерные спектры поглощения в ультрафиолетовой и видимой областях спектра. Изоэлектрическая точка гемоглобина ~ 7. В кислой и щелочной среде гемоглобин легко денатурируется, скорость денатурации различна у различных видов гемоглобинов.
Синтез гемоглобина
Функция гемоглобина требует наличия обоих компонентов гема и глобина. Синтез гемоглобина осуществляется 2 путями – синтез гема и глобина. Затем эти составные объединяются и составляют молекулу гемоглобина. Синтез гемоглобина начинается в митохондриях с конденсации молекул: глицина и сукцинил – КоА, конечным продуктом конденсации этих молекул является дельта – аминолевулиновая кислота, далее конденсация 2- х молекул аминолевулиновой кислоты образует пироловое кольцо, которое подвергаясь действию аминолевулинатдегидрогеназы переходит в порфобилиноген, конденсация 4 – х колец которого даёт образование уропорфириногена, эта реакция катализируется комплексом 2 – х ферментов. Уропорфириногенсинтетаза –I катализирует конденсацию и дезаминирование порфобилиногена в уропорфириноген I, эта реакция активна при некоторых видах порфирий. В нормальных условиях работает, почти исключительно, уропорфириноген-III-косинтетаза при этом образуется уропорфириноген III, который при декарбоксилировании образует копропорфириноген. Копропорфириноген подвергаясь процессам декарбосилирования превращается в протопорфириноген III, далее под воздействием оксидазы образуется протопорфирин 9. Завершающей стадией является включение в протопорфирин 2 – х валентного железа, эта реакция катализируется митохондриальным ферментом гем – синтетаза или ферро-хелатаза (однако эта реакция хорошо идёт и без ферментов). Биосинтез гемма идёт в большинстве тканей млекопитающих, за исключением зрелых эритроцитов, которые не содержат митохондрий. Преимущественныи местом синтеза является печень, т.к. именно в печени протекает основной метаболизм порфиринов. Все порфобилиногены бесцветны, тогда как порфирины – имеют окраску.
Регуляция синтеза гема
Скорость – лимитирующей реакцией синтеза гема является конденсация сукцинил-КоА и глицина, приводящая к образованию амино – левуленовой кислоты. Т.О. основным регуляторным ферментом является АЛК — синтетаза.
1. Гем является аллостерическим ингибитором АЛК – синтетазы, по принципу обратной связи.
2. Гем является корепрессором синтеза самого фермента АЛК — синтетазы.
3. Железо регулирует синтез этого фермента на этапе трансляции.
Механизм: На матричной РНК, кодирующей АЛК – синтетазу имеется определённая последовательность нуклеотидов, которая называется железо – чувствительным элементом. Этот участок связывается с регуляторным железо-связывающим белком, который ингибирует процесс трансляции. При высоких концентрациях железа в клетках, оно образует комплекс с регуляторным железосвязывающим белком и снижает сродство этого белка к железочувствительному элементу мРНК, тем самым, активируя трансляцию АЛК — синтетазы. При низких концентрациях железо не связывается с регуляторным белком и трансляция тормозится.
На индукцию АЛК – синтетазы в печени оказывают действие и другие факторы: при приёме лекарственных средств, метаболизм которых происходит в печени при участии цитохрома Р450, возрастает потребность в геме за счёт повышенного расхода, соответственно активируется АЛК – синтетаза. Глюкоза может тормозить индукцию АЛК – синтетазы. Гипоксия способствует повышению активности АЛК – синтетазы в клетках костного мозга, а в печени не изменяет активность этого фермента.
Дата добавления: 2016-10-23; просмотров: 1370 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2021 lektsii.org — Контакты — Последнее добавление
Источник