Предшественник мевалоната в синтезе холестерина
Содержание статьи
ервная система при нарушениях обмена холестерина: мевалоновой ацидурии
Нервная система при нарушениях обмена холестерина: мевалоновой ацидурии
а) Мевалоновая ацидурия. Мевалоновая ацидурия является врожденным нарушением биосинтеза холестерина, вызванным дефицитом мевалонаткиназы. Данное нарушение проявляется двумя нозологическими формами: повышенным уровнем IgD и периодической лихорадкой (HIDS) и классической мевалоновой ацидурией (МА). HIDS характеризуется рецидивирующими приступами лихорадки, которые обычно начинаются на первом году жизни и не сопровождаются явными неврологическими аномалиями.
С другой стороны, vевалоновая ацидурия (МА) обычно характеризуется задержкой психомоторного развития, атаксией и дисморфическими проявлениями. У пациентов также отмечаются приступы лихорадки. В настоящее время оба нарушения расцениваются как единое заболевание с общими клиническими и биохимическими изменениями (Simon et al., 2004; Waterham и Clayton, 2006).
1. Биохимические изменения и патогенез. Мевалонаткиназа, которая фосфорилирует мевалоновую кислоту, является центральным ферментом изопренового пути с основными конечными продуктами холестерином, долихолом и убихиноном, что определяет решающую роль пути для пролиферации и функционирования клеток. Соответствующие патогенетические роли накопления конечных продуктов и токсического действия накопления мевалоната неясны.
Любая из этих ролей представляется достаточной для объяснения возникновения полиорганного поражения и тератогенного действия, предполагаемого на основании высокой частоты выкидышей и мертворождений плодов с мальформациями в семьях с данными заболеваниями. В постнатальном периоде отмечается высокая восприимчивость мозжечка и сетчатки к окислительному стрессу и/или токсическому действию мевалоновой кислоты. Механизм аутовоспалительного процесса остается невыясненным.
2. Генетические изменения. Мевалоновая ацидурия (МА) и HIDS являются аутосомно-рецессивными заболеваниями, выявлено около 40 вызывающих заболевание мутаций, затрагивающих ген МК. Некоторые мутации, проявляются преимущественно фенотипом HIDS, а три другие встречаются относительно часто. Большинство пациентов являются гетерозиготами по двум различным мутациям, сочетанное воздействие которых на остаточную ферментную активность отчасти объясняет вариабельность фенотипов. Активность мевалонаткиназы проявляется в фибробластах, амниотических клетках, лейкоцитах и хорионических ворсинах.
Пренатальная диагностика проводилась на основании исследования образцов ворсин хориона на предмет ферментной активности и содержания мевалоновой кислоты в амниотической жидкости. Более достоверная диагностика возможна по результатам молекулярного тестирования (Waterham и Clayton, 2006).
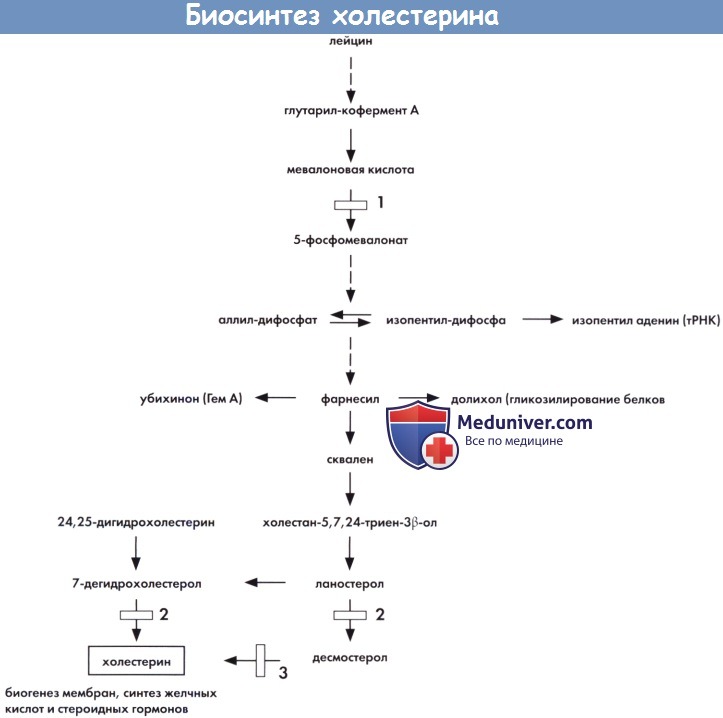
Схематичное изображение биосинтеза холестерина и основных взаимосвязей с другими путями метаболизма (см. текст).
1 — мевалонат киназа (мевалоновая ацидурия). 2 — 7-дегидрохолестерин дегидрогеназа (синдром Смита-Лемли-Опитца).
3 — редуктаза двойной связи С24-С25 (возможен дефект десмостеролозиса).
3. Нейропатология. При нейропатологическом исследовании одного пациента был выявлен агенез червя мозжечка, некроз гранулярных клеток и некроз нейронов коры головного мозга (Hoffman et al., 1993).
4. Клинические проявления. Заболевание может проявляться в младенческом или детском возрасте и характеризуется фенотипической гетерогенностью. Тяжелые формы могут приводить к смерти в раннем младенческом возрасте или даже во внутриутробном периоде. С другой стороны, при легких формах заболевания пациенты доживают до детского возраста с формированием различных нарушений. МА и HIDS обычно проявляются рецидивирующими эпизодами аутовоспаления, длящимися 3-5 дней. Обострения могут возникать до двух раз в месяц в младенческом возрасте и менее часты в позднем детском возрасте.
Обострения представлены выраженной лихорадкой, болью в животе, рвотой, диареей, лимфоаденопатиями, гепатоспленомегалией, артралгиями и кожной сыпью. Кроме того, у пациентов с МА отмечается задержка умственного развития различной степени выраженности. У большинства пациентов в течение двух лет развивается прогрессирующая атаксия, дизартрия и прогрессирующая мозжечковая атрофия. У всех пациентов отмечается мышечная гипотония и слабость. Часто встречается замедление скорости роста, анемия, перманентная гепатоспленомегалия и лимфоаденопатия. Легкий дисморфизм был зарегистрирован у 8 из 11 пациентов (Hoffman et al., 1993). Катаракта, увеит, прогрессирующая дистрофия сетчатки и атрофия зрительного нерва приводят к прогрессирующим ухудшениям зрения. У отдельных пациентов отмечались парциальные или генерализованные тонико-клонические припадки. При менее выраженной форме заболевания пациенты могут доживать до подросткового и даже до взрослого возраста с незначительной инвалидностью и гораздо менее острыми эпизодами лихорадки (Prietsch et al., 2003; Simon et al., 2004).
5. Биохимическая диагностика. Диагностика основана на определении уровня органических кислот для выявления накопления мевалоновой кислоты в жидкостях организма. Уровень мевалоновой кислоты обычно повышается в случае классического фенотипа, но встречается и при менее тяжелых формах заболевания. Постоянное повышение уровня IgD и/или IgA отмечается при HIDS, а при МА имеет непостоянный характер. Лучшим методом диагностики является определение активности ферментов в лейкоцитах или фибробластах, а также молекулярные исследования.
6. Лечение. В настоящее время эффективных методов лечения не существует. Поддерживающее лечение предположительной недостаточности конечных продуктов, таких как холестерин, желчные кислоты и убихинон, не привело к клиническому или биохимическому улучшению. Блокирование гиперпродукции мевалоната с помощью ингибитора HMG-кофермент А редуктазы (ловастатина) привело к тяжелым обострениям у двух пациентов с МА. Лучшим методом лечения считается интермиттирующее применение стероидов.
б) Другие нарушения метаболизма холестерина. Синдром Смита-Лемли-Опитца является комплексным пороком развития в результате нарушения биосинтеза холестерина в связи с блоком на уровне фермента 3-бета гидроксистерол D-7 редуктазы. Данное заболевание описано в отдельной статье на сайте.
Другие редкие мальформационные синдромы, вызванные дефектами биосинтеза холестерина, включают болезнь CHILD (врожденная гемидисплазия с ихтиозоформной эритродермией и дефектами конечностей), синдром Конради-Хюнермана (сцепленная с Х-хромосомой доминантная точечная эпифизарная дисплазия) и десмостеролоз (Haas et al, 2001).
— Также рекомендуем «Нервная система при болезни Ниманна-Пика С типа (НПС)»
Редактор: Искандер Милевски. Дата публикации: 14.12.2018
Источник
Синтез холестерола должен быть согласован с его выведением
Синтез холестерола в организме составляет примерно 0,5-0,8 г/сут, примерно 50% образуется в печени, около 15% в кишечнике. Все клетки организма способны синтезировать холестерол. Поступление с пищей составляет около 0,4 г/сут.
Единственным реальным способом выведения холестерола является желчь – до 1 г/сут.
Биосинтез холестерола
Биосинтез холестерола происходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА, поступающий сюда из митохондрий в составе цитрата, также как при синтезе жирных кислот. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН.
Образование холестерола идет более чем в 30 реакциях, которые можно сгруппировать в несколько этапов.
1. Синтез мевалоновой кислоты.
Первые две реакции синтеза совпадают с реакциями кетогенеза, но после синтеза 3-гидрокси-3-метилглутарил-SКоА вступает в действие фермент гидроксиметил-глутарил-SКоА-редуктаза (ГМГ-SКоА-редуктаза), образующая мевалоновую кислоту.
2. Синтез изопентенилдифосфата. На этом этапе при использовании АТФ мевалоновая кислота трижды фосфорилируется. Затем промежуточный продукт декарбоксилируется и дефосфорилируется с получением изопентенилдифосфата.
3. После объединения трех молекул изопентенилдифосфата (если не считать промежуточных превращений) синтезируется фарнезилдифосфат.
4. Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата.
5. После сложных реакций линейный сквален циклизуется в ланостерол.
6. Удаление лишних метильных групп, восстановление и изомеризация молекулы приводит к появлению холестерола.
Регуляция синтеза
Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза, активность которой может изменяться в 100 и более раз.
1. Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. Это помогает поддерживать внутриклеточное содержание холестерола постоянным.
2. Регуляция транскрипции гена ГМГ-SКоА-редуктазы (в печени) – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента.
3. Ковалентная модификация при гормональной регуляции:
- Инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние.
Важным следствием такой регуляции является активация кетогенеза при отсутствии инсулина.
- Глюкагон и адреналин посредством аденилатциклазного механизма активируют протеинкиназу А, которая фосфорилирует фермент и переводит его в неактивную форму.
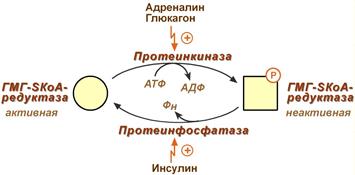
Регуляция активности гидроксиметилглутарил-S-КоА-редуктазы
Кроме указанных гормонов, на ГМГ-SКоА-редуктазу действуют эстрогены и тиреоидные гормоны (повышают активность) и глюкокортикоиды (снижают активность).
Изменение транскрипции гена ГМГ-КоА редуктазы (генетическая регуляция) осуществляется стерол-регулируемым элементом в ДНК (SREBP, sterol regulatory element-binding protein) с которым способны связываться белки — факторы SREBP. Эти факторы при достаточном количестве холестерина в клетке закреплены в мембране ЭПР. Когда уровень холестерина падает, факторы SREBP активируются под действием специфичных протеаз комплекса Гольджи, передвигаются в ядро, взаимодействуют на ДНК с участком SREBP и стимулируют биосинтез холестерина.
Скорость биосинтеза холестерола также зависит от концентрации специфического белка-переносчика, обеспечивающего связывание и транспорт гидрофобных промежуточных метаболитов синтеза.
Источник
Биосинтез и распад холестерина
БИОСИНТЕЗ ХОЛЕСТЕРИНА
В 40-60-х годах нашего столетия К. Блох и сотр. в опытах с использованием ацетата, меченного 14 С по метильной и карбоксильной группам, показали, что оба атома углерода уксусной кислоты включаются в холестерин печени приблизительно в одинаковых количествах. Кроме того, было доказано, что все атомы углерода холестерина происходят из ацетата.
В дальнейшем благодаря работам Ф. Линена, Г. Попьяка, Дж. Корн-форта, А.Н. Климова и других исследователей были выяснены основные детали ферментативного синтеза холестерина, насчитывающего более 35 энзиматических реакций. В синтезе холестерина можно выделить три основные стадии: I – превращение активного ацетата в мевалоновую кислоту, II – образование сквалена из мевалоновой кислоты, III – циклизация сквалена в холестерин.
Рассмотрим стадию превращения активного ацетата в мевалоновую кислоту. Начальным этапом синтеза мевалоновой кислоты из ацетил-КоА является образование ацетоацетил-КоА посредством обратимой тиолазной реакции:
Затем при последующей конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА:
Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновую кислоту:
ГМГ-КоА-редуктазная реакция – первая практически необратимая реакция в цепи биосинтеза холестерина. Она протекает со значительной потерей свободной энергии (около 33,6 кДж). Установлено, что данная реакция лимитирует скорость биосинтеза холестерина.
Наряду с классическим путем биосинтеза мевалоновой кислоты имеется второй путь, в котором в качестве промежуточного субстрата, по-видимому, образуется не β-гидрокси-β-метилглутарил-КоА, а β-гидрокси-β-метилглутарил-S-АПБ. Реакции этого пути идентичны начальным стадиям биосинтеза жирных кислот вплоть до образования ацетоацетил-S-АПБ. В образовании мевалоновой кислоты по этому пути принимает участие ацетил-КоА-карбоксилаза – фермент, осуществляющий превращение ацетил-КоА в малонил-КоА. Оптимальное соотношение малонил-КоА и ацетил-КоА для синтеза мевалоновой кислоты – 2 молекулы ацетил-КоА на 1 молекулу малонил-КоА.
Участие малонил-КоА – основного субстрата биосинтеза жирных кислот в образовании мевалоновой кислоты и различных полиизопреноидов показано для ряда биологических объектов: печени голубя и крысы, молочной железы кролика, бесклеточных дрожжевых экстрактов. Этот путь биосинтеза мевалоновой кислоты отмечен преимущественно в цитозоле клеток печени. Существенную роль в образовании мевалоната в данном случае играет ГМГ-КоА-редуктаза, обнаруженная в растворимой фракции печени крысы и неидентичная микросомному ферменту по ряду кинетических и регуляторных свойств. Регуляция второго пути биосинтеза мевалоновой кислоты при ряде воздействий (голодание, кормление холестерином, введение поверхностно-активного вещества тритона WR-1339) отличается от регуляции первого пути, в котором принимает участие микросомная редуктаза. Эти данные свидетельствуют о существовании двух автономных систем биосинтеза мевалоновой кислоты. Физиологическая роль второго пути окончательно не изучена. Полагают, что он имеет определенное значение не только для синтеза веществ нестероидной природы, таких, как боковая цепь убихинона и уникального основания N 6 -(Δ 2 -изопентил)-аденозина некоторых тРНК, но и для биосинтеза стероидов (А.Н. Климов, Э.Д. Полякова).
На II стадии синтеза холестерина мевалоновая кислота превращается в сквален. Реакции II стадии начинаются с фосфорилирования мевалоновой кислоты с помощью АТФ. В результате образуется 5-фосфорный эфир, а затем 5-пирофосфорный эфир мевалоновой кислоты:
5-пирофосфомевалоновая кислота в результате последующего фосфорилирования третичной гидроксильной группы образует нестабильный промежуточный продукт – 3-фосфо-5-пирофосфомевалоновую кислоту, которая, декарбоксилируясь и теряя остаток фосфорной кислоты, превращается в изопентенилпирофосфат. Последний изомеризуется в диметилаллилпирофосфат:
Затем оба изомерных изопентенилпирофосфата (диметилаллилпирофос-фат и изопентенилпирофосфат) конденсируются с высвобождением пи-рофосфата и образованием геранилпирофосфата:
К геранилпирофосфату вновь присоединяется изопентенилпирофосфат. В результате этой реакции образуется фарнезилпирофосфат:
В заключительной реакции данной стадии в результате НАДФН-за-висимой восстановительной конденсации 2 молекул фарнезилпирофосфата образуется сквален:
На III стадии биосинтеза холестерина сквален под влиянием сквален-оксидоциклазы циклизируется с образованием ланостерина. Дальнейший процесс превращения ланостерина в холестерин включает ряд реакций, сопровождающихся удалением трех метильных групп, насыщением двойной связи в боковой цепи и перемещением двойной связи в кольце В из положения 8, 9 в положение 5, 6 (детально эти последние реакции еще не изучены):
Приводим общую схему синтеза холестерина:
Начиная со сквалена, все промежуточные продукты биосинтеза холестерина (включая и холестерин) нерастворимы в водной среде. Поэтому они участвуют в конечных реакциях биосинтеза холестерина, будучи связанными со стеринпереносящими белками (СПБ). Это обеспечивает их растворимость в цитозоле клетки и протекание соответствующих реакций. Данный факт имеет важное значение и для вхождения холестерина в клеточные мембраны, окисления в желчные кислоты, превращения в стероидные гормоны. Как отмечалось, реакцией, регулирующей скорость биосинтеза холестерина в целом, является восстановление β-гидрокси-β-метилглутарил-КоА в мевалоновую кислоту, катализируемое ГМГ-КоА-редуктазой. Данный фермент испытывает регуляторное воздействие ряда
факторов. В частности, скорость синтеза редуктазы в печени подвержена четким суточным колебаниям: максимум ее приходится на полночь, а минимум – на утренние часы.
Активность ГМГ-редуктазы возрастает при введении инсулина и тире-оидных гормонов. Это приводит к усилению синтеза холестерина и повышению его уровня в крови.
При голодании, тиреоидэктомии, введение глюкагона и глюкокорти-коидов, напротив, отмечается угнетение синтеза холестерина, что прежде всего связано со снижением активности ГМГ-КоА-редуктазы.
источник
Холестерин, строение, биологическая роль, биосинтез и распад холестерина в организме человека
Холестерин является одноатомным циклическим спиртом, который в тканях легко образует ХОЛЕСТЕРИДЫ. В организм человека поступает в составе пищи и синтезируется в печени, тонком отделе кишечника и коже.
Биологическая роль холестерина:
1.Структурная. Свободный холестерин является, структурным компонентом мембран клеток.
2.Метаболическая. Холестерин является предшественником биологически активных веществ: витамина D3,СТЕРОИДНЫХ гормонов (АНДРОГЕНОВ, ЭСТРОГЕНОВ, КОРТИКОИДОВ) При окислении холестерина в печени при участии ЦИТОХРОМА Р-450 образуются желчные кислоты. В свободном виде холестерин транспортируется по организму с помощью транспортных ЛИПОПРОТЕИНОВ крови. Источники холестерина:
1. Пища. За сутки в организм взрослого человека поступает 0,3гр. холестерина.
2. У человека в среднем с массой 65-70кг за сутки синтезируется 3.5 -4,2гр. холестерина. Печень занимает главное место в синтезе холестерина При поражении печени и кишечника нарушается образование и транспорт ЛП крови. При поражении печени и желчевыводяицих путей нарушается образование и экскреция желчных кислот, участвующих в переваривании жиров пищи. В случае нарушения оттока желчи происходит насыщение её холестерином, что ведёт к образованию холестериновых камней. Развивается ЖЕЛЧЕКАМЕННАЯ БОЛЕЗНЬ. В крови отмечается ГИПЕРХОЛЕСТЕРИНЕМИЯ.
1.Образование ацетоацетил-КоА из двух молекул ацетил-КоА с помощью тиолазного фермента ацетоацетилтрансферазы.Происходит в цитозоле.
2.Образование β-гидрокси-β-метилглутарил-КоА из ацетоацетил-коА с третьей молекулой ацетил-КоА с помощью гидроксиметилглутарил-КоА-синтазы .
3.Образование мевалоната восстановлением ГМГ и отщеплением HS-KoA с помощью НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы.
4. мевалоновая кислота дважды фосфорилируется с помощью АТФ: до 5-фосфомевалоната, а затем до 5-пирофосфомевалоната.
5.5-пирофосфомевалонат фосфорилируется по 3 атому углерода, образуя — 3-фосфо-5-пирофосфомевалонат.
6.Последний декарбоксилируется и дефосфорилируется, образуется изопентенилпирофосфат.
7.после ряда последовательных реакций образуется сквален
8.после ряда реакций образуется ланостерин
9.Ланостерин превращается в мембранах гладкого эндоплазматического ретикулума в холестерин
Гормоны щитовидной железы, надпочечников, половых желез при гиперфункции усиливают выделение холестерина, а при гипофункции — активизируют его распад. Не использованный организмом холестерин подвергается распаду в печени. Продукты распада превращаются в желчные кислоты и выделяются в кишечник с желчью.
источник
Синтез холестерола должен быть согласован с его выведением
Синтез холестерола в организме составляет примерно 0,5-0,8 г/сут, примерно 50% образуется в печени, около 15% в кишечнике. Все клетки организма способны синтезировать холестерол. Поступление с пищей составляет около 0,4 г/сут.
Единственным реальным способом выведения холестерола является желчь – до 1 г/сут.
Биосинтез холестерола
Биосинтез холестерола происходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА , поступающий сюда из митохондрий в составе цитрата, также как при синтезе жирных кислот. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН.
Образование холестерола идет более чем в 30 реакциях, которые можно сгруппировать в несколько этапов.
1. Синтез мевалоновой кислоты.
Первые две реакции синтеза совпадают с реакциями кетогенеза, но после синтеза 3-гидрокси-3-метилглутарил-SКоА вступает в действие фермент гидроксиметил-глутарил-SКоА-редуктаза (ГМГ-SКоА-редуктаза), образующая мевалоновую кислоту.
Источник