Превращение гемоглобина в тканях
Содержание статьи
Распад гема — многостадийный процесс
За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов.
Эритроциты в норме живут 90-120 дней, после чего лизируются в клетках ретикулоэндотелиальной системы – макрофагах селезенки (главным образом), купферовских клетках печени и макрофагах костного мозга. При разрушении эритроцитов в кровеносном русле высвобождаемый гемоглобин образует комплекс с белком-переносчиком гаптоглобином (фракция α2-глобулинов крови) и также переносится в клетки РЭС селезенки, печени и костного мозга.
Синтез билирубина
В клетках РЭС гем в составе гемоглобина окисляется молекулярным кислородом. В реакциях последовательно происходит разрыв метинового мостика между 1-м и 2-м пиррольными кольцами гема с их восстановлением, отщеплением железа и белковой части и образованием оранжевого пигмента билирубина. Высвобождаемое железо может либо запасаться в клетке в комплексе с ферритином, либо выделяться наружу и связываться с трансферрином.
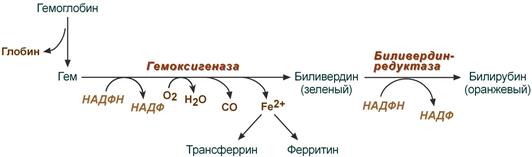
Реакции распада гемоглобина и образования билирубина
Билирубин – токсичное, жирорастворимое вещество, способное разобщать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани.
Строение билирубина
Выведение билирубина
Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы, в гораздо меньшем количестве – в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов не позволяет выделяться билирубину с мочой. Билирубин в комплексе с альбумином называется свободный (неконъюгированный) или непрямой билирубин.
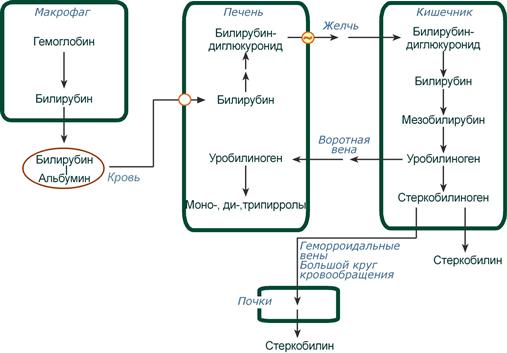
Этапы метаболизма билирубина в организме
Из сосудистого русла в гепатоциты билирубин попадает с помощью белка-переносчика (транспортный белок органических анионов) или по механизму флип-флоп. Далее при участии цитозольного связывающего белка лигандина (Y-протеин) билирубин транспортируется в ЭПР, где протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой, при этом образуются моно- и диглюкурониды. Кроме глюкуроновой кислоты, в реакцию конъюгации могут вступать сульфаты, фосфаты, глюкозиды.
Билирубин-глюкуронид получил название связанный (конъюгированный) или прямой билирубин.
После образования билирубин-глюкурониды АТФ-зависимым переносчиком секретируются в желчные протоки и далее в кишечник, где при участии бактериальной β-глюкуронидазы превращаются в свободный билирубин. Одновременно, даже в норме (особенно у взрослых), некоторое количество билирубин-глюкуронидов может попадать из желчи в кровь по межклеточным щелям.
Таким образом, в плазме крови обычно присутствуют две формы билирубина: свободный (непрямой), попадающий сюда из клеток РЭС (80% и более всего количества), и связанный (прямой), попадающий из желчных протоков (в норме не более 20%).
Термины «связанный«, «конъюгированный«, «свободный«, «несвязанный» отражают взаимодействие билирубина и глюкуроновой кислоты (но не билирубина и альбумина!).
Термины «прямой» и «непрямой» введены, исходя из возможности химической реакции билирубина с диазореактивом Эрлиха. Связанный билирубин реагирует с реактивом напрямую, без добавления дополнительных реагентов, т.к. является водорастворимым. Несвязанный (жирорастворимый) билирубин требует добавочных реактивов, реагирует не прямо.
Превращение в кишечнике
В кишечнике билирубин подвергается восстановлению под действием микрофлоры до мезобилирубина и мезобилиногена (уробилиногена). Часть уробилиногена всасывается и с кровью портальной вены попадает в печень, где либо распадается до моно-, ди- и трипирролов, либо окисляется до билирубина и снова экскретируется. При этом при здоровой печени в общий круг кровообращения и в мочу мезобилирубин и уробилиноген не попадают, а полностью задерживаются гепатоцитами.
Оставшаяся в кишечнике часть пигментов ферментами бактериальной флоры толстого кишечника восстанавливается до стеркобилиногена. Далее
- малая часть стеркобилиногена может всасываться и катаболизировать в печени, подобно уробилиногену,
- незначительное количество стеркобилиногена через геморроидальные вены попадает в большой круг кровообращения, отсюда в почки и в мочу. После окисления на воздухе из стеркобилиногена образуется стеркобилин мочи,
- однако основное количество стеркобилиногена достигает нижних отделов толстого кишечника и выделяется. В прямой кишке и на воздухе стеркобилиноген окисляется в стеркобилин, окрашивая кал,
- аналогично уробилиноген, появляющийся в моче при патологии печени, окисляется в уробилин.
Очень часто стеркобилиноген, содержащийся в нормальной моче, называют уробилиногеном. И в клинической практике обычно не проводят различий между стеркобилиногеном и уробилиногеном мочи, их рассматривают как один пигмент – урохромы (уробилиноиды), что может создавать некоторую путаницу при оценке результатов анализа.
Источник
Гемоглобин: роль в газообмене и процессе дыхания
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии… Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1–2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
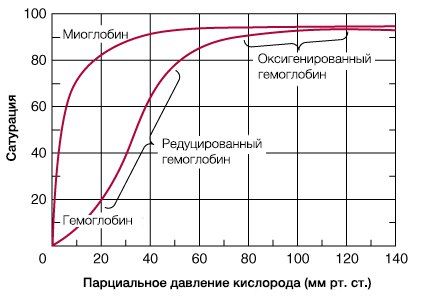
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.
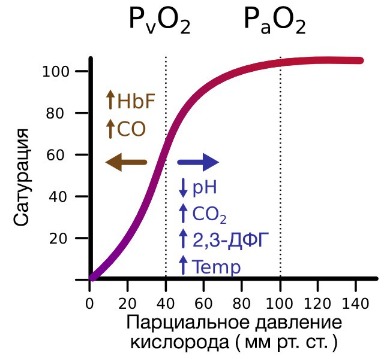
В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
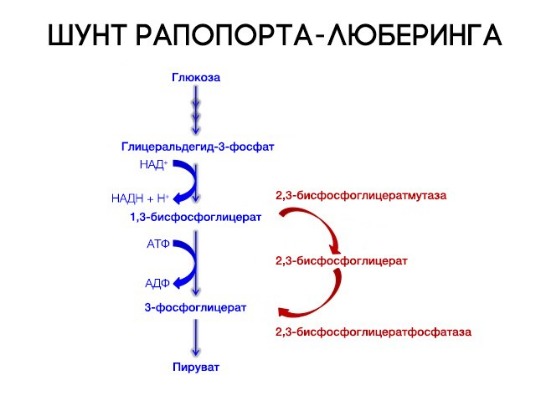
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
- Harrison’s hematology and oncology Longo, Dan L (Dan Louis), Third edition. New York : McGraw-Hill Education Medical, 2017.
- Наглядная физиология, С. Зильбернагль, А. Деспопулос, 2013.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. /Д. Нельсон, М. Кокс ; Пер. с англ.-М.: БИНОМ: Лаборатория знаний, 2011.- 694 с.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Распад и синтез гемоглобина в тканях.


Мы поможем в написании ваших работ!

Мы поможем в написании ваших работ!

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
Ответ: Гемоглобин, как и другие хромопротеиды(хлорофиллпротеиды, миогло-бин и др.), попав с пищей в пищеварительный канал, гидролизуется пищевари-тельными ферментами, распадаясь на белок и простетическую группу(гем). Глобиновая часть подвергается обычным превращениям, которые свойственны простым белкам. Простетическая же группа гемоглобина – гем – окисляется в гематин. Гематин, так же как и хлорофилл,всасывается в кишечнике очень плохо и поэтому выделяется, в основном, с калом. Таким образом, простетиче-ская группа хромопротеидов пищи не может быть использована для синтеза соответствующих сложных белков.
Иные превращения свойственны гемоглобину в тканях организма. В печени распад гемоглобина начинается с разрыва α-метиновой связи между 1 и 2 пиррольными кольцами порфиринового ядра. Реакция катализи-руется НАДФ-зависимой оксидазой и приводит к образованию вердоглобина (зеленого пигмента). В реакции участвуют в качестве кофакторов аскорбино-вая кислота, ионы двухвалентного железа и др.В дальнейшем происходит распад вердоглобина на глобин, биливердин и железо. Биливердин в основном в печени превращается при восстановлении в билирубин– главный желчный
пигмент у человека и плотоядных животных.Частично билирубин может об-разовываться также в селезенке и, по-видимому, в эритроцитах.
Образовавшийся свободный билирубин плохо растворим в воде и не дает прямой реакции с диазореактивом Эрлиха,так как легко адсорбируется на белках плазмы крови. Поэтому он получил название «непрямого билирубина».
Свободный билирубин (непрямой) является для организма токсическим веще-ством. Поступающий с током крови в печень и образовавшийся в печени сво-бодный («непрямой») билирубин подвергается обезвреживанию в печени пу-тем образования с глюкуроновой кислотой диглюкуронида билирубина(час-тично – моноглюкуронида). Он хорошо растворим в воде и дает прямую реак-цию с диазореактивом. Поэтому он получил название«прямой» билирубин. Глюкуроновая кислота вступает в реакцию с билирубином в виде уридинди-фосфатглюкуроновой кислоты в присутствии особого фермента глюкуронид-трансферазы.
Синтез гемоглобина характеризуется многостадийностью. Считается, что пиррольные кольца порфиринового ядра гема синтезируются в организме че-ловека и животных с использованием гликокола(глицина) и сукцинилкоэнзи-ма А при участии фермента, содержащего фосфопиридоксаль.
57. В тканях нуклеиновые кислоты распадаются до мононуклеотидов под влиянием тканевых нуклеаз – дезоксирибонуклеаз и рибонуклеаз, локали-зованных главным образом в митохондриях клеток.
Мононуклеотиды в тканях распадаются дальше до более простых соеди-нений. Первый этап состоит в отщеплении остатка фосфорной кислоты под влиянием тканевых фосфатаз (или нуклеотидаз).
Далее осуществляется перенос пентозы от нуклеозида на фосфорную ки-слоту. Реакция катализируется специфической для каждого нуклеозида рибо-зилтрансферазой (нуклеозидфосфорилазой).
Таким путем в результате распада нуклеозидов образуются пентозо-1-фосфат и все виды пуриновых и пиримидиновых оснований,участвующих в построении нуклеиновых кислот.
Надо сказать, что нуклеозиды могут расщепляться не только путем пере-носа пентозы от нуклеозида на фосфорную кислоту, но и гидролитическим пу-тем при участии ферментов нуклеозидаз:
Образующиеся пентозо-1-фосфат и пентоза включаются в реакции обме-на, характерные для углеводов.
Пуриновые основания претерпевают последующие из-менения и превращаются в те или иные простейшие азотсодержащие продук-ты, которые либо выводятся из организма, либо откладываются в нем. Первая фаза распада пуриновых оснований заключается в дезами-нировании под влиянием специфических аминогидролаз тех из них,которые имеют аминогруппу. В результате пуриновые основания – аденин превращает-ся в гипоксантин, а гуанин – в ксантин:
Гипоксантин и ксантин окисляются в мочевую кислоту. Ре-акция катализируется ксантиноксидазой, представляющей собой молибденсо-держащий флавопротеид.
Мочевая кислота является конечным продуктом распада пуриновых осно-ваний у человека и некоторых животных(чел В норме концентрация мочевой кислоты в цельной крови человека со-ставляет 0,18-0,24 ммоль/л, а в сыворотке крови 0,1-0,4 ммоль/л. При наруше-нии обмена пуриновых оснований(при подагре, заболеваниях почек, при за-болеваниях, сопровождающихся усиленным распадом нуклеопротеидов – лей-козах, диабете, аллергии и др.) содержание мочевой кислоты может значи-тельно увеличиваться (гиперурикемия).
58. Начальным этапом превращений нуклеопротеидов пищи в пищеваритель-ном канале следует считать отщепление нуклеиновой кислоты от белковой части нуклеопротеида. В желудке это происходит либо неферментативным пу-тем под действием кислоты желудочного сока(если разрываются солеобраз-ные связи между нуклеиновой кислотой и белком,имеющим щелочные свой-ства), либо под действием пепсина, либо, наконец, и под влиянием пепсина и под влиянием кислоты желудочного сока. В кишечнике расщепление нуклео-протеидов на белок и нуклеиновую кислоту происходит под влиянием соот-ветствующих протеолитических ферментов (трипсина и других).
Отщепившийся в желудочно-кишечном тракте белок подвергается обыч-ным для белка превращениям. Расщепление же нуклеиновых кислот происхо-дит далее под влиянием особых ферментов поджелудочной железы и тонкого кишечника – специфических нуклеаз и неспецифических фосфодиэстераз. Они ускоряют реакции разрыва межнуклеотидных связей в молекулах нуклеино-вых кислот. Нуклеазы, действующие на внутренние межнуклеотидные связи в молекулах РНК и ДНК, называются эндонуклеазами. При их участии осущест-вляется деполимеризация нуклеиновых кислот в основном до олигонуклеоти-дов. Нуклеазы, ускоряющие реакции последовательного отщепления нуклео-тидов от РНК и ДНК,начиная с конца полинуклеотидной цепи,называются экзонуклеазами. Эти ферменты обеспечивают распад нуклеиновых кислот до отдельных мононуклеотидов. При этом различают эндо- и экзорибонуклеазы и эндо- и экзо-дезоксирибонуклеазы. Первые ускоряют реакции распада внут-ренних и внешних(концевых) межнуклеотидных связей в молекулах РНК. Вторые выполняют ту же роль в молекулах ДНК.
Существует также группа неспецифических эндо-и экзонуклеаз, дейст-вующих одновременно на РНК и ДНК.
Большинство нуклеаз являются гидролазами, однако, часть из них при-надлежит к группе фосфотрансфераз (например, эндонуклеаза поджелудочной железы). В результате каталитического влияния разнообразных нуклеаз в по-лости пищеварительного тракта нуклеиновые кислоты распадаются на слож-ную смесь индивидуальных мононуклеотидов.
Образовавшиеся мононуклеотиды гидролизуются малоспецифическими и высокоспецифическими фосфатазами с образованием нуклеозидов и неорга-нического фосфата. В виде этих соединений(нуклеотидов и нуклеозидов) и происходит всасывание продуктов гидролиза нуклеиновых кислот.Всосав-шиеся нуклеотиды и нуклеозиды частично используются в организме для син-теза простетических групп нуклеопротеидов.
Пиримидиновые основания претерпевают последующие из-менения и превращаются в те или иные простейшие азотсодержащие продук-ты, которые либо выводятся из организма, либо откладываются в нем. Первая фаза распада пиримидиновых оснований заключается в дезами-нировании под влиянием специфических аминогидролаз тех из них,которые имеют аминогруппу.
В отличие от пуриновых оснований дезаминированные пиримидиновые основания подвергаются восстановлению. В частности, урацил переходит в
дигидроурацил. Донором атомов водорода служит НАД.Н.Далее дигидро-
урацил гидролизуется в N-карбамил-β-аланин, который гидролизуется в свою очередь до β-аланина и карбаминовой кислоты. Последняя либо используется для синтеза мочевины, либо распадается до углекислого газа и аммиака.Все эти реакции катализируются соответствующими ферментами:
59.Синтез ДНК (репликация) характеризуется рядом особенностей.
При биосинтезе ДНК первой характерной чертой специфического -био синтеза является то, что он протекает только при участии всех четырех видов дезоксирибонуклеозид-5’-трифосфатов (дАТФ, дГТФ, дЦТФ , дТТФ). Вторая особенность состоит в том, что биосинтез ДНК идет при каталитическом воз-действии комплекса ферментов: ДНК-репликазной системы или реплисемы, включающей более 20 т.н. репликативных ферментов и белковых факторов, в том числе ДНК-полимеразыI, II и III, РНК-полимеразы, ДНК-лигазы, ДНК-связывающего, ДНК-закручивающего и ДНК-раскручивающего белка и др. Наконец, третьей чертой биосинтеза ДНК является необходимость для его осуществления «затравки» в виде олигорибонуклеотида и ДНК-матрицы, что обеспечивает специфический биосинтез нуклеиновых кислот со строго задан-ной последовательностью нуклеотидных остатков в синтезируемой молекуле
по механизму комплементарности азотистых оснований дочерней ДНК и ДНК-матрицы. Общая схема биосинтеза ДНК может быть представлена,со-гласно Корнбергу, в следующем виде:
формула
Сталь и Меселсон установили, что в организме репликация ДНК осущест-вляется по полуконсервативному механизму, при котором цепи родительской ДНК расходятся и на каждой из них образуются комплементарные цепи до-черней ДНК. Механизм ферментативной реакции, происходящей при биосин-тезе ДНК, сводится к наращиванию полинуклеотидных фрагментов,закреп-ленных на одноцепочной ДНК-матрице, за счет переноса на их свободную гидроксильную группу при 3’-углеродном атоме пентозы нуклеозидмонофос-фатного остатка с дезоксирибонуклеозидтрифосфата, закрепленного в сосед-нем положении на матричной одноцепочной ДНК в соответствии с принципом комплементарности. Перенос идет в направлении5’ 3’ и сопровождается выделением пирофосфата, что обеспечивает синтез энергией.
Детали синтеза пока не ясны. Считается, что биосинтез ДНК начинается с раскручивания биспиральной цепи ДНК с образованием т.. нрепликативных вилок, двух репликативных вилок в фиксированной точке родительской ДНК под влиянием ДНК-раскручивающего белка у прокариот или сразу множества репликативных вилок у эукариот. Инициация синтеза дочерней ДНК предва-рительно требует синтеза на одной из одноцепочечных цепей(т.н. ведущей цепи) необычного затравочного олигорибонуклеотида (т.н. праймера – затрав-
| ки) со свободной ОН-группой | 3’у-углеродного | атома рибозы. С этой | |||
| ОН-группы праймера начинается затем истинный синтез дочерней ДНК по | |||||
| принципу | комплементарности | азотистых | оснований | под | влиянием |
ДНК-полимеразы III в направлении 5’ З’, обратному направлению исходной цепи ДНК. На второй цепи ДНК-матрицы(т.н. отстающей цепи) также идет синтез ДНК, но в виде фрагментов(т.н. фрагментов Оказаки) в направлении 5’ 3’. В последующем фрагменты ДНК объединяются при участии ДНК-лигаз в единую полинуклеотидную цепь. Праймер разрушается рибонуклеазой Н с последующей заменой на фрагмент ДНК с помощью ДНК-полимеразы I.
Источник